嗜盐性蛋白酶产生菌Virgibacillus sp. P-4的筛选鉴定及其特性分析
张延杰,王静雪*,牟海津
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
嗜盐性蛋白酶产生菌Virgibacillus sp. P-4的筛选鉴定及其特性分析
张延杰,王静雪*,牟海津
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
利用酪蛋白琼脂平板从传统虾酱中分离嗜盐性蛋白酶产生菌,经形态学、生理生化和分子生物学鉴定,确定该菌隶属于枝芽孢杆菌属Virgibacillus sp. P-4,并用此菌为后续研究菌株。结果表明,该菌最适生长温度为30~37 ℃,最适生长NaCl质量分数为5%~15%;所产胞外蛋白酶在20~50 ℃条件下酶活力较高且保持稳定,最适反应温度为40 ℃,当NaCl质量分数为15%时酶活力达到最高,并且所产胞外蛋白酶种类可能不只一种,但不包含巯基蛋白酶;通过分析酶解液中游离氨基酸释放速率,预测其酶切位点为Phe-、Tyr-、Lys-、His-、Pro-及Leu-。
蛋白酶产生菌;嗜盐菌;虾酱;性质
传统虾酱是以虾为原料,在高盐条件下,经自然发酵而成的一种风味独特的黏稠状紫红色调味料,富含不饱和脂肪酸以及游离氨基酸等营养物质,深受我国以及东南亚各国人民的喜爱[1]。然而目前我国虾酱产业存在发酵周期长、盐度过高(30%~35%)等问题,制约了其产业化的发展[2]。许多学者尝试通过减少盐用量和降低pH值[3]、提高发酵温度[4]、外加蛋白酶[5]等加速蛋白质降解的方式来缩短发酵周期。但是这些方法也存在缺陷,如低盐会促进致病菌的滋生,高温则会使必要的蛋白酶变性并且还会增加投资成本,外加酶发酵的产品风味不及自然发酵[6]。
近年来,以微生物为启动子,通过纯培养的方式来发酵水产品,受到越来越多学者的关注,这种方式对提高加工速率、稳定产品质量、改善产品感官品质以及缩短发酵周期等方面都有积极作用[7],Speranza等[8]利用3 株片球菌(Pediococcus)在实验室条件下发酵鱼露,结果发现这种发酵方式不仅可以缩短发酵时间,并且还能够改善产品质量。自然发酵方式不受人为控制,产品质量总是参差不齐,选择合适的嗜盐菌作为启动子,优化和控制发酵过程,就成为研究热点。段杉等[9]研究发现,虾酱在发酵过程中内源性蛋白酶活力不断降低,细菌蛋白酶活力逐渐增加,细菌蛋白酶对发酵风味的形成有极大贡献。吕欣然等[10]研究表明,虾酱中产蛋白酶的嗜盐性葡萄球菌和枝芽孢杆菌是导致虾酱中蛋白质降解的主体微生物类群。鉴于嗜盐性蛋白酶产生菌在虾酱发酵过程中起着至关重要的作用,因此一些学者将目光集中于此,例如,Tanasupaw at等[11]从泰国虾酱中分离到一株盐脱氮枝芽孢杆菌(Virgibacillus halodenitrificans TKNR13-3),它的嗜盐嗜热特性将在食品发酵方面有巨大的应用潜力;连鑫等[12]从传统虾酱中分离出一株具有水解蛋白质能力的黑曲霉(Aspergillus niger),而霉菌在发酵食品中往往会产生良好的风味。综上所述,有针对性地分离嗜盐性蛋白酶产生菌,对它的生长特性、酶学性质进行研究,这对于将来用其进行虾酱的标准化生产有重要意义。
本研究主要是通过分离筛选传统虾酱中的嗜盐性蛋白酶产生菌,并对其特性进行分析,以期为虾酱的分步发酵提供优良的微生物菌株,最终达到缩短发酵周期、降低盐度、稳定生产的目的。
1 材料与方法
1.1 材料与试剂
虾酱采购于山东青岛。
酪蛋白、琼脂 北京索莱宝科技有限公司;酵母膏北京双旋微生物培养基制品厂;氯化钠、三氯乙酸(均为分析纯) 国药集团化学试剂有限公司;营养肉汤培养基、营养琼脂培养基及蛋白酶制剂 北京路桥技术有限公司;聚合酶链式反应中所用试剂均购自上海生物工程技术有限公司。
酪蛋白液体培养基:酪蛋白10 g/L,酵母膏1 g/L,NaCl 100 g/L,pH 7.2±0.2。
酪蛋白固体培养基:酪蛋白10 g/L,酵母膏1 g/L,NaCl 100 g/L,琼脂15 g/L,pH 7.2±0.2。
1.2 仪器与设备
HH-1恒温水浴锅 国华电器有限公司;M LS-3750全自动灭菌锅 日本三洋电子公司;WPG-350隔水式电热恒温培养箱 上海精宏实验设备有限公司;HZQ-F恒温振荡培养箱 哈尔滨东联电子技术开发有限公司;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司。
1.3 菌株的筛选及鉴定
1.3.1 菌株的初筛
称取1 g虾酱置于酪蛋白液体培养基中进行多次富集培养,吸取100 μL富集培养液进行梯度稀释后涂布于酪蛋白固体培养基上,37 ℃培养6 d,选取菌落周围有透明圈的菌株进行纯化,然后点种于酪蛋白固体培养基上,37 ℃培养6 d后,在平板上加0.4 mol/L三氯乙酸观察透明圈的大小。
1.3.2 菌株的复筛
挑取一环菌株接种于50 m L酪蛋白液体培养基中(250 m L锥形瓶),37 ℃、150 r/m in振荡培养7 d。吸取1、3、5、7 d的适量培养液进行蛋白酶活力测定。参考GB/T 23527—2009《蛋白酶制剂》[13]采用Folin-酚法,利用酶标仪分别测定菌株的酸性、中性、碱性蛋白酶活力。对于酸性、中性、碱性蛋白酶的活力测定需分别使用pH 3.0乳酸-乳酸钠缓冲液、pH 7.5磷酸盐缓冲液和pH 10.0硼酸-硼酸钠缓冲液进行适当稀释。一般认为,在40 ℃适当pH值条件下,1 m in水解酪蛋白产生1 μg酪氨酸所需的酶量为1 个蛋白酶活力单位。
1.3.3 分子生物学鉴定[14]
挑取一环单菌落置于500 μL无菌水中,置于95 ℃水浴加热5 m in后作聚合酶链式反应(polymerase chain reac tion,PCR)模板。PCR体系为50 μL,其中:PCR M aster M ix(2×)25 μL,16S Primer Up 1 μL,16S Primer Down 1 μL,模板2 μL,加RNase-Free Water补至50 μL。PCR条件:94 ℃预变性10 m in;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 m in,共35 个循环;72 ℃延伸10 m in。最后将PCR扩增产物交由上海生物工程技术有限公司测序。将测得的序列登录EzTaxon数据库进行比对,应用MEGA 5.0软件构建系统发育进化树。
1.3.4 形态学及生理生化鉴定
参照《常见细菌系统鉴定手册》[15]和《伯杰细菌鉴定手册》[16]进行形态学及生理生化鉴定。
1.3.5 生长特性
挑取一环待测菌株接种于50 m L营养肉汤中,37 ℃、150 r/m in振荡培养24 h,而后按2%(体积分数)接种量接种于营养肉汤中,将其分别设置为不同的培养时间(自0 h开始,每隔4 h测定一次)、培养温度(10、20、30、35、37、45 ℃)、pH值(4.5、5.5、6.5、7.5、8.5、9.5)、NaCl质量分数(0%、5%、10%、15%、20%、25%)的培养基,在适宜温度振荡培养48 h后测定OD600nm,每个梯度设置3 个平行。
1.3.6 酶学性质测定
1.3.6.1 最适反应温度及温度稳定性
取适量经缓冲液适当稀释的粗酶液,将其分别置于20、30、40、50、60、70 ℃条件下测定中性蛋白酶活力,计算相对酶活力。
取经缓冲液适当稀释的粗酶液,分别置于20、30、40、50、60、70 ℃条件下保温30 m in,待恢复到室温后在最适反应温度测定中性蛋白酶活力,计算相对酶活力。
1.3.6.2 NaCl质量分数对酶活力的影响
将待测菌株置于不同质量分数的NaCl(0%、5%、10%、15%、20%)酪蛋白液体培养基中,取适量粗酶液测定中性蛋白酶活力,计算相对酶活力。
1.3.6.3 金属离子对酶活力的影响
向粗酶液中分别加入A gNO3、A lC l3、CaC l2、COCl2、CuSO4、Fe2(SO4)3、MgSO4、MnSO4和ZnSO4至最终浓度为5 mmol/L,室温静置30 m in,在最适条件下测定中性蛋白酶活力,以不加金属离子的粗酶液作对照酶活力为100%,计算相对酶活力。
1.3.6.4 抑制剂对酶活力的影响
向粗酶液中分别加入不同的蛋白酶抑制剂:碘乙酰胺(iodoacetam ide,IAM,巯基蛋白酶抑制剂)、乙二胺四乙酸(ethylenediam inetetraacetic acid,EDTA,金属蛋白酶抑制剂)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF,丝氨酸蛋白酶抑制剂)、胃蛋白酶抑制剂(Pepstatin)使抑制剂浓度达到1 mmol/L,在室温静置30 m in,在相同条件下测定中性蛋白酶活力,未经处理的粗酶液作对照,酶活力为100%,计算加入抑制剂后的相对酶活力。
1.3.7 酶解特异性分析[17]
向经过灭菌处理的100 m L南极磷虾匀浆液中加入5 m L粗酶液,以不加粗酶液酶解的样品为空白。在最适温度条件下,于恒温振荡摇床中振荡酶解1~21 h。酶解结束后,将酶解产物置于沸水中15 min灭酶,冷却后8 000 r/min离心30 m in,收集上清液即为酶解液,采用氨基酸自动分析仪测定酶解液中游离氨基酸,同时设置空白对照。
1.4 数据分析
运用软件Origin 8.5对试验数据进行统计分析。
2 结果与分析
2.1 嗜盐性蛋白酶产生菌的筛选
据报道,水产品中存在多样且复杂的微生物群体[18],在发酵过程中嗜盐性蛋白酶产生菌起着主导作用[19],它的主要作用是在高盐环境下仍具有蛋白酶活力,降解水产品中的蛋白质。一般来说,当盐质量分数范围1%~10%逐步递增时,就会明显影响微生物的生长、发酵的速率、产品的感官质量等。因此,从发酵水产品中分离出固有的嗜盐性微生物,可能会拥有更理想的特性,可以重现原产品的风味甚至提高原产品的质量[8,20]。

图1 嗜盐性蛋白酶产生菌在酪蛋白平板上的透明圈Fig. 1 Transparent zones around colonies on casein agar p lates
从虾酱样品中初筛得到11 株嗜盐性蛋白酶产生菌,将这11 株菌在酪蛋白平板上点种培养6 d后,添加0.4 mol/L三氯乙酸,结果如图1所示。然后对图1中这11 株菌进行酸性、中性、碱性蛋白酶活力测定,结果如图2所示。综合以上结果表明,这11 株菌以产中性蛋白酶为主,尤其以P-4所产中性蛋白酶活力最为突出。此外,P-2虽然在酪蛋白平板上透明圈较小,但是其蛋白酶活力却比大多数测定菌株都高,这一结果表明透明圈的大小并不能十分准确地反映蛋白酶的活力。此外,连鑫等[12]采用与本实验相同的筛选方法,在中性酪蛋白琼脂平板上筛选到一株黑曲霉,采用Folin-酚法测定其蛋白酶活力,结果发现这株黑曲霉的酸性蛋白酶活力最高。

图2 11 株嗜盐性蛋白酶产生菌酶活力Fig. 2 Protease activities of 11 selected isolates
2.2 基于16S rDNA序列分析的系统发育树的构建
将测序结果与Ez Taxon数据库(h ttp://w w w.ezbiocloud.net/)进行比对,结果发现,P-4与模式菌株V. halodenitrificans DSM 10037T具有最大相似度,可达99.39%。在构建的系统发育树中,如图3所示,P-4与V. ha lodenitrificans DSM 10037T最接近,隶属于同一分支,因此,初步确定P-4属于枝芽孢杆菌属(Virgibacillus)。为进一步比较分析P-4与枝芽孢杆菌属已知种相互之间的差异,需要对其进行形态学及生理生化特征的鉴定。

图3 嗜盐性蛋白酶产生菌P-4的建树结果Fig. 3 Neighbor-joining phylogenetic tree for strain P-4 based on 16S rDNA gene sequences
2.3 表型鉴定

图4 嗜盐性蛋白酶产生菌P-4的透射电镜照片(×25 000)Fig. 4 Transm ission electron m icrographs of strain P-4 (× 25 000)
将菌株P-4分别接种在NA平板上观察菌落形态,用显微镜观察细胞形态及染色特征。P-4在NA平板上长出的菌落为圆形,乳白色,表面光滑不透明,革兰氏染色可变,菌体呈杆状,周生鞭毛。图4即为P-4在NA平板上培养3 d后的透射电镜照片。
经过16S rDNA鉴定之后,认定P-4隶属于枝芽孢杆菌属(Virgibacillus)。以不产生色素、能降解酪蛋白为标准,目前为止符合上述标准,可供选取的枝芽孢杆菌属已知种有8 个,表1列出了P-4与这8个枝芽孢杆菌属已知种在生理生化特征上的异同。可以看出,P-4拥有大量枝芽孢杆菌属的特征,如生长范围、氧化酶活性、V-P实验、吲哚实验、精氨酸双水解酶及鸟氨酸脱羧酶活性等都基本一致;但是也有部分不同于枝芽孢杆菌属已知种的特征,如革兰氏染色、硝酸盐还原性、H2S产气、赖氨酸脱羧酶活性等。

表1 P-4区别于枝芽孢杆菌属其他种细菌的不同特征Tab le 1 Differential characteristics between strain P-4 and related species of the genus Virgibacillus
通过以上对各项实验结果的分析,初步认定菌株P-4可能为芽孢杆菌科枝芽孢杆菌属的一个新种,命名为Virgibacillus sp. P-4。
2.4 Virgibacillus sp. P-4的生长特性

由图5可知,该菌在经过液体培养之后,20 h之后即可进入生长稳定期;最适生长温度为30~37 ℃;当pH值小于6.5时,菌体几乎不生长或生长缓慢,当pH 6.5~7.5时,随着pH值的升高,菌体呈对数生长;当pH值大于7.5时,菌体生长速率减缓,但仍旧继续生长;最适生长NaCl质量分数为5%~15%,当NaCl质量分数超过20%,菌体几乎不再生长。从生长特性来看,该菌对NaCl有一定的耐受性和依赖性,这也为今后将其应用于高盐发酵提供了可能性。
2.5 Virgibacillus sp. P-4的酶学性质
由图6可知,Virgibacillus sp. P-4的粗酶液受温度、NaCl质量分数、金属离子及添加剂的影响。图6A表明,Virgibacillus sp. P-4所产胞外蛋白酶的最适反应温度是40 ℃,并且在20~50 ℃处理30 m in后,仍保持较高且比较稳定的酶活力,这表明Virgibacillus sp. P-4所产胞外蛋白酶具有一定的耐热能力,而耐热能力对食品发酵是至关重要的。因为食品发酵过程中会产生一定的热量,具有耐热能力的蛋白酶即使温度升高仍能保持较高且稳定的酶活力[30]。图6B表明,Virgibacillus sp. P-4所产胞外蛋白酶的活性随着NaCl质量分数的升高而逐渐升高,当NaCl质量分数达到15%时,蛋白酶活力达到最高,随后蛋白酶活力随NaCl质量分数升高而急剧下降。这一结果表明该蛋白酶需要一定浓度的NaCl来达到最高酶活力并且可以在高盐环境下保持性质稳定。图6C表明,不同的金属离子对Virgibacillus sp. P-4所产胞外蛋白酶粗酶液的活性均有不同程度的抑制作用,其中Zn2+、Fe2+、Co2+对酶活力具有明显的抑制作用。图6D表明,EDTA、PMSF、Pepstatin对Virgibacillus sp. P-4所产胞外蛋白酶也有不同程度的抑制作用,其原因是,该菌所产胞外蛋白酶的种类可能不只一种。而IAM是一种巯基反应物,在添加了一定浓度的IAM后,蛋白酶的活性几乎不受影响,表明该粗酶液中不包含巯基蛋白酶。
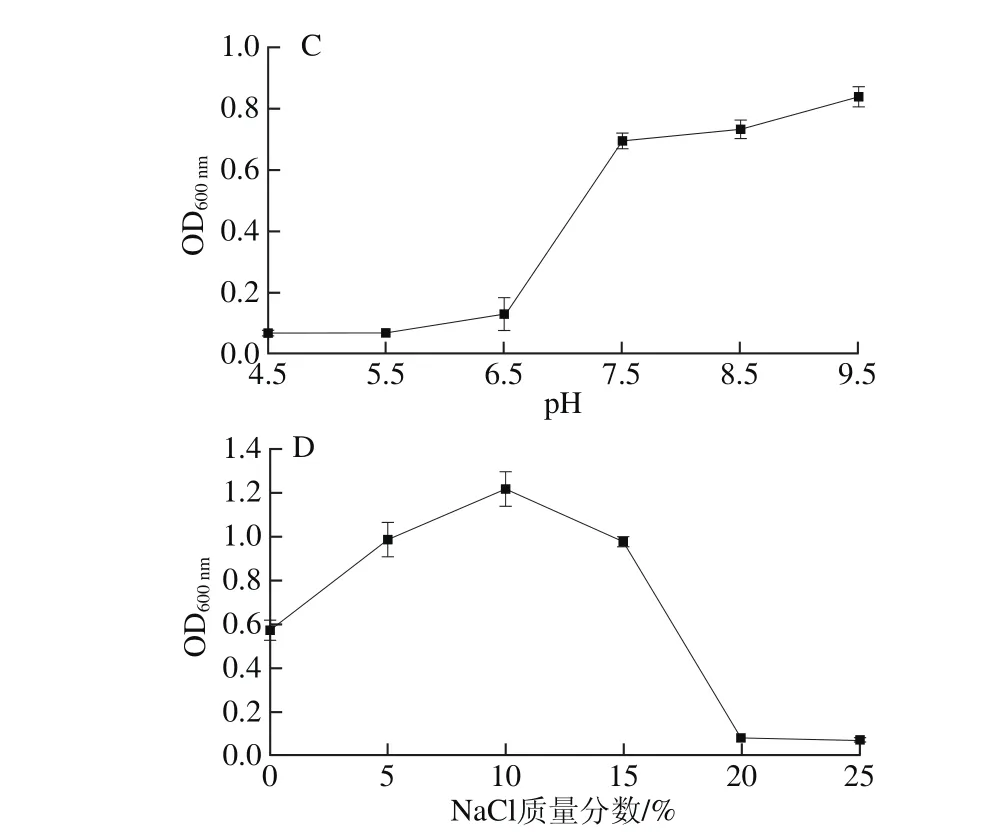
图5 Virgibacillus sp. P-4培养过程中时间(A)、温度(B)、pH值(C)、NaCl质量分数(D)对菌株生长量的影响Fig. 5 Effects of culture time (A), temperature (B), pH (C), and NaCl concentration (D) on biomass of Virgibacillus sp. P-4

图6 温度(A)、NaCl质量分数(B)、金属离子(C)、抑制剂(D)对Virgibacillus sp. P-4蛋白酶活力的影响Fig. 6 Effects of temperature (A), NaCl concentration (B), metal ions (C),and inhibitors (D) on protease activity of Virgibacillus sp. P-4
关于枝芽孢杆菌属(Virgibacillus)的嗜盐性、胞外蛋白酶性质及发酵特性近年来也曾有报道,Sinsuwan等[31]从发酵1个月的鱼露中筛选到1株中度嗜盐性蛋白酶产生菌Virgibacillus sp. SK37,其粗酶液在0%~25%NaCl下具有稳定酶活力;Udomsil等[32]在鱼露发酵过程中相继接种Virgibacillus sp. SK37和Tetragenococcus halophilus MS33,结果表明这种发酵方式对改善产品的挥发性成分,提高谷氨酸含量和整体可接受度上具有较大潜力。由图3的建树结果可知P-4与Virgibacillus sp. SK 37处于同一分支,它们的16S rDNA序列相似度很高,都属于嗜盐菌。但是通过对比它们粗酶液的性质,发现Virgibacillus sp.SK 37的酶活力最佳条件为p H 8.0和65 ℃[31],而Virgibacillus sp. P-4的最佳酶活力则是在pH 7.0和40 ℃处获得。由此表明,Virgibacillus sp. SK37所产蛋白酶对温度的要求比较高,而Virgibacillus sp. P-4则可以在适宜温度同时达到生长最佳和酶活力最高,因此Virgibacillus sp.P-4在实际生产中更具应用潜力。
2.6 Virgibacillus sp. P-4所产胞外蛋白酶的酶解特异性
蛋白酶降解蛋白质,使蛋白质的肽键破裂,导致氨基酸的释放,用游离氨基酸的释放速率来预测Virgibacillus sp. P-4所产胞外蛋白酶优先作用于哪些氨基酸组成的肽键。Lei Fenfen等[33]将应用最广泛、效果较好、酶切位点确定的两种商业酶(Papain和A lcalase 2.4L)用来酶解凤尾鱼蛋白和大豆蛋白时,通过游离氨基酸的释放速率来预测酶切位点,所得结果与文献报道的这两种商业酶的特异性酶切位点结论几乎完全一致。因此,游离氨基酸的释放速率在一定程度上能够反映蛋白酶的酶解特异性。
然而酶促反应通常很复杂,不一定满足线性关系,但在酶促反应的初期可以认为是符合线性关系的。在本实验中,南极磷虾酶解的前11 h内,游离氨基酸含量与时间有较好的线性关系,在这个时间段内,游离氨基酸的释放速率如表2所示,Virgibacillus sp. P-4的粗酶液在酶解南极磷虾时,释放速率最快的是Phe、Tyr、Lys、His、Pro与Leu,由此可推测Virgibacillus sp. P-4所产胞外蛋白酶在酶解过程中优先酶解含Phe-、Tyr-、Lys-、His-、Pro-及Leu-的肽键。

表2 Virgibacillus sp. P-4的蛋白酶酶解南极磷虾各种氨基酸的释放速率Table 2 The rate of release of FAAs from Antarctic krill meat hyd rolyzed by the protease from Virgibacillus sp. P-4
3 结 论
虾酱作为一种特殊的盐生环境,分布着多种嗜盐菌,这些嗜盐菌在虾酱的发酵成熟过程中起着至关重要的作用。采用酪蛋白琼脂平板法从虾酱中分离得到一株在高盐环境下仍能保持稳定酶活力的蛋白酶产生菌Virgibacillus sp. P-4,并通过分子鉴定、表型鉴定、生长特性研究、酶学性质研究、酶切位点预测等手段对其进行了全面解析,从实验结果可以看出,Virgibacillus sp.P-4确实是一株嗜盐性蛋白酶产生菌,其生长特性和胞外蛋白酶活力都对NaCl有较强依赖性,这为将其应用于盐生环境发酵提供了可能性。其次,Virgibacillus sp. P-4的生长最适温度和酶解最适反应温度比较接近,在发酵过程中只需设置适宜温度,即可让Virgibacillus sp. P-4同时满足生长最佳和胞外蛋白酶活力最高。以上这些结果都为进一步利用该菌株进行低盐发酵提供了理论支持。
[1] MONTANO N, GAVINO G, GAVINO V C. Polyunsaturated fatty acid contents of some traditional fish and shrimp paste condiments of Philippines[J]. Food Chem istry, 2001, 75(2): 155-158. DOI:10.1016/S0308-8146(01)00126-1.
[2] 吴帅, 杨锡洪, 解万翠, 等. 低值虾发酵制备传统虾酱风味的综合分析与比较[J]. 食品科学, 2016, 37(2): 121-127. DOI:10.7506/spkx1002-6630-201602021.
[3] GILDBERG A, ESPEJO-HERMES J, MAGNO-OREJANA F.Acceleration of autolysis during fish sauce fermentation by adding acid and reducing the salt content[J]. Journal of the Science of Food and Agriculture, 1984, 35(12): 1363-1369. DOI:10.1002/jsfa.2740351214.
[4] LOPETCHARAT K, PARK J W. Characteristics of fish sauce made from pacific whiting and surim i by-products during fermentation stage[J]. Journal of Food Science, 2002, 67(2): 511-516. DOI:10.1111/j.1365-2621.2002.tb10628.x.
[5] BEDDOWS C G, ARDESHIR A G. The production of soluble fish protein solution for use in fish sauce manufacture Ⅰ. The use of added enzymes[J]. International Journal of Food Science & Technology,1979, 14: 603-612. DOI:10.1111/j.1365-2621.1979.tb00907.x.
[6] AKOLKAR A V, DURAI D, DESAI A J. Halobacterium sp. SP1(1)as a starter culture for accelerating fish sauce fermentation[J]. Journal of Applied M icrobiology, 2010, 109(1): 44-53. DOI:10.1111/j.1365-2672.2009.04626.x.
[7] VISESSANGUAN W, BENJAKUL S, SM ITINONT T, et al. Change in m icrobiological, biochem ical and physico-chem ical properties of Nham inoculated w ith different inoculum levels of Lactobacillus curvatus[J]. Lebensmittel-Wissenschaft und-Technologie, 2006, 39(7):814-826. DOI:10.1016/j.lw t.2005.05.006.
[8] SPERANZA B, RACIOPPO A, BEVILACQUA A, et al. Selection of autochthonous strains as starter cultures for fermented fish products[J]. Journal of Food Science, 2015, 80(1): M 151-M 160.DOI:10.1111/1750-3841.12721.
[9] 段杉, 胡小喜, 廖广强, 等. 盐度对虾油中蛋白酶系、微生物和及其品质的影响[J]. 现代食品科技, 2014(7): 38-43. DOI:10.13982/j.m fst.1673-9078.2014.07.021.
[10] 吕欣然, 李莹, 马欢欢, 等. 传统锦州虾酱中产蛋白酶嗜盐菌的分离与鉴定[J]. 食品工业科技, 2016, 37(7): 121-125. DOI:10.13386/j.issn1002-0306.2016.07.016.
[11] TANASUPAWAT S, TAPRIG T, AKARACHARANYA A, et al.Characterization of Virgibacillus strain TKNR13-3 from fermented shrimp paste (ka-pi) and its protease production[J]. A frican Journal of M icrobiology Research, 2011, 5(26): 4714-4721. DOI:10.5897/AJMR10.520.
[12] 连鑫, 杨锡洪, 解万翠, 等. 中国传统虾酱中产蛋白酶霉菌的分离和鉴定[J]. 食品与机械, 2014(3): 40-43. DO I:10.3969/j.issn.1003-5788.2014.03.010.
[13] 中国国家标准化委员会. 蛋白酶制剂: GB/T 23527—2009[S]. 北京:中国标准出版社, 2009.
[14] 李梦哲. 宽谱沙门氏菌噬菌体STP4-a的发酵制备及其在蛋鸡体内的抑菌研究[D]. 青岛: 中国海洋大学, 2014.
[15] 蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[16] 布坎南, 吉本斯. 伯杰细菌鉴定手册[M] . 8版. 北京: 科学出版社, 1984.
[17] 雷芬芬. 深海菌株Exiguobacterium sp. SWJS2发酵产蛋白酶、酶学性质及酶解特异性研究[D]. 广州: 华南理工大学, 2014.
[18] ROH S W, KIM K H, NAM Y D, et al. Investigation of archaeal and bacterial diversity in fermented seafood using barcoded pyrosequencing[J]. ISME Journal, 2009, 4(1): 1-16. DOI:10.1038/ismej.2009.83.
[19] DUAN S, HU X, LI M, et al. Composition and metabolic activities of the bacterial community in shrimp sauce at the flavor-forming stage of fermentation as revealed by metatranscriptome and 16S rRNA gene sequencings[J]. Journal of Agricultural and Food Chem istry, 2016,64(12): 2591-2603. DOI:10.1021/acs.jafc.5b05826.
[20] 吴燕燕, 游刚, 李来好, 等. 低盐乳酸菌法与传统法腌干鱼制品的风味比较[J]. 水产学报, 2014, 38(4): 601-612. DOI:10.3724/SP.J.1231.2014.49049.
[21] DENARIAZ G, PAYNE W J, GALL J L. A halophilic denitrifier,Bacillus halodenitrificans sp. nov. Int J Syst Bacteriol[J]. International Jou rnal o f System atic Bacterio logy, 1989, 39(2): 145-151.DOI:10.1099/00207713-39-2-145.
[22] YOON J H, OH T K, PARK Y H. T ransfer o f Bacillus halodenitrificans Denariaz et al. 1989 to the genus Virgibacillus as Virgibacillus halodenitrificans comb. nov.[J]. International Journal of Systematic & Evolutionary M icrobiology, 2004, 54(6): 2163-2167.DOI:10.1099/ijs.0.63196-0.
[23] PROOM H, KNIGHT B C. Bacillus panto thenticus (n.sp.)[J].Jou rnal o f Genera l M ic robio logy, 1950, 4(3): 539-541.DOI:10.1099/00221287-4-3-539.
[24] HEYRMAN J, LOGAN N A, BUSSE H J, et al. Virgibacillus carmonensis sp. nov. Virgibacillus necropo lis sp. nov. and Virgibacillus picturae sp. nov. three novel species isolated from deteriorated mural paintings, transfer of the species of the genus salibacillus to Virgibacillus, as Virgibacillus[J]. International Journal of Systematic and Evolutionary M icrobiology, 2003, 53(Pt 2):501-511. DOI:10.1099/ijs.0.02371-0.
[25] GARABITO M J, ARAHAL D R, MELLADO E, et al. Bacillus salexigens sp. nov. a new moderately halophilic Bacillus species[J].International Journal of Systematic Bacteriology, 1997, 47(3):735-741. DOI:10.1099/00207713-47-3-735.
[26] ARAHAL D R, MÁRQUEZ M C, VOLCANI B E, et al. Bacillus marismortui sp. nov. a new moderately halophilic species from the Dead Sea[J]. International Journal of Systematic Bacteriology, 1999,49 Pt 2(2): 521-530. DOI:10.1099/00207713-49-2-521.
[27] YOON J H, KANG S J, LEE S Y, et al. Virgibacillus dokdonensis sp. nov. isolated from a Korean island, Dokdo, located at the edge of the East Sea in Korea[J]. International Journal of Systematic &Evolutionary M icrobiology, 2005, 55(Pt 5): 1833-1837. DOI:10.1099/ijs.0.63613-0.
[28] WANG C Y, CHANG C C, NG C C, et al. Virgibacillus chiguensis sp.nov. a novel halophilic bacterium isolated from Chigu, a previously commercial saltern located in southern Taiwan[J]. International Journal of Systematic & Evolutionary M icrobiology, 2008, 58(Pt 2):341-345. DOI:10.1099/ijs.0.64996-0.
[29] HUA N P, HAM ZACHAFFA I A, VREELAND R H, et al.Virgibacillus salarius sp. nov. a halophilic bacterium iso lated from a Saharan salt lake[J]. International Journal of Systematic &Evolutionary M icrobiology, 2008, 58(10): 2409-2414. DOI:10.1099/ijs.0.65693-0.
[30] 高瑞昌, 刘向东, 陆文婷, 等. 嗜盐古生菌Halogranum rubrum RO2-11胞外蛋白酶酶学特性研究[J]. 现代食品科技, 2015(2): 32-36.DOI:10.13982/j.m fst.1673-9078.2015.2.006.
[31] SINSUWAN S, RODTONG S, YONGSAWATDIGUL J. NaCl-Activated extracellular proteinase from Virgibacillus sp. SK37 isolated from fish sauce fermentation[J]. Journal of Food Science, 2007, 72(5):C264-C269. DOI:10.1111/j.1750-3841.2007.00375.x.
[32] UDOMSIL N, CHEN S, RODTONG S, et al. Imp rovemdent of fish sauce quality by combined inoculation of Tetragenococcus halophilus MS33 and Virgibacillus sp. SK37[J]. Food Control, 2016.DOI:10.1016/j.foodcont.2016.10.007.
[33] LEI F F, CUI C, ZHAO Q Z, et al. Evaluation of the hydrolysis specifi city of protease from marine Exiguobacterium sp. SWJS2 via free amino acid analysis[J]. Applied Biochem istry and Biotechnology,2014, 174(4): 1260-1271. DOI:10.1007/s12010-014-1088-7.
Isolation, Identification and Properties of Protease-Producing Halophilic Bacterium Virgibacillus sp. P-4 from Traditional Shrimp Sauce
ZHANG Yanjie, WANG Jingxue*, MOU Haijin
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Protease-producing bacteria were isolated from traditional shrimp sauce by using casein agar medium containing 10% NaCl. Based on its morphological, biochem ical and molecular properties, Virgibacillus sp. P-4 was determ ined as target strain for further study. The strain grew best at 30–37 ℃ w ith a salinity of 5%–15%. The protease produced by Virgibacillus sp. P-4 showed the optimum activity at 40 ℃, and was stable in the range of 20–50 ℃. The enzymatic activity reached its peak when NaCl concentration was 15%. Besides, Virgibacillus sp. P-4 m ight produce more than one extracellular protease except sulfhydryl protease. According to the rate of release of free am ino acids, the protease m ight preferably hydrolyze peptides containing Phe-, Tyr-, Lys-, His-, Pro- and Leu-.
protease-producing bacteria; halophilic bacteria; shrimp sauce; properties
10.7506/spkx1002-6630-201722016
TS254.1
A
1002-6630(2017)22-0102-07
张延杰, 王静雪, 牟海津. 嗜盐性蛋白酶产生菌Virgibacillus sp. P-4的筛选鉴定及其特性分析[J]. 食品科学, 2017, 38(22):102-108. DOI:10.7506/spkx1002-6630-201722016. http://www.spkx.net.cn
ZHANG Yanjie, WANG Jingxue, MOU Haijin. Isolation, identification and properties of protease-producing halophilic bacterium Virgibacillus sp. P-4 from traditional shrimp sauce[J]. Food Science, 2017, 38(22): 102-108. (in Chinese w ith English abstract)
10.7506/spkx1002-6630-201722016. http://www.spkx.net.cn
2017-01-04
山东省自主创新及成果转化专项计划项目(2015ZDZX05003);国家现代农业(海水鱼)产业技术体系建设专项(CARS-47);水产品(甲壳类)高效保鲜模式的建立与示范项目(931566010)
张延杰(1990—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:zhangyjouc@163.com
*通信作者:王静雪(1976—),女,教授,博士,研究方向为食品安全与质量控制。E-mail:snow@ouc.edu.cn

