pH与Ca2+浓度对磷石膏常压制备α-半水硫酸钙的影响
王鑫,纪利俊,陈葵,武斌,吴艳阳,朱家文
(华东理工大学化工学院,上海200237)
pH与Ca2+浓度对磷石膏常压制备α-半水硫酸钙的影响
王鑫,纪利俊,陈葵,武斌,吴艳阳,朱家文
(华东理工大学化工学院,上海200237)
研究了以Ca-Mg-K复合盐溶液为转晶体系中pH及Ca2+浓度对磷石膏常压水热法制备α-半水硫酸钙的影响。通过测定反应中固、液两相组成随时间的变化,得到了磷石膏在不同盐溶液体系当中的转晶速率。采用TESEM、XRD、TG等检测方法对产物做了表征,根据不同初始条件对最终产物晶体形貌的影响,讨论了不同条件下的影响机理。建立了以表面反应控制为基础的原料磷石膏溶解动力学模型,拟合得到不同Ca2+浓度条件下的表观溶解反应速率常数及反应级数,结果表明:磷石膏的溶解过程属于表面反应控制,在Ca2+浓度为2.5~3.5 mol/L的中性环境中,其溶解反应表观反应级数相差不大,平均值为1.533。
磷石膏;α-半水硫酸钙;晶型;溶解动力学
磷石膏(phosphogypsum,简称PG)是湿法磷酸工艺生产过程中的副产物,每生产1 t的磷酸约产生4.5 t磷石膏。目前,中国对磷石膏的利用率仅为2%~3%,相较于发达国家仍处于较低水平[1-6]。磷石膏主要成分为二水硫酸钙(CaSO4·2H2O,简称DH),二水硫酸钙在一定条件下可以脱去1.5个结晶水转晶成为半水硫酸钙(CaSO4·0.5H2O,简称HH),半水硫酸钙根据晶型不同又可分为β-半水硫酸钙(β-CaSO4·0.5H2O,简称β-HH)及α-半水硫酸钙(α-CaSO4·0.5H2O,简称α-HH)。研究表明[7-9],α-HH的水化产物较β-HH有强度高、需水量小、水化结构稳定、性价比优越等优势,目前已广泛应用于石膏陶瓷模具、地板材料、石膏装饰材料等领域。以磷石膏为原料制备α-半水硫酸钙,可望在解决固废堆积、环境污染问题的同时,生产出具有较高经济价值的高强石膏材料,对于磷化工行业固废排放的处理、生态环境的保护具有长远的意义,有助于促进生态可持续发展。
在溶液环境中,二水硫酸钙向α-半水硫酸钙转晶可分为2个步骤:1)二水相(CaSO4·2H2O)溶解;2)半水相(α-CaSO4·0.5H2O)析出。反应方程式见式(1)、(2),其中式(1)为控制步骤:
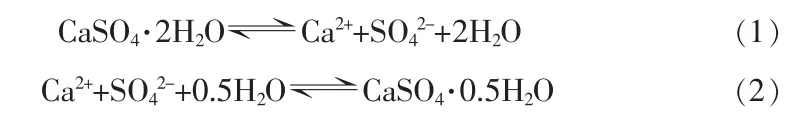
以水作为介质的条件下,DH向α-HH转晶的临界温度为114℃,转晶所需温度与水的活度密切相关,由于此时温度高于100℃,在传统方法中需要通过加压或以水蒸气加热为条件才能使转晶反应正常进行,常见的方法有蒸压法、液相法等[10]。为使操作更灵活,减少能耗与设备投入,可通过在溶液中添加无机盐或有机溶剂,以降低水的活度αw,从而降低转晶反应所需温度,使反应能够在常压下进行,这便是常压水热转晶方法的核心理论。近年来,学者们对以二水硫酸钙常压法制备α-半水硫酸钙的转晶体系做了相关研究,主要方法有2类。一类是通过改变溶剂,采用一定配比的醇、水混合溶液作为转晶溶剂,使反应在其混合溶液的共沸点处进行[11-12];但该方法仅适合杂质含量低的原料,例如天然石膏、脱硫石膏,应用面较窄。另一类方法是通过在水溶液中添加无机酸或无机盐,例如HCl、H2SO4、NaCl、CaCl2等[6,13-14],这类方法适用的范围较广,对原料纯度要求相对较低,应用的范围较广,对原料纯度要求相对较低。
磷石膏所含杂质较多,故采取水热盐溶液法制备α-HH较为适宜。CaCl2作为主要溶质在水溶液中达到一定浓度时,能有效降低水的活度并提高溶液中的Ca2+浓度,对半水硫酸钙起到稳定作用。KCl、MgCl2可增大二水硫酸钙溶解度,对钙盐结晶起辅助作用,常应用于硫酸钙析晶过程中[15]。本实验选取Ca-Mg-K混合盐溶液作为转晶体系,考察了Ca2+浓度和pH对磷石膏转晶制备α-半水硫酸钙的影响,研究了其转晶过程的动力学特征。
1 实验部分
1.1 原料与试剂
原料:净化磷石膏(二水硫酸钙质量分数为92.7%),取自中化化肥成都研发中心,其SEM照片如图1所示。由图1可见,磷石膏表面粗糙,为板状晶型。采用ARL SMS-2500型X荧光分析仪(XRF)分析其组成,结果见表1。
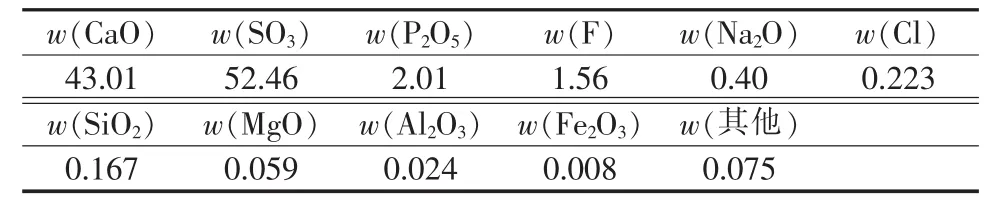
表1 磷石膏的主要化学组成%
试剂:无水氯化钙、六水合氯化镁、氯化钾,盐酸、氢氧化钠,购自上海国药试剂;钙羧酸示剂、乙二胺四乙酸二钠(EDTA)、铬酸钾、氯化钡、氨水,购自上海凌峰试剂厂。实验所用试剂均为分析纯。

图1 原料磷石膏的SEM照片
1.2 实验方法
实验采用带恒速机械搅拌器的500 mL三口烧瓶作为水热结晶反应器,配备玻璃冷凝管进行冷凝回流。反应前先将预先在三口烧瓶中配置好的盐溶液通过油浴加热,溶液组分及浓度:CaCl2,2.5~4.5 mol/L、MgCl2·6H2O,0.4 mol/L、KCl,0.05 mol/L。待溶液温度达到96℃时,迅速将磷石膏加入到烧瓶内开始反应,固液比为1∶5左右,反应温度维持在96℃保持不变,搅拌速率为200 r/min,总反应时间为6~8 h。隔一定时间对固液两相取样做组成分析,每次取液量控制为2~3 mL,样品取出后经抽滤,液相收集于比色管中待测,固相沉淀分别用90℃去离子水洗涤并抽滤2次、常温无水乙醇终止反应后抽滤,滤饼于烘箱中在85℃下干燥1 h置于干燥器中贮存。
1.3 检测与表征方法
液相中Ca2+浓度采用EDTA滴定法(钙红指示剂)滴定。SO42-浓度采用铬酸钡分光光度法测定,检测仪器为201型紫外可见光分光光度计。通过拟合浓度与吸光度关系曲线,在0.2~8 mmol/L范围内线性相关系数R2=0.991。
固相经乙醇超声分散2 min后,采用BX51型金相显微镜对固相晶体进行初步观察;干燥后通过S-53655型场发射扫描电镜进一步观察产物表面结构及晶体相貌;采用TF-5500型X射线衍射仪对产物进行XRD表征;采用STA-6000型同步热分析仪对固相结晶水含量进行热重分析。
2 结果与讨论
2.1Ca2+浓度与pH对转晶速率的影响
本实验中反应物与产物均为硫酸钙水合物,二水硫酸钙、α-半水硫酸钙的理论结晶水含量(质量分数,下同)分别为20.9%和6.21%,通过热重分析方法测定不同时间点固相产物的含水量,经数学换算后可得到不同时间原料的转化率,Ca2+浓度相同、pH不同以及pH相同、Ca2+浓度不同的反应条件下产物结晶水含量随时间的变化曲线,如图2所示。

图2c(Ca2+)=3.5 mol/L时,不同pH下产物(a)及pH=7.9时,不同Ca2+浓度下产物(b)结晶水含量随时间的变化
对比图2发现,当c(Ca2+)=2.5 mol/L时并未发生转晶反应,这是由于Ca2+浓度过低,未能达到转晶所需的饱和度。在同离子效应的作用下,Ca2+会对二水硫酸钙的溶解产生阻碍,故随着体系中Ca2+浓度提高,原料二水相溶解速率变慢,转晶速率也相应变慢;而Ca2+浓度相同、酸碱度不同的体系中,酸性越强,则转晶速率越快,这是因为溶液中H+浓度的升高,提高了溶液中HSO4-的浓度,在一定程度上提升了溶液中游离态SO42-的浓度,有利于溶液在较短的时间内达到析晶所需的过饱和度,使反应加快。
由图2还可以看出,不同Ca2+浓度的反应体系,在反应进行1 h内其产物结晶水基本与原料结晶水含量相同,这表明反应1 h内为原料溶解阶段,进一步的详细讨论见2.3节。
2.2pH与Ca2+浓度对产物晶体形貌的影响
图3为8 h条件下产物的场发射扫描电镜照片。由图3可以看出,由于不同反应体系中Ca2+含量与pH的不同,影响转晶过程中晶体的生长习性,使得产物的形貌有所区别;相同的是,6组样本均具有六棱柱晶体构型,这是α-半水硫酸钙晶型的特征。

图3 不同反应条件下产物的TE-SEM照片
选取4个晶型差异较大的初始条件,即图4中的样1、样3、样5和样6进行粒径及长径比分布统计,结果如表2所示。与图3对比后发现,随着应体系中Ca2+浓度升高,产物晶体尺寸增大;而当体系中pH降低时,产物晶体向细针状生长,这对于α-半水硫酸钙是不利的。因为晶体长径比越大,其水化后产物的强度将大大降低,而反应在c(Ca2+)=4.2 mol/L、pH=8.0条件下(图3c)进行时,产物晶体尺寸大,长径比小,晶体结构完整。
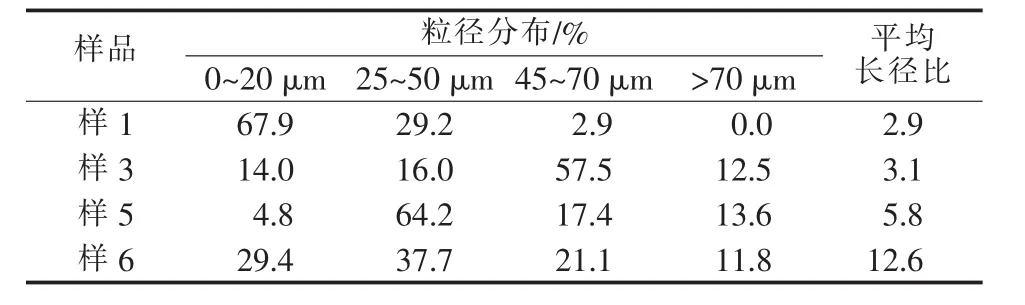
表2 产物粒径分布及平均长径比
因此,转晶反应的进行需要提高Ca2+浓度范围以保证产物质量,但过度提高体系中Ca2+浓度并不一定有利,实验中发现当初始c(Ca2+)>4.2 mol/L时,磷石膏转晶速率极其缓慢,需要反应5 h以上才能发生反应,故选择Ca2+浓度范围需考虑2个制约因素:1)Ca2+浓度提高不利于原料溶解,使得转晶速率变慢;2)Ca2+浓度提高有利于生产出结构性能更好的产物。在此基础上,Ca2+浓度范围可选取3.0~4.0 mol/L,同时为避免产物出现细针状结构,影响水化后产物的力学性能,选取中性-弱碱性的反应环境较为适宜。
α-CaSO4·0.5H2O晶体生长过程中,溶液中离子在其生长界面上进入晶体表面晶格,结合晶面离子并沿纵轴螺旋生长[16]。不同的晶面在离子构成上有所区别,可用SO42-与Ca2+物质的量比来表示其差异。异性离子之间在晶面生长界面上吸附力大于同性离子,因此在高浓度Ca2+环境中,SO42-与Ca2+物质的量比越高的晶面其接纳Ca2+的能力越强,如两侧晶面(200)、(400)、(020),使得其晶面生长更快,致使产物长径比减小,晶体呈短柱状。
反之,当溶液中SO42-含量较高,晶体将有利于SO42-与Ca2+物质的量比小的晶面生长,如晶体顶部晶面(001),晶体长径比将随之增大,pH较低的反应环境中,H+能与SO42-结合形成HSO4-,提高了溶液中游离态SO42-浓度,晶体顶部生长速率将加快,其产物晶体长径比会相应增大。图4为样1、样3和样6的XRD谱图。由图4可见,3个样品主要峰位衍射角分别为14.72°(200)、25.67°(204)和29.69°(400),与α-半水硫酸钙标准卡片(PDF 41-0024)中对应的出峰位置一致,说明所得产物均为α-半水硫酸钙。

图4 部分产物的XRD谱图
2.3 磷石膏溶解动力学研究
本实验转晶过程可视为二水硫酸钙溶解-转晶反应的串联过程。前文提到,二水硫酸钙在水中属于微溶物,二水相溶解过程是整个转晶反应的控制步骤。
在pH为中性的盐溶液反应体系当中,CaCl2作为盐溶液体系的主要溶质,当Ca2+浓度大于2.5 mol/L时,其浓度相对于二水硫酸钙的溶解度而言已大大过量,故反应初磷石膏溶解过程进行时体系中Ca2+浓度可视为常数,因此溶液中SO42-浓度变化即反映了溶解过程进行的快慢。
假定该过程为表面反应控制的固相溶解过程,其溶解速率主要与溶液中溶质的饱和度C*有关,在此基础上建立磷石膏溶解动力学模型:
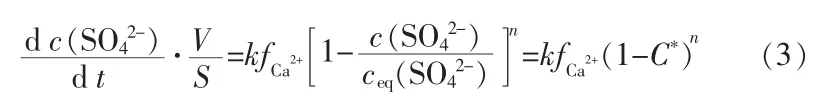
式中,c(SO42-)为溶质中硫酸根浓度,mol/L;k为溶解反应速率常数,mol/(L2·min);fCa2+为Ca2+对溶解过程的阻力,为虚拟参数,与Ca2+浓度及溶液体系的性质相关;n为反应级数;C*为溶质饱和度,参考文献[17]的测定方法得到;V、S分别表示转晶反应体系中的反应体积与反应面积,在溶解过程中可视为常量。原料溶解过程中,溶质溶解量也远小于原料的量,故在溶解过程中反应体积V与反应面积S均可视为不变,将V、S、fCa2+一同并入反应速率常数项,对式(3)进行简化:
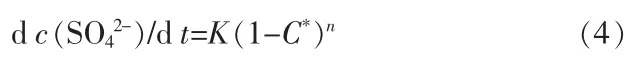
其中K为表观溶解反应动力学常数,K=kfCa2+S/V,与反应温度、体系盐组分含量有关。为简化表达式,可再将式(4)简化:
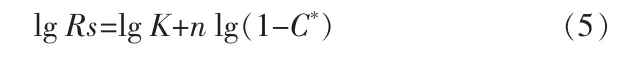
图5为不同Ca2+浓度反应体系下溶解阶段的硫酸根浓度随时间的变化曲线。结合不同体系中的硫酸根溶解平衡数据,可得到Rs与C*的对应关系,分别对其取对数后拟合得到其关系曲线,结果见图6。
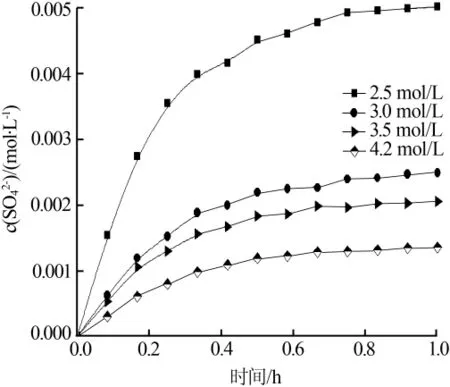
图5 不同Ca2+浓度下硫酸根浓度随时间的变化曲线
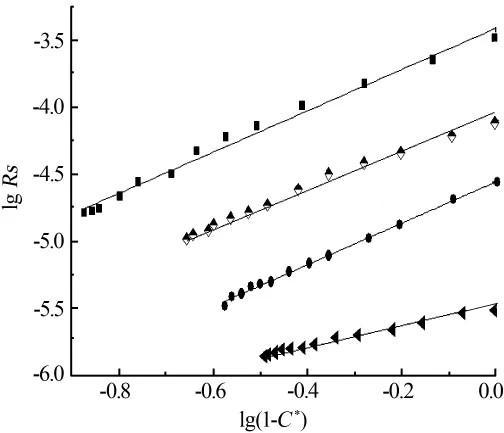
图6lg(1-C*)与lgRs对应关系曲线
由图6可知,各条件下函数拟合结果良好,表明假设成立,该过程确实属于表面反应控制,具体相关动力学数据见表3。由表3可见,在Ca2+浓度为2.5~3.5 mol/L时,溶解过程的表观反应级数数值相差不大,平均反应级数为1.533;而在Ca2+浓度为4.2 mol/L的体系中,其数值偏离前面3个条件下反应级数,这可能是由于Ca2+浓度过高增大了溶液中的离子强度,使得离子之间相互作用力加强,对磷石膏与液相中离子间交换产生了阻碍所导致的[18]。

表3 不同Ca2+浓度初始条件下磷石膏溶解动力学数据
3 结论
1)在96℃常压水热Ca-Mg-K混合盐溶液体系中,采用磷石膏作为原料转晶制备得到了α-半水硫酸钙,并分析pH与Ca2+浓度对磷石膏转晶速率的影响。
2)在中性或弱碱性反应条件下,产物α-半水硫酸钙的晶体形貌更好,颗粒尺寸较大,长径比小,各晶面生长完整;而当反应初始pH降低,产物晶体向细针状生长,长径比增大,颗粒尺寸变小,讨论了反应条件对产物晶体结构的影响机理,得到较为合适的工艺条件。
3)建立磷石膏溶解过程建立溶解动力学模型,通过饱和度C*及瞬时溶解速率Rs进行函数拟合,得到了相应条件下的反应动力学数据。结果表明:模型拟合情况良好(R2>0.98),磷石膏的溶解过程属于表面反应控制,在Ca2+浓度为2.5~3.5 mol/L的中性环境中,溶解反应的表观反应级数相差不大,平均值为1.533。
[1]田立楠.磷石膏综合利用[J].化工进展,2002,21(1):56-59.
[2]杨沛浩.磷石膏的综合利用[J].中国资源综合利用,2009,27(1):13-15.
[3]钱文敏,唐芬,许中俊,等.云南磷石膏综合利用现状及次生环境问题[J].环境科学导刊,2015,34(1):58-60.
[4]周静,邹洪涛,邢焰,等.磷石膏制备纳米氧化钙基二氧化碳吸附剂工艺的优化[J].无机盐工业,2016,48(10):73-76.
[5]谭明洋,张西兴,相利学,等.磷石膏作水泥缓凝剂的研究进展[J].无机盐工业,2016,48(7):4-6.
[6]杨校铃,刘荆风,王辛龙,等.硫磺分解磷石膏制硫化钙工艺研究[J].无机盐工业,2015,47(3):45-48.
[7]Chen H Y,Wang J,Hou S C,et al.Influence of NH4Cl on hydrothermal formation of α-CaSO4·0.5H2O whiskers[J].Journal of Nanomaterials,2015(4):1-6.
[8]杨林,柏山光,曹建新.杂质对硫酸钙晶须形貌及生长过程的影响[J].建筑材料学报,2015,18(1):156-161.
[9]WuXQ,TongS,GuanB,etal.Trans for mationofflue-gas-desulfurization gypsum to α-hemihydrated gypsum in salt solution atmospheric pressure[J].Chinese Journal of Chemical Engineering,2011,19(2):349-355.
[10]丁萌,李建锡,李兵兵.磷石膏制备α半水石膏的试验研究[J].硅酸盐通报,2013,32(11):2379-2384.
[11]Guan B H,Jiang G M,Fu H,et al.Thermodynamic preparation window of alpha calcium sulfate hemihydrate from calcium sulfate dihydrate in non-electrolyte glycerol-water solution under mild conditions[J].Industrial&Engineering Chemistry Research,2011,50(23),13561-13567.
[12]Song X Y,Sun S X,Fan W L,et al.Preparation of different morphologies of caicium sulfate in organic media[J].Journal of Materials Chemistry,2003,13(7),1817-1821.
[13]Thomas F,George P D.Influence of impurities on crystallization kinetics of calcium sulfate dihydrate and hemihydrate in strong HCl-CaCl2solutions[J].Industrial&Engineering Chemistry Research,2013,52(19),6540-6549.
[14]Mao J W,Jiang G,Chen Q S,et al.Influences of citric acid on the metastability of α-calcium sulfate hemihydrate in CaCl2solution[J].Colloids and Surfaces A:Physicochem.Eng.Aspects,2014,443:265-271.
[15]马保国,茹晓红,邹开波,等.常压水热Ca-Na-Cl溶液中用磷石膏制备α-半水石膏[J].化工学报,2013,64(7):2701-2707.
[16]施尔畏,陈之战,元如林等.水热结晶学[M].北京:科学出版社,2004:93-109.
[17]Wu X Q,Wang K M,Xiong Z Y,et al.Solubility of α-calcium sulfate hemihydrate in Ca-Mg-K chloride salt solution at(353.0 to 371.0)K[J].Journal of Chemical and Engineering Data,2013,2013,58(1):48-54.
[18]Tang M L,Li X R,Shen Y S,et al.Kinetic model for calcium sulfate α-hemihydrate produced hydrothermally from gypsum formed by flue gas desulfurization[J].Journal of Applied Crystallography,2015,48(3):827-835.
Effects of pH and Ca2+concentration on formation of α-hemihydrate calcium sulfate by phosphogypsum under atmospheric pressure
Wang Xin,Ji Lijun,Chen Kui,Wu Bin,Wu Yanyang,Zhu Jiawen
(College of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China)
The effects of pH and Ca2+concentration on the reaction rate and crystal morphology of Ca-Mg-K hydrothermal salt solution method preparing α-hemihydrate calcium sulfate by phosphogypsum under atmospheric pressure were investigated.The conversion rates of phosphogypsum in different reaction conditions were obtained by measuring the change of solid and liquid phases in the reaction slurry.The products were determined and characterized by the means of TE-SEM,XRD,and TG.According to the effects of different initial conditions on the crystal morphology of products,the influencing mechanisms under different conditions were investigated.The raw material dissolution kinetics model was established based on surface reaction control mechanism,and the apparent reaction rate constant and reaction order under different initial conditions were obtained by fitting relative parameters.The results showed that the dissolution process of phosphogypsum was controlled by surface reaction.In the neutral environment of Ca2+concentration of 2.5~3.5 mol/L,the apparent reaction order of dissolution reaction was numerical similarity,with an average value of 1.533.
phosphogypsum;α-hemihydrate calcium sulfate;crystal morphology;dissolution kinetics
TQ132.32
A
1006-4990(2017)11-0054-05
2017-05-10
王鑫(1992—),男,硕士,主要研究方向为无机化工。
联系方式:395246152@qq.com

