rhIL-1Ra抑制大鼠颞下颌关节骨关节炎软骨破坏的研究
满城 蒋练 徐凡
rhIL-1Ra抑制大鼠颞下颌关节骨关节炎软骨破坏的研究
满城 蒋练 徐凡
目的探讨关节腔内注射重组人IL-1Ra对实验性大鼠颞下颌关节炎软骨关节修复的影响。方法取SD大鼠24 只,用关节腔内注射II型胶原酶法建立双侧颞下颌关节骨关节炎模型,1 周后,右侧(实验侧)关节腔内一次性注射重组人IL-1Ra 5 μg(稀释于0.05 ml生理盐水),左侧(对照侧)注射等量生理盐水。建模后2 周、4 周各处死12 只动物,取颞下颌关节标本进行HE染色、免疫组化染色及RT-PCR检测,用Mankin评分方法评估TMJ组织病理变化程度。另取1 只SD大鼠用作空白对照,2 周后处死。结果2 周时双侧颞下颌关节软骨均呈现不同程度的关节病损,实验侧和对照侧Mankin计分分别为1.33±0.52和2.00±6.63(P>0.05)。4 周时,实验侧改良和对照侧Mankin评分分别为3.00±0.63和6.50±0.84(P<0.05),ADAMTS-4、5的蛋白及mRNA表达也低于对照侧(P<0.05)。结论颞下颌关节腔内注射重组人IL-1Ra能缓解骨关节炎导致的软骨病损,其治疗机制可能是通过抑制ADAMTS-4、5的表达来实现的。
颞下颌关节(TMJ); 骨关节炎(OA); IL-1Ra; ADAMTS-4; ADAMTS-5
骨关节炎(osteoarthritis, OA)是最常见的骨关节病,主要表现为骨关节的退行性改变。OA的病因尚未完全阐明,一般认为是力学及生物学因素共同作用导致内环境稳定的破坏,软骨细胞、细胞外基质及软骨下骨的合成与降解失衡所致[1],其中细胞外基质(extracellular matrix, ECM)的降解被认为是OA早期最主要的病理改变[2]。Ⅱ型胶原和蛋白聚糖是构成ECM的主要成分,Ⅱ型胶原提供骨架结构,蛋白聚糖提供抗压性。体外研究证实[3],蛋白聚糖降解先于Ⅱ型胶原发生。因此,保护蛋白聚糖不被降解对保护关节软骨的完整性具有重要意义。本实验通过II型胶原酶注射法建立大鼠颞下颌关节OA模型,观察关节腔内注射重组人IL-1Ra对OA的治疗作用。
1 材料与方法
1.1 实验动物
取25 只2 月龄雄性Sprague-Dawley(SD)大鼠(第三军医大学动物实验中心提供),体重200~220 g,无明显口颌系统疾病,饲养1 周让动物熟悉环境。
1.2 实验试剂
大鼠注射用II型胶原酶,重组人IL-1Ra购于上海近岸蛋白质科技有限公司;ADAMTS-4、ADAMTS-5多克隆抗体购于英国Abcam公司;ADAMTS-4、5及内参β-actin引物由上海生工合成(表 1)。

表 1 PCR引物
注: F: Forward primer; R: Reverse primer
1.3 实验方法
1.3.1 麻醉 0.3%戊巴比妥钠(1 ml/100 g)腹腔注射。
1.3.2 注射 麻醉效果满意后,剪除双侧关节区毛发,碘伏消毒,触摸颧弓后下方,采用1 ml胰岛素注射器(30 G针头),循颧弓后方进针,直抵骨面,稍后退,推注生理盐水,如能回抽出生理盐水,即证明针尖位于关节腔内,反之,则需调整进针方向或深度。
1.3.3 处理 麻醉下双侧关节腔一次性注射2% II型胶原酶0.05 ml建模,1 周后右侧(实验侧)关节腔内一次性注射重组人IL-1 Ra 5 μg(稀释于0.05 ml生理盐水),左侧(对照侧)注射等量生理盐水。建模后2、4 周各处死12 只动物,其中随机选取6 只用于HE及免疫组化染色,6 只用于RT-PCR检测。空白对照组不作任何处理。
1.4 检测方法
1.4.1 标本处理 取出双侧颞下颌关节组织,10%中性甲醛溶液固定,脱钙液脱钙,37 ℃水浴。约2 周后常规脱水石蜡包埋切片。
1.4.2 HE染色 每个标本选取5 个部位参照改良Mankin法(表 2)对OA的病损程度进行组织学评分。
1.4.3 免疫组化染色 常规切片脱蜡,抗原修复,灭活内源性酶。孵育一抗:1∶200稀释一抗,4 ℃冰箱过夜。PBS洗3 次,每次5 min。孵育二抗:37 ℃孵育30 min,PBS洗3 次,每次5 min。DAB显色,蒸馏水终止反应。苏木精复染8 min,梯度酒精脱水,中性树胶封片镜检。图像分析:每张切片选取5 个视野,OLYMPUS BX43显微镜下放大200 倍,采用Image-Pro Plus图像分析软件测定阳性染色平均累积吸光度(A值),用改良Mankin评分法计分(表 2)。
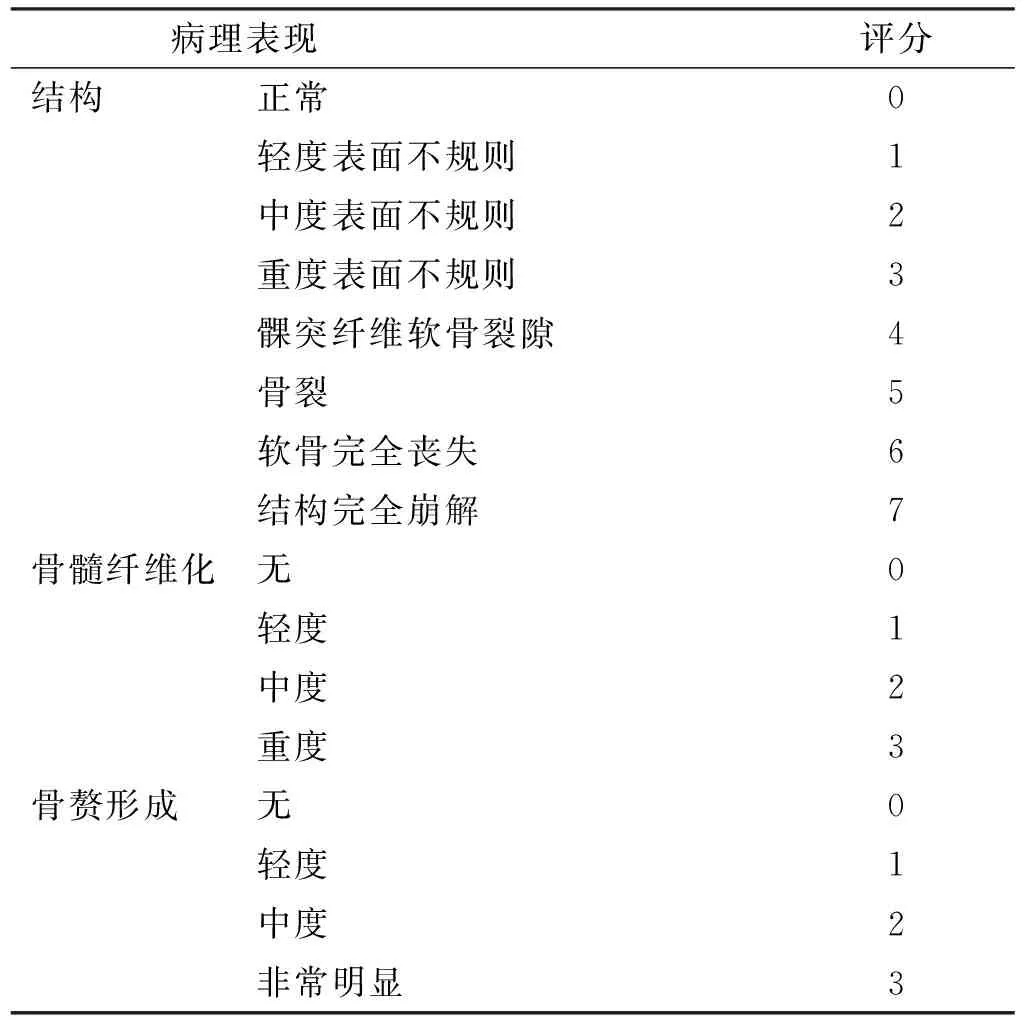
表 2 颞下颌关节Mankin评分
1.4.4 RT-PCR 完整剥离髁突软骨组织,取10 mg于液氮中研磨,放入-80 ℃冰箱中保存。应用Trizol(Invitrogen公司,美国)试剂盒,按操作手册要求提取总RNA并溶解于DEPC水中,紫外线分光度计检测样品吸光度。每组取2 μl总RNA采用“两步法”逆转录为cDNA。将cDNA按1∶5稀释后,取1 μl cDNA进行PCR扩增。扩增完毕后取5 μl产物与2 μl上样buffer混合在1.5%的琼脂糖凝胶电泳,用Image-Pro Plus软件对图片进行吸光度分析,以β-actin作为内参,目的条带的吸光度值除以对应内参的吸光度值计算出目的基因的相对表达量。
1.5 统计学处理
2 结 果
2.1 HE染色
2.1.1 空白对照侧 无明显病理学改变,髁突软骨表面光滑且连续,由表及里可分为纤维层、增殖层、肥大层和钙化软骨层,4 层结构排列紧密,层次清楚,细胞排列整齐(图 1)。

图 1 2 月龄SD大鼠颞下颌关节软骨组织形态特点
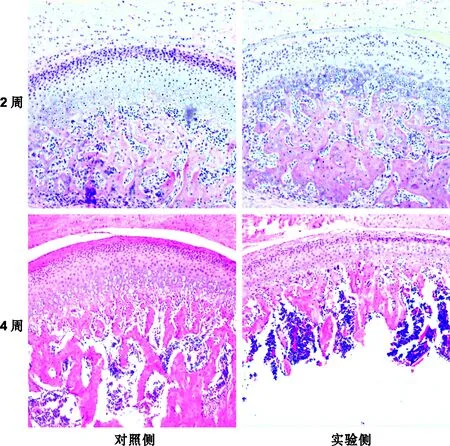
图 2 关节腔内注射IL-1Ra 4 周后颞下颌关节组织学改变 (HE,×100)
Fig 2 Histological feature of TMJ 4 weeks after injection of IL-1Ra into the TMJ cavity (HE,×100)
2.1.2 实验侧与对照侧 2 周时,对照侧关节盘及髁突表面胶原纤维轻微裂解,髁突表面凹凸不平。髁突软骨细胞数量减少,细胞层次不清。实验侧关节盘及髁突表面胶原纤维裂解稍减轻,髁突表面较光滑。髁突软骨细胞数量增多,细胞层次较为清晰。对照侧和实验侧改良Mankin法评分为2.00±0.63和1.33±0.52(P>0.05)。
4 周时,对照侧关节盘及髁突表面胶原纤维出现崩解现象,关节软骨萎缩。髁突软骨细胞数量明显减少,近骨组织处关节软骨崩解。实验侧关节盘及髁突表面胶原纤维未见崩解现象。髁突软骨细胞明显增殖,细胞数量增多,近骨组织处软骨缺乏崩解。对照侧和实验侧改良Mankin法评分为6.50±0.84和3.00±0.63(P<0.05)(图 2)。
2.2 免疫组化染色
2 周时实验侧ADAMTS-4、5蛋白阳性表达细胞与对照侧无明显差异(P>0.05),4周时实验侧ADAMTS-4、5蛋白阳性表达细胞均低于对照侧(P<0.05),4 周时实验侧ADAMTS-4、5蛋白阳性表达细胞均较2 周实验侧无明显差异(P>0.05)(图 3)。
2.3 RT-PCR
2 周和4 周时实验侧ADAMTS-4、5 mRNA表达均低于对照侧(P<0.05),4 周时实验侧ADAMTS-4、5 mRNA表达均高于2 周实验侧(P<0.05)(图 4)。
3 讨 论
蛋白聚糖酶属于ADAMTS 家族,其中ADAMTS-1、4、5、8、9及15具有降解蛋白聚糖的作用,因此也被称为蛋白聚糖酶,ADAMTS-4、5是最重要的蛋白聚糖酶[4],在蛋白聚糖的降解过程中起决定性作用。截止现在,在体外细胞培养及动物实验方面,对ADAMTS-4、5的研究已经取得了很大进展,在对小鼠的研究中,分别通过敲除ADAMTS-4、5基因,来观察手术诱导OA模型下小鼠OA的发展变化,得出结论ADAMTS-5在小鼠OA的病变起主要作用,而ADAMTS-4几乎不起作用[5-6];同时敲除ADAMTS-4、5基因后,仍然是手术诱导OA模型,发现实验组小鼠的OA相比正常组明显改善;这2组实验证明了针对ADAMTS-5的治疗对小鼠OA的治疗是有效的[7],然而针对小鼠的研究并不能说明ADAMTS-4、5在人关节软骨中也起到相同的作用,随着生物技术的发展,通过TNF-α和OSM联合诱导正常人关节软骨细胞,利用小干扰RNA(siRNA)技术来抑制ADAMTS-4、5的表达,发现无论是抑制ADAMTS-4或ADAMTS-5,蛋白聚糖的降解会被明显抑制。提示ADAMTS-4、5在人和小鼠中的作用不同,它们均在人OA的发展中起作用[4]。
图 3 颞下颌关节软骨组织中ADAMTS-4、5蛋白表达 (DAB,×200)
Fig 3 Protein expression of ADAMTS-4 and ADAMTS-5 in the cartilage of TMJs (DAB,×200)
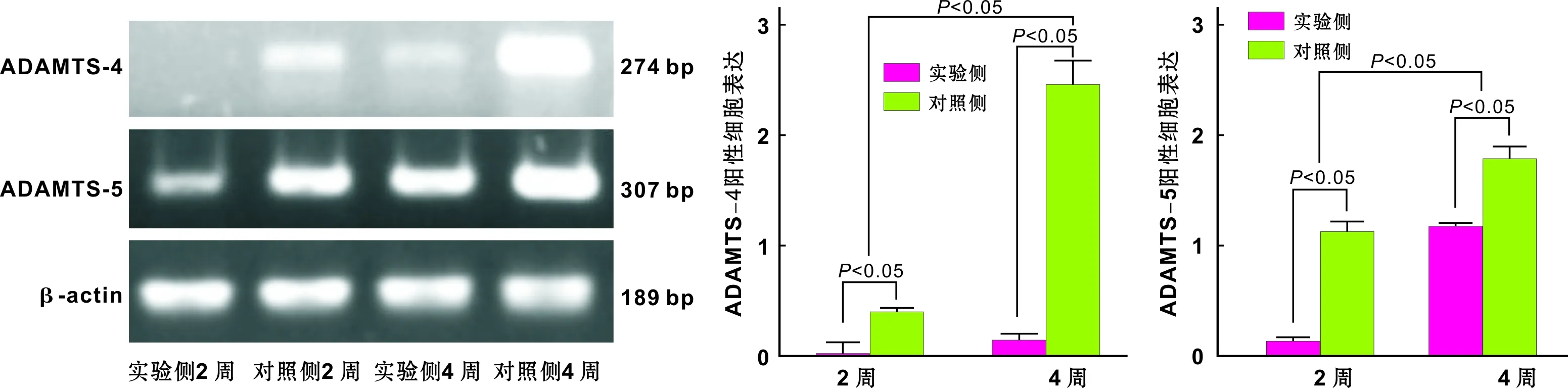
图 4 颞下颌关节软骨组织中ADAMTS-4、5 mRNA表达
IL-1被认为是骨关节炎发生发展中的中心环节[8]。可以诱导蛋白聚糖酶的表达,但其诱导机制并没有完全阐明,在对牛鼻软骨细胞的体外培养中,Pratta等[9]利用IL-1进行干预,发现ADAMTS-4的活性显著升高。Sheu等[10]对小鼠关节软骨的体外培养研究中发现,经IL-1β干预后ADAMTS-5的表达增高。但HU等[11]发现,经IL-1β干预的人软骨细胞体外培养时ADAMTS-4、5均升高,而且这种升高被认为是有个体差异的[12]。虽然这些实验结果不同甚至是相互矛盾,但均提示抑制IL-1的表达,可以起到保护关节软骨的作用。
IL-1Ra是IL-1特异性拮抗因子,在关节内的主要作用是对抗IL-1的生物效力[13]。在OA患者的软骨细胞和滑膜细胞中,均可见IL-Ra蛋白显著增高,但是相比IL-1的增高幅度,IL-1Ra/IL-1比值明显减小[14]。本研究证明在药物诱导大鼠TMJOA 4周内,通过关节腔内注射重组人IL-1Ra的方式能降低OA的病损程度。
本实验结果显示,2 周时实验侧ADAMTS-4、5蛋白阳性表达细胞与对照侧无明显差异,4 周时实验侧ADAMTS-4、5蛋白阳性表达细胞均低于对照侧,这与组织学大体标本观察结果相符,然而却与ADAMTS-4、5核酸水平表达不一致,2 周和4 周时ADAMTS-4、5 mRNA表达均低于对照侧,这可能是由于蛋白表达滞后于基因表达所致。4 周时实验侧ADAMTS-4、5蛋白阳性表达细胞均较2周实验侧无明显差异,这与ADAMTS-4、5核酸水平表达也不相同,4 周时实验侧ADAMTS-4、5 mRNA表达均高于2 周实验侧。这种不同可能是免疫组化主要用于蛋白定位,无法精确定量所致。本实验表明颞下颌关节腔内注射IL-1Ra可以缓解早期OA的软骨病损,其作用机制可能是通过抑制ADAMTS-4、5的表达实现的。
本实验初步探讨了抑制ADAMTS-4、5后TMJOA的病理变化,为以后靶向药物的研发提供一定的参考。
[1] Berenbaum F. New horizons and perspectives in the treatment of osteoarthritis[J].Arthritis Res Ther, 2008, 10 Suppl 2: S1.
[2] Hardingham T. Extracellular matrix and pathogenic mechanisms in osteoarthritis[J].Curr Rheumatol Rep, 2008, 10(1): 30-36.
[3] Fosang AJ, Rogerson FM, East CJ, et al. ADAMTS-5: The story so far[J].Eur Cell Mater, 2008, 15: 11-26.
[4] Song RH, Tortorella MD, Malfait AM, et al. Aggrecan degradation in human articular cartilage explants is mediated by both ADAMTS-4 and ADAMTS-5[J].Arthritis Rheum, 2007, 56(2): 575-585.
[5] Stanton H, Rogerson FM, East CJ, et al. ADAMTS5 is the major aggrecanase in mouse cartilageinvivoandinvitro[J]. Nature, 2005, 434(7033): 648-652.
[6] Glasson SS, Askew R, Sheppard B, et al.Deletion of active ADAMTS5 prevents cartilage degradation in a murine model of osteoarthritis[J]. Nature, 2005, 434(7033): 644-648.
[7] Majumdar MK, Askew R, Schelling S, et al.Double-knockout of ADAMTS-4 and ADAMTS-5 in mice results in physiologically normal animals and prevents the progression of osteoarthritis[J].Arthritis Rheum, 2007, 56(11): 3670-3674.
[8] 陈瞰, 满城, 胡静, 等. 白细胞介素-1受体拮抗剂抑制兔颞下颌关节骨关节炎软骨破坏的研究[J]. 实用口腔医学杂志, 2011, 27(5): 589-592.
[9] Pratta MA, Scherle PA, Yang G, et al. Induction of aggrecanase 1(ADAM-TS4) by interleukin-1 occurs through activation of constitutively produced protein[J]. Arthritis Rheum, 2003, 48(1): 119-133.
[10]Sheu SY, Ho SR, Sun JS, et al. Arthropod steroid hormone(20-Hydroxyecdysone) suppresses IL-1β-induced catabolic gene expression in cartilage[J]. BMC Complement Altern Med, 2015, 15: 1.
[11]Hu P, Chen W, Bao J, et al. Cordycepin modulates inflammatory and catabolic gene expression in interleukin-1beta-induced human chondrocytes from advanced-stage osteoarthritis: Aninvitrostudy[J]. Int J Clin Exp Pathol, 2014, 7(10): 6575-6584.
[12]Imada K, Oka H, Kawasaki D, et al. Anti-arthritic action mechanisms of natural chondroitin sulfate in human articular chondrocytes and synovial fibroblasts[J]. Biol Pharm Bull, 2010, 33(3): 410-414.
[13]Jacques C, Gosset M, Berenbaum F, et al. The role of IL-1 and IL-1Ra in joint inflammation and cartilage degradation[J].Vitam Horm, 2006, 74: 371-403.
[14]Caron JP, Fernandes JC, Martel-Pelletier J, et al. Chondroprotective effect of intraarticular injections of interleukin-1 receptor antagonist in experimental osteoarthritis. Suppression of collagenase-1 expression [J]. Arthritis Rheum, 1996, 39(9): 1535-1544.
Theeffectsofrecombinanthumaninterleukin-1receptorantagonistonthecartilagerepairinrattemporomandibularjointwithosteoarthritis
MANCheng,JIANGLian,XUFan.
563000,DepartmentofOralandMaxillofacialSurgery,StomatologicalHospital,ZunyiMedicalCollege,China
Objective: To investigate the effects of recombinant human interluekin-1 receptor antogonist(rhIL-1Ra) on the cartilage repair in rat temporomandibular joint(TMJ) with osteoarthritis(OA).MethodsCollagenase-II was injected into bilateral TMJs of 24 adult rats for the induction of bilateral TMJOA, 1 week after injection, 5μg rhIL-1Ra(diluted in 0.05 ml normal saline) was injected into each right TMJ and the left joint
the same amount of normal saline injection as the control. 12 animals were sacrificed at 2 and 4 weeks after the first injection respectively. HE staining, immunnohistochemical method and RT-PCR examination were conducted. Mankins scere was used to evaluate the TMJOA degree. 1 adult SD rat was used as healthy control, and sacrificed at 2 weeks of the experiment.ResultsThe TMJs of both sides showed typical OA-related cartilage degradation 2 week after IL-1Ra treatment, the Mankin's score of the IL-1Ra treated and control joints was 1.33±0.52 and 2.00±6.63(P>0.05), 4 week after treatment that was 3.00±0.63 and 6.50±0.84(P<0.05), respectively. Lower expression of ADAMTS-4 and ADAMTS-5 was observed in the treated joints than in the controls(P<0.05).ConclusionIntra-articular injection of IL-1Ra into TMJ can alleviate the cartilage lesion, the mechanism may lie in the inhibition of the expression of ADAMTS-4 and ADAMTS-5.
Temporomandibularjoint(TMJ);Osteoarthritis(OA);IL-1Ra;ADAMTS-4;ADAMTS-5
贵州省科技厅联合基金(编号: 黔科合J字LKZ[2013]09号); 遵义医学院博士启动基金(编号: F-458)
563000, 遵义医学院附属口腔医院[满城 蒋练 徐凡(现在孝感市中心医院)]
徐凡 0851-28608120 E-mail: 13797189527@163.com
R782.6
A
10.3969/j.issn.1001-3733.2017.04.003
(收稿: 2016-11-18 修回: 2017-02-14)

