食用油加工过程中3-氯丙醇脂肪酸酯生成的影响因素研究
王风艳 周澍堃 刘孟涛 李晓龙 王满意
(营养健康与食品安全北京市重点实验室;老年营养食品研究北京市工程实验室;中粮营养健康研究院有限公司,北京 102209)
食用油加工过程中3-氯丙醇脂肪酸酯生成的影响因素研究
王风艳 周澍堃 刘孟涛 李晓龙 王满意
(营养健康与食品安全北京市重点实验室;老年营养食品研究北京市工程实验室;中粮营养健康研究院有限公司,北京 102209)
本研究3-氯丙醇脂肪酸酯(3-MCPDE)在4种常用食用油脂中的含量,及影响其生成的主要因素。分析了大豆油、菜籽油、玉米油、葵花籽油4个油品中的3-MCPDE含量,所选油脂样品中均检测出3-MCPDE,并且3-MCPDE含量由高到低的顺序为玉米油>葵花籽油>菜籽油>大豆油。以玉米毛油为原料,考察了脱胶、脱酸、脱色、脱臭等精炼工段对3-MCPDE的影响。结果表明,3-MCPDE主要在脱臭阶段生成,并且随着脱臭温度的上升,3-MCPDE生成量上升,随着脱臭时间的延长,3-MCPDE的含量先增加后趋于平稳。考察了在脱色玉米油中添加不同量的氯和甘油二脂(DAG)2种前体物质对脱臭玉米油中3-MCPDE的影响。结果表明随着氯含量及DAG含量的增加,3-MCPDE呈现先迅速增长后趋于平稳的趋势。
氯丙醇脂肪酸酯 食用油 加工过程 危害因子
1978年,3-氯-1,2-丙二醇(3-MCPD)被发现是酸水解蛋白等含脂食品的加工污染物从而引起广泛关注。随着研究的不断深入,人们发现食品中的3-MCPD多数以酯的形式存在。Svejkovská等[1]于2004年报道了多种加工食品中存在3-MCPDE。油脂中3-MCPD多数是以脂肪酸酯的形式存在的(即3-MCPDE),游离形式很少。大量研究发现在多种食用油中均检测出较高水平的3-MCPDE[2-5],自此油脂中3-MCPDE污染的问题逐渐被重视。2009年,在检测日本花王集团的“Econa”烹调油产品中3-MCPDE的过程中发现产品中同时存在大量的缩水甘油酯,导致“Econa”烹调油及其相关12类产品被迫下架。
目前,已经有多个国家和地区的研究机构开始对油脂中的3-MCPDE含量进行了监测评估[6-7]。德国化学与兽医调查研究所(CVUA)的抽样调查结果显示,天然未精炼的植物油没有或存在微量3-MCPDE(<0.1mg/kg),经过精炼以后的植物油中3-MCPDE含量显著(>0.4 mg/kg)。卢跃鹏等[8]对10个植物油品种的491批次食用植物油样本中的3-MCPDE含量进行监测分析,结果显示3-MCPDE检出率为83.3%,检出结果范围为0.104~8.580mg/kg油,其中,以棕榈油和油茶籽油中3-MCPDE的含量最高。3-MCPDE问题已经成为油脂行业广泛关注的难题。
德国联邦风险评估机构(BfR)和欧盟食品安全局(EFSA)评估后认为3-MCPDE可以在胃肠道内完全水解生成3-MCPD。3-MCPD具有肾脏毒性,被国际癌症组织(IARC)划分为2B类致癌物。联合国食品添加剂专家委员会(JECFA)进行评估后制定了3-MCPD的限量标准,TDI值为每日不超过2 μg/kg体重。
3-MCPDE对油脂行业的影响已经非常明显,然而目前国内外的研究主要集中于3-MCPDE的形成机理及检测方法等的研究,而对于如何控制或降低油脂中的3-MCPDE研究较少。因此,在分析4种常用食用油脂中的3-MCPDE含量的基础上,对精炼工段及条件、前体物质含量等对3-MCPDE生成的影响进行了研究,以期为油脂中3-MCPDE含量的控制研究提供参考。
1 材料与方法
1.1 试验材料
大豆油、菜籽油、玉米油、葵花籽油等4种食用油共39个样品:市售。
1.2 仪器与试剂
1.2.1 仪器
安捷伦 GC 7890B-5977 MS气相色谱-质谱联用仪、HP-5MS 色谱柱(30 m×0.25 mm×0.25 μm):安捷伦科技有限公司;TTL-DC Ⅱ氮吹仪:北京同泰联科技发展有限公司。
1.2.2 标准品与试剂
1,2-二亚油酸-3-氯丙醇酯标品(纯度98%)/氘代同位素1,2-二月桂酸-3-氯丙醇酯(d5-3-MCPDE,纯度98%):加拿大 Toronto Research Chemicals公司;甲基叔丁基醚(色谱纯)、苯基硼酸(分析纯):德国Sigma-Aldrich公司。
1.3 试验方法
1.3.1 精炼过程对3-MCPDE形成的影响
1.3.1.1 磷酸水化脱胶对3-MCPDE形成的影响
将玉米毛油称重后边搅拌边升温至75 ℃,加入0.1%油重磷酸溶液,加10%油重的水,保持反应30 min,趁热离心取轻相,测定油脂中3-MCPDE含量。
1.3.1.2 脱酸对3-MCPDE形成的影响
将脱胶后玉米油搅拌预热至85 ℃,根据原料酸价配制碱液,缓慢滴加碱液,搅拌反应15 min,趁热离心取轻相,在105 ℃真空条件下干燥,取样测定油脂中3-MCPDE含量。
1.3.1.3 脱色
真空条件下将干燥后玉米油搅拌升温至110 ℃,加入2.5%的白土反应30 min,破除真空将白土过滤去除,取样测定油脂中3-MCPDE含量。
1.3.1.4 脱臭
真空条件下将脱色玉米油加热至240 ℃进行脱臭,真空<0.5 mmHg,脱臭时间90 min,取样测定油脂中3-MCPDE含量。
1.3.2 脱臭条件的影响
取脱色玉米油5份,每份500 g,分别在220、230、240、250、260 ℃下进行脱臭,脱臭时间90 min,取样测定油脂中3-MCPDE含量。
另取脱色玉米油5份,每份500 g,在240 ℃下进行脱臭,脱臭时间分别为60、90、120、150、180 min,取样测定油脂中3-MCPDE含量。
1.3.3 氯的影响试验
取脱色玉米油5份,每份500 g,分别添加0、0.2、0.4、0.6、0.8、1.0 mg/kg(以脱色油重量计)的氯,在240 ℃下进行脱臭,脱臭时间90 min,取样测定油脂中3-MCPDE含量。
1.3.4 DAG含量影响试验
取脱色玉米油5份,每份500 g,分别添加0%、0.2%、0.4%、0.6%、0.8%(以脱色油质量计)的DAG,在240 ℃下进行脱臭,脱臭时间90 min,取样测定油脂中3-MCPDE含量。
1.3.5 3-氯丙醇酯的检测方法
参照AOCS Cd 29a-13方法测定油脂中的3-MCPDE含量,即在酸性甲醇溶液中,植物油脂中的3-MCPDE会转化为游离的3-MCPD,3-MCPD用苯基硼酸衍生后进行气相色谱-质谱法分析。以3-MCPD含量评价植物油脂中3-MCPDE的含量,内标法定量。
1.3.5.1 酸水解
称取(100±5) mg样品,加入内标d5-3-MCPDE标准品溶液和2 mL甲基叔丁基醚(MTBE),涡旋10 s使其充分混匀。加入1.8 mL硫酸/甲醇溶液后,置于(40±1) ℃恒温振荡16 h。反应完成后,加入0.5 mL饱和氯化钠溶液,涡旋以终止反应,以待净化。
1.3.5.2 净化
向待净化液中依次加入2 mL硫酸钠溶液和2 mL正己烷,涡旋后静置5 min,待分层后弃去正己烷,并用正己烷重复洗涤1次。随后加入1 mL乙酸乙酯/乙醚混合溶液,分层后将上层溶液转移至装有少量无水硫酸镁的玻璃试管中,重复提取3次,待衍生化反应。
1.3.5.3 衍生化
向提取液中加入200 μL苯基硼酸,涡旋后静置。氮吹至全干,然后加入500 μL正己烷复溶,涡旋后用滤膜过滤转移至进样小瓶。
1.3.5.4 GC-MS分析
色谱条件:85 ℃保持12 min;以20 ℃/min的速率升温至165 ℃,保持10 min;然后以20 ℃/min 的速率升温至300 ℃,保持8 min。进样口温度250 ℃。载气为高纯氦气,流速1 mL/min;进样体积1 μL。
质谱条件:电子轰击离子源(EI),离子源温度230 ℃;四极杆温度150 ℃;扫描方式为离子监测(SIM)模式。
2 结果与讨论
2.1 市售4种油品中3-MCPDE含量
此次抽样调查发现所采集的植物油中均存在3-MCPDE的污染,且不同油脂品种3-MCPDE含量水平差异较大,见表1。玉米油中3-MCPDE含量最高,检出结果范围为0.342~2.693 mg/kg,中位数0.879 mg/kg;其次是葵花籽油,检出结果范围为0.309~1.158 mg/kg,中位数0.881 mg/kg;菜籽油和大豆油中3-MCPDE含量较低(中位数0.476 mg/kg和0.425 mg/kg)。分析原因,不同油料中3-MCPDE的前体物质(如氯和甘油二酯等)含量不同;在精炼工艺中,不同油料的精炼工艺及精炼参数也有所差异。
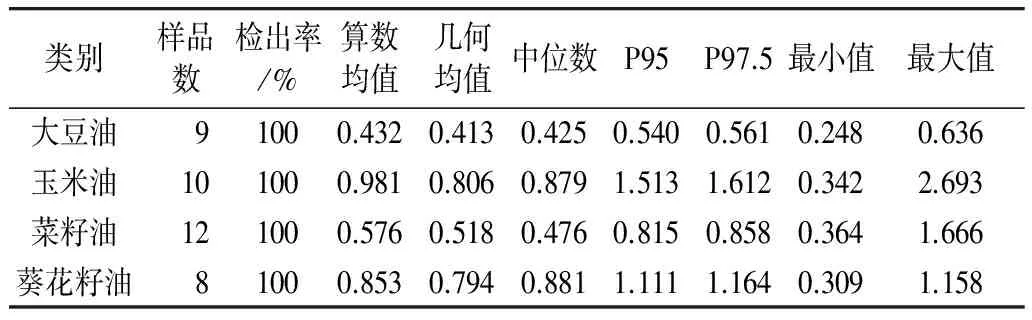
表1 市售食用植物油中3-MCPDE含量的分布情况/mg/kg
相比较2008年CVUA的抽样调查,本次调查中4种精炼植物油3-MCPDE含量均在低含量组(0.5~1.5 mg/kg),与CVUA将大豆油、菜籽油、葵花籽油归于低含量组结果一致;与玉米油归于中含量组(1.5~4.0 mg/kg)有所区别。在调查10份玉米油样品中,检出结果范围为0.342~2.693 mg/kg,反映了目前市场上不同玉米油3-MCPDE含量差异较大。
2.2 不同精炼工段对3-MCPDE的影响
以玉米油为研究对象,考察不同精炼工段对3-MCPDE形成的影响,结果如图1所示。从图1中可以看出,3-MCPDE主要生成于脱臭阶段。脱臭前3-MCPDE含量极低(<0.05 mg/kg)。毛油经过脱胶、脱酸、脱色工艺,3-MCPDE含量没有发生明显变化。脱臭后3-MCPDE含量显著升高,从0.046 mg/kg增加至0.379 mg/kg,说明脱臭工艺为生成3-MCPDE主要工艺阶段,这与文献[9-11]报道中对于菜籽油、葵花籽油及花生油等在各精炼工序中脱臭工序中3-MCPDE生成量最多结论一致,说明高温是引起3-MCPDE大量生成的重要因素。

图1 不同精炼工段对3-MCPDE的影响
2.3 脱臭温度对3-MCPDE的影响
考察了不同脱臭温度对脱臭玉米油3-MCPDE的生成的影响,结果如图2所示。从图2中可以看出,随着脱臭温度的增加,3-MCPDE的生成量显著增加。与脱臭温度220 ℃相比,在230~260 ℃温度范围内3-MCPDE值含量大幅升高,特别是当温度升高至260 ℃,3-MCPDE的含量约为220 ℃时的6倍。表明样品油中含有大量的3-MCPDE的前体物质(如甘油二酯、氯离子等),只要有足够高的温度,前体物质会大量反应转化为3-MCPDE。因此,脱臭温度是3-MCPDE生成最重要条件之一。
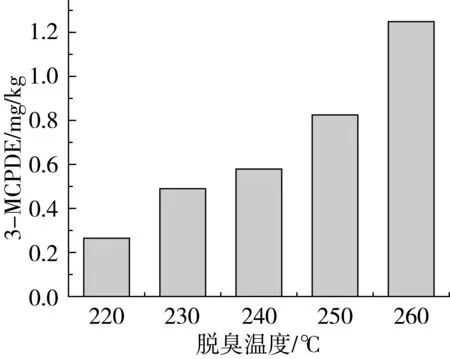
图2 脱臭温度对3-MCPDE的影响
2.4 脱臭时间对3-MCPDE的影响
考察了不同脱臭时间对3-MCPDE的影响,结果如图3所示。从图3中可以看出,随着脱臭时间的延长,在60~120 min内,3-MCPDE的含量显著增加;随着脱臭时间在120~180 min,3-MCPDE的含量趋于平稳,这与Shimizu等[12-13]的研究结果相似。Pudel等[14]研究发现,脱臭温度和脱臭时间对3-MCPDE的生成均具有显著影响,当脱臭温度在240 ℃时随着脱臭时间从1.5 h延长至6 h时,3-MCPDE的含量呈下降趋势,表明在脱臭过程中3-MCPDE可以随着水蒸气一起被蒸馏至脱臭馏出物中。

图3 脱臭时间对3-MCPDE的影响
2.5 氯含量对3-MCPDE的影响
氯是形成3-MCPDE的主要前体之一[5,13,15-17]。在脱色玉米油中添加不同含量的氯然后再进行脱臭,脱臭油中的3-MCPDE含量结果如图4所示。从图4中可以看出,随着氯离子的添加,在0~0.4 mg/kg的添加量下,3-MCPDE的含量呈现近似直线增加的趋势;在0.4~1.0 mg/kg添加量下,3-MCPDE的含量增加趋势减缓,在1.0~2.0 mg/kg添加量下,3-MCPDE的含量趋于平稳。这一变化趋势与Shimizu等[13]的研究结果一致。在油脂精炼的各个工段中所使用的酸、碱、脱色助剂、水蒸气等都有可能向样品中引入氯离子,因此筛选精炼助剂降低氯的引入是控制3-MCPDE生成重要的措施之一。
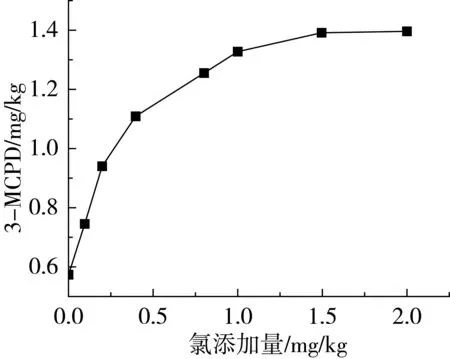
图4 氯含量对3-MCPDE的影响
2.6 DAG含量对3-MCPDE的影响
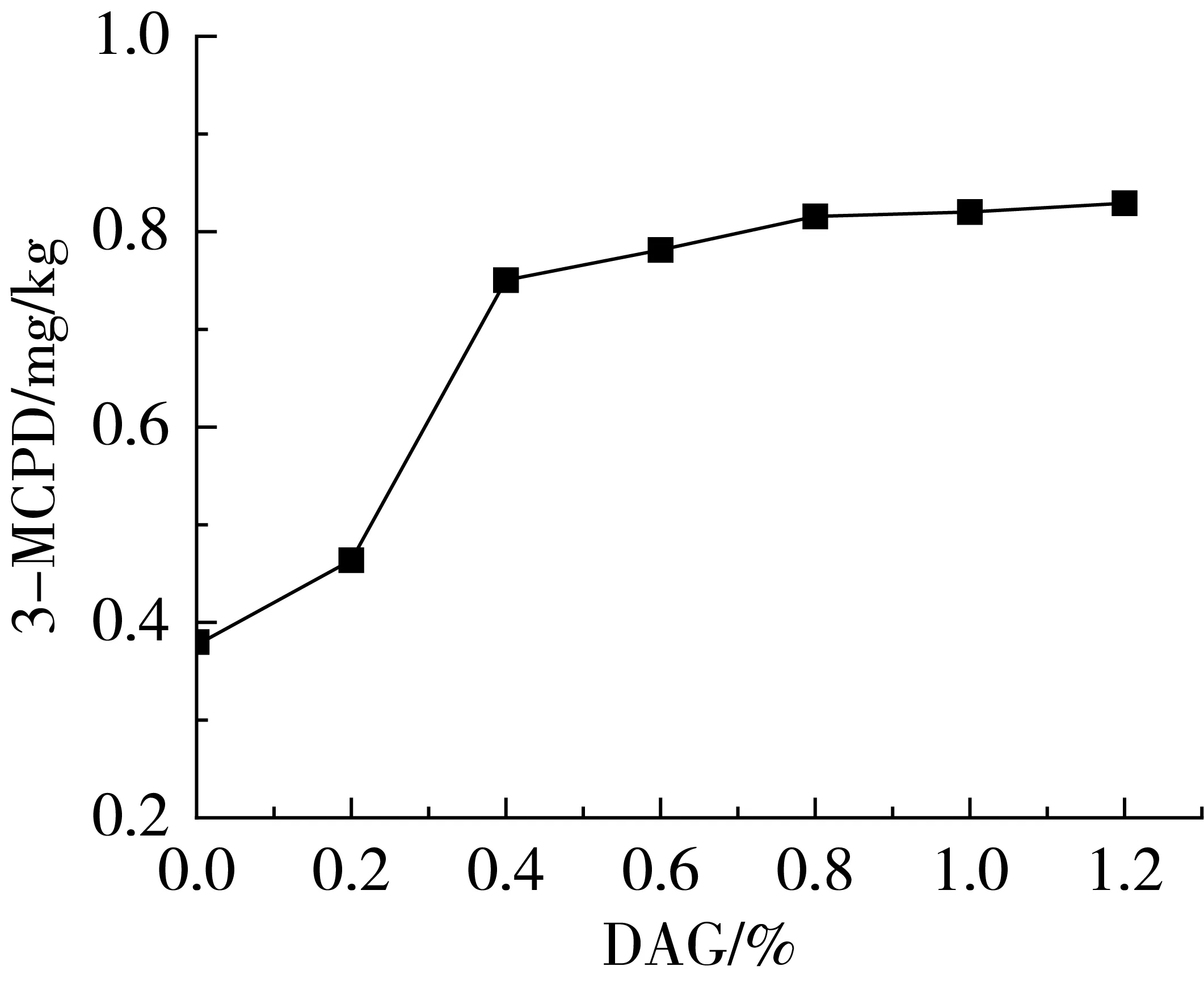
图5 DAG含量对3-MCPDE的影响
DAG是形成3-MCPDE的另一个重要前体[18-20]。在脱色玉米油中添加不同含量的DAG然后再进行脱臭,脱臭油中的3-MCPDE含量结果如图5所示。从图5中可以看出,随着DAG含量的添加,在0%~0.4%的添加量下,3-MCPDE的含量呈现明显增加的趋势;随着DAG含量的进一步增加,3-MCPDE的含量趋于平缓。除DAG之外,油脂样品中的甘油一酯(MAG)等极性组分也可能是形成3-MCPDE的重要前体[18],但MAG生成3-MCPDE的速率远低于DAG。因此,降低DAG的含量是控制3-MCPDE生成的重要措施之一,可以通过优选低DAG含量的新鲜油脂原料或筛选合适的精炼助剂去除油脂原料中DAG等措施降低3-MCPDE的生成。
3 结论
食用植物油中普遍存在3-MCPDE污染,不同油种间含量差异较大,所选4种油脂样品中玉米油的3-MCPDE含量最高。脱臭工段是3-MCPDE生成的最主要工段,脱臭温度、脱臭时间均影响3-MCPDE的生成,降低脱臭温度、缩短脱臭时间均有利于控制3-MCPDE的生成。氯和DAG等是影响3-MCPDE生成的关键前体物质,氯或DAG含量的增加均会导致3-MCPDE含量的迅速升高,但当反应趋于平衡时再增加氯或者DAG的含量则3-MCPDE趋于平稳。因此,脱臭温度和前体物质才是控制3-MCPDE生成的关键条件。所以,控制植物油中3-MCPDE含量可行的办法是:采用优质原料、降低脱臭温度、减少辅料中氯离子引入等。
[1]Svejkovska B, Novotny O, Divinova V, et al.Esters of 3-chloropmpane-1,2-diol in foodstuffs [J]. Czech Journal of Food Science, 2004, 22 (5): 190-196
[2]Weißhaar R, Determination of total 3-chloropropane-1,2-diol (3-MCPD) in edible oils by cleavage of mcpd esters with sodium methoxide [J]. European Journal of Lipid Science and Technology, 2008, 110 (2): 183-186
[3]Razak R A Abd, Kuntom A, Siew W L, et al. Detection and monitoring of 3-Monochloropropane-1,2-Diol (3-Mcpd) esters in cooking oils [J]. Food Control, 2012, 25 (1): 355-360
[4]Seefelder W, Varga N, Studer A, et al. Esters of 3-chloro-1,2-propanediol (3-MCPD) in vegetable oils: significance in the formation of 3-MCPD [J]. Food Additives and Contaminants: Part A, 2008, 25 (4): 391-400
[5]Destaillats F, Craft B D, Sandoz L, et al. Formation Mechanisms of monochloropropanediol (MCPD) fatty acid diesters in refined palm (elaeis guineensis) oil and related fractions [J]. Food Additives and Contaminants: Part A, 2012, 29 (1): 29-37
[6]Authority E F S. Analysis of occurrence of 3-monochloropropane-1, 2-diol (3-MCPD) in food in europe in the years 2009-2011 and preliminary exposure assessment [J]. EFSA Journal, 2013, 11 (9): 3381
[7]Jędrkiewicz R, Gowacz A, Gromadzka J, et al. Determination of 3-MCPD and 2-MCPD esters in edible oils, fish oils and lipid fractions of margarines available on polish market [J]. Food Control, 2016, 59: 487-492
[8]卢跃鹏, 金绍明, 江小明, 等. 部分省份食用植物油中脂肪酸氯丙醇酯含量水平调查分析[J]. 中国油脂, 2015, 40 (11): 79-84
Lu Yuepeng, Jin Shaoming, Jiang Xiaoming, et al. Survey on content of fatty acid esters of chloropropanols in edible vegetable oils from some provinces in China [J]. China Oils and Fats, 2015, 40 (11): 79-84
[9]Sampaio K A, Arisseto A P, Ayala J V, et al. Influence of the Process Conditions on the Formation of 3-Mcpd Esters in Palm Oil [J]. Toxicology Letters, 2013, 221: S122
[10]Ermacora A, Hrncirik K. Influence of oil composition on the formation of fatty acid esters of 2-chloropropane-1,3-diol (2-MCPD) and 3-chloropropane-1,2-diol (3-MCPD) under conditions simulating oil refining [J]. Food Chemistry, 2014, 161: 383-389
[11]Li C, Li L, Jia H, et al. Formation and reduction of 3-monochloropropane-1,2-diol esters in peanut oil during physical refining [J]. Food Chemistry, 2016, 199: 605-611
[12]Shimizu M, Weitkamp P, Vosmann K, et al. Temperature dependency when generating glycidyl and 3-MCPD esters from diolein [J]. Journal of the American Oil Chemists' Society, 2013, 90 (10): 1449-1454
[13]Shimizu M, Weitkamp P, Vosmann K,et al. Influence of chloride and glycidyl-ester on the generation of 3-MCPD-and glycidyl-esters [J]. European Journal of Lipid Science and Technology, 2013, 115 (7): 735-739
[14]Pudel F, Benecke P, Fehling P,et al. On the necessity of edible oil refining and possible sources of 3-MCPD and glycidyl esters [J]. European Journal of Lipid Science and Technology, 2011, 113: 368-373
[15]Smidrkal J, Tesarova M, Hradkova I, et al. Mechanism of formation of 3-chloropropan-1,2-diol (3-MCPD) esters under conditions of the vegetable oil refining [J]. Food Chemistry, 2016, 211: 124-129
[16]Zhang Z, Gao B, Zhang X, et al. Formation of 3-monochloro-1,2-propanediol (3-MCPD) di-and monoesters from tristearoylglycerol (TSG) and the potential catalytic effect of Fe2+and Fe3+[J]. Journal of Agricultural and Food Chemistry, 2015, 63 (6): 1839-1848
[17]Zhao Y, Zhang Y, Zhang Z, et al. Formation of 3-MCPD fatty acid esters from monostearoyl glycerol and the thermal stability of 3-MCPD monoesters [J]. Journal of Agricultural and Food Chemistry, 2016, 64 (46): 8918-8926
[18]Freudenstein A, Weking J, Matthäus B. Influence of precursors on the formation of 3-MCPD and glycidyl esters in a model oil under simulated deodorization conditions [J]. European Journal of Lipid Science and Technology, 2013, 115 (3): 286-294
[19]Ramli M R, Siew W L, Ibrahim N A, et al. Other factors to consider in the formation of chloropropandiol fatty esters in oil processes [J]. Food Additives and Contaminants: Part A, 2015, 32 (6): 817-824
[20]Craft B D, Chiodini A, Garst J, et al. Fatty acid esters of monochloropropanediol (MCPD) and glycidol in refined edible oils [J]. Food Additives and Contaminants: Part A, 2013, 30 (1): 46-51.
The Influence Factors of Chloropropanol Fatty Acid Ester’s Formation in Oil Processing
Wang Fengyan Zhou Shukun Liu Mengtao Li Xiaolong Wang Manyi
( Beijing Key Laboratory of Nutrition & Health and Food Safety; Beijing Engineering Laboratory of Geriatric Nutrition Food Research, COFCO Nutrition & Health Research Institute, Beijing 102209)
The contents of 3-MCPDE (calculated as 3-MCPD) in twenty-eight samples of four kinds oil, named soybean oil,rapeseed oil, corn oil and sunflower oil, were measured according to the standard procedure of AOCS-cd-29a-13. Results showed that: 3-MCPDE was detected in all selected oil samples and the levels were varied from 0.25 to 2.693 mg/kg. Corn oil contained the maximum level of 3-MCPDE, followed by sunflower oil, then rapeseed oil and soybean oil. The influence of refining process, i.e. degumming, neutralization, bleaching and
deodorization, on 3-MCPDE formation were evaluated by using crude corn oil as raw material. 3-MCPDE was mainly generated in the deodorization stage. As the deodorization temperature rising, 3-MCPDE content increased; when the extension of deodorization time, 3-MCPDE content first increased then tended to be stable. Chlorine and diacylglycerol (DAG) were known as the main precursors for the formation of 3-MCPDE. Different amounts of chlorine and diacylglycerol (DAG) were added to the bleached corn oil to evaluate their effects on 3-MCPDE after deodorization. The content of 3-MCPDE increased significantly at first, then tended to be stable with increasing chloride and DAG content.
3-monochloropropanel-1,2-diol fatty acid esters, edible oil, processing, contaminant
TS221
A
1003-0174(2017)10-0106-06
“十三五”国家重点研发计划(2016YFD0401405)
2017-04-05

