改良被动皮肤过敏试验方法的建立*
井中旭 张妍妍 冯宇飞
(黑龙江中医药大学·150040)
改良被动皮肤过敏试验方法的建立*
井中旭 张妍妍 冯宇飞**
(黑龙江中医药大学·150040)
目的:对被动皮肤过敏试验影响因素佐剂种类、剂量、致敏次数、间隔时间等进行考察,建立灵敏、可靠的过敏反应体内试验方法,为中药注射剂过敏性检测提供可靠的方法。方法:将大鼠进行多次致敏后得到抗血清后,将抗血清背部注射于空白大鼠后激发。结果:卵白蛋白剂量为5mg/只,隔日致敏1次,共免疫3次,末次致敏后15天,制备抗血清,于被动皮肤致敏后24h用抗原与伊文思兰的混合溶液激发为最佳的PCA方法。结论:建立了可靠、灵敏的被动皮肤过敏试验方法,为中药注射剂过敏性检测及过敏原的筛选提供了可靠方法。
改良 被动皮肤过敏试验 方法 建立
目前,中药注射剂的过敏性问题较为突出,被动皮肤过敏试验(PCA)是进行中药注射剂过敏性检测常用的体内研究方法,其评价指标可量化,不易受主观判断的影响,但灵敏度不高,易产生假阴性结果[1],因此,本研究主要针对中药注射剂的过敏性检测的临床前与临床反应不符这个问题,立足于前人研究基础[2-5]对中药注射剂经典的体内评价方法被动皮肤过敏试验(PCA)进行方法学研究,对其主要影响因素佐剂种类、致敏剂量、致敏次数、间隔时间以及激发时间等因素进行考察,通过优化各影响因素,旨在建立可靠、灵敏的中药注射剂过敏性检测以及致敏物质筛方法,并采用所建立的PCA方法对双黄连粉针和刺五加注射液的过敏性进行了检测。
1 材料与方法
1.1 药品与试剂
弗氏完全佐剂、弗氏不完全佐剂、伊文思兰(进口分装);卵白蛋白(进口分装)均购于sigma公司;生理盐水(广东大冢制药有限公司,批号:1410111);氢氧化铝佐剂(自制);双黄连粉针(批号为1412211、1504209、1502202,×××制药有限公司);刺五加注射液(批号为20140308、20140704、20140917,×××制药有限公司)。
1.2 实验动物
SD大白鼠,雄性,体重180±20g,由黑龙江中医药大学药物安全性评价中心提供,合格证号为SCXK(黑)2008004号。
1.3 实验方法
1.3.1 抗血清的制备
根据选择的佐剂种类、剂量、致敏次数、间隔时间的不同将SD大鼠随机分为16组,每组6只,处理方式见表1,每组分别于末次致敏后第14、15天眼眶采血,室温自然凝固,6000rpm、离心20min,分离血清并按组合并,置-60℃冰箱备用。

表1 抗血清制备分组处理方法Table 1 Different methods of preparation of antiserium
1.3.2 被动致敏及抗原激发方法
取上述抗血清,加生理盐水稀释为1:2、1:4等不同比例的抗血清稀释液。分别将抗血清原液和稀释液分别皮内注射于空白大鼠背部,每组6只,分别于24和48小时后用1%伊文思兰和抗原的混合溶液激发。
1.3.3 结果判定方法
激发后半小时处死大鼠,剪取背部皮肤,测量内层皮肤蓝斑直径。直径大于5mm者判定为阳性,不规则斑点直径按长径和短径之和的一半计算。
1.3.4 统计学分析
采用SPSS16.0统计学分析软件,对实验结果进行统计分析。
2 实验结果
2.1 改良被动皮肤过敏试验直观结果
实验结果见图1~图3。图1为卵白蛋白第15天抗血清致敏激发组,大鼠背部抗血清原液和1:2抗血清稀释液被动皮肤致敏处,呈现明显的蓝色椭圆形斑点,长短直径分别为10mm、6mm、4.7mm、7.7mm,图2为卵白蛋白第14天抗血清致敏激发组,大鼠背部抗血清原液和1:2抗血清稀释液被动皮肤致敏处,同样呈现蓝色椭圆形斑点,但斑点颜色变淡,长短直径分别为7mm、5mm,3mm、5mm,由图1、图2可知抗血清效价最高时间为末次致敏后第15天。
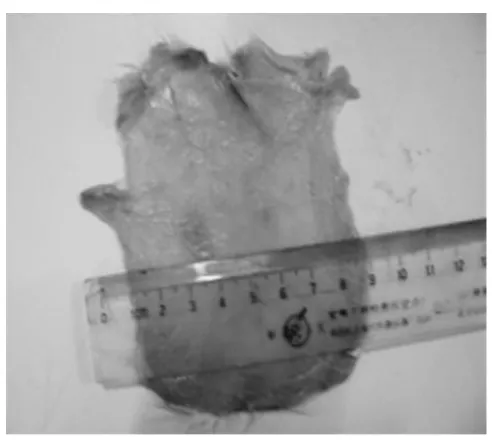
图1 卵白蛋白第15天抗血清所得结果

图2 卵白蛋白第14天抗血清所得结果

图3 刺五加注射液致敏后所得结果

图4 双黄连粉针致敏后所得结果
2.2 改良被动皮肤过敏试验蓝斑直径结果
结果见表2。由统计学分析可知,不同的佐剂致敏条件下各组间存在显著性差异(p<0.05),致敏间隔时间不同、致敏次数不同各组间存在显著性差异(p<0.05)。
抗血清原液致敏激发后,处理组2-6,14-16组的 24h与48h的蓝斑直径有显著性差异(p<0.05),24h的蓝斑直径显著高于48h的蓝斑直径,抗血清原液1:2稀释液致敏激发后,处理组2、5、9组的 24h与48h的蓝斑直径有显著性差异(p<0.05)。24h的蓝斑直径显著高于48h的蓝斑直径。
当卵白蛋白剂量为5mg/只,致敏时间为隔日1次,免疫次数为3次,抗血清制备时间为末次致敏后15天,激发时间为被动皮肤致敏后24h时,该条件下原液斑点的阳性反应率为100%,1:2稀释斑点的阳性反应率为66.7%。

表2 不同抗血清被动皮肤致敏后大鼠皮肤蓝斑直径(,mm,n=3)Table 2 Diameter of blue spot after rat skin was sensitized passively by antiserum (,mm, n=3)

注:同种抗血清间,不同激发时间差异显著*:P<0.05;不同处理组间原液斑点直径差异显著△:P<0.05
4 改良被动皮肤过敏试验检验双黄连粉针和刺五加注射液过敏性
健康SD大鼠,随机分为8组,每组6只,分别为阳性对照组、阴性对照生理盐水组、双黄连粉针2960mg/kg给药组,刺五加注射液批号为34ml/kg 给药组溶于生理盐水配制成各药液与弗氏完全佐剂混合,按阳性药的方法将大鼠致敏,末次致敏后第15天眼眶采血,室温自然凝固,6000rpm、离心20min,分离血清并按组合并,置-20℃冰箱备用,将抗血清原液加生理盐水稀释为1:2、1:4等不同比例的抗血清稀释液。分别将抗血清原液和稀释液分别皮内注射于空白大鼠背部,每组6只,分别于24小时后用1%伊文思兰和抗原的混合溶液激发,30min后取背部皮肤观察蓝斑情况,结果见图3,4,双黄连粉针组蓝斑直径均小于5mm,无阳性结果出现,刺五加注射液批号为20100702组出现蓝斑直径大于5mm阳性结果,蓝斑直径阳性率为84%。
5 讨论
5.1 被动皮肤过敏试验(PCA)是一种常用的注射剂过敏物质筛选方法。将受试物致敏动物的血清(含丰富的IgE抗体)给正常动物皮内注射,IgE的Fc端与皮肤的肥大细胞表面的特异受体结合,形成IgE的复合物,使肥大细胞致敏。当抗原攻击时,抗原与肥大细胞表面上IgE的Fab端结合,导致IgE分子结构的改变,引起肥大细胞脱颗粒,释放过敏介质如组胺、慢反应物质等,使皮肤局部血管的通透性增加,使静脉注射抗原的同时注入的伊文思蓝染料在该皮肤处渗出着色。根据局部皮肤蓝染范围或程度,可判定血管通透性变化的大小,继而判定皮肤过敏反应的程度[6]。其中佐剂种类、致敏剂量、致敏次数、间隔时间以及激发时间等因素是PCA方法成功的关键,本研究通过对上述各影响因素的考察,建立灵敏、可靠的改良被动皮肤过敏试验方法,以明确是否因试验方法的不足而无法准确预测中药注射剂临床应用的过敏反应的发生。
5.2 PCA试验中多采用豚鼠及大鼠为实验动物[2-5],本实验初期,也将豚鼠作为研究对象对其PCA试验条件进行摸索,但在实验过程中,多数豚鼠死亡,分析原因可能是因为豚鼠对弗氏佐剂的毒性不耐受,因此,最终只选择大鼠进行PCA试验,笔者建议,PCA试验中动物的选择以大鼠为宜。
5.3 通过对佐剂种类的考察发现,选择弗氏佐剂作为佐剂时,大鼠对抗原较为敏感;对致敏剂量以及致敏次数考察发现,致敏效果与致敏剂量成正比,但与致敏次数不呈依赖关系;对致敏间隔时间及激发时间考察发现,其致敏间隔时间以1天为宜,激发时间为背部皮肤致敏后24h为最佳时间。
5.4 近年来,随着中药注射剂应用范围扩大和使用人群的增加,不良反应也日渐增多,其不良反应临床报道呈日趋增多之势,甚者造成了过敏性休克而死亡[7]。因此,建立一套能够快速检测中药注射剂致敏原的方法不但可以减少过敏反应的发生、指导临床用药,更主要的是可以制定中药注射剂杂质定性定量标准,对今后中药注射剂安全性问题给予根本性的解决,也为传统中药和中药现代化的发展奠定坚实的基础。通过临床调查,本研究选择了在临床上发生过敏反应的三个批号的两种中药注射剂作为研究对象,采用改良被动皮肤过敏试验对其致敏性进行了研究,结果未发现致敏批号双黄连粉针剂,但发现临床上存在过敏反应的某些批号的刺五加注射液可引起大鼠产生过敏反应。
5.5 分析临床上高频率报道的双黄连粉针过敏反应,多为类过敏现象,而刺五加注射液的过敏症状主要是由免疫系统参与的过敏反应。因此,分别采用灵敏、可靠的类过敏反应检测方法和过敏反应检测方法对双黄连粉针及刺五加注射液进行研究,筛选其中的致敏物质是十分必要的。5.6 通过本研究,建立了中药注射剂过敏反应更为灵敏的体内评价方法,这为我们进行中药注射剂的过敏性研究以及对其致敏物质进行筛选提供方法学基础。
[1] 韩佳寅,易艳,梁爱华.药物过敏和类过敏的临床前评价要求概述[J].中国中药杂志,2015,40(14):2685-2689.
[2] 李苏玲,杨莹,田义超,惠晓琳等.被动皮肤过敏实验方法探讨[J].(第五届)药物毒理学年会论文集,2015.
[3] 陈文培,张子扬,周成浩等.大鼠被动皮肤过敏反应实验条件的优化[J].中国药理学与毒理学杂志.2016,30(7):747-753.
[4] 王冲,侯娟,戚文军等.大鼠被动皮肤过敏试验影响因素探讨[J].天津药学,2016,28(5):1-5.
[5] 王维丽,段小花,张超等.雅解沙把对小鼠同种被动皮肤过敏的影响[J].云南中医中药杂志.2016,35(9):61-63.
[6] SFDA.《中药、天然药物免疫毒性(过敏性、光过敏反应)研究的技术指导原则》[S].国家食品药品监督管理局,2005.
[7] 谭乐俊,王萌。朱彦.中药注射剂的不良反应研究进展[J].中国中药杂志,2014,20(2):3889-3898.
黑龙江省中医药科研项目(ZHY16-095);黑龙江省中医药科研项目(ZHY16-098);黑龙江省博士后资助经费项目(LBH-Z14203)
** 通讯作者

