重组aFGF大肠杆菌发酵条件的初步优化
吴 伟,张思远,徐一芩,张锦涛
(湖北理工学院 医学院,湖北 黄石 435003)
重组aFGF大肠杆菌发酵条件的初步优化
吴 伟,张思远,徐一芩,张锦涛
(湖北理工学院 医学院,湖北 黄石 435003)
为优化能稳定表达人酸性成纤维细胞生长因子(aFGF)的重组大肠杆菌的发酵条件,采用分批发酵方式,在菌体对数生长期通过添加IPTG诱导目的蛋白高效表达,确定aFGF工程菌较优发酵条件为:培养温度为37 ℃、培养基pH值为7.4、摇床转速为200 r/min。
酸性成纤维细胞生长因子;发酵;诱导;表达量
0 引言
aFGF是成纤维细胞生长因子家族(FGFs)的基本成员之一,最早由Thomas于1984年从牛脑中分离纯化得到,与FGFs的其他22个因子的蛋白序列有30%~70%的同源性[1-2]。全长度的aFGF由154个氨基酸残基组成,是一种介导细胞间信号传递的多肽类物质。aFGF是一种广谱促分裂原,对源自中胚层及神经外胚层的细胞具有明显的促分裂和增殖作用[3-4]。aFGF主要分布于脑、视网膜、垂体、神经组织、心脏、肾上腺和骨等组织器官中,血清和体液中含量则极少。此外,aFGF的稳定性差,对温度、pH及金属离子敏感,极易失活。研究表明,aFGF的生物学效应可分为促有丝分裂效应和非促有丝分裂效应,可促进创伤愈合、骨骼修复、溃疡愈合、眼晶状体再生、神经组织修复、神经突起生长以及胚胎发育与分化等,有着非常广阔的应用前景[5-8]。
由于aFGF是人体内源性的微量活性物质,难于在体液或组织液中提取,因此,采用重组DNA技术构建重组aFGF基因工程菌,实现aFGF的体外表达并获得相应的产品是研究aFGF的生物学功能和应用的重要途径。但在其实际生产过程中常会出现表达水平低且不稳定的现象。除质粒不稳定外,不同的培养、诱导条件下,工程菌的表达效率也有一定差异。因此,实现aFGF产量化、工业化是其能够得到广泛应用的前提和保障。本研究在实验室已构建好的基因工程菌的基础上,进行初步的发酵培养条件的优化,期望得到能稳定表达的工程菌株和最优的发酵条件。
1 材料与方法
1.1材料与仪器
人酸性成纤维细胞生长因子(aFGF)的重组大肠杆菌由本实验室构建和保存;LB培养基,北京索莱宝科技有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside, IPTG)、氨苄青霉素均购自北京华美公司;超净工作台,苏州苏洁净化设备有限公司;恒温摇床,金坛市瑞华仪器有限公司;紫外可见分光光度计,尤尼柯仪器有限公司。
1.2菌种活化
将100 μL甘油保存的菌种转种至30 mL LB液体培养基中,37 ℃,200 r/min培养12 h。取少量菌液,于氨苄青霉素(Ampicillin,Amp)(100 μg/mL)平板划线培养12 h,保存备用。
1.3抗生素抗性实验
用接种环蘸取活化的菌液少量,分别在含有终浓度为0 μg/mL、100 μg/mL、150 μg/mL、200 μg/mL、250 μg/mL、300 μg/mL Amp的平板上划线,37 ℃培养10~12 h,根据平板所生菌落检测重组子,同时初步确定工程菌对Amp的敏感浓度。
1.4 SDS-PAGE电泳检测重组蛋白
1)取保种菌液活化,按2%的接种量,接种到LB液体培养基中,37 ℃,200 r/min培养。
2)待菌液OD600至0.4~0.6,加入IPTG(终浓度为0.5 mmol/L),诱导培养4 h。
3)取菌液1 mL,8 000 r/min离心5 min,收集菌体;再用磷酸盐缓冲液(pH7.4)重悬菌体,8 000 r/min离心5 min收集菌体。
4)加裂解液破碎细胞,再将裂解液100 ℃煮沸5 min,立即冰浴3~5 min,4 ℃,12 000 r/min离心2 min,收集上清至EP管。待电泳检测用。
1.5发酵条件优化
1.5.1培养温度的优化
取保种菌液活化,按2%接种量,接种到6管5 mL LB液体培养基(Amp,100 μg/mL)中,各取2管分别在30 ℃、37 ℃、42 ℃下培养,摇床转速为200 r/min。培养2~3 h至A600为0.4~0.6,加入IPTG(终浓度为0.5 mmol/L)诱导,继续培养3 h,测菌体干重和目的蛋白的表达。
1.5.2培养基初始pH的优化
实验步骤参照1.5.1,其中pH梯度设置为6.0,7.4,8.0。
1.5.3摇床转速的优化
实验步骤参照1.5.1,其中摇床转速梯度设置为180 r/min、200 r/min、220 r/min、240 r/min。
2 结果
2.1青霉素抗性实验
将活化后的菌株分别在终浓度为0 μg/mL、100 μg/mL、150 μg/mL、200 μg/mL、250 μg/mL、300 μg/mL Amp的平板上划线,平板编号依次为1,2,3,4,5,6,37 ℃培养10~12 h。工程菌抗生素抗性实验结果如图1所示,在6种不同的抗生素浓度下,aFGF工程菌都能生长,说明工程菌对青霉素耐受力良好,即重组质粒载入宿主细胞后表达正常。

图1 工程菌抗生素抗性实验
2.2重组蛋白检测
收获完成诱导表达的基因工程菌,细胞裂解后进行SDS-PAGE电泳检测,SDS-PAGE电泳检测重组蛋白结果如图2所示。对比空白样,参照Marker,由图2可观察到泳道1和4 有大小为18.5 kb目的蛋白条带,而2,3涌道内对应条带不明显。结果显示aFGF工程菌成功表达了目的蛋白,工程菌可用于后续的研究。
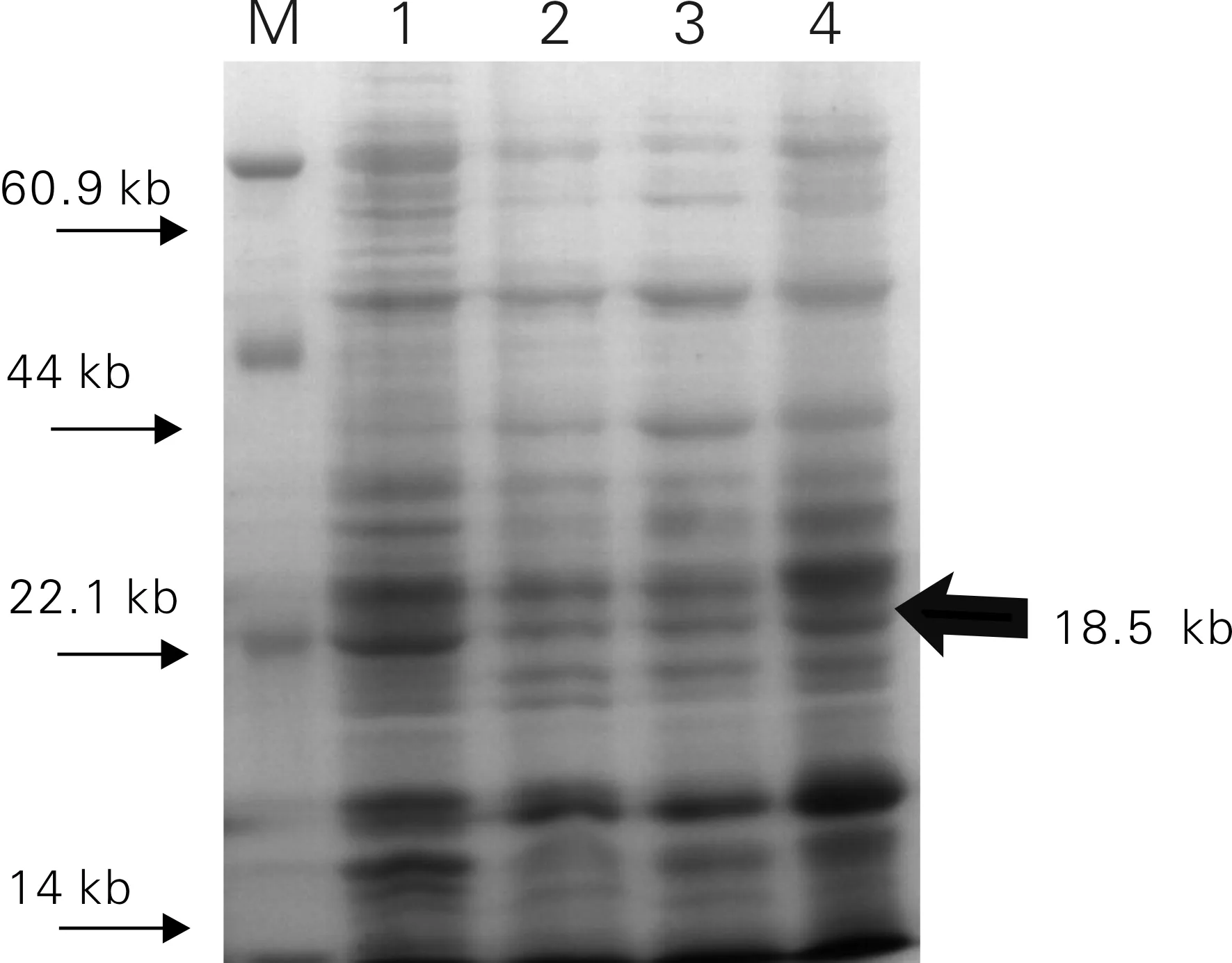
M:Marker;泳道1和4:诱导后菌体总蛋白;泳道2和3:空白样。
2.3工程菌发酵条件优化
2.3.1培养温度的影响
不同培养温度下目的蛋白表达量及菌体干重见表1。基因工程菌在30 ℃发酵培养时,目的蛋白的表达量最高,但菌体干重最小;而在42 ℃培养时,目的蛋白的表达量较低,但收获的细胞较多。综合表达量和菌体干重的变化情况,选择37 ℃作为最佳培养温度。

表1 不同培养温度下目的蛋白表达量及菌体干重
2.3.2培养基初始pH值的影响
不同培养基初始pH值下目的蛋白表达量及菌体干重见表2。随着培养基初始pH值的变化,菌体干重和目的蛋白表达量的变化均不大,说明pH值在接近中性的区间内,菌体生长和目的蛋白的表达量受其影响不大。综合实验结果,选取pH7.4作为最优的发酵pH值。
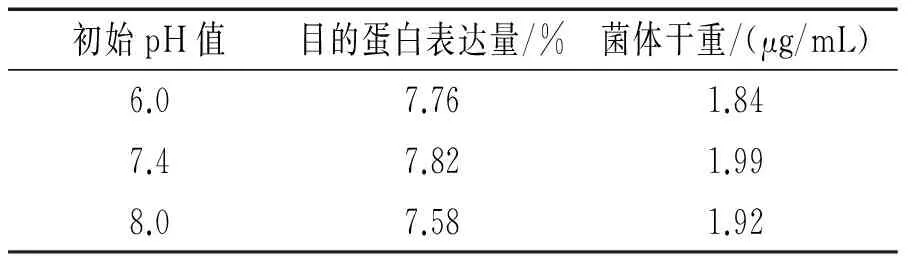
表2 不同培养基初始pH值下目的蛋白表达量及菌体干重
2.3.3摇床转速的影响
不同摇床转速下目的蛋白表达量及菌体干重见表3。就目的蛋白表达量而言,摇床转速对其影响不是很明显,表达水平维持在一个较为接近的水平;而当摇床转速高于200 r/min时,菌体干重相差不大,但明显高于180 r/min时的菌体质量。综合考虑实验结果,选择200 r/min为最适摇床转速。
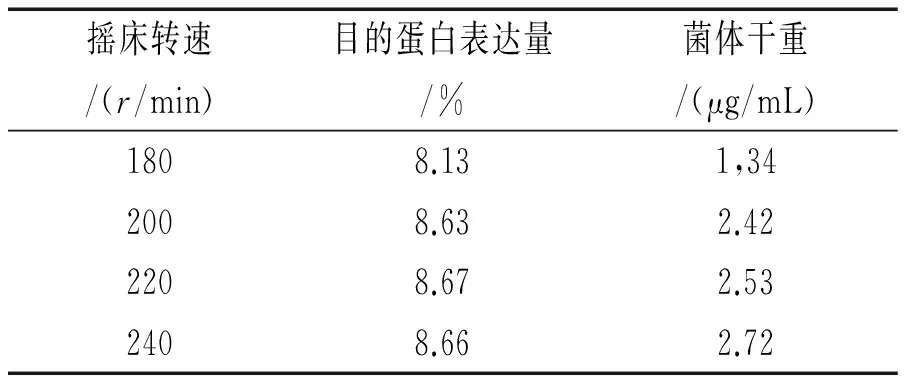
表3 不同摇床转速下目的蛋白表达量及菌体干重
3 讨论及结论
近年来,科研工作者在重视上游基因工程菌的构建和下游分离纯化工艺研究的同时,重组菌的发酵工艺的优化也越来越被重视。优化发酵工艺的目的是希望尽可能获得大量的外源基因产物,减少宿主细胞自身蛋白对下游工艺的影响。外源基因的高水平表达不仅仅取决于宿主细胞、载体和目的基因三者之间的相互关系,而且与其所处环境条件密切相关。本实验已基本确定较为优化的发酵工艺:培养温度为37 ℃、培养基pH值为7.4、摇床转速为200 r/min。但该工程菌诱导条件仍然可以进一步优化,这是后续研究课题。
[1] 纪孝伟,王兴臣,吴春玲.成纤维细胞生长因子的研究进展[J].医学综述,2014,20(3):411-413.
[2] 刘春英,黄巨恩,吴世芬,等.酸性成纤维细胞生长因子对庆大霉素诱导的海马星形胶质细胞MDA、NO、SOD、GSH-Px的影响[J].广东医学,2016,29(2):4-6.
[3] 吴艳青,肖健,李校堃.成纤维细胞生长因子的转化研究及药物研发进展[J].生物产业技术,2016(6):21-24.
[4] 兰兰.农杆菌介导的酸性成纤维细胞生长因子转化人参愈伤组织的研究[D].长春:长春师范大学,2015.
[5] 夏庆友,王峰,徐汉福,等.适于家蚕丝腺表达的改造人酸性成纤维细胞生长因子基因及其表达系统和应用:中国,CN201410177732.8[P].2016.3.30.
[6] 唐树尧.碱性成纤维细胞生长因子和微血管密度在大肠癌中的表达及意义[D].哈尔滨:哈尔滨医科大学,2005.
[7] 刘士君,李建华.碱性成纤维细胞生长因子和血管内皮生长因子在结肠癌表达的相关性及其临床意义[J].中国医药导报,2012,9(14):50-51.
[8] 谢深科,舒千玉.碱性成纤维细胞生长因子、血管内皮生长因子、P53和nm23表达与乳腺癌及增生性病变的浸润与转移相关性分析[J].中国实用医刊,2011,38(16):63-64.
Preliminary Optimization of Conditions for Fermentation of Recombinant Escherichia Coli with aFGF Gene
WuWei,ZhangSiyuan,XuYiqin,ZhangJintao
(School of Medicine,Hubei Polytechnic University,Huangshi Hubei 435003)
Objective:to optimize the condition for fermentation of an engineering E.coli strain which expressed human acidic fibroblast growth factor (aFGF).Methods:the engineering E.coli strain with human aFGF gene was grown by batch fermentation,adding IPTG during the logarithmic growth phase supported a high expression of target protein.Results:the optimal condition was confirmed,which was incubation at 37 ℃,200 rpm and pH 7.4 of culture medium.Conclusion:the condition for fermentation of engineering E.coli strain with human aFGF gene was preliminarily optimized.
acidic fibroblast growth factor;fermentation;induction;expression level
2017-05-25
湖北理工学院校级科研重点项目(项目编号17xjz07A)。
吴伟,副教授,博士,研究方向:生物技术制药。
10.3969/j.issn.2095-4565.2017.05.011
Q939.9
A
2095-4565(2017)05-0051-04
(责任编辑吴鸿霞)

