中国北亚热带油橄榄(城固32)开花生物学特性研究
吴文俊 芦 娟 赵梦炯 史艳虎 姜成英*
(1.甘肃省林业科学研究院,兰州 730020; 2.国家林业局油橄榄工程技术研究中心,兰州 730020)
中国北亚热带油橄榄(城固32)开花生物学特性研究
吴文俊1,2芦 娟1,2赵梦炯1,2史艳虎1,2姜成英1,2*
(1.甘肃省林业科学研究院,兰州 730020; 2.国家林业局油橄榄工程技术研究中心,兰州 730020)
为研究北亚热带内陆地区油橄榄(OleaeuropaeaL.)开花物候、开花样式及花器官特征,探讨其有性繁殖系统的特点。试验对西秦岭南坡地区油橄榄(城固32)的开花生物学进行研究,统计开花进程,雄花和两性花在花序上的着生位置和数量,测定雄花和两性花形态指标并切片观察,电镜扫描分析雄花与两性花花粉粒。结果表明:(1)在北亚热带北缘内陆气候条件下油橄榄花期集中在5月,单株花期15~20 d,盛花期持续4~6 d;(2)油橄榄具有雄全同株的性系统且花器官较小,雄花及两性花都具有正常发育的雄蕊。通过制作石蜡切片观察,发现两性花的雌蕊正常发育,而雄花只有较小的子房和败育的柱头;(3)雌蕊是两种花型花器官生物量差异的主要部位,两性花雌蕊的生物量明显比雄花大(P<0.01),树体分化出雄花投入的资源更少;(4)雄花与两性花在花粉量、花粉粒大小上差异不显著,在着生位置上,花序轴顶花全部为两性花,雄花出现在花序轴的中部和基部的几率分别是21.13%和30.77%。油橄榄品种城固32具有典型的雄全同株现象,雄花更倾向于在花序上出现的位置在行使它雄性功能方面并无优势可言,而且雄花花粉粒在数量、活力方面也没有优势,但是雄花的出现增加了花粉数量和P/O值,提高了植株的雄性适合度,雄花的出现也降低了两性花落花导致的树体资源浪费,保障其在资源有限的环境中能够繁殖最大化。
油橄榄;花序;花器官;花粉
油橄榄(OleaeuropaeaL.),属木犀科(Oleaceae)木犀榄属(Olea),原产于地中海地区,目前许多国家都有引种栽培。我国规模引种油橄榄始于1964年,经过数十年的艰苦探索和广泛试验,油橄榄在中国已能够完成生长、开花、结实等生理过程,部分产区的鲜果产量已达到甚至超过原产地的产量。但是作为一种引种树木,由于我国油橄榄适生区气候和土壤等自然条件与原产地地中海地区有一定的差异,为了适应当地环境,其生物学特性也会发生改变,特别是对油橄榄成花过程缺乏认识,常常难以解释雄全同株性系统在群体繁殖中的作用,造成大小年现象严重,极大地制约了油橄榄产业的发展[1]。Bertin等人指出雄全同株是植物体一种特殊的性表达系统,指植物的个体上同时产生雄花和两性花的现象[2],被认为是性系统的某一种过渡阶段[3~4]。目前,针对雄全同株性系统的研究普遍集中在,花器官特征、开花样式、授粉受精及显微结构等方面。Lavee和Brooks等人对原产地地中海地区气候条件下油橄榄开花生物学研究进行了研究[5],在研究过程中发现,即使是同一株油橄榄树雄花比例也不是一成不变的[6],而且不同品种间雄花比例差异显著,Georgios等许多学者都推断油橄榄雄全同株现象发生可能由品种基因型和环境条件共同作用[7],与其类似的还有白花菜科的刺山柑(Capparisspinosa)[8~9],但是也有些雄全同株植物群体内性比相对稳定,只受遗传因素的控制,如簇花芹[10]。另Rapoport等人从雌花败育[11]的角度探讨有限资源条件下雄全同株的繁殖方式[12~13],Connolly和Anderson等人进而分析雄全同株的系统对植株产量的影响[14]。植物显微技术的发展也为研究雄全同株的系统提供了有利的条件,发现两性花比雄花有着更发达的花柱和引导组织[15]。这些对雄全同株现象植物的雄花和两性花的花部特征,雄花和两性花着生位置与开花式样的研究,能够为全面了解繁育系统的进化积累理论资料。为此,对我国最佳适生区白龙江河谷地带油橄榄开花习性进行详细的观察与分析,旨在探讨油橄榄在中国适生区的开花物候、规律及雄花和两性花在形态、数量以及性表达特征上分别具有哪些特点,重点分析油橄榄雄全同株现象对及生殖的影响,以期为进一步探讨该物种在繁殖最大化提供重要的理论依据,为引种和推广,特别是为制定合理的栽培技术措施提供科学依据,同时这也是驯化育种研究的工作基础[16]。
1 材料与方法
1.1 材料
所有供试材料的采集及试验于2013和2014年在甘肃陇南武都区大湾沟油橄榄示范园和陇南田园油橄榄公司生产试验基地完成。品种为城固32(chenggu 32),前苏联混合品种杂交实生选优。试验地点年平均气温13.9~14.9℃,绝对最高气温39.9℃,绝对最低气温-8.8℃,年平均降水量474 mm,年日照数1 911 h,无霜期263 d。
1.2 试验设计
1.2.1 花期物候及两种花型开花特征观察
2013和2014年观测地点在中国北亚热带北缘白龙江河谷地带油橄榄适生区,花期对开花式样进行30 d的连续观测并记录花芽形态建成期月平均空气温度和湿度。随机选择树龄一致,大小长势一致、生长健壮的植株30个,每个植株按照东南西北方向随机标记30个花序,将花序按照图1中顶花,部位1及部位2观测并统计花序中两性花与雄花的位置和数目、两种花型的花数以及开花顺序,统计开花进程(Georgios),注:初花期(花朵开始开放-60%花朵开放);盛花期(全树60%~100%花朵开放);末花期(全树花朵100%开放~花瓣全部掉落)。
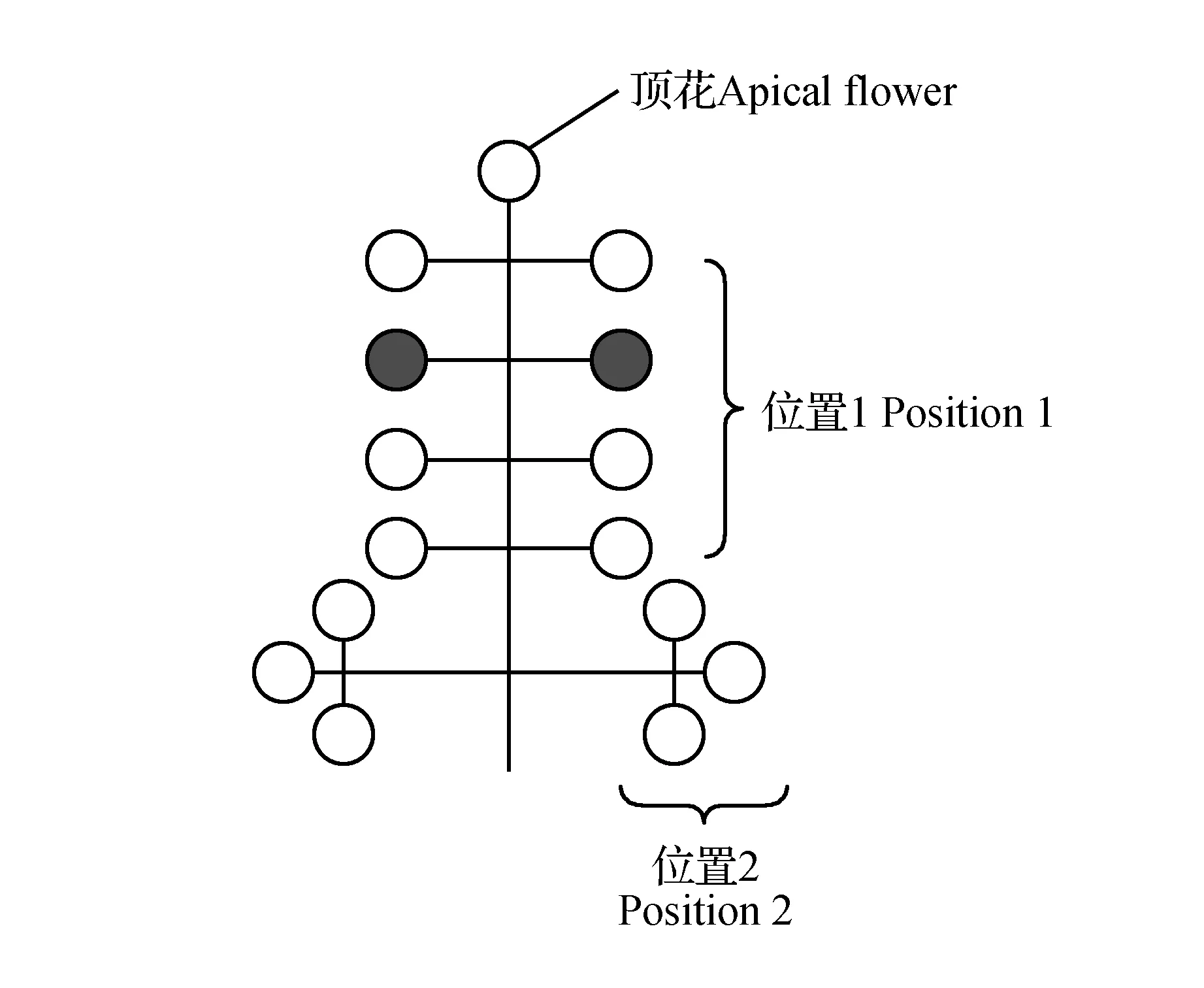
图1 油橄榄花序示意图及位置分配Fig.1 Inflorescence structure of O.europaea L. panicle
1.2.2 花器官生物量测定
随机选择树龄一致,大小长势一致、生长健壮的10个植株,每个植株上随机选取刚开放而花药尚未开裂的雄花和两性花各30朵,迅速带回室内,用镊子分解雄蕊、花瓣及雌蕊,游标卡尺测量单花纵横经、花瓣直径、雄蕊长度、子房长度和直径等指标后置于80℃下烘干48 h至恒重,用电子天平(精度为0.01 mg)分别称重。
1.2.3 花粉数量及扫描电镜观察
按照Dafni等的方法[17],在10个不同植株上,随机选取刚开放且花药尚未开裂的雄花和两性花各30朵,分别利用血球计数器统计雄蕊花药中的花粉粒数,计算每枚花药中花粉数。同时,将两性花的子房用解剖针划开,统计其胚珠数,计算胚珠比(P/O值)=花粉数/胚珠数[18]。将新鲜采集的雄花花粉和两性花花粉直接沾于样品台上,喷金后扫描电镜下观察、拍照并记录。
1.2.4 雄花和两性花花器官石蜡切片
于花期采集雄花与两性花,经FAA固定液固定48 h以上,按照李正理,张新英的方法制作石蜡切片,并观察记录[19]。
1.3 数据处理
利用SPSS17.0统计分析软件对数据进行处理分析,检验各组数据均符合正态分布后,用One-way ANOVA分析品种内和品种间各变量的差异。
2 结果与分析
2.1 油橄榄花期
从图2可以看出,在我国北亚热带北缘内陆气候条件下(花芽形态分化期空气平均温湿度见表2),各年份油橄榄开花物候期存在一定差异,但一般都集中在5月,单株全株花期15~21 d,盛花期持续约5~8 d,末花期时间一般7 d,单株花序及单朵花的开放时间都较短,单个花序从第一朵小花开放到所有小花完全全部开放持续5~9 d。2年的花期差异主要与花序形态建成期平均空气温度有关系(表1),温度高促进花期提前。
表12013,2014年1~5月平均空气温度及湿度
Table1AverageairtemperatureandhumidityfromJanuarytoMayin2013and2014
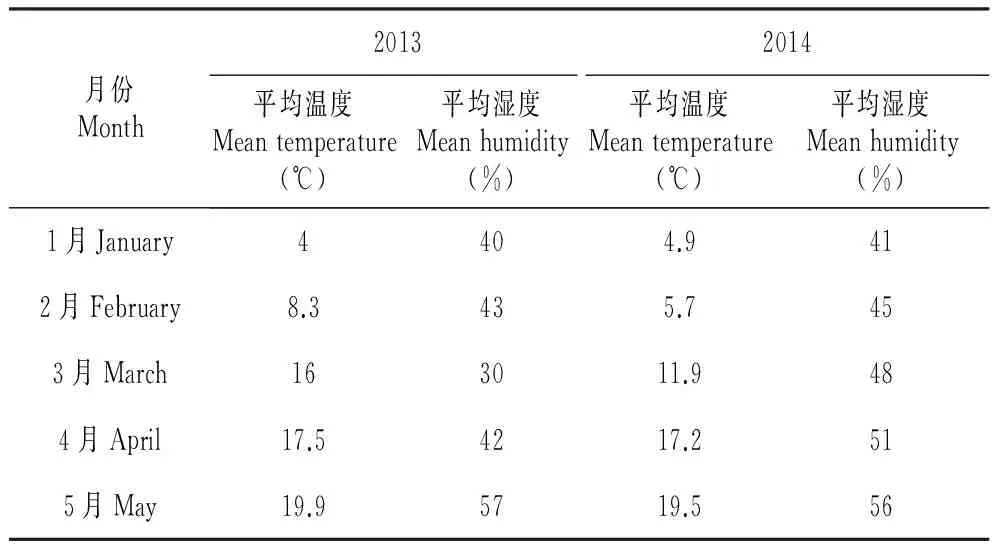
月份Month20132014平均温度Meantemperature(℃)平均湿度Meanhumidity(%)平均温度Meantemperature(℃)平均湿度Meanhumidity(%)1月January4404.9412月February8.3435.7453月March163011.9484月April17.54217.2515月May19.95719.556
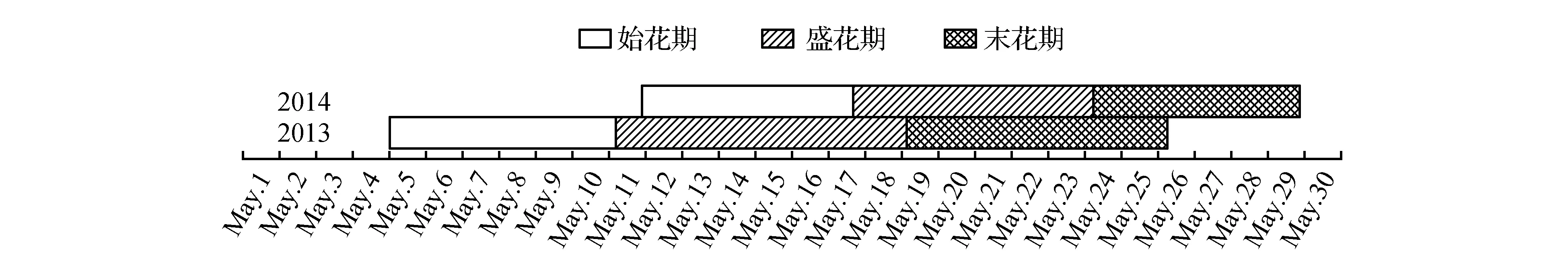
图2 2013~2014年油橄榄花期物候表(城固32)Fig.2 Reproductive Phenology of the O.europaea L. in the northern-tropical area of China
2.2 开花式样
油橄榄的花序大部分为腋生的有限圆锥状花序,花序的各分支节点规则对称,一般有3~7节,供试品种城固32花序平均长度26.41±5.52 mm,每个花序平均着生小花数15.7±4.38个,花序长度与着生小花数线性回归分析,y=0.576 5x+0.472 2,R2=0.528 2,P<0.001。顶花全部为两性花,在花序其他部位雄花和两性花出现的位置和开放顺序都是随机的(表2),雄花比例37.50%±18.91%。根据2013、2014两年统计,单个花序开花持续时间为7~12 d,单朵花在露瓣后1~3 d开花,开花后可持续2~3 d,单朵花脱落时花瓣、雄蕊同时脱落,其雌蕊宿存至子房膨胀后脱落。
表2两性花与雄花在花序上着生位置比例
Table2Relationshipamongflowerpositionsinthepanicle

雄花比例Staminateflowers’ratio两性花比例Hermaphroditeflowers’ratio顶花Apicalflower0%100%位置1Position121.13%78.87%位置2Position230.77%69.23%
2.3 花器官特征
分布有两性花及雄花,单朵小花大小、花瓣直径、花粉粒数量、花粉粒大小都是雄花略小于两性花,雄花中雄蕊长度大于两性花,但都不存在显著差异(P>0.05),花粉粒电镜扫描照片见图3。两种花型的花器官生物量差异主要集中在雌器官上,两性花雌蕊的生物量明显比雄花大(P<0.01)。两性花P/O值为26 173±1 188。

图3 雄花与两性花花粉粒电镜扫描(SEM) a.两性花;b.雄花Fig.3 Observations of pollen grains under the scanning electron microscope(SEM) between hermaphrodite and staminate flowers of O.europaea L. a.Staminate flowers; b.Hermaphrodite flowers
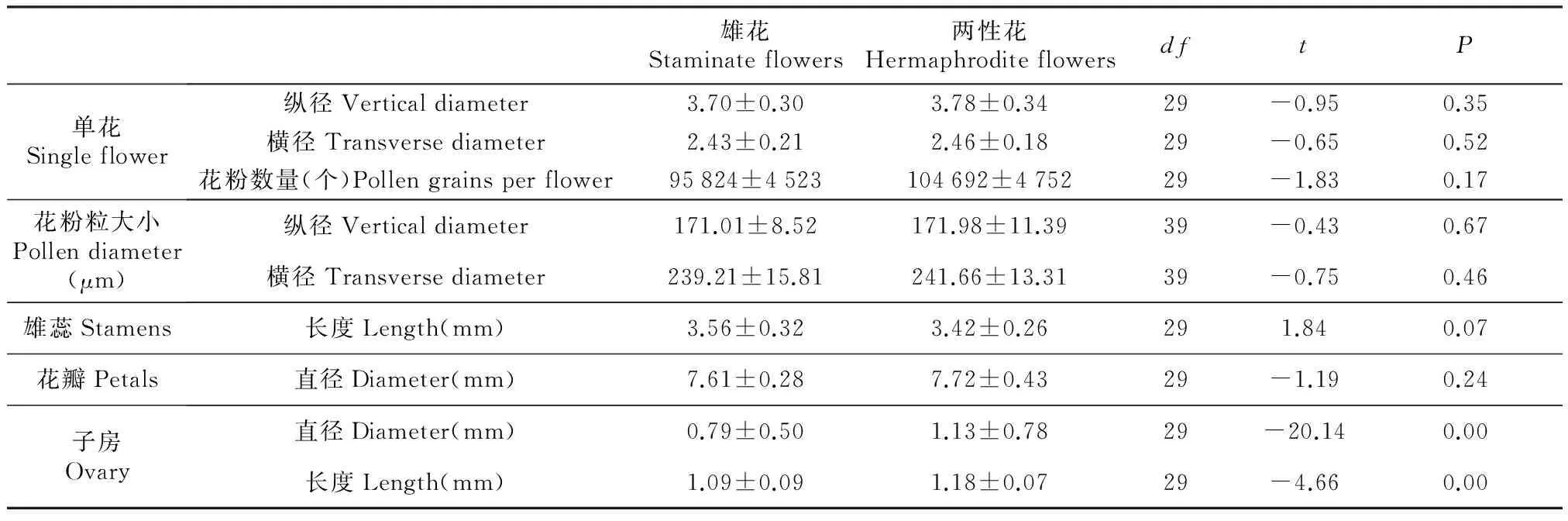
雄花Staminateflowers两性花HermaphroditeflowersdftP单花Singleflower纵径Verticaldiameter3.70±0.303.78±0.3429-0.950.35横径Transversediameter2.43±0.212.46±0.1829-0.650.52花粉数量(个)Pollengrainsperflower95824±4523104692±475229-1.830.17花粉粒大小Pollendiameter(μm)纵径Verticaldiameter171.01±8.52171.98±11.3939-0.430.67横径Transversediameter239.21±15.81241.66±13.3139-0.750.46雄蕊Stamens长度Length(mm)3.56±0.323.42±0.26291.840.07花瓣Petals直径Diameter(mm)7.61±0.287.72±0.4329-1.190.24子房Ovary直径Diameter(mm)0.79±0.501.13±0.7829-20.140.00长度Length(mm)1.09±0.091.18±0.0729-4.660.00
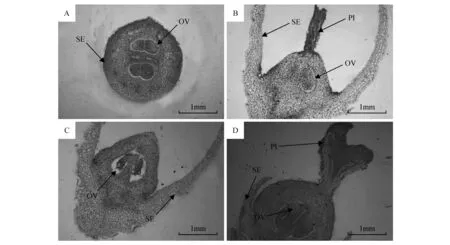
图4 雄花与两性花石蜡切片 A.两性花横切;B.雄花纵切-1;C.雄花纵切-2;D.两性花纵切 OV.胚珠;SE.花萼;PI.柱头Fig.4 Paraffin section of hermaphrodite and staminate flowers A.Transection of hermaphrodite flower; B.Longitudinal section of male flower-1; C.Longitudinal section of male flower-2; D.Longitudinal section of hermaphrodite flower OV.Ovule; SE.Calyx; PI.Stigma
Table4Dryweightoffloralpartsinhermaphroditeandstaminateflowers
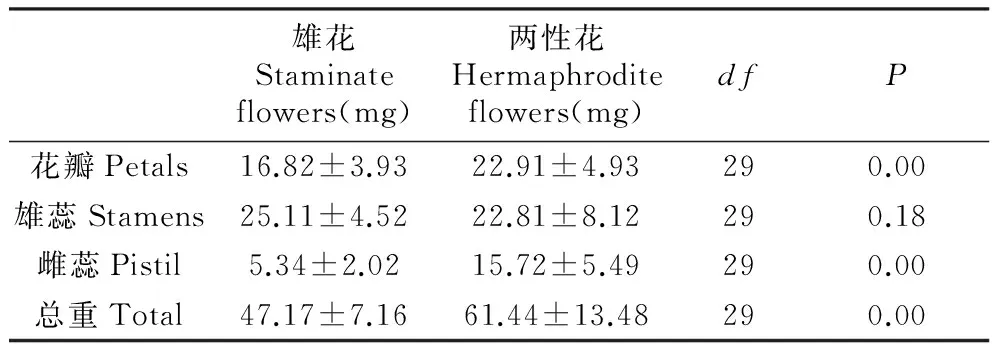
雄花Staminateflowers(mg)两性花Hermaphroditeflowers(mg)dfP花瓣Petals16.82±3.9322.91±4.93290.00雄蕊Stamens25.11±4.5222.81±8.12290.18雌蕊Pistil5.34±2.0215.72±5.49290.00总重Total47.17±7.1661.44±13.48290.00
2.4 花器官生物量
雄花与两性花两种花型花器的花瓣、雄蕊及雌蕊均存在显著差异,雄花花器官各部位生物量都小于两性花,两性花雌蕊的生物量明显比雄花大(P<0.01),品种间两性花各器官生物量没有显著差异(P>0.05)。
2.5 花器官石蜡切片
对雄花及两性花采样经FAA固定液固定并制作石蜡切片,观察了两性花、雄花切片,不完全两性花主要有两种类型,一种是雄花,其花柱及柱头全部退化,另一种类型为两性花发育过程中由于花期风、雨等其他外力因素损伤柱头,存在发育不良的花柱。比较两性花及雄花切片,明显发现两性花子房、花柱及柱头都较雄花大,与花部特征测定结果相吻合(图4)。
3 讨论
油橄榄原产于地中海地区,原产地的地中海气候条件(希腊克里特岛)与中国北亚热带北缘内陆气候条件下油橄榄花期物候虽然有所差异,但是其他方面基本一致,部分品种都表现出典型的雄全同株现象,通过2年在中国引种地区的研究,与Cuevas等人的研究结论相似,发现两性花与雄花花粉都可育,两者的差别在于两性花具有发育完全的子房,能够最终发育成果实,而雄花子房退化,不能发育成果实,只能行使其雄性功能。
对油橄榄树常有千花一果的描述,结实必须有一定的花量作为基础,而且大部分花朵在花期结束时脱落,而在花器官的形态建成过程中,雌器官具有较高的资源分配,但是雄蕊干重在雄花中并没有比两性花中提高,这样雄花中分配给雌器官的资源就节省了很多,产生雄花比产生两性花需要的资源量更少,避免雌器官败育导致的树体资源浪费,从而提高个体的适合度,这与1982年Bertin提出了最优资源分配假说(optimal resource allocation hypothesis)相一致,在有限的树体资源条件下,雄全同株植物往往通过提高一定比例雄花的分化,来保证其繁殖最大化(Solomon,1985),百合科藜芦Liliaceae、刺山柑等植物也是如此。更进一步来讲,雄全同株植物两性花和雄花的位置及其开放式样的差异也会导致其在繁殖中所起的作用不同(张大勇,2004),油橄榄雄花与两性花在开放顺序上没有固定位置,雄花与两性花在花粉量、花粉粒大小上也没有差异,但是在着生位置上,雄花更加倾向于出现在花序轴的基部,雄花在其行使雄性功能方面没有优势,但是油橄榄花序上最终能够发育为成熟果实的比例大约为1%~5%,而在落花的过程中基部的小花最容易脱落,而顶部的花发育成成熟果实的几率最大,雄花着生位置也很好的印证了油橄榄落花落果规律,雄花在其形态建成时,本身消耗的树体资源就少,另一方面雄花在行使完其雄性功能后迅速脱落,同样是为了减少花序轴营养的消耗,从而增加花序轴上两性花最终发育成果实的几率,保障其在资源有限的环境中繁殖成功。油橄榄两性花比例的高低不仅与品种自身基因型、气候因子有关,而且与树体前一年挂果情况有关系,最终雄花比例的多少与树体营养水平的关系?最终与树体产量波动有何潜在的联系?这些问题还需要进一步研究证实。
4 结论
中国亚热带北缘油橄榄适生区油橄榄花期集中在5月,花器官较小,部分品种存在雄全同株的性系统,顶花全部为两性花,在花序其他部位雄花和两性花出现的位置和开放顺序都是随机的,雄花更倾向于在花序上出现的位置在行使它雄性功能方面并无优势可言,而且雄花花粉粒在行使其功能方面也没有优势,但是雄花的出现不仅增加了花粉数和P/O值,提高了植株的雄性适合度。两种花型的花器官生物量差异主要集中在雌器官上,雄花的出现也避免柱头败育导致的树体资源浪费,保障其在资源有限的环境中繁殖成功。
1.姜成英,戚登臣,苏瑾,等.甘肃省油橄榄生产现状与发展对策[J].经济林研究,2006,24(2):78-81.
Jiang C Y,Qi D C,Su J,et al.Status and developing countermeasures of olive production in Gansu Province[J].Nonwood Forest Research,2006,24(2):78-81.
2.Bertin R I.The evolution and maintenance of andromonoecy[J].Evolutionary Theory,1982,6:25-32.
3.Podolsky R D.Strange floral attractors:pollinator attraction and the evolution of plant sexual systems[J].Science,1992,258(5038):791-793.
4.Narbona E,Ortiz P L,Arista M.Sexual dimorphism in the andromonoeciousEuphorbianicaeensis:effects of gender and inflorescence development[J].Annals of Botany,2008,101(5):717-726.
5.Lavee S.Olea europaea[M].//Halevy A H.Handbook of Flowering.Boca Raton,FL:CRC Press,1985.
6.Brooks R M.Seasonal incidence of perfect and staminate olive flowers[J].Proceedings of the American Society for Horticultural Science,1948,52:213-218.
7.Koubouris G C,Metzidakis I T,Vasilakakis M D.Phenological,morphological and functional indicators of genetic variability and their implication in the sexual reproductive system ofOleaeuropaeaL.(Oleaceae)[J].Scientia Horticulturae,2010,123(4):547-550.
8.张涛,谭敦炎.刺山柑雄全同株性系统的适应意义[J].植物分类学报,2008,46(6):861-873.
Zhang T,Tan D Y.Adaptive significances of sexual system in andromonoeciousCapparisspinosa(Capparaceae)[J].Journal of Systematics and Evolution,2008,46(6):861-873.
9.Zhang T,Tan D Y.An examination of the function of male flowers in an and romonoecious shrubCapparisspinosa[J].Journal of Integrative Plant Biology,2009,51(3):316-324.
10.张振春,谭敦炎.雄全同株植物簇花芹花期性别分配与开花式样[J].植物生态学报,2012,36(1):63-71.
Zhang Z C,Tan D Y.Floral sex allocation and flowering pattern in the andromonociousSoranthusmeyeri(Apiaceae)[J].Chinese Journal of Plant Ecology,2012,36(1):63-71.
11.Rapoport H F,Rallo L.Postanthesis flower and fruit abscission in ‘Manzanillo’ olive[J].Journal of the American Society for Horticultural Science,1991,116(4):720-723.
12.Cuevas J,Polito V S.The role of staminate flowers in the breeding system ofOleaeuropaea(oleaceae):an andromonoecious,wind-pollinated taxon[J].Annals of Botany,2004,93(5):547-553.
13.Rosati A,Caporali S,Paoletti A,et al.Pistil abortion is related to ovary mass in olive(OleaeuropaeaL.)[J].Scientia Horticulturae,2011,127(4):515-519.
14.Connolly B A,Anderson G J.Functional significance of the androecium in staminate and hermaphroditic flowers ofSolanumcarolinense(Solanaceae)[J].Plant Systematics and Evolution,2003,240(1-4):235-243.
15.王艳杰,刘林德,孔冬瑞,等.刺五加雌、雄花的花柱引导组织结构观察[J].电子显微学报,2011,30(4-5):460-465.
Wang Y J,Liu L D,Kong D R,et al.Ultrastructure of stylar transmitting tissue in male and female flowers ofEleutherococcussenticosus[J].Journal of Chinese Electron Microscopy Society,2011,30(4-5):460-465.
16.贺善安,顾姻.油橄榄驯化育种[M].南京:江苏科学技术出版社,1984.
He S A,GU Y.Domestication and breeding of olive[M].Nanjing:Jiangsu Science and Technology Press,1984.
17.Dafni A,Kevan P G,Husband B C.Practical pollination biology[M].Cambridge:Enviroquest Ltd,2005.
18.李亚兰 梁凤丽.线叶忍冬开花动态特征与繁育系统研究[J].植物研究,2016,36(4):503-510.
Li Y L,Liang F L.Stamen dynamics and breeding system ofLoniceraalberti[J].Bulletin of Botanical Research,2016,36(4):503-510.
19.李正理.植物组织制片学[M].北京:北京大学出版社,1996:130-145.
Li Z L.Production of plant tissue sections[M].Beijing:Peking University Press,1996:130-145.
“The Role of Staminate Flowers in the Breeding System ofOleaeuropaea”(31360172);Gansu science fund projects(1308RJZA118)
introduction:WU Wen-Jun(1983—),male,master,research on economic forest.
date:2016-8-24
FloweringBiologicalCharacteristicsofOleaeuropaea(Chenggu32)intheNorthSubtropicalofChina
WU Wen-Jun1,2LU Juan1,2ZHAO Meng-Jiong1,2SHI Yan-Hu1,2JIANG Cheng-Ying1,2*
(1.Gansu Academy of Forestry,Lanzhou 730020;2.Ceter for Olive Research and Technology,Lanzhou 730020)
We studied the flowering phenology, sexual system and flowering characters ofOleaeuropaeaL.(Chenggu 32) grown in the north subtropical areas of China to explore the characteristics of its sexual reproduction system. We analyzed the flowering biology including the florescence process, flower shape, the position and quantity of male and hermaphrodite flower as well as the pollen morphology of chenggu32 located in the southern slope of West Qinling region. These results indicated that:(1)O.europaeaL. flowering phase is concentrated in May under the climatic conditions of tropical inland North. Plant flowering individuals last 15-20 days, while full-blossom period within 4-6 days; (2)O.europaeaL. has an andromonoecy sexual system and the flower organ is small. Both the male flower and hermaphrodite flower have normal developing stamens. Based on the morphological observation conventional paraffin sectioning method, the pistil of hermaphrodite flower grow normally, while the pistil of male flowers has the smaller ovary and abortive stigma; (3)The pistil is the major organ for influencing biomass between the two flower types. Compared with male flowers, biomass of hermaphrodite flower is significantly larger than male flower(P<0.01), which needs fewer resources during tree differentiation; (4)There is no significant difference of pollen amount and pollen grains between male and hermaphrodite flower. The hermaphrodite flowers developed on the top of rachis, while male flowers mainly distributed at the base and center of rachis at the ratio of 21.13% and 30.77% respectively. Therefore, Chenggu 32 has typical andromonoecy. As for male flowers of Chenggu32, the location of inflorescence has no advantage for his male function. It also has no superiority about the pollen grain quantity and vitality of male flowers. However, the appearance of male flowers increased the pollen quantity and P/O, and improved the male fitness. It reduced the plant resource waste for the reason of hermaphrodite flowers fallen, thus guaranteeing the maximum breeding in limited environmental resources.
OleaeuropaeaL.;inflorescence;floral organ;pollen
国家自然科学基金项目“雄全同株现象在油橄榄有性繁殖系统中的作用”资助(31360172);甘肃省自然科学基金项目资助(1308RJZA118)
吴文俊(1983—),男,硕士研究生,主要从事经济林方面的研究。
* 通信作者:E-mail:jcytxb@126.com
2016-8-24
* Corresponding author:E-mail:jcytxb@126.com
S565.7
A
10.7525/j.issn.1673-5102.2017.02.011

