鸡源乳酸菌细菌素的分离筛选及鉴定
黄奕雯, 刘悦欣, 陶 政, 张学良 , 王 萍
(1.江西农业大学动物科学技术学院 , 江西 南昌 330045 ; 2.南昌市农村综合产权交易中心 , 江西 南昌 330038)
鸡源乳酸菌细菌素的分离筛选及鉴定
黄奕雯1, 刘悦欣1, 陶 政1, 张学良2, 王 萍1
(1.江西农业大学动物科学技术学院 , 江西 南昌 330045 ; 2.南昌市农村综合产权交易中心 , 江西 南昌 330038)
为了分离鉴定产乳酸菌细菌素,采用双层琼脂扩散法,对从健康鸡肠道内容物分离到的68株乳酸菌进行筛选,获得对大肠杆菌、金黄色葡萄球菌、鸡白痢沙门菌均有抑制作用的17株乳酸菌,在排除酸、过氧化氢等因素作用后仍具有较强抑菌活性,表明发酵液中还有其他抑菌活性物质的存在,用蛋白酶处理上清液后有6株菌的抑菌效果消失,表明抑菌物质具有蛋白质性质,是一种细菌素类物质。筛选出的菌株所产抑菌物质是一种广谱细菌素,它们对革兰阳性菌和革兰阴性菌均具有较强抑制效果。结合形态鉴定、生理生化特性试验以及16S rRNA 序列同源性分析鉴定菌株 LABJN02、LABJN05、LABJN06和LABJN14 分离菌为唾液乳杆菌,LABJN16 为约氏乳杆菌,LABJN31为卷曲乳杆菌。细菌素作为潜在的抑菌物质,与其产生菌一起在平衡肠道菌群中具有重要意义。
乳酸菌 ; 细菌素 ; 16S rRNA ; 鉴定
抗生素的使用在全世界的养殖业都是较为普遍的,在动物疾病防治、提高饲料利用率、促进畜禽生长等方面发挥了重要作用。但随着抗生素的滥用,特别是在饲料中添加亚治疗剂量的抗生素,导致动物细菌对抗生素产生耐药性,并通过食物链将耐药性转移给人类。人们迫切需要探寻一种能改变这种现状的途径,于是细菌素便成为近年来研究的热点。
细菌素是由某些细菌在代谢过程中通过核糖体合成的一类具有抑(杀)菌作用的蛋白质、多肽或前体多肽[1]。乳酸菌作为动物肠道的优势菌群,具有耐胆盐、耐酸及耐高温等微生物学特征[2],乳酸菌细菌素是乳酸菌在代谢过程中通过核糖体机制合成并分泌到环境中的一类具有抑菌活性的多肽或蛋白类物质,具有高效、无抗药性、无毒、无残留、耐酸、耐高温、大部分基因位于质粒上、相对分子质量小、含修饰氨基酸、结构复杂等特点。能抑制或杀死食物中多数革兰阳性致病菌和腐败菌,少数乳酸菌素对革兰阴性菌也有抑菌效果。乳酸菌细菌素以其良好的抑菌性和来自于被FDA认定的食品级安全微生物(GRAS)而受到越来越多的关注[3-5]。在过去几年中细菌素激发了人们的研究热情,然而鸡源乳酸菌细菌素的研究仍较少,更未见替代抗生素作为饲料添加剂的报道。
本试验从江西优良地方品种宁都三黄鸡的胃肠道分离筛选对大肠埃希菌、金黄色葡萄球菌、鸡白痢沙门菌、纳豆芽孢杆菌、枯草芽孢杆菌及地衣芽孢杆菌均具有抑菌活性的细菌素产生菌,采用微生物学和分子生物学方法综合鉴定分离菌株,以期获得可应用动物生产和活菌生物制剂的优良菌种,为产细菌素菌株在饲料添加剂中的应用提供理论和实践依据。
1 材料与方法
1.1 菌株 乳酸菌从健康鸡胃肠道中分离筛选;指示菌:致病性大肠埃希菌(E.coli)、金黄色葡萄球菌(Staphylococcusaureus)、鸡白痢沙门菌(Salmonellapullorum)、纳豆芽孢杆菌(Bacillusnatto)、枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌(Bacilluslicheniformis),及鸡巴氏杆菌(Pasteurellagallinarum)均由本实验自保菌种。
1.2 培养基及主要试剂 乳酸菌培养用培养基:MRS培养基。乳酸菌分离筛选用培养基:MRS 固体培养基(加0.5%碳酸钙)。芽孢杆菌、大肠埃希菌、金黄色葡萄球菌等指示菌选用培养基:LB培养基;胰蛋白酶、蛋白酶K为 Sigama 公司产品;rTaqDNA 聚合酶、dNTPs、DNA Marker、琼脂糖凝胶 DNA 回收试剂盒,均为宝生物工程(大连) 有限公司的产品。其他化学试剂均为国产分析纯产品。
1.3 方法
1.3.1 乳酸菌的分离纯化 无菌采取健康鸡的肠黏膜及内容物,称取1 g样品于5 mL灭菌生理盐水中混悬,以10倍系列稀释,分别取不同稀释度于平皿中,以 MRS(含0.5%碳酸钙)培养基倒平板,37 ℃培养 48 h。挑取具有溶钙圈,形状不同的单个菌落进行革兰染色,选取革兰阳性菌,分别接种于 MRS 液体培养基,37 ℃ 培养,将筛选得到的乳酸菌编号后于 MRS 固体培养基上画线纯化,用50%甘油保存,并分别保存于4 ℃ 和-20 ℃冰箱中备用。
1.3.2 抑菌试验 采用双层琼脂平板扩散法检测待检菌发酵上清液中是否含有抑菌物质。即在灭菌平皿内倒入 10 mL 2% 灭菌水琼脂,待琼脂冷却凝固后放入灭菌的牛津杯,将 100 μL 含菌约 106CFU/mL 的指示菌悬液加入到 20 mL 50 ℃ 的指示菌软琼脂培养基中,混匀后倾注灭菌的平皿内,待培养基凝固后,用无菌镊子取出牛津杯,在孔中加200 μL无细胞上清液,室温扩散 3~5 h ,37 ℃ 培养24 h,设3个重复,以未接菌的 MRS 液体培养基作对照,测量抑菌圈直径。
1.3.3 乳酸菌产细菌素的确定 乳酸菌在生长过程中产生的许多物质均具有抑菌能力,如有机酸、过氧化氢等,因此在细菌素产生菌的筛选中要排除这些干扰因素。选择大肠埃希菌为指示菌。
任何革命者、创业者,没有信仰,肯定走不远。赣东北苏区的斗争是在敌我力量对比极为悬殊,处在白色政权严密包围之下进行的。是何等力量支撑着根据地军民在严酷的环境下同敌人血战到底呢?那就是共产主义的理想和革命必胜的信念!革命斗争的历史表明,没有坚定的共产主义理想和赤诚的爱国之心,就不会有“方志敏式”革命道路的开辟。
1.3.3.1 排除有机酸的干扰 将纯化后的菌株在液体MRS培养基中培养24 h,采用NaOH中和法排除细菌发酵产物中酸性物质,用1 mol/L NaOH调节细菌发酵上清液至pH值至6.0,以未调节pH值发酵原液及pH值为6.0的乳酸、盐酸和醋酸作为对照,进行指示菌抑菌试验,37 ℃培养24 h测量抑菌圈直径。
1.3.3.2 过氧化氢检测与排除 取2 mL 排除酸作用后仍有抑菌效果的菌株发酵液。采用H2O2酶法进行H2O2检测。同时将H2O2酶处理前后的发酵上清液进行抑菌试验,比较抑菌活性。
1.3.3.3 蛋白酶处理 将胰蛋白酶和蛋白酶K分别溶解于 pH值=6 和 pH值=7磷酸盐缓冲液中,加入已经调好相应 pH值的发酵上清液中,使酶的终浓度为 1 mg/L,37 ℃温浴4 h,然后再将处理后的发酵液上清 pH值调至 6~7,做相应处理但未加酶的进行对照。进行抑菌试验,测定抑菌圈的大小。
1.3.4 抑菌谱的测定 将活化好的各指示菌活菌数调整为106CFU/mL,检测抑菌物质对各指示菌的抑制作用,根据抑菌圈的大小确定产抑菌物质菌株的抑菌谱。
1.3.5 产细菌素菌株的鉴定
1.3.5.1 菌体形态及生理生化试验 MRS固体平板上观察菌落形态;革兰染色后显微镜下观察菌体形态;做各项生理生化试验,包括:H2O2酶、明胶液化试验、硝酸盐还原试验、精氨酸产氨试验、H2S试验以及接种各类糖醇发酵试验等。
1.3.5.2 乳酸菌16S rDNA基因序列测定和系统进化树构建 引物参照文献的通用引物序列,由上海华大生物科技有限公司合成。预期扩增片段大小为1 500 bp。引物序列如下:27F:5′-AGAGTTTGATCMTGGCTCAG-3′,1492R:5′-TACGGYTACCTTGTT ACGACTT- 3′。依照细菌基因组 DNA提取试剂盒提取 DNA模板,PCR 反应体系(25 μL):模板DNA 1 μL,Taq DNA 聚合酶 0.5 μL, dNTPs(25 mmol/mL)1μL,10×PCR Buffer 2.5 μL,上下游引物(10 pmol/μL)各0.5 μL,加去离子水至25 μL。反应程序如下:94 ℃ 5 min;94 ℃ 40 s,55 ℃ 50 s,72 ℃ 50 s,共33个循环;最后于72 ℃延伸10 min。用去离子水作为阴性对照。取5 μL PCR 扩增产物于1% 琼脂糖凝胶中进行电泳,于凝胶成像系统观察和记录结果。用DNA胶回收试剂盒收取鉴定正确的PCR产物。
将纯化回收的PCR产物送至上海生工生物工程技术服务有限公司进行序列测定。利用 NCBI 工作站的 Blast 程序,将所测序列与 GenBank 中核酸序列数据库进行比对分析,并基于相关属菌 株的16S rDNA 序列,利用软件MEGA 6 软件绘制系统进化树。
2 结果与讨论
2.1.1 有机酸和过氧化氢的排除 将培养过夜后的乳酸菌上清液,用1 mol/L NaOH将上清液pH值调整到6.0左右,以大肠杆菌为指示菌,有6株菌的上清液仍具有抑菌活性,而且作为对照的pH值为6.0的乳酸、盐酸和醋酸均无抑菌活性,说明发酵上清液的抑菌效果不是由有机酸引起的。在用过氧化有机酸的排除氢酶处理发酵上清液后,以大肠杆菌为指示菌,抑菌效果也未见明显变化(表1),由此排除过氧化氢的影响。发酵上清液中存在其他的抑菌活性物质。
2.1.2 蛋白酶对发酵上清液的敏感性 将培养过夜后的乳酸菌上清液,经过胰蛋白酶、蛋白酶K处理以后,以大肠杆菌为指示菌,发酵上清液的抑菌活性消失(表1),因此可初步确定发酵上清液中的抑菌活性物质是蛋白质类物质,为细菌素。
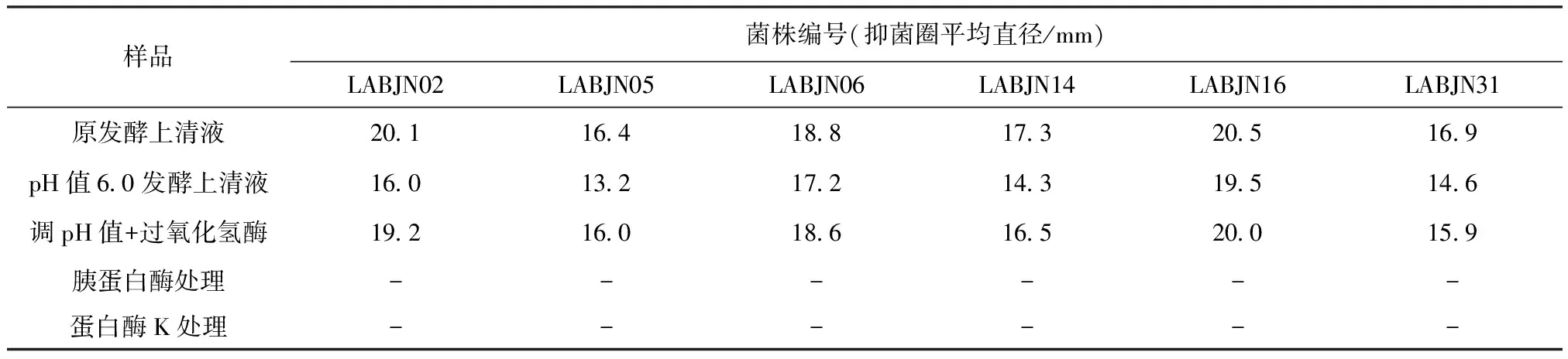
表1 发酵上清液的抑菌活性变化
2.2 乳酸菌所产细菌素抑菌谱的测定 分别选取 8 株具有代表性的革兰阳性菌和革兰阴性菌为指示菌,进行抑菌试验。 6株乳酸菌产生的细菌素对 8 株菌都有不同程度的抑制作用,能抑制革兰阳性菌(金黄色葡萄球菌、纳豆芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌),又对革兰阴性菌(致病性大肠埃希菌、鸡白痢沙门菌、嗜水气单胞菌、鸡巴氏杆菌)有抑制作用,表明这6株乳酸菌所产细菌素是 1 类具有广谱抑菌活性的细菌素,结果见表2。

表2 乳酸菌素的抑菌谱
2.3 产细菌素乳酸菌的鉴定
2.3.1 菌株形态学特征 菌株LABJN02、LABJN05、LABJN06和LABJN14在MRS培养基上菌落表现为白色圆形不透明表面光滑,镜检为革兰阳性菌,菌体呈短杆状,二端呈圆形,通常单独出现,成对短链状。
菌株LABJN16在MRS培养基上菌落凸起,表面光滑,边缘整齐,乳白色不透明,镜检为革兰阳性菌,无芽孢,菌体呈长杆状,但有时几乎是球状,通常成短链状。
菌株LABJN31在MRS培养基上菌落白色,边缘不整齐,片状,中央凸起,镜检为革兰阳性菌,无芽孢,菌体细长杆,微弯成链出现,无鞭毛。
2.3.2 生理生化试验 结果见表3。

表3 乳酸菌的生理生化特性
2.3.3 16S rRNA基因序列分子生物学鉴定 以筛选到的6株产细菌素的乳酸菌基因组 DNA 为模板,进行 16S rRNA 基因序列的 PCR扩增,得到的约 1 500 bp 产物,将纯化回收的PCR产物送至上海生工生物工程技术服务有限公司进行序列测定。将测序后得到的序列进行 BLAST 比对,通过比对发现LABJN02、LABJN05、LABJN06和LABJN14与Lactobacillus salivarius有超过99%的同源性,LABJN16与Lactobacillus johnsonii有超过99%的同源性,LABJN31与Lactobacillus crispatus 有超过99%的同源性。选取相似度达 99%的部分序列和其他乳酸菌16S rDNA 序列,经多重序列对比,用软件 MAGE 6构建系统发育树(图1),结合生理生化试验。结果,可以鉴定筛选的LABJN02、LABJN05、LABJN06和LABJN14为唾液乳杆菌,LABJN16为约氏乳杆菌,LABJN31为卷曲乳杆菌。
3 讨论
乳酸菌种类繁多,分布广泛,长期用于干酪、酸奶的生产,其产生的乳酸菌素已被广泛 用于食品的保鲜防腐等方面,细菌素在动物生产中应用前景也是非常广阔的[6]。产细菌素的乳酸菌种属主要有乳杆菌属、乳球菌属、明串珠菌属、肠球菌属、片球菌属等。
本研究从健康鸡肠道内容物中筛选出68株乳酸菌,筛选出具有一定抑菌能力的乳酸菌,乳酸菌的抑菌作用由多种因素构成,包括甲酸、乙酸等有机酸、过氧化氢和细菌素等物质 。 筛选产细菌素乳酸菌,一般采用有机酸和过氧化氢排除抑菌试验后,发酵液仍具有抑菌活性, 可以初步确定菌株产生细菌素。本试验排除发酵上清液中有机酸、过氧化氢的影响后筛选得到6株具有较强抑菌活性的乳酸菌;结合蛋白酶酶解等试验,证实分离到的6株乳酸菌能产生细菌素。通过蛋白酶敏感性试验确定该菌株所产抑菌物质为具有蛋白质性质的细菌素,根据16S rDNA序列的测定,结合生理生化试验和形态学观察,确定乳酸菌LABJN02、LABJN05、LABJN06和LABJN14为唾液乳杆菌,LABJN16为约氏乳杆菌,LABJN31为卷曲乳杆菌。目前,对所筛选出的6株乳酸菌产细菌素的报道很少。
目前,细菌素大多仅仅抑制同种的或亲缘关系较近的细菌,Stevens theorized 理论认为,革兰阴性菌存在外膜,细菌素很难到达细胞膜上的作用位点[7],即一般细菌素不对革兰阴性菌有抑制作用,而本试验筛选的乳酸菌产生的细菌素,不仅可以抑制革兰阳性菌,如金黄色葡萄球菌、纳豆芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌,而且还对革兰阴性菌有抑制作用,如致病性大肠埃希菌、鸡白痢沙门菌、嗜水气单胞菌、鸡巴氏杆菌,所产细菌素的抑菌谱较广,并且对动物体安全无毒,能够被消化系统的蛋白酶分解成各种氨基酸而被动物体吸收,所以它作为一种天然、高效、安全的饲料添加剂,有着广阔的应用前景。

图1 乳酸菌的 16S rRNA 基因序列系统进化树
[1] 王净净,顾青.1株分泌细菌素屎肠球菌ZJ19的筛选和鉴定[J].中国食品学报, 2014(01):251-257.
[2] 张永红,阮文科,李焕荣,等.猪源产细菌素肠球菌的分离鉴定[J].动物医学进展,2013,34(06):26-32.
[3] 刘宝生,张锦华,罗军荣.细菌素及其应用的研究进展[J].中国畜牧兽医,2013,40(05):123-128.
[4] 丹彤,张和平.乳酸菌细菌素的分类、生物合成及其应用[J].中国乳品工业,2013,41(03):29-32.
[5] 刘国荣,李平兰,王成涛.乳酸菌细菌素作为天然生物防腐剂在食品工业中的应用进展[J].北京工商大学学报(自然科学版),2012(02):64-69.
[6] 朱双,张爱忠,姜宁,等.细菌素及其在动物生产中的应用[J].动物营养学报,2014,26(02):327-333.
[7] 贡汉生,孟祥晨.1株产细菌素乳杆菌的鉴定及其所产抑菌物质的特性[J].山东大学学报(理学版), 2008,46(07):33-39.
IsolationandIdentificationofBacteriocinProducingLactobacillusfromChicken
HUANG Yi-wen1, LIU Yue-xin1, TAO Zheng1, ZHANG Xue-liang2, WANG Ping1
(1.College of Animal Science and Technology, Jiangxi Agricultural University, Nanchang 330045, China; 2.Nanchang Rural Comprehensive Property Rights Exchange Center , Nanchang 330038 , China)
To characterize lactic acid bacteria produced by bacteriocin, we isolated 68 strainsLactobacillusfrom the digestive tracts of healthy chicken.A double-layer agar plate proliferation experiment was used screen 17 strains which had antibacterial activity to Salmonella- lmonellapullorum Staphylococcu saureus andEscherichiacoli. After eliminating the interference factors such as the organic acids,hydrogen peroxides,6 strains still had the inhibitory activity. But inhibitory activity was lost after treatment with trypsin and proteinase K.Therefore the inhibitory substance was classed as bacteriocin. In addition,the bacteriocin had a broad inhibitory spectrum and showed inhibitory activity against gram-positive bacterium and gram-nagetive bacterium.Through detection of its appearance,physiological and biochemical character-istics and 16 SrRNA gene sequence homology analysis,LABJN02,LABJN05,LABJN06 and LABJN14 were identified as Lactobacillus salivarius,LABJN16 as Lactobacillus johnsonii,and LABJN31 as Lactobacillus crispatus.The bacteriocins are potential antimicrobial agents, and in conj unction with their producers,they might contribute a positive effect on the balance of intestinal microflora.
Lactobacillus ; Bacteriocin ; 16S rRNA
WANG Ping
S852.61
A
0529-6005(2017)09-0023-05
2016-11-02
江西省科技厅基金项目(20142BBF 60004)
黄奕雯(1992-),女,硕士生,研究方向为动物免疫学基础理论与运用,E-mail: Hywsuny. yun@qq.com
王萍,E-mail: jxjs6263wplm@163.com

