三氯乙烯对黑土酶活及理化性质的影响
张 颖,李鹏飞,孟庆娟,刘 莹,张馨元,梁世超
(东北农业大学资源与环境学院,哈尔滨 150030)
三氯乙烯对黑土酶活及理化性质的影响
张 颖,李鹏飞,孟庆娟,刘 莹,张馨元,梁世超
(东北农业大学资源与环境学院,哈尔滨 150030)
以黑土为研究对象,采用室内培养方法,研究三氯乙烯(TCE)对黑土酸性磷酸酶、纤维素酶、多酚氧化酶以及土壤理化性质影响,分析其相关性。研究结果表明,较低浓度(0.5,1,5 mg·kg-1)TCE对酸性磷酸酶表现显著促进作用,而较高浓度(10,20 mg·kg-1)TCE对酸性磷酸酶表现抑制作用。培养初期除10 mg·kg-1TCE外,其余浓度处理组均对纤维素酶产生不同程度抑制作用。14 d后除0.5 mg·kg-1处理组外,其余浓度处理组对多酚氧化酶均表现抑制作用。较高浓度TCE对有机质以及铵态氮含量呈显著抑制作用。
黑土;三氯乙烯;土壤酶;土壤理化性质
氯代烃作为重要化工原料和有机溶剂被广泛应用于电子、化学、纺织、造纸、化工、航空、干洗等行业[1]。一般来说,人工应用、自然生成和人工条件下有机物氯化可产生氯代有机化合物[2]。美国环境保护局(United States Environmental Protection Agency,USEPA)公布129种优先控制污染物中三分之一是毒性大、分布广的氯代有机污染物[3],其中三氯乙烯(Trichloroethylene,TCE)是最常见氯代有机污染物[4]。欧盟公布“黑名单”、中国环境优先监测和控制污染物中均包括TCE。TCE作为重要化工原料和有机溶剂,广泛应用于现代工业[5]。因其不合理使用、使用后废液处理不当及储存泄漏等,大量TCE进入土壤及地下水环境,其吸附性和稳定性造成土壤环境长期污染,威胁人类健康和生态安全[6-7]。
土壤是环境系统重要组成部分,为生物圈提供生存、栖息和繁衍场所。东北黑土区粮食产量占全国粮食总产量1/5,是中国最重要商品粮基地。近年来,由于黑土区化肥、农药等化学物质大量使用,黑土区土壤污染形势严峻、耕地质量日益退化。
土壤酶是土壤新陈代谢主要动力,可表征土壤综合肥力特征及养分循环过程,反映土壤微生物活性[8-9]。由于土壤酶活性与土壤质量理化指标相关性,对生态环境变化敏感性,反映土壤微生物活性[10],是土壤污染重要生物活性指标之一[11]。近年来黑土污染与退化问题凸显,有效保护珍贵黑土资源势在必行[12]。
目前有关TCE对黑土酶活性影响及不同浓度条件下对土壤理化性质影响研究相对较少。本研究从生态毒理效应角度研究TCE污染对黑土毒理效应、环境影响,为TCE毒性提供理论基础。研究不同浓度TCE对黑土酶活性及理化性质影响,可为TCE对黑土污染影响早期预测及其生态风险评价及土壤污染控制提供理论依据。
1 材料与方法
1.1 菌种
1.1.1 供试药剂
99.0 % 三氯乙烯(TCE)购自天津基准化学试剂有限公司;其余药品均为分析纯。
1.1.2 供试土壤
黑土样品采集自黑龙江省东北农业大学香坊实验实习基地试验田长期未接触TCE的表层(0~20 cm)土壤。取样后,将采集黑土样品除去植物残体及其他杂物,室温下自然风干,磨碎并过2 mm筛,备用。土壤基本理化性质如下:pH 6.98,有机质 21.2 g·kg-1,总氮 1.87 g·kg-1,总磷 3.32 g·kg-1,总钾 4.21 g·kg-1,阳离子交换量(CEC)13.1 cmol·kg-1,未检测出TCE。
将经预培养7 d后黑土样品采用逐级拌土法制成5个不同浓度污染样品,使土壤中TCE最终浓度分别为:0、0.5、1、5、10、20 mg· kg-1。并设置未添加TCE处理作空白对照,每个处理设置3个平行,加入预先灭菌蒸馏水调节土壤含水率为田间最大持水量60% 。于培养第0、1、3、7、14、21、30天取样用于测定各项指标。
1.1.3 主要设备和仪器
万分之一天平购自北京赛多利斯;灭菌锅购自上海申安;T6新世纪紫外分光光度计购自北京普析通用仪器有限责任公司;SPX-250C型恒温恒湿箱购自上海博迅实业有限公司医疗设备厂;FP640火焰分光光度计购自济南玉宏医疗器械有限公司;ATN-100凯氏定氮仪购自上海洪纪仪器设备有限公司。
1.2 方法
1.2.1 土壤酶活性测定
土壤酸性磷酸酶、纤维素酶以及多酚氧化酶均采用比色法测定。土壤磷酸酶活性以24 h后1 g土壤酚毫克数表示;土壤纤维素酶活性以72 h后1 g干土生成葡萄糖毫克数表示;土壤多酚氧化酶活性以3 h后1 g土壤中酚毫克数表示[13-15]。
1.2.1.1 土壤酸性磷酸酶活性测定
称2 g土样于50 mL三角瓶中,加入10滴甲苯处理,15 min以后,加入5 mL磷酸苯二钠溶液和5 mL(pH 5)醋酸缓冲液,设置无基质、无土对照。摇匀后将反应物置于37℃恒温培养箱中培养12 h。过滤后取1 mL滤液于100 mL容量瓶,加入5 mL硼酸缓冲液(pH 9)、3 mL 2.5%铁氰化钾溶液和3 mL 0.5%4-氨基安替吡啉溶液,摇至溶液成粉红色,加蒸馏水定容。待褪色稳定,20~30 min,在分光光度计上于波长570 nm处比色。土壤磷酸酶活性以每克土壤酚毫克数表示。
1.2.1.2 土壤纤维素酶活性测定
称10 g土壤置于50 mL三角瓶中,加入1.5 mL甲苯,摇匀后放置15 min,再加5 mL 1%羧甲基纤维素溶液和5 mL pH 5.5醋酸盐缓冲液,将三角瓶放在37℃恒温箱中培养72 h。培养结束后,过滤并取1 mL滤液,绘制标准曲线显色法比色测定。(为消除土壤中原有蔗糖、葡萄糖引起误差,每份土样需作无基质对照,整个试验需作无土壤对照;如果样品吸光值超过标准曲线最大值,则应增加分取倍数或减少培养土样)。纤维素酶活性以72 h、1 g干土生成葡萄糖毫克数表示。
1.2.1.3 土壤多酚氧化酶活性测定
称取1 g土样置于带磨口塞50 mL容量瓶中,注入1%邻苯三酚溶液10 mL,摇匀。然后将瓶置于30℃恒温培养箱中培养3 h,加入4 mL柠檬酸-磷酸缓冲液,加乙醚至刻度。用力震荡容量瓶,邻苯三酚经酶促作用生成红紫棓精,从培养液水相被萃取到有机相中。用分液漏斗将上述容量瓶中溶液分开,将含溶解红紫棓精着色乙醚作比色。比色时用波长为430 nm滤光片。另设置无土和无基质对照,步骤相同并比色。土壤多酚氧化酶活性以单位土重单位时间内产生红紫棓精毫克数表示。
1.2.2 土壤理化性质测定
土壤有机质测定采用重铬酸钾外加热法,全氮测定采用半微量开氏法,全磷测定采用氢氧化钠熔-钼锑抗比色法,全钾测定采用氢氧化钠碱熔-火焰光度法,铵态氮测定采用纳氏试剂光度法,硝态氮测定采用紫外分光光度法,速效磷测定采用0.05 mol·L-1NaHCO3法,速效钾测定采用NH4OAc浸提,火焰光度法[16-17]。
1.2.3 数据处理
试验数据均为3次重复平均值,采用SPSS 21.0软件作统计分析,最小显著差(LSD)法作显著性检验,Origin 8.5和Microsoft Excel 2010绘制图表。
2 结果与分析
2.1 TCE对土壤酶活性影响
2.1.1 TCE对土壤酸性磷酸酶活性影响
TCE对于土壤酸性磷酸酶活性影响如图1所示。整个培养周期过程中,包括对照组在内,土壤酸性磷酸酶活性呈先升后降趋势。培养14 d,5 mg·kg-1处理组土壤酸性磷酸酶活性最高,达到0.94 phenol mg·g-1。在整个培养周期过程中,较低浓度处理组(0.5,1,5 mg·kg-1)对土壤酸性磷酸酶活性均呈显著促进作用,而较高浓度处理组(10,20 mg·kg-1)对土壤酸性磷酸酶活性均表现不同程度抑制作用。随着TCE浓度增加表现剂量-效应关系。培养21~30 d,各浓度处理下土壤酸性磷酸酶活性逐渐趋于平稳。

图1 TCE对土壤酸性磷酸酶活性影响Fig.1 Effect of TCE on soil acid phosphataseactivity
2.1.2 TCE对土壤纤维素酶活性影响
由图2可知,在整个培养阶段,TCE对土壤纤维素酶活性产生不同程度促进或抑制作用,在培养初期(0 d)除10 mg·kg-1TCE处理组对土壤纤维素酶产生轻微促进作用外,其余浓度处理组均对土壤纤维素酶产生不同程度抑制作用。培养第7天,土壤纤维素酶活性显著下降,后逐渐升高。随着培养时间延长,除20 mg·kg-1TCE处理组外,其余浓度处理组均对土壤纤维素酶活性产生不同程度促进作用。至培养末期(30 d)各浓度处理组土壤纤维素酶活性与对照组相比差异不显著。
2.1.3 TCE对土壤多酚氧化酶活性影响
由图3可知,整个培养周期内,土壤多酚氧化酶活性整体呈先降后升随后趋于平稳。各浓度处理组土壤多酚氧化酶活性在第3天达到最低,40 mg·kg-1处理组对土壤多酚氧化酶抑制率最大,抑制率为25%。培养第14天后,除0.5 mg·kg-1处理组对土壤多酚氧化酶表现激活作用外,其余TCE处理组对土壤多酚氧化酶均表现抑制作用,呈明显剂量-效应关系,TCE浓度越高,抑制现象明显。培养末期(30 d),土壤多酚氧化酶活性趋于稳定。
2.2 TCE对土壤理化性质影响

图2 TCE对土壤纤维素酶活性影响Fig.2 Effect of TCEon soil cellulaseactivity
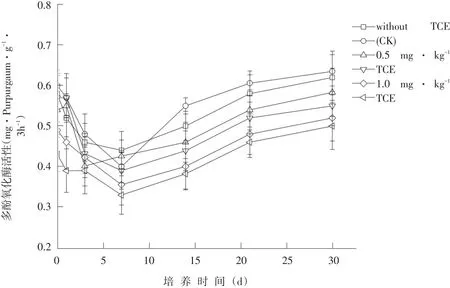
图3 三氯乙烯对土壤多酚氧化酶活性影响Fig.3 Effect of TCEon soil polyphenol oxidaseactivity
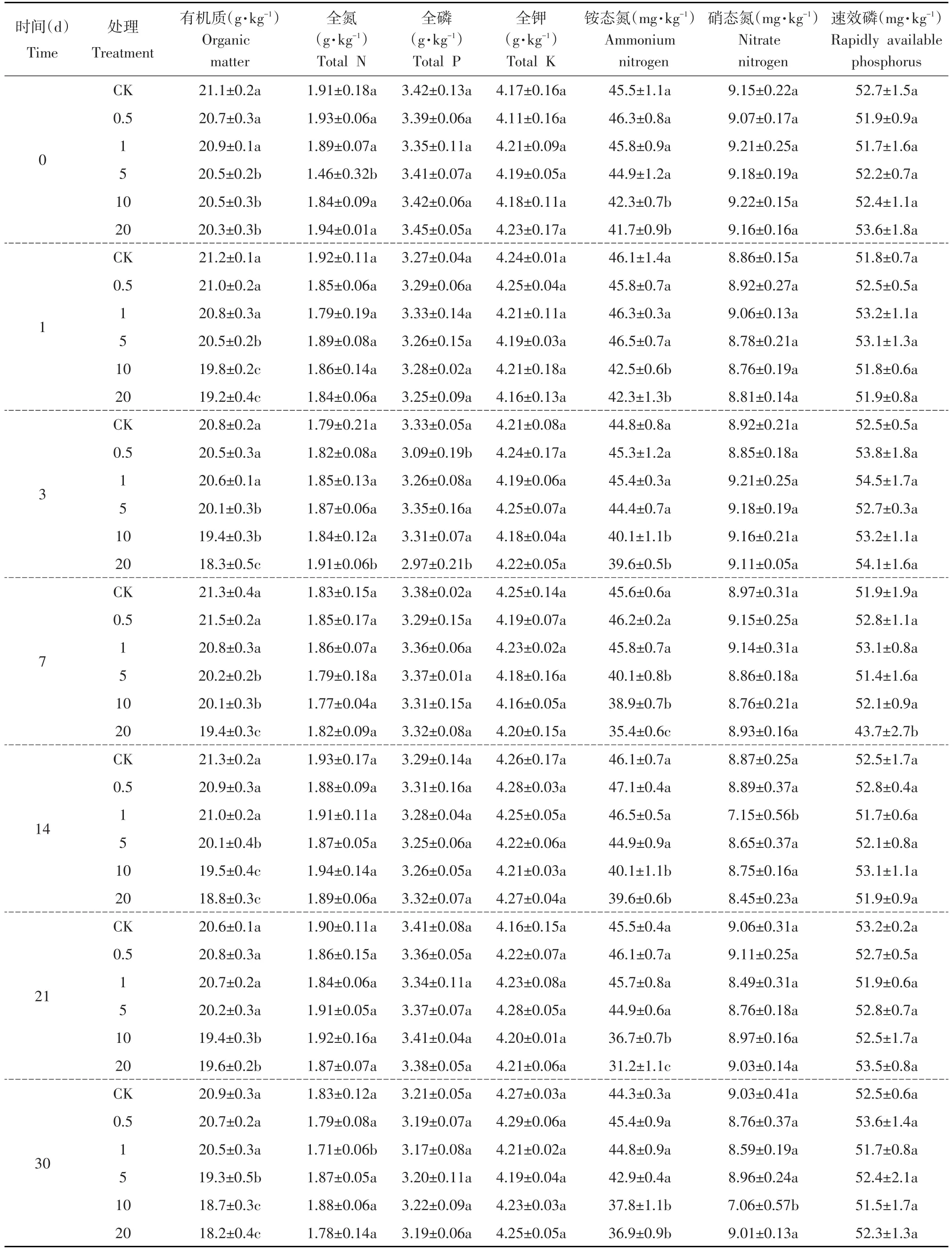
表1 TCE对于土壤理化性质影响Table 1 Effect of TCE on soil physical and chemical properties
TCE对土壤理化性质影响如表1所示。
由表1可知,不同浓度TCE胁迫对于土壤有机质含量呈不同影响,较低浓度TCE胁迫(0.5、1、5 mg·kg-1)对土壤有机质含量影响不显著,而较高浓度TCE(10,20 mg · kg-1)胁迫条件下,对土壤有机质含量呈显著抑制作用。不同浓度TCE胁迫对于土壤全氮、全磷、全钾含量影响不显著。不同浓度TCE胁迫对土壤铵态氮含量影响不同,影响程度与TCE对土壤有机质含量影响相似,较低浓度TCE胁迫(0.5、1、5 mg·kg-1)对于土壤铵态氮含量影响不显著,而较高浓度TCE(10,20 mg·kg-1)胁迫,对土壤铵态氮含量呈显著抑制作用。不同浓度TCE胁迫对于土壤硝态氮与速效磷含量影响不显著。将TCE胁迫下土壤有机质与铵态氮和土壤酶活性作相关性分析。
2.3 TCE胁迫下土壤酶活性与土壤理化性质相关性
TCE胁迫下土壤酶活性与土壤理化性质相关性,由表2可知,土壤有机质与土壤铵态氮之间呈现显著正相关,相关系数为0.769。土壤有机质与土壤多酚氧化酶间呈显著正相关,而与土壤纤维素酶呈显著负相关。土壤铵态氮与土壤多酚氧化酶之间呈显著正相关,相关系数为0.485。土壤纤维素酶与土壤酸性磷酸酶呈显著负相关,相关系数为-0.438。
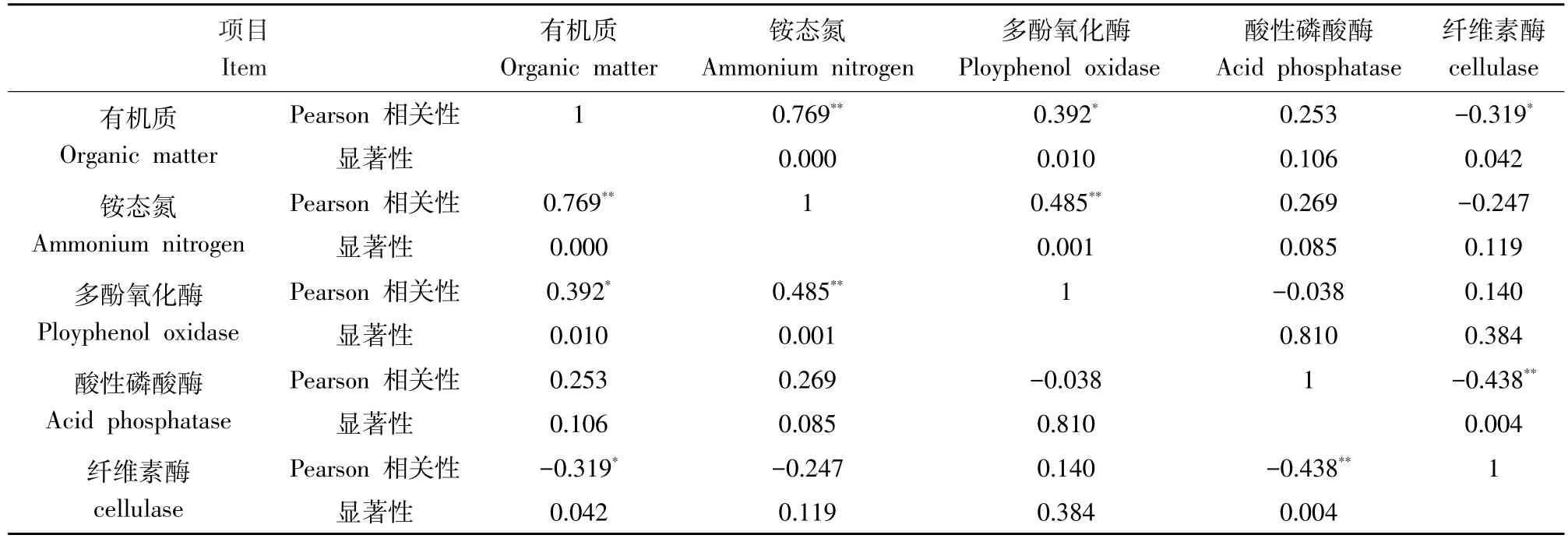
表2 土壤酶活性与土壤理化性质相关性Table 2 Correlation between soil enzymes and soil physical and chemical properties
3 讨论
3.1 TCE对土壤酶活性影响
土壤酶是土壤新陈代谢重要因素,土壤酶活性反映土壤中各种生物化学过程强度和方向。土壤酶是敏感指标,土壤水分、土壤深度及施肥等环境条件均影响土壤酶活性[18-19]。其活性变化可同时反映土壤微生物活性及土壤理化状况,敏感指示土壤质量变化,土壤酶活性可作土壤质量指示指标[20]。Moreno等利用蚯蚓粪修复受TCE污染石灰质壤土研究表明,80μg·g-1TCE对脱氢酶、葡萄糖苷酶、磷酸酶、脲酶和芳基硫酸酯酶等5种土壤酶有显著抑制作用[21]。Moreno等研究发现60μg·g-1TCE对邻二酚氧化酶有显著抑制作用[22]。石瑛等研究发现,褐土土壤酶活(多酚氧化酶、过氧化氢酶、脱氢酶和脲酶)对不同浓度1,4-二氯苯(0~50 mg·kg-1)污染产生不同响应,多酚氧化酶和脱氢酶与1,4-二氯苯处理浓度间均具有一定浓度-效应和时间-效应关系[23]。本试验研究表明,低浓度TCE对土壤酸性磷酸酶活性具有刺激作用,随浓度增加,土壤酸性磷酸酶活性受抑制程度加深。由于土壤中存在各类分解TCE微生物,较低浓度下微生物将TCE分解为结构简单有机物并被利用至完全分解,与Moreno等研究发现结果一致[21]。在培养初期(0 d)除10 mg·kg-1TCE处理组对土壤纤维素酶产生轻微促进作用之外,其余浓度处理组均对土壤纤维素酶产生不同程度抑制作用。随着培养时间延长,除20 mg·kg-1TCE处理组外,其余浓度处理组均对土壤纤维素酶活性产生不同程度促进作用。推测土壤微生物在接触TCE初期,对TCE产生明显应激反应,而较低浓度TCE可被分泌土壤纤维素酶微生物利用,影响分解植物残体活动,土壤中碳素增加。而20 mg·kg-1TCE表现对土壤纤维素酶抑制作用,由于分泌土壤纤维素酶微生物不耐受较高浓度TCE。本研究表明,TCE与土壤多酚氧化酶呈现明显剂量-效应关系,TCE浓度越高,抑制现象越明显。与石瑛等研究1,4-二氯苯与土壤多酚氧化酶活性之间关系结论一致[23]。
3.2 TCE对土壤理化性质影响
土壤理化性状是影响土壤肥力内在条件,综合反映土壤质量[24]。土壤有机质是土壤中含碳有机物质,包括各种动植物残体、微生物残体及其会分解与合成的各种有机质。土壤有机质矿质化过程分为化学转化过程、转化过程和微生物转化过程,使土壤有机质转化为二氧化碳、水、氨和矿质养分,释放能量。为植物和土壤微生物提供养分和活动能量,影响土壤性质,为合成腐殖质提供物质基础。土壤酶是有机体代谢动力,因此,土壤酶在土壤有机质转化过程中起重要作用。相关性分析可知,TCE胁迫下,土壤有机质与土壤铵态氮之间呈显著正相关,推测在TCE胁迫下,土壤微生物对含氮有机物转化产生影响,影响土壤氮素循环。土壤有机质与土壤多酚氧化酶之间呈显著正相关,推测原因是TCE影响下,分泌土壤多酚氧化酶微生物分解代谢动植物残体所致。
4 结论
研究结果表明,在整个培养周期过程中,较低浓度TCE(0.5,1,5 mg· kg-1)对土壤酸性磷酸酶活性均表现显著促进作用,而较高浓度TCE(10,20 mg·kg-1)对土壤酸性磷酸酶活性均表现不同程度抑制作用。在培养初期(0 d)除10 mg·kg-1TCE处理组对土壤纤维素酶产生轻微促进作用之外,其余浓度处理组均对土壤纤维素酶产生不同程度抑制作用。第14天后,除0.5 mg·kg-1处理组外对土壤多酚氧化酶表现激活作用以外,其余TCE处理组对土壤多酚氧化酶均表现抑制作用,且呈现明显剂量-效应关系。较高浓度TCE(10和20 mg·kg-1)胁迫条件下,对土壤有机质含量呈显著抑制作用,且对土壤铵态氮含量呈显著抑制作用。TCE胁迫下有机质与铵态氮之间呈显著正相关,与多酚氧化酶间呈显著正相关,与纤维素酶呈显著负相关。铵态氮与多酚氧化酶间呈显著正相关,纤维素酶与酸性磷酸酶呈显著负相关。
[1]王雪莲.三氯乙烯的好氧共代谢与挥发模型研究[D].北京:中国地质大学,2006.
[2] 夏北成.环境污染物生物降解[M].北京:化学工业出版社,2002.
[3] David M B,Michelle L,et al.Acclimation of Anaerobic Systems to Biodegrade Tetrachloroethene in the Presence of Carbon Tetrachloride and Chloroform[J].Water Research,2000,34(1):171-178.
[4] 崔俊芳,郑西来,林国庆.地下水有机污染处理的渗透性反应墙技术[J].水科学进展,2003,14(3):363-367.
[5] 张颖,刘洋,李娟,等.三氯乙烯厌氧降解颗粒污泥影响因素分析[J].东北农业大学学报,2014,45(11):52-58.
[6]孙芹菊.三氯乙烯污染的地下水生物修复技术研究进展[J].环境科学与管理,2007,32(6):42-45.
[7] 王爱宽,秦勇,单爱琴,等.三氯乙烯、四氯乙烯对小麦叶绿素和土壤呼吸率的影响[J].东北农业大学学报,2009,40(5):13-16.
[8] 马春梅,庄倩倩,龚振平,等.保护性耕作对寒地土壤酶活性影响[J].东北农业大学学报,2012,43(11):40-44.
[9] 孟立军,吴凤芝.土壤酶研究进展[J].东北农业大学学报,2004,35(5):622-626.
[10] Darine T,Cherni A,Fethi B,et al.Fluazifop-P-butyl(herbicide)affects richness and structure of soil bacterial communities[J].Soil Biology&Biochemistry,2015(8):89-97.
[11] Ma J,Shen J,Liu Q,et al.Risk assessment of petroleumcontaminated soil using soil enzyme activities and genotoxicity to Vicia faba[J].Ecotoxicology,2014,23(4):665-673.
[12] Hou S,Xin M,Wang L,et al.The effects of erosion on the microbial populations and enzyme activity in black soil of northeastern China[J].Acta Ecologica Sinica,2014,34(6):295-301.
[13] 张颖,吴雪峰,董世佳,等.DEHP对黑土微生物数量及酶活性影响[J].东北农业大学学报,2015,46(1):47-57.
[14] 张颖,曹博,姜昭,等.阿特拉津对黑土酶活及其微生物多样性影响研究[J].东北农业大学学报,2017,48(3):48-53.
[15] 关松荫,张德生,张志明.土壤酶及其研究法 [M].北京:农业出版社,1986.
[16] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000.
[17] 吴凤芝,郭晓,刘守伟,等.夏季填闲对连作黄瓜根区土壤酶活性及土壤化学性状的影响[J].东北农业大学学报,2014,45(10):29-34.
[18] 邸宏,周成生,曾兴,等.转BADH基因耐盐碱玉米对根际土壤酶活性的影响[J].东北农业大学学报,2014,45(4):25-29.
[19] 迟凤琴,刘晶鑫,匡恩俊,等.黑土长期定位试验原状土搬迁对土壤微生物性质的影响[J].东北农业大学学报,2015,46(7):28-34.
[20] Alka S,Nandita G.Impact of herbicide and various soil amend-ments on soil enzymes activities in a tropical rainfed agroecosys-tem[J].European Journal of Soil Biology,2013,54:56-62.
[21] Moreno B,Vivas A,Nogales R,et al.Restoring biochemical activity and bacterial diversity in a trichloroethylene-contaminated soil:The reclamation effect of vermicomposted olive wastes[J].Environmental Science and Pollution Research,2009,16(3):253-264.
[22] Moreno B,Nogales R,Macci C,et al.Microbial eco-physiological profiles to estimate The biological restoration of a tri-
Effect of Trichloroethylene on enzyme activities and physical and chemical properties in black soil/
ZHANG Ying,LI Pengfei,MENG Qingjuan,LIU Ying,ZHANG Xinyuan,LIANG Shichao
(School of Resource and Environmental Science,Northeast Agricultural University,Harbin 150030,China)
The aim of this work was to evaluate the effect of Trichloroethylene(TCE)on the activities of black soil acid phosphatase,cellulase and polyphenol oxidase by simulated experiments,and analyze its relevance.The results showed that the lower concentrations of TCE(0.5,1 and 5 mg·kg-1)showed a significant role in promoting the acid phosphatase,while the higher concentrations of TCE(10 and 20 mg·kg-1)showed inhibitory effect.At the beginning of the incubation,in addition to the 10 mg·kg-1TCE,other concentrations of TCE showed inhibitory effects on cellulose in different degrees.After 14 d,in addition to the 0.5 mg·kg-1TCE,other concentrations of TCE showed inhibitory effects on polyphenol oxidase.The higher concentrations of TCE showed significant inhibitory effects on the contents of organic matter and ammonium nitrogen.
black soil;Trichloroethylene(TCE);soil enzyme;soil physical and chemical property
X172
A
1005-9369(2017)09-0051-08
时间 2017-10-19 17:14:28 [URL]http://kns.cnki.net/kcms/detail/23.1391.S.20171019.1714.004.
张颖,李鹏飞,孟庆娟,等.三氯乙烯对黑土酶活及理化性质的影响[J].东北农业大学学报,2017,48(9):51-58.
Zhang Ying,Li Pengfei,Meng Qingjuan,et al.Effect of Trichloroethylene on enzyme activities and physical and chemical properties in black soil[J].Journal of Northeast Agricultural University,2017,48(9):51-58.(in Chinese with English abstract)
2017-09-14
国家自然科学基金项目(31500435);哈尔滨市应用技术研究与开发项目(2016RAXXJ103);农业科研杰出人才及其创新团队;黑龙江省应用技术研究与开发计划项目(GA14B105)
张颖(1972-),女,教授,博士,博士生导师,研究方向为土壤保护与修复。E-mail:zhangying_neau@163.com

