某猪场猪瘟病例的综合诊断及病原基因分析
古金元,王玉超,彭 涛,马梓承,刘照虎,孟凡亮,王文武,刘思当
(山东农业大学动物科技学院,山东泰安 271000)
某猪场猪瘟病例的综合诊断及病原基因分析
古金元,王玉超,彭 涛,马梓承,刘照虎,孟凡亮,王文武,刘思当
(山东农业大学动物科技学院,山东泰安 271000)
2017年3月山东省莱芜市某猪场保育猪群发生以高热(40.8~41.5 ℃)、精神高度沉郁、食欲不振、皮肤出血潮红及耳尖发绀为主要症状的急性热性传染病。为明确引起此次疫情的致病因素,对患病猪进行了病理剖检、组织病理学检查、分子生物学检测、病毒分离与鉴定,对分离病毒进行了E2基因的分子克隆测序及同源性比对,最终确定该病由猪瘟病毒感染引起,并分离到1株猪瘟病毒(SDLW2017)。该病毒株E2基因全长1 119个碱基(nt),共编码373个氨基酸(aa);相似性分析表明,SDLW2017分离株与其它参考株的核苷酸相似性介于82.1%~96.3%,氨基酸相似性介于88.5%~97.6%,与1.1亚群HCLV株的核苷酸和氨基酸相似性最低,分别为82.1%和88.5%,而与2.1亚群参考株的核苷酸和氨基酸相似性较高,分别为91.8%~96.3%和95.2%~97.6%,其中与2.1b亚型参考株(GXWZ02)的相似性最高,分别为96.3%和97.6%。
猪瘟病毒;病毒分离鉴定;同源性比对
猪瘟(Classical swine fever,CSF)是一种由猪瘟病毒(CSFV)引起的,可以对养猪业造成重大损失的高度接触性传染病。当前在临床上,根据其表现症状不同,CSF可分为6种病型:最急性型、急性型、亚急性型、慢性型、持续感染型和复杂感染型[1]。不同病型的临床表现各异。目前,CSF临床病例以非典型性症状为主。母猪不表现明显临床症状,但会因繁殖障碍造成新生仔猪的慢性死亡或继发其他疾病[2]。
目前CSF的诊断方法主要有临床病理学诊断、中和试验、酶联免疫吸附试验(ELISA)、免疫荧光抗体试验和分子生物学诊断。当前最常用的分子生物学检测方法是聚合酶链式反应技术(PCR)、逆转录PCR或者称反转录PCR(Reverse transcription-PCR,RT-PCR)。RT-PCR 技术能够根据不同病原基因序列设计的相应特异性引物,区分常见猪病中的多种病原,已被广泛应用于CSFV的实验室检测。为进一步提高检测效率,多重RTPCR技术应运而生。多重 RT-PCR 是一种快速、高效、高敏的实验室检测手段,只需进行1次试验就可以检测多种病毒,为实验室检测的开展提供了很大便利[3-5]。
针对CSF疫情,目前尚无有效的防治药物,必须借助实验室进行综合诊断、快速确诊,以便采取针对性的防控措施,减少细菌的继发感染,避免疫情蔓延。抗体检测能够明确猪群的猪瘟免疫状态并指导免疫程序的优化调整,因此需对猪群进行系统的抗体检测,并以此为依据,优化免疫程序,降低CSF的发生风险。现就一临床病例进行CSF综合诊断及病毒的分离鉴定和基因测序。
1 材料与方法
1.1 猪场发病背景及样品采集
疑似病料采自山东省莱芜市某规模化猪场。该场保育后期猪群发生以高热(40.8~41.5℃)、精神沉郁、食欲不振、皮肤潮红及耳尖发绀为主要特征的急性热性传染病,发病率约20%(75/370),3 d内病死率为36%(27/75)。猪场技术人员对发病猪只肌注退烧药后,未见明显疗效,遂送来2头病猪,请求进行实验室确诊。
1.2 送检病猪的临床检查
对送检病猪解剖前进行临床检查,发现病猪主要表现为精神高度沉郁,食欲下降乃至废绝,喜欢扎堆,高烧不退(40.8~41.5℃),全身皮肤呈紫红色,有密集的出血点及出血斑,耳尖及四肢末梢发绀。
1.3 样品采集
在对病猪进行系统的临床症状观察和病史调查后,初步怀疑为CSF,随后对患病猪进行了病理剖检和病料采集。采集大脑、脾脏、淋巴结、扁桃体、肾脏、肺脏及肝脏等组织,将每头猪的组织病料分开保存,并将各组织分成两份:一份冻存于-80 ℃冰箱,以备进行病原分离及病原检测;另一份则固定于10%的福尔马林溶液中,以备进行组织病理学检查。同时,对发病猪场的经产母猪、断奶前仔猪及保育仔猪进行前腔静脉采血,分离血清,待检。
1.4 实验室检查
1.4.1 组织病理学检查。将采集的组织病料经10%的福尔马林溶液固定后,制作常规石蜡切片,经苏木素-伊红(HE)染色后进行光镜观察。
1.4.2 病原学检查。将冻存于-80 ℃冰箱中的组织病料取出,解冻后取一部分加入适量灭菌磷酸盐缓冲液(PBS)并研磨成匀浆,10 000 r/min离心4 min后取上清,然后用病毒核酸提取试剂盒提取病毒核酸。依据Genbank公布的序列分别设计CSFV、猪蓝耳病病毒(PRRSV)、猪伪狂犬病病毒野毒(PRV gE)及猪圆环病毒2型(PCV2)的特异性引物(表1);用PCR/RT-PCR方法进行扩增后,将扩增产物于1.5%的琼脂糖凝胶中进行电泳;电泳结束后在紫外凝胶成像仪下根据条带位置大小判定病猪的病原感染状况。

表1 PCR/RT-PCR引物序列
1.4.3 病毒分离及CSFV E2基因序列分析。将经过RT-PCR鉴定为CSFV阳性且其余病原阴性的病料匀浆液上清过滤(0.22 µm滤器),将滤液接种于长满单层的猪肾(PK-15)细胞,盲传3代后收毒;将细胞及上清按上述方法提取核酸后进行PCR鉴定。另外,设计扩增CSFV E2基因全长的特异性引物,对仅CSFV阳性的核酸进行E2基因全长的扩增。将扩增产物进行胶回收纯化,并连接pMD 18-T载体,然后转化DH5α感受态细胞及挑菌培养;将经鉴定为CSFV E2基因阳性的菌液送至上海生工生物公司测序。对本研究中分离到的与GenBank中录入的CSFV的E2基因(表2)进行核苷酸序列及氨基酸序列比对,分析分离株的序列特征。
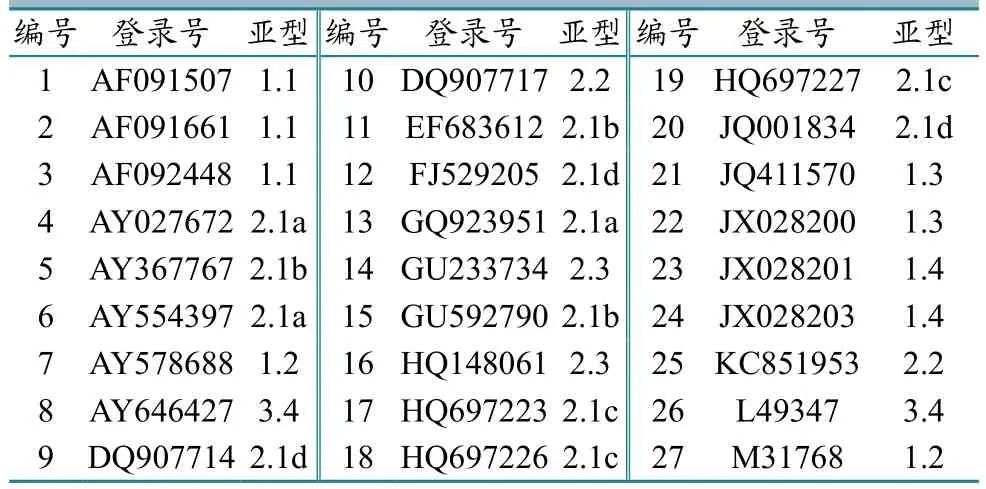
表2 Gen Bank中27株参考毒株E2基因的序列信息
1.4.4 血清学检查。为进一步明确致病原因,同时监测该场的CSFV免疫状态。经前腔静脉无菌采集该猪场经产母猪血液10份、哺乳仔猪血液10份、45日龄保育猪血液10份,分离血清后使用CSF抗体检测试剂盒检测猪群抗体水平及其离散度。
2 结果
2.1 患病猪临床剖检结果
临床检查可见病猪全身皮肤潮红(图1-A)、耳朵发绀(图1-B)。剖检可见其全身淋巴结肿大、出血,切面呈典型“大理石样”变化(图1-C);脾脏边缘可见出血性梗死灶(图1-D);肾脏表面可见呈弥漫性分布的针尖至斑点大出血点(图1-E);心外膜出血(图1-F);结肠肠黏膜表面覆盖一层糠麸样物质,剥离后可见结肠黏膜充血、溃疡(图1-G);膀胱黏膜表面可见大小不等的出血斑点(图1-H);喉头出血(图1-I)。

图1 病猪的剖检病变
2.2 病理组织学检查结果
将固定于10%福尔马林溶液中的组织器官病料,经常规石蜡切片、HE染色后镜检,能够见到典型的病毒性脑炎病变:大脑毛细血管周围可见大量淋巴细胞和单核细胞浸润形成“脑血管袖套现象”(图2-A);变性坏死的神经元被胶质细胞吞噬,出现“噬神经现象”及“卫星现象”(图2-B)。淋巴结表现出血性坏死性淋巴结炎病变,淋巴细胞大量崩解坏死,细胞核浓缩深染、崩解破碎、溶解消失(图2-C)。心肌出血,肌纤维间散在红细胞(图2-D)。肾小球充血、出血,肾小管上皮细胞变性、坏死,肾间质充血、出血(图2-E)。脾脏出现出血性梗死区,并充满红细胞(图2-F)。
2.3 病原学检查结果
对采集的病料进行了CSFV、PRRSV、PRV gE、PCV2检测,仅在病料样品中检出了CSFV,未检出其它病毒(图3)。
2.4 病毒接种细胞后的分离与鉴定结果
将经RT-PCR鉴定为CSFV阳性且其它病原均为阴性的病料匀浆液,用0.22 µm滤膜过滤,然后接种到长满单层的PK-15细胞,置于37 ℃、5%CO2的条件下培养。在PK15细胞接种病料40 h后,在显微镜下观察,可见明显的细胞病变,以细胞圆缩、聚集和脱落为主要特征。继续培养至48 h,此时细胞病变达70%,收毒;将细胞瓶置于-20 ℃冰箱中进行反复冻融3次后,10 000 r/min,5 min离心;用细胞上清提取核酸进行PCR/RT-PCR检测,发现仅有CSFV被检出,未检出PRRSV、PRV或PCV2,从而成功分离出CSFV。
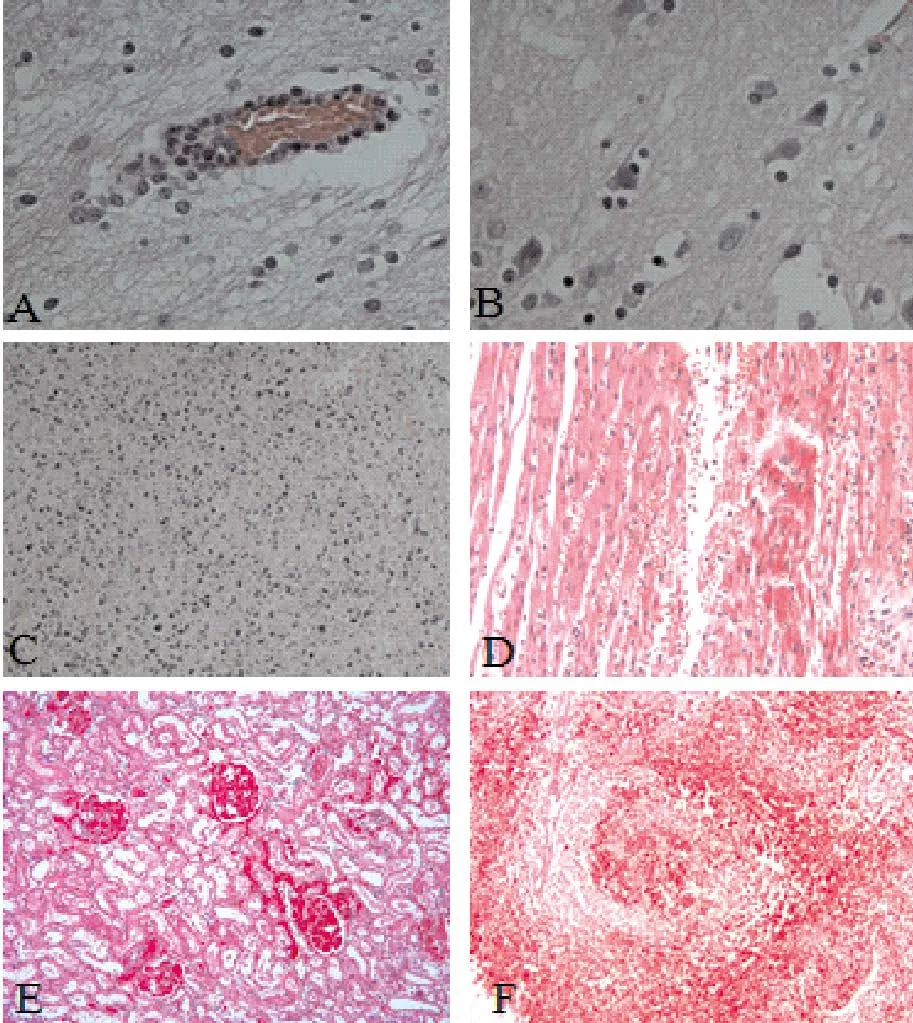
图2 病猪的组织病理学变化
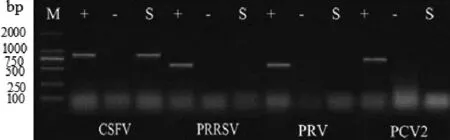
图3 病料样品中相关病原的检测结果
2.5 分离毒株与参考株E2基因核苷酸及氨基酸序列相似性分析结果
将分离到的病毒命名为SDLW2017。对该毒株的E2全基因扩增后进行测序,发现扩增片段大小为1 402 bp,其中E2基因全长为1 119 bp,共编码373个氨基酸。相似性分析结果表明,该分离毒株与其它参考毒株的核苷酸相似性在82.1%~96.3%之间(图4),氨基酸相似性在88.5%~97.6%之间(图5)。该分离株与其它8个基因亚型的参考毒株相比(表3),与1.1亚型的HCLV株核苷酸和氨基酸相似性最低,分别为82.1%和88.5%,而与2.1亚型的参考毒株具有较高的核苷酸和氨基酸相似性,分别为91.8%~96.3%和95.2%~97.6%。其中,SDLW2017与2.1b亚型参考毒株(GXWZ02)的同源性最高,核苷酸和氨基酸相似性分别为96.3%和97.6%。此外,新分离株与2.1d亚型的同源性要高于2.1a及2.1c。这表明2.1b亚型和2.1d 亚型具有较高的相似度。这与之前的报道相吻合。
2.6 分离毒株与CSFV参考株E2基因系统发育进化树分析结果
将新分离株SDLW2017与27株参考毒株构建进化树(图6)。结果表明,这28株序列被分到了3个基因群(1、2、3)中,其中包括8个基因亚群(1.1~1.4、2.1~2.3、3.4)。2.1 亚群在进化树中被突出显示,并被进一步划分为 2.1a、2.1b、2.1c及1个被新定义的2.1d基因亚群。本次分离得到的CSFV在进化树中处于2.1b亚群,与传统的石门毒株(1.1)或兔化弱毒疫苗毒株(HCLV,1.1)相比,具有较大差异。

图4 SDLW2017与27个参考毒株E2基因核苷酸序列的相似性

图5 SDLW2017与27个参考毒株E2基因推导氨基酸序列的相似性
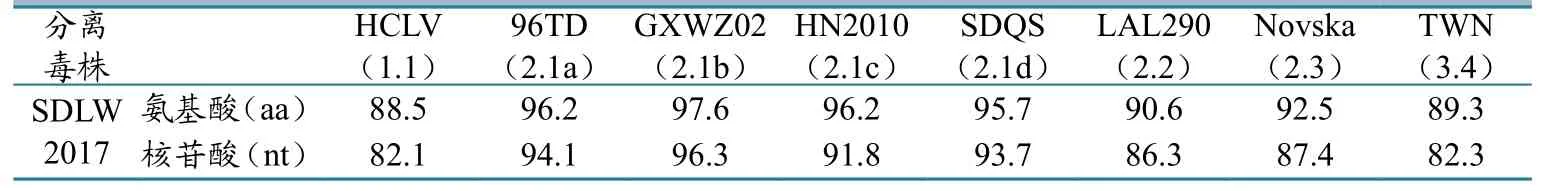
表3 分离株与8个CSFV参考毒株的核苷酸及氨基酸相似性 单位:%
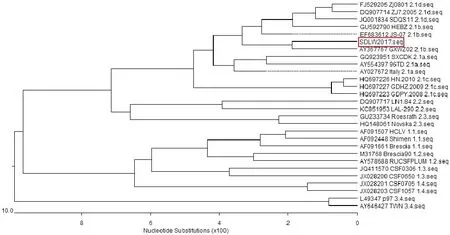
图6 分离株与参考毒株的进化树分析结果
2.7 血清中CSF抗体水平检测结果
抗体检测结果显示,经产母猪整体阳性率偏低,且离散度大,因而哺乳仔猪得不到有效的母源抗体保护,极易受到外界野毒的感染。而保育猪平均抗体阻断率偏高,不符合一免之后的抗体消长规律,怀疑有CSFV野毒感染。CSFV抗体水平检测结果见下表4。
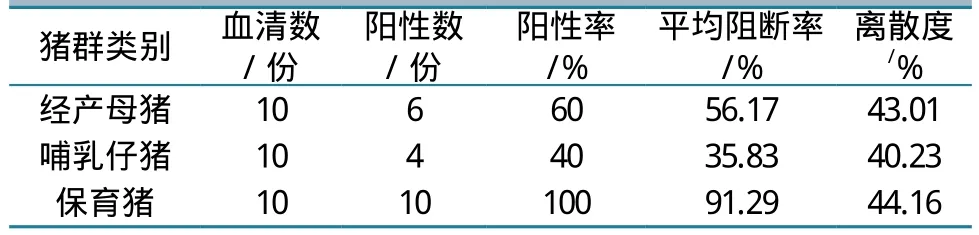
表4 不同阶段猪群的猪瘟抗体水平
3 讨论
CSF作为我国畜牧业四大疫病之一,至今流行已超过70年。我国虽然于1956年就提出了消灭CSF计划,并在一定程度上控制了其暴发和大范围流行,但并未杜绝其流行,而且其流行特点和发病特征还发生了很大变化,呈现为大范围的散发流行[6]。目前大多数CSF病例都是亚临床性的非典型病例,主要引起妊娠母猪生殖障碍、新生仔猪成活率低及保育猪的慢性感染和发病。此外,分子流行病学调查结果显示,我国流行的CSFV的基因型也在逐渐发生变化。中国兽医药品监察所等单位对1979—2008年间从我国近60 免疫CSF疫苗的猪场发生了疑似CSF疫情,且发病率较高[8]。2015年初,相似疫情也发生在山东省的一些常规免疫猪场,并造成了不同程度的经济损失[9]。为查找引起该疫情的病原,明确其发病机制,在山东省莱芜市某疑似发生CSF的猪场采集病料并进行了系统的实验室检测,最终确认疫情系CSFV感染所致。
本研究利用CSFV E2基因全长序列,构建了系统发育进化树,发现该CSFV分离株与参考毒株(1.1、2.1、2.2、2.3和3.4)相比,处于2.1亚型,而且与其中的2.1b基因亚型具有最高的相似度,因而判定造成该场CSF疫情发生和流行的病毒株属于2.1b亚型。文献资料表明,该基因亚型的CSFV能够导致易感猪群发生疫情并造成较大经济损失,而传统的C株疫苗免疫难以有效阻止该毒株的流行和致病。由于本研究的局限性,未能对该病毒株的分子生物学特性、抗原性及病毒毒力等进行深入探究,但是可以推测该病毒株可能在传统C株疫苗免疫压力下发生了适应性进化,并且与当前疫苗免疫效果较差有一定的关系。
抗体检测结果表明,该猪场保育猪平均抗体阻断率偏高,不符合一免之后的抗体消长规律,极有可能为野毒感染所致。在确诊为CSFV感染后,通过采取疫苗紧急免疫措施,使猪场疫情得到了有效控制,随后基本恢复正常生产。
[1] 孟晓芹,郑明. 国内猪瘟研究概况[J]. 中国兽药杂志,1995,29(3):56-58.
[2] SAKODA Y,HIKAWA M,TAMURA T,et al.Establishment of a serum-free culture cell line,CPK-NS,which is useful for assays of classical swine fever virus[J].Journal of virological methods,1998,75(1):59-68.
[3] 刘维全,刘海鹏,江禹,等. 禽流感病毒、新城疫病毒、猪瘟病毒和口蹄疫病毒多联RT-PCR诊断技术的建立[J]. 农业生物技术学报,2005(1):92-95.
[4] 刘辉,熊金凤,邹浩勇,等. 猪瘟病毒、猪繁殖与呼吸障碍综合征病毒和乙型脑炎病毒多重RT-PCR检测方法的建立[J]. 华中农业大学学报,2008(1):12-18.
[5] 李晶梅,刘丹,薛霜,等. 猪瘟病毒和牛病毒性腹泻病毒双重RT-PCR鉴别检测方法的建立及应用[J]. 动物医学进展,2014(4):66-71.
[6] 王琴. 猪瘟病毒流行病学、病原致病特性及猪瘟综合防制研究[J]. 中国农业科技导报,2006,8(5):13-18.
[7] 宁宜宝,吴文福. 我国猪瘟流行新特点与疫苗免疫研究[J].中国兽药杂志,2011,45(8):33-37.
[8] ZHANG H L,LENG C L,FENG L P,et al. A new subgenotype 2.1d isolates of classical swine fever virus in China,2014[J]. Infection,genetics and evolution,2015,34:94-105.
[9] HU D F,LÜ L,GU J Y,et al. Genetic diversity and positive selection analysis of classical swine fever virus envelope protein gene e2 in east china under c-strain vaccination[J].Frontiers in microbiology,2016,7(378):85.
(责任编辑:朱迪国)
Diagnosis and Pathogen Gene Analysis on An Outbreak of Classical Swine Fever in a Swine Farm
Gu Jinyuan,Wang Yuchao,Peng Tao,Ma Zicheng,Liu Zhaohu,Meng Fanliang,Wang Wenwu,Liu Sidang
(Animal Science and Technology Academy of Shandong Agricultural University,Tai'an,Shandong 271000)
An acute febrile infectious disease occurred in a swine farm,with high fever(40.8-41.5 ℃),depressed spirit,inappetence,the skin fl ushing and cyanosed tip of ear,and so on,in March 2017 in Laiwu City of Shandong Province. To identify the infective pathogen,pathological examination,histopathological examination,molecular biology detection,virus isolation and identification were carried out,and molecular cloning,sequencing and homology comparison of E2 gene were performed on the isolated virus. It's diagnized as CSFV infection finally,and a strain named SDLW2017 was isolated. The results revealed that the E2 gene of SDLW2017 was 1 119 nucleotide(nt)in length and coded 373 amino acids(aa). The similarity analysis of nucleotide and amino acid sequences revealed that SDLW2017 strain shared a nucleotide similarity of 82.1%-96.3% and an amino acid similarity of 88.5%-97.6% with other reference strains. The nucleotide and amino acid similarity of the HCLV strain with the 1.1 subpopulation were 82.1% and 88.5%,respectively. When compared with the subgenotype 2.1 strains,SDLW2017 strain shared higher nucleotide(91.8%-96.3%)and amino acid(95.2%-97.6%)similarities. The newly isolated strain shared the highest nucleotide(96.3%)and amino acid(97.6%)similarity with subgenotype 2.1b strain(GXWZ02).
Classical swine fever virus;virus separation and identification;homology comparisons
S945.4
A
1005-944X(2017)11-0008-06
10.3969/j.issn.1005-944X.2017.11.003
国家重点研发计划项目(2017YFD0500605)通讯作者:刘思当

