人参皂苷Rg1对局灶性脑缺血再灌注后大鼠海马微管相关蛋白表达的影响
黄 俊,吕立华,杨特清,邓 敏,陆曲折
(邵阳学院,湖南 邵阳,422000)
2017-09-03
湖南省教育厅一般课题(15C1258)
黄俊(1982-),男,湖南新邵人,医学硕士,副教授,主要从事中枢神经系统疾病的发病机制的研究
1672-7010(2017)05-0109-05
人参皂苷Rg1对局灶性脑缺血再灌注后大鼠海马微管相关蛋白表达的影响
黄 俊,吕立华,杨特清,邓 敏,陆曲折
(邵阳学院,湖南 邵阳,422000)
目的探讨人参皂苷Rg1是否可通过促进局灶性脑缺血再灌注大鼠海马微管相关蛋白(Doublecortin,DCX)而改善神经功能缺损体征。方法采用大脑中动脉栓塞法(MACO)制作局灶性脑缺血再灌注模型。雄性SD大鼠随机被分成假手术组(n=10)、模型组(n=10)和人参皂苷Rg1组(n=10)。模型组脑缺血再灌注后30min腹腔注射等体积的0.9%生理盐水,1次/d,人参皂苷Rg1组ip人参皂苷Rg1(50mg/kg,浓度为8g/L),1次/d。14d后对3组大鼠进行神经功能评分;采用免疫组织化学染色和Western-blot观察3组大鼠DCX在海马的表达。结果与模型组相比,人参皂苷Rg1组神经功能缺损程度评分下降(P<0.05);给予人参皂苷Rg1干预后,局灶性脑缺血再灌注大鼠海马SGZ(齿状回颗粒细胞下层)区DCX阳性细胞、海马区DCX蛋白水平显著增加(P<0.05)。结论人参皂苷Rg1可通过上调海马微管相关蛋白的表达而改善局灶脑缺血大鼠的神经功能缺损体征。
人参皂苷Rg1;局灶脑缺血再灌注;海马;微管相关蛋白
脑卒中作为一种急性脑血管疾病,严重危害人们身体健康。脑缺血损害是脑卒中最主要的形式,约占60%~80%。脑卒中存活患者常可出现不同程度的神经功能缺损体征,如神经元的丢失和伴有认知及运动功能的损害。中医药具有全方位、多靶点的作用,在治疗脑中风积累了丰富的临床经验。人参是我国珍贵的中药材,有“大补元气,复脉固脱,生津安神”等功效。人参皂苷Rg1是五加科植物人参Panax ginseng C.A.Mey.的干燥根。人参皂苷Rg1可以增强神经前体细胞增殖能力,促进神经发生[1],可通过下调大鼠缺血大脑皮层肿瘤坏死因子受体1和多聚二磷酸腺苷核糖聚合酶-1的表达而发挥神经保护作用[2]。除此之外,人参皂苷Rg1可以促进培养的胎鼠大脑皮质神经干细胞的增殖[3]。Doublecortin(DCX)作为一种微管相关蛋白,是神经元前体细胞的标志物,表达在迁移的神经祖细胞和未成熟神经元中[4]。脑缺血后可刺激大脑相关脑区神经前体细胞的增殖和迁移,改善大脑的突触可塑性和促进脑的自身修复。但关于人参皂苷RG1是否可增强脑缺血后大脑海马区微管相关蛋白的表达而发挥神经保护作用报道较少,因此本次研究通过大脑中动脉栓塞法(MACO)建立局灶性脑缺血再灌注模型,观察人参皂苷Rg1是否通过促进海马SGZ区微管相关蛋白的表达而发挥改善神经功能缺损体征的作用。
1 材料与方法
1.1 实验材料
出生2月左右体重为230~280g的雄性Sprague-Dawley大鼠,由湖南斯莱克景达实验动物有限公司提供。动物饲养于聚丙烯笼中,房室温保持(22±1)℃,相对湿度50%~55%,光照与黑暗各为12h的环境,自由饮水和摄给予标准饮食。
1.2 实验仪器和试剂
珊顿冰冻切片机(Shandon公司),人参皂苷Rg1(南京泽朗生物科技有限公司,HPLC≥98%),羊抗DCX抗体(Santa Cruz Biotechnology公司),生物素化山羊抗大鼠(武汉博士德公司),抗生物素蛋白-生物素复合物(ABC Kit),二氨基联苯胺(武汉博士德公司)。
1.3 实验方法
1.3.1 局灶性脑缺血模型的建立
参考Longa EZ等[5]制作MCAO(大脑中动脉栓塞)模型。所有大鼠经腹腔注射10%水合氯醛(0.35ml/100g)麻醉,仰卧固定于手术台。去毛,碘伏消毒,从颈部右侧做手术切口,分离颈总动脉、颈外动脉、颈内动脉及迷走神经。其中颈内动脉分离至翼腭动脉,颈外动脉分离出来3~5mm。动脉夹夹闭颈总动脉和颈内动脉。在颈外动脉距颈总动脉叉3~5mm处结扎剪断颈外动脉,提起颈外动脉游离端使其与颈内动脉成一直线,于颈外动脉结扎处近心端用眼科手术剪约剪一小切口,将拴线(用直径为0.26mm 渔线,头端用石蜡制备成膨大且光滑的球形)插入到颈内动脉,插入深度为(18±4)mm。阻闭2h后抽出栓塞线制备成再灌注模型。模型制作过程中尽量减少大鼠的痛疼和动物的使用数量。
1.3.2 实验设计
将所有大鼠随机分成假手术组、模型组、人参皂苷Rg1组。假手术组只分离颈总动脉,不栓塞,不给于任何药物干预;模型组右侧缺血再灌注后30min给予等体积0.9%NaCl,1次/d;人参皂苷Rg1组再灌注后30min给予人参皂苷Rg1(50mg/kg,浓度为8g/L),1次/d。造模成功14d后免疫组化观察三组大鼠神经功能缺损程度及DCX在海马的表达。
1.3.3 神经功能缺失体征评分
参考Longa等[5]制定的 5分法在造模成功14d后对大鼠进行神经功能缺失体征评分。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:行走是向对侧转圈;3分:不能站立,向对侧倾斜;4分:不能自发行走,意识丧失。其中1~3分为模型成功。模型制备成功后,假手术组死掉1只,模型组死掉4只,人参皂苷Rg1组死掉2只。
1.3.4 脑组织标本的制备
10%水合氯醛麻醉成功后,从大鼠心尖部位插入灌注针头直到主动脉,0.9%生理盐水快速灌注,然后改用4%多聚甲醛磷酸盐缓冲液灌注;取出脑组织,多聚甲醛磷酸盐缓冲液后固定过夜;梯度沉糖(15%和30%各一遍);包埋。采用冠状位切片,切片厚度为30μm。
1.3.5 免疫组织化学染色(ABC法)
0.01M PBS(PH=7.3)溶液漂洗脑片3次,每次10min;3% H2O2处理脑组织30min;漂洗3次,每次10min;5%马血清孵育2h;加入羊抗- DCX(1∶1000)4℃孵育过夜;漂洗3次,每次10min;加入生物素化马抗山羊IgG(1∶400),室温孵育2h;抗生物素蛋白-生物素复合物(ABC Kit)(1∶400),室温孵育2h;DAB显色;酒精脱水、二甲苯脱脂、中性树脂封片。
1.3.6 免疫印迹技术
麻醉大鼠,冰上操作,分离海马。使用总蛋白提取试剂盒提取蛋白,4℃,12,000r/min条件下离心20min。收集上清液,测定蛋白浓度并配平。用SDS-PAGE凝胶电泳,每个泳道加入30μg总蛋白。电泳蛋白分离转移至硝酸纤维膜上,转膜30min。将含有羊抗-DCX(1∶1000)孵育2h,4℃过夜。1×TBST 溶液漂洗,和偶联HRP 标记的兔抗山羊IgG(1∶1000)反应。室温孵育2h,1×TBST 溶液漂洗,15min×3 次,采用ECL化学发光法进行显影。以GAPDH作为内参,采用NIH Image J分析DCX条带,蛋白相对量表示DCX条带的平均吸光度值与内参的平均吸光度的比值。
1.4 统计结果处理
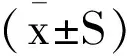
2 实验结果
2.1 各组大鼠神经功能评分比较
各组大鼠苏醒后,假手术组未出现神经功能缺损症状,模型组人参皂苷Rg1组均出现相应的神经功能缺损体征:左前肢肌张力下降,爬行时可发现大鼠向右侧转圈。局灶性脑缺血再灌注后14d,模型组神经功能评分为(2.83±0.37)分,人参皂苷Rg1组评分为(1.67±0.75)分,两组大鼠的神经功能评分有显著性差异(P<0.05)。
2.2 人参皂苷Rg1促进海马区DCX细胞和蛋白水平的表达DCX
阳性细胞主要表达在海马的齿状回颗粒细胞下层(SGZ),假手术组SGZ区DCX阳性细胞为(14.83±8.30)个/mm2,脑缺血再灌注14d后,DCX阳性细胞密度显著增加(P<0.05),给予人参皂苷Rg1干预后,DCX阳性细胞密度进一步显著上升(P<0.05)。见表1。Western-blot结果显示模型组海马DCX蛋白水平较假手术组显著升高(P<0.05),人参皂苷Rg1组DCX蛋白水平与模型组及假手术组相比,均有统计学差异(P<0.05)。见表1。
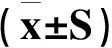
表1 各组大鼠神经功能评分及海马区DCX阳性细胞、蛋白水平比较
注:与模型组相比,△P<0.05;与假手术组相比,*P<0.05,##P<0.05。
3 讨论
笔者之前研究表明人参皂苷Rg1可以通过上调局灶性脑缺血再灌注大鼠海马CA1区脑源性神经营养因子(BDNF)的表达而改善学习记忆能力[6]。本次研究在前期的工作基础上进一步探讨人参皂苷Rg1是否通过促进局灶性脑缺血再灌注大鼠大脑的神经再生能力而改善神经功能缺损体征。
人参皂苷Rg1是从我国名贵中药人参中提取而来,具有抗氧化、延缓智力下降和改善由神经退行性疾病导致的行为学障碍,被广泛运用于心脑血管疾病的基础实验研究。神经功能缺损程度评分是评价脑缺血再灌注后大鼠的运动功能、感觉功能及反射和平衡能力,作为反应脑缺血后药物治疗的疗效评价指标之一。本次神经功能评级采用传统的Longa及Bederson制定的5分法。行为学结果显示局灶性脑缺血再灌注后,大鼠出现显著的神经功能缺损体征。而给予人参皂苷Rg1干预后,局灶性脑缺血再灌注大鼠的神经功能缺损体征得到显著改善。这再次证明人参皂苷Rg1具有神经功能保护的作用。那么人参皂苷Rg1是通过什么机制而发挥神经保护的作用呢?
Doublecortin(DCX)是分子量为40KDa的一种磷酸化蛋白,其基因位点为Xq22.3-23,由DCX基因编码。DCX是神经系统特异性相关蛋白,表达在胚胎期和出生后中枢和外周神经系统发育阶段的迁移神经元[7]。DCX能特异性的表达于未成熟和迁移神经元,是未成熟神经元的特异性标记物[8],代表神经再生的水平[9]。DCX主要表达在海马的SGZ区、脑室的室管膜下区[10]、吻侧迁移流[11]、嗅球及梨状皮质[12]等部位,而脑缺血后常能刺激这些部位加速神经元前体细胞的增殖和迁移。本次实验结果显示假手术组海马SGZ区DCX阳性细胞为(14.83±8.30)个/mm2,局灶性脑缺血再灌注14d后, DCX阳性细胞密度为(20.67±5.09)个/mm2,这说明脑缺血刺激了大鼠海马神经元前体细胞的增殖和迁移。而给予人参皂苷 Rg1治疗后,DCX阳性细胞密度进一步增加,这说明人参皂苷 Rg1有益于脑缺血再灌注大鼠大脑的神经再生。为了进一步证明笔者的结论,笔者采用免疫印迹技术测量3组大鼠海马DCX 的蛋白水平。3组大鼠海马DCX 蛋白水平的表达趋势与形态学实验结果保持一致。
综上所述,人参皂苷 Rg1可以通过促进局灶性脑缺血再灌注大鼠海马神经元前体细胞的增殖和迁移而发挥神经保护作用。
[1]张均田.人参皂苷Rg1的促智作用机制——对神经可塑性和神经发生的影响[J].药学学报,2005,40(5):385-388.
[2]于洋,刘学政,包翠芬,等.人参皂苷Rg1对局灶性脑缺血大鼠PARP-1和TNFR1表达的影响[J].天津医药,2015,43(3):245-248.
[3]庄朋伟,张艳军,庞坦.人参皂苷Rg1促进体外培养神经干细胞增殖的研究[J].中国中药杂志,2009,(4):443-446.
[4]谭新杰,胡长林,蔡文琴.微管相关蛋白Doublecortin在成年大鼠神经元前体细胞发生中的表达[J].解剖学杂志,2006,29(5):601-603.
[5]LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]唐舸航,刘乐吟,向彦霖,等.人参皂苷Rg1对局灶性脑缺血再灌注大鼠学习记忆及海马BDNF表达的影响[J].湘南学院学报(医学版),2016,18(4):5-8.
[7]GLEESON J G,LIN P T,FLANAGAN L A,et al.Doublecortin is a microtubule-associated protein and is expressed widely by migrating neurons[J].Neuron,1999,23(2):257-271.
[8]Ayanlaja A A,Xiong Y,Gao Y,et al.Distinct Features of Doublecortin as a Marker of Neuronal Migration and Its Implications in Cancer Cell Mobility[J].Front Mol Neurosci,2017,10:199.
[9]COUILLARD-DESPRES S,WINNER B,SSHAUBECK S,et al.Doublecortin expression levels in adult brain reflect neurogenesis[J].Eur J Neurosci,2005,21(1):1-14.
[10]李明,高俊彦,吴海平,等.微管相关蛋白在幼犬脑组织的表达[J].长治医学院学报,2015,29(3):167-170.
[11]贺旭,严小新,潘爱华,等.成年大鼠吻侧迁移流的神经发生[J].中国组织化学与细胞化学杂志,2017,26(4):315-320.
[12]HE X,ZHANG X M,WU J,et al.Olfactory experience modulates immature neuron development in postnatal and adult guinea pig piriform cortex[J].Neuroscience,2014,259:101-112.
TheEffectoftheGinsenosideRg1ontheExpressionoftheMicrotubule-associatedProteininRatHippocampusFollowingFocalCerebralIschemiaandReperfusion
HUANG Jun,LV Lihua,YANG Teqing,DENG min,LU Quzhe
(Shaoyang University,Shaoyang 422000,China)
ObjectiveTo explore the effect of Ginsenoside Rg1 on the neurological function deficit and expression of Doublecortin (DCX) in rat hippocampus following focal cerebral ischemia reperfusion.MethodsFocal cerebral ischemia reperfusion model was made by the MACO method and all male rats were randomly divided into sham operation group (n=10), model group (n=10) and Ginsenoside Rg1 group (n=10). The model group was administered with the equal volume of normal saline once a day 30 minutes after cerebral ischemia reperfusion. The Ginsenoside Rg1 group was treated with Ginsenoside Rg1 once a day. The does of Ginsenoside Rg1 was 50mg/kg and the concentration was 8g/L.Fourteen days later, the neurological function deficit score was assessed and the expression of DCX in rat hippocampus of 3 groups was observed via immunohistochemistry and Western-blot.ResultsIn comparison with the model group,the neurological function deficit score of the Ginsenoside Rg1 group decreased (P<0.05). After the intervention of Ginsenoside Rg1, the DCX positive cells in the hippocampal SGZ zone and the DCX protein level expressed in rat hippocampus significantly increased (P<0.05).ConclusionGinsenoside Rg1 could improve the neurological function deficit signs of rats with focal cerebral ischemia through upregulating the DCX expression in hippocampus.
Ginsenoside Rg1;focal cerebral ischemia reperfusion;hippocampus;microtubule-associated protein
R285.5
A

