706例食管癌术后并发症诱因及早晚期食管癌关键基因差异性表达研究
朱溢智, 徐 叶, 王雪艳, 刘凌翔
(1. 南京医科大学, 江苏 南京, 210000;2. 南京医科大学第一附属医院 肿瘤科, 江苏 南京, 210029)
706例食管癌术后并发症诱因及早晚期食管癌关键基因差异性表达研究
朱溢智1, 徐 叶1, 王雪艳1, 刘凌翔2
(1. 南京医科大学, 江苏 南京, 210000;2. 南京医科大学第一附属医院 肿瘤科, 江苏 南京, 210029)
目的探讨食管癌术后并发症诱因,并对关键基因的mRNA、甲基化以及突变对不同食管癌分期的表达差异性进行分析。方法将2010—2013年以及2015—2016年南京医科大学第一附属医院暨江苏省人民医院食管癌术后共706例连续患者进行回顾性分析。从癌症基因组图谱(TCGA)数据库中共得到食管癌患者基因数据后进行统计分析。结果患者年龄与术后败血症发生相关(P=0.011), 术后pTNM分期与吻合口瘘(P=0.010)以及乳糜漏(P=0.030)的发生相关,患者的术后营养方式与吻合口瘘(P=0.041)的发生也显著相关。对不同分期的食管癌患者, EPHA3 mRNA表达存在显著差异(P=0.006); NOTCH1 DNA甲基化水平存在显著差异(P=0.027); 具有统计学意义差异的突变基因是ZNF750 (P=0.037)、MALAT1 (P=0.044)。结论食管癌患者术后并发症的发生与患者年龄、肿瘤TNM分期以及术后营养方式相关。EPHA3的mRNA表达、NOTCH1的甲基化在食管癌不同TNM分期下存在明显差异,并且二者在中晚期患者中表达水平更高, ZNF750和MALAT1的缺失或插入性突变与食管癌的分期均呈负相关。
食管癌; 并发症; 诱因; 肿瘤分期; mRNA; 甲基化; 突变基因; 差异
根据2017年最新统计数据,食管癌死亡率在美国男性当中排第7位且其5年生存率仅为12%~20%[1]。在中国,鳞形细胞癌是食管癌中最常见的组织学分型[2-3]。手术切除对于早期食管癌患者来说仍是最佳选择[4]。有文献[5-8]报道,食管癌术后存在3大严重的并发症,分别为吻合口瘘、肺部感染和喉返神经损伤。Bertals等[9]研究结果显示,对食管癌患者进行术前评估对预测手术相关死亡率有一定价值。目前,食管癌患者的平均5年生存率只有25%左右,而术后的2年生存率有34%[10-11]。本研究对中晚期与非中晚期食管癌患者可能存在的分子生物学差异进行研究,探讨其中与食管癌发展相关的分子差异,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析南京医科大学第一附属医院暨江苏省人民医院胸心外科2010—2013年以及2015—2016年入院行食管癌根治术的患者共706例。入组标准为: ① 所有患者均为术后患者; ② 术后病理诊断为食管癌; ③ 患者手术时间2010—2013年及2015—2016年; ④ 具有齐全的相关临床信息,取得患者同意。于TCGA数据库获得164例食管癌病例,经过筛选并去除信息不全的病例后得到107例食管癌患者的117个关键基因mRNA表达数据、122个基因甲基化数据以及突变基因数据。
1.2 研究方法
对纳入研究的食管癌术后患者的相关数据整理后进行回顾性分析; 统计手术时的患者年龄、性别,并根据AJCC 2012版分期标准进行术后病理TNM分期,按照2000年WHO食管癌组织学分类标准分为鳞形细胞癌、腺癌、小细胞癌共3类。记录患者术后重症监护室(ICU)治疗时间、术后在院总时间,记录患者术后营养方式,其中包括为单纯肠内营养和肠内加肠外混合营养,根据手术入路将术式归纳为微创(腔镜)、左后外切口(经左胸、经膈入腹)、右后外开胸开腹类以及经食管裂孔途径(腹正中切口,扩大食管裂孔后入胸)共4类,统计下呼吸道感染、肺不张、胸腔(心包)积液、心律失常、肺栓塞、败血症、吻合口瘘、乳糜漏、幽门梗阻共9项术后并发症发生情况。另外,将TCGA数据库获得的107例食管癌患者的数据进行整理,根据患者病理TNM分期以Ⅰ、Ⅱ期为A组,Ⅲ、Ⅳ期为B组,再将得到的数据进行PSM匹配,排除了年龄、性别、种族、组织学分类以及烟酒暴露等因素的混杂影响,从而获得用于后续差异性分析的数据。将A、B组基因mRNA、甲基化表达值进行独立样本t检验,从而得到具有差异的关键基因。另外,通过Spearman相关性分析得到A、B组间存在显著差异的突变基因。
1.3 统计学分析
采用SPSS 22.0软件及RStudio1.0.136进行统计分析,基因表达的相关临床数据经过RStudio进行PSM匹配后再由SPSS软件行独立样本t检验和Spearman相关性分析,术后并发症诱因分析采用多变量分析,P<0.05为差异有统计学意义。
2 结 果
2.1 入组706例食管癌术后患者的临床特征
入组的706例患者中,男524例(占74.2%), 女182例(占25.8%); 手术时患者年龄为32~86岁,中位手术年龄为62岁; 腺癌共32例(占5%), 鳞癌共659例(占93%), 神经内分泌癌共15例(占2%), 肿瘤TNM分期从0至Ⅳ期分别有39例(占6%)、151例(占21%)、241例(占34%)、270例(占38%)、5例(占1%)。
2.2 食管癌术后并发症诱因分析结果
在706例患者中,对于纳入的9种并发症,包括下呼吸道感染、肺不张、胸腔(心包)积液、心律失常、肺栓塞、败血症、吻合口瘘、乳糜漏、幽门梗阻,发生的患者总例数(发病率)分别289例(40.9%)、24例(3.4%)、464例(65.7%)、129例(18.3%)、0例(0%)、2例(0.3%)、12例(1.7%)、4例(0.6%)、1例(0.1%)。
对数据进行多变量分析后发现,患者年龄与术后发生败血症显著相关(P=0.011), 发生败血症的患者年龄在70岁以上; 患者的术后pTNM分期与术后发生吻合口瘘、乳糜漏显著相关(P=0.010、0.030), 分期较高的患者术后更易发生吻合口瘘、乳糜漏; 另外,术后给予患者的营养支持方式与吻合口瘘的发生也具有相关性,术后以单一肠内营养的患者术后吻合口瘘发生率为2.53%, 显著高于术后给予肠内加肠外混合营养的患者0.64%的吻合口瘘发生率(P=0.041)。见表1。
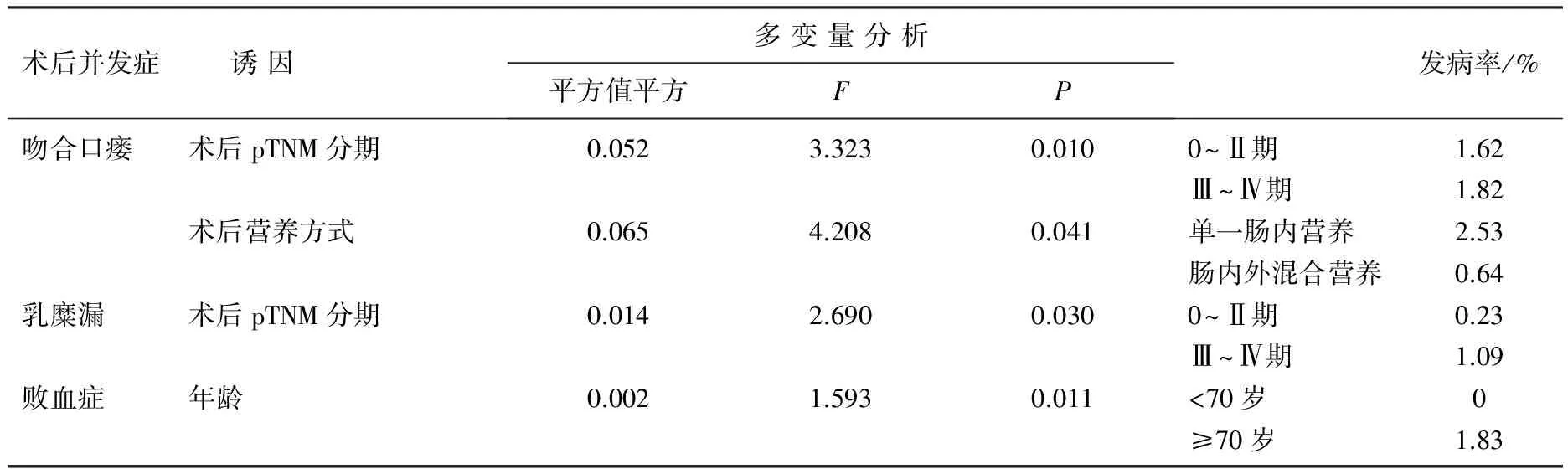
表1 术后并发症诱因分析结果
2.3 A、B组食管癌患者关键基因mRNA及甲基化表达差异和突变分析
从TCGA数据库获得并筛选得到具有全面相关信息的107例食管癌患者的117个关键基因mRNA表达数据、122个关键基因甲基化数据,见表2。

表2 107例食管癌患者临床特征[n(%)]
经过PSM匹配后,排除其他对分期的混杂因素的影响后,得到了117个mRNA表达数据、患者的122个甲基化数据以及不同突变基因数据。分析A、B组的数据,对mRNA及甲基化表达进行独立样本t检验,而对突变基因数据进行Spearman相关性分析,最终得到在A、B组之间EPHA3的mRNA表达存在显著差异(P=0.006), NOTCH1的甲基化水平存在显著差异(P=0.027), 见表3。
另外,具有统计学意义的缺失或插入性突变基因有ZNF750(相关性为-0.211,P=0.037)和MALAT1(相关性为-0.204,P=0.044), 并且这2个基因在A组的突变率分别为8.16%、12.24%, 均高于B组的突变率0%、2.04%。
3 讨 论
手术是食管癌十分重要的治疗手段。有研究[12]表明,有多种因素可以造成吻合口的愈合不良,如营养不良、术前合并呼吸系统疾病、吻合口血供不足、张力过高、感染、吻合口位置、吻合技术等。本文对术后吻合口瘘的发生与可能相关的影响因素分析发现,患者的术后营养支持方式(单一肠内营养对比肠内加肠外混合营养)以及术后pTNM分期与术后吻合口瘘的发生有显著相关性。食管作为消化系统器官,食管癌患者伴随体质量下降和营养风险的比率在60%~70%以上,恶液质发生率在60%~80%, 仅次于胃癌,因此食管癌患者很容易伴随营养不良[13]。除了患者术后营养方式的影响之外,患者的pTNM分期越高,其肿瘤负荷以及肿瘤对机体的营养消耗越大,此类患者较分期较早的患者更容易发生营养不良,从而影响后续术后吻合口的愈合。另外,乳糜漏是食管癌术后较严重的术后并发症之一,严重者可能会导致血容量减少、代谢及营养状况的异常甚至死亡[14-16]。已有研究[17]证实,具有更多阳性淋巴结转移的食管癌术后患者更易发生乳糜漏(P=0.041)。因此,这也解释了患者的术后pTNM分期与术后乳糜漏的发生有着密切关系。此外,患者接受手术时的年龄与术后发生败血症的发生关系密切,小于70岁的患者群体的败血症发生率为0%, 而≥70岁的患者群体的败血症发生率为1.9%。可以推论,随着患者年龄的增加,手术恢复的时间和难度都增加,患者机体抵抗感染的能力下降,使得术后发生败血症的概率也随之增加[18]。对于接受手术时年龄较大的患者,术后应该积极预防感染以及防止因为长期卧床而导致的褥疮的发生,从而降低高龄患者术后败血症的发生率。
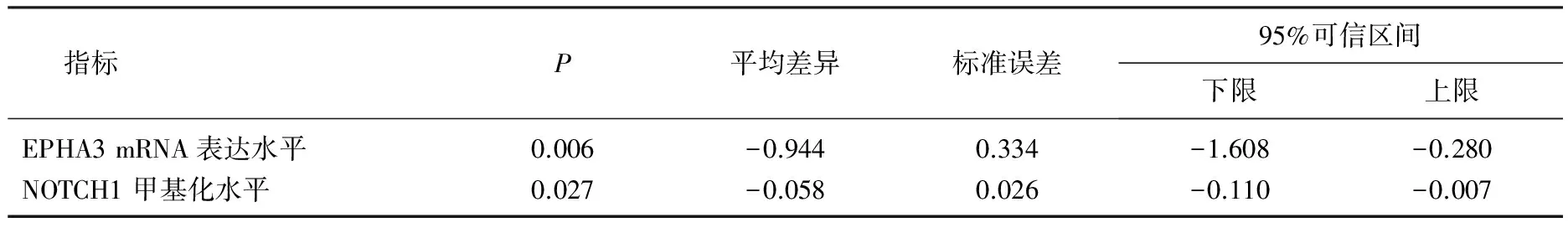
表3 A、B组EPHA3 mRNA表达水平和NOTCH1甲基化水平独立样本T检验结果
EPHA3编码了EPH受体A3, 并且属于蛋白-酪氨酸激酶家族的ephrin受体亚家族,参与了多种肿瘤相关的信号通路,并且已经有研究[19-20]证实, Ephs和ephrins在食管癌中过表达,并与预后差相关。本研究显示,中晚期患者和非中晚期患者EPHA3 mRNA的表达存在显著差异,且在中晚期患者中更多表达(P=0.006), 意味着EPHA3在食管癌的发展中发挥着一定作用,可能预示着较差的预后。另外,在中晚期与非中晚期患者之间具有显著差异的还有NOTCH1甲基化水平,并且相似得在中晚期患者中其甲基化水平更高(P=0.027)。相比于食管腺癌, NOTCH1突变在食管鳞癌中更加多见,并可能参与调节鳞状细胞分化[21]。有研究[22]表明, NOTCH1的过表达是食管鳞癌患者的显著独立预后因素, NOTCH1过表达的食管癌患者预后较差。此外,与食管癌分期呈负相关的包括ZNF750(P=0.037)和MALAT1 (P=0.044)突变。MALAT1在多种肿瘤中高表达,包括乳腺癌、结肠癌、肝癌、膀胱癌、宫颈癌等[23-27]。还有研究[28]表明在食管鳞癌中MALAT1的过表达与肿瘤的分期、原发灶大小以及淋巴结转移呈正相关。研究[29]发现,当MALAT1的3′端6 918 nt至8 441 nt片段发生突变时, MALAT1会丧失促进细胞增殖与侵袭转移的能力。ZNF750是p63的一个靶基因,可诱导终末表皮分化[30]。有研究[21, 31]发现, ZNF750的表达与突变率都在食管鳞癌患者中有着显著增高,并且认为ZNF750可能以类似NOTCH1通过调节鳞状细胞分化的方式从而成为食管鳞癌新的肿瘤抑制因子。
综上所述,食管癌术后并发症可以与患者年龄、肿瘤TNM分期以及术后营养方式相关。EPHA3的mRNA表达水平以及NOTCH1的甲基化水平在食管癌不同TNM分期下存在显著差异,并且二者在中晚期患者中表达水平更高。另外, ZNF750和MALAT1的缺失或插入性突变与食管癌的分期均呈负相关。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 7-30.
[2] ZENG H. Esophageal cancer statistics in China, 2011: Estimates based on 177 cancer registries [J]. Thorac Cancer, 2016, 7: 232-237.
[3] WANG Q, JIAO J. Health Disparity and Cancer Health Disparity in China[J]. Asia Pac J Oncol Nurs, 2016, 3: 335-343.
[4] AJANI J. Esophageal cancer. Clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2003, 1: 14-27.
[5] KIM R H, TAKABE K. Methods of esophagogastric anastomoses following esophagectomy for cancer: A systematic review[J]. J Surg Oncol, 2010, 101: 527-533.
[6] TABATABAI A. Incidence and risk factors predisposing anastomotic leak after transhiatal esophagectomy[J]. Ann Thorac Med, 2009, 4: 197-200.
[7] JONES CE, WATSON T J. Anastomotic Leakage Following Esophagectomy[J]. Thorac Surg Clin, 2015, 25: 449-459.
[8] KOYANAGI K, IGAKI H, IWABU J, et al. Recurrent Laryngeal Nerve Paralysis after Esophagectomy: Respiratory Complications and Role of Nerve Reconstruction[J]. Tohoku J Exp Med, 2015, 237: 1-8.
[9] BARTELS H, STEIN H J, SIEWERT J R. Preoperative risk analysis and postoperative mortality of oesophagectomy for resectable oesophageal cancer[J]. Br J Surg, 1998, 85: 840-844.
[10] ALLUM WH, STENNING SP, BANCEWICZ J, et al. Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer[J]. J Clin Oncol, 2009, 27: 5062-5067.
[11] D′AMICO T A. Outcomes after surgery for esophageal cancer[J]. Gastrointest Cancer Res, 2007, 1: 188-196.
[12] PATIL P K, PATEL S G, MISTRY R C, et al. Cancer of the esophagus: esophagogastric anastomotic leak-a retrospective study of predisposing factors[J]. J Surg Oncol, 1992, 49: 163-167.
[13] MARIETTE C, DE BOTTON M L, PIESSEN G. Surgery in esophageal and gastric cancer patients: what is the role for nutrition support in your daily practice[J]. Ann Surg Oncol, 2012, 19: 2128-2134.
[14] MARCON F. Percutaneous treatment of thoracic duct injuries[J]. Surg Endosc, 2011, 25: 2844-2848.
[15] NAIR S K, PETKO M, HAYWARD M P. Aetiology and management of chylothorax in adults [J]. Eur J Cardiothorac Surg, 2007, 32: 362-369.
[16] Cerfolio R J. Chylothorax after esophagogastrectomy[J]. Thorac Surg Clin, 2006, 16: 49-52.
[17] LAGARDE S M. Incidence and management of chyle leakage after esophagectomy[J]. Ann Thorac Surg, 2005, 80: 449-454.
[18] KIM D, CHO J, KIM K, et al. Chyle leakage patterns and management after oncologic esophagectomy: A retrospective cohort study[J]. Thorac Cancer, 2014, 5: 391-397.
[19] XI HQ, W U X S, WEI B, et al. Eph receptors and ephrins as targets for cancer therapy[J]. J Cell Mol Med, 2012, 16: 2894-2909.
[20] MIYAZAKI T, KATO H, FUKUCHI M, et al. EphA2 overexpression correlates with poor prognosis in esophageal squamous cell carcinoma[J]. Int J Cancer, 2003, 103: 657-663.
[21] RESEARCH N. Integrated genomic characterization of oesophageal carcinoma[J]. Nature, 2017, 541: 169-175.
[22] OGAWA R. NOTCH1 expression predicts patient prognosis in esophageal squamous cell cancer[J]. Eur Surg Res, 2013, 51: 101-107.
[23] ELLIS MJ. Whole-genome analysis informs breast cancer response to aromatase inhibition[J]. Nature, 2012, 486: 353-360.
[24] ZHENG H T. High expression of lncRNA MALAT1 suggests a biomarker of poor prognosis in colorectal cancer[J]. Int J Clin Exp Pathol, 2014, 7: 3174-3181.
[25] LAI M C. Long non-coding RNA MALAT-1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplantation[J]. Med Oncol, 2012, 29: 1810-1816.
[26] HAN Y, LIU Y, NIE L, et al. Inducing cell proliferation inhibition, apoptosis, and motility reduction by silencing long noncoding ribonucleic acid metastasis-associated lung adenocarcinoma transcript 1 in urothelial carcinoma of the bladder[J]. Urology, 2013, 81: 209 e201-207.
[27] GUO F. Inhibition of metastasis-associated lung adenocarcinoma transcript 1 in CaSki human cervical cancer cells suppresses cell proliferation and invasion[J]. Acta Biochim Biophys Sin (Shanghai), 2010, 42: 224-229.
[28] HU L. Up-regulation of long noncoding RNA MALAT1 contributes to proliferation and metastasis in esophageal squamous cell carcinoma[J]. J Exp Clin Cancer Res, 2015, 34: 7.
[29] XU C, YANG M, TIAN J, et al. MALAT-1: a long non-coding RNA and its important 3′end functional motif in colorectal cancer metastasis[J]. Int J Oncol, 2011, 39: 169-175.
[30] SEN G L. ZNF750 is a p63 target gene that induces KLF4 to drive terminal epidermal differentiation[J]. Dev Cell, 2012, 22: 669-677.
[31] LIN D C. Genomic and molecular characterization of esophageal squamous cell carcinoma[J]. Nat Genet, 2014, 46: 467-473.
Analysisofpredisposingfactorsofpostoperativecomplicationsof706patientsandthedifferentialexpressionofkeygenesinearlyandadvancedstagesofesophagealcancer
ZHUYizhi1,XUYe1,WANGXueyan1,LIULingxiang2
(1.NanjingMedicalUniversity,Nanjing,Jiangsu, 210000; 2.DepartmentofOncology,TheFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing,Jiangsu, 210029)
ObjectiveTo study the predisposing factors of postoperative complications of esophageal cancer, and analyze the different genetic expression of mRNA, DNA methylation and mutations with different esophageal cancer staging.MethodsA total of 706 patients with esophageal cancer from the First Affiliated Hospital of Nanjing Medical University and Jiangsu People′s Hospital from 2010 to 2013 and 2015 to 2016 were involved in this study. Data of genetic information from 107 patients with esophageal cancer were obtained from the Cancer Genome Atlas (TCGA) database.ResultsThe analysis showed that age was correlated with SEP (P=0.011), and pTNM staging was correlated with the occurrence of AF (P=0.010) and CL (P=0.030). The postoperative nutritional pattern was also significantly associated with the occurrence of AF (P=0.041). There was a significant difference in the expression of EPHA3 mRNA in patients with esophageal cancer in different TNM stage (P=0.006), DNA methylation level of NOTCH1 (P=0.027), and mutations genes such as ZNF750 (P=0.037) and MALAT1 (P=0.044).ConclusionPostoperative complications of esophageal cancer could be associated with patients′age, TNM staging and postoperative nutritional patterns. The expression of EPHA3 mRNA and the DNA methylation of NOTCH1 show significant difference in different TNM stages of esophageal cancer, and both of them have higher expression in advanced patients. Mutation of ZNF750 and MALAT1 are negatively correlated with the staging of esophageal carcinoma.
esophageal cancer; postoperative complications; predisposing factors; tumor staging; mRNA; DNA methylation; gene mutation; difference
R 735.1
A
1672-2353(2017)19-091-04
10.7619/jcmp.201719026
2017-04-16
国家自然科学基金面上项目(81472782); 江苏省自然科学基金面上项目(BK20141491)
刘凌翔

