不同剂量钙尔奇D 对维生素D缺乏的糖耐量减低患者胰岛素抵抗的影响
谢 宇, 王 春, 姜 敏
(南京大学医学院附属鼓楼医院 老年医学科, 江苏 南京, 210008)
不同剂量钙尔奇D对维生素D缺乏的糖耐量减低患者胰岛素抵抗的影响
谢 宇, 王 春, 姜 敏
(南京大学医学院附属鼓楼医院 老年医学科, 江苏 南京, 210008)
目的探讨不同剂量钙尔奇D对维生素D缺乏的糖耐量减低(IGT)患者胰岛素抵抗的影响。方法将糖耐量减低的116例患者根据维生素D水平分为维生素D充足组和维生素D缺乏组。再将维生素D缺乏组随机分为常规剂量组(给予钙尔奇D 1片/d)、双倍剂量组(给予钙尔奇D 2片/d)、对照组(不给予钙尔奇D)。检测血液生化指标,并计算稳态模型胰岛素抵抗指数及稳态模型胰岛素β细胞功能指数, 1年后复查。结果治疗1年后, FBG、HbA1C、BMI、HOMA-IR、25 (OH)D均较治疗前有明显改善(P<0.05), 且与常规剂量相比较,双倍剂量组的HbA1C、25 (OH)D改善更明显(P<0.05)。将25 (OH)D水平作为因变量,将BMI、HbA1C等其他指标作为自变量,采取多元回归分析显示,血25 (OH)D水平与HOMA-β、Ca呈正相关,与HbA1C、FPG呈负相关。结论补充维生素D可以更好地改善维生素D缺乏的IGT患者胰岛素抵抗状况,且改善程度与维生素D剂量有相关性。
维生素D; 糖耐量减低; 胰岛素抵抗; 剂量
维生素D是一种脂溶性维生素,可调节钙磷代谢,在骨骼代谢、骨质形成方面起重要作用。研究[1-2]发现,维生素D缺乏参与到多种疾病的病理机制中。有研究[3-5]指出,维生素D通过改善胰岛β细胞功能、外周组织的胰岛素敏感性和脂质代谢,从而在一些慢性疾病中发挥重要的作用,如2型糖尿病、代谢综合征、心血管疾病等。流行病学研究[6]表明,维生素D缺乏会增加机体胰岛素抵抗,损伤胰岛β细胞功能。本研究探讨补充不同剂量钙尔奇D对糖耐量减低(IGT)患者糖脂代谢及胰岛素抵抗的影响,现报告如下。
1 资料与方法
1.1 一般资料
选择2012年12月—2015年6月在南京鼓楼医院老年科进行体检的IGT患者116例,其中男83例,女33例,平均年龄(57±5)岁。根据25 (OH)D水平分为VitD充足组和VitD缺乏组,再按随机数字表法将VitD缺乏患者随机分为常规剂量组36例,给予钙尔奇D 1片/d(VitD 125 U/d+钙600 mg); 双倍剂量组38例,给予钙尔奇D 2片/d(VitD 250 U/d+钙1 200 mg); 对照组36例,未服药。纳入标准: IGT诊断符合1999年WHO诊断标准[即口服葡萄糖耐量试验(OGTT) 2 h血糖(2 hPG)≥7.8 mmol/L但<11.1 mmol/L]。排除标准: ① 已患糖尿病; ② 有严重心、肝、肾疾病; ③ 近3个月曾服用VitD类药物以及钙剂; ④ 罹患恶性肿瘤; ⑤ 严重应激状态。所有参与者均签署知情同意书。
1.2 方法
测量患者身高、体质量,计算体质量指数。空腹12 h后,进行OGTT试验及胰岛素释放试验,采用日立7600-020全自动生化分析仪检测血糖、血脂、血钙等指标。电化学发光法测定空腹及OGTT 2 h血清胰岛素(2 hINS)、25 (OH)D水平,高效液相色谱法检测HbA1c。具体操作方法参照说明书。计算稳态模型胰岛素抵抗指数(HOMA-IR)=空腹血糖(FPG, mmol/L)×空腹胰岛素(FINS, mU/L)/22.5, 以及稳态模型胰岛素β细胞功能指数(HOMA-β)=FINS(mU/L)×20/[FPG(mmol/L)-3.5], 以评价胰岛素敏感性和胰岛β细胞功能。根据维生素D与成年人骨骼健康应用指南将 25 (OH)D<20 μg/L定为维生素D缺乏; 25 (OH)D≥20 μg/L定为维生素D充足。
VitD缺乏3组患者干预全程均给予一般治疗(非药物治疗: 生活方式指导、健康教育)。常规剂量组在一般治疗基础上再加钙尔奇D片1片/d(VitD 125 U/d)。双倍剂量组: 在一般治疗基础上再加钙尔奇D片2片/d(含VitD 250 U/d)。对照组仅给予一般治疗。钙尔奇D为美国惠氏制药有限公司生产,饭后服用。
1.3 统计学分析
采用SPSS 17.0软件进行数据统计分析,采用Shapiro-Wilk法进行正态性检验,对正态分布的计量资料用均数±标准差表示,对非正态分布的计量资料进行对数转换成正态分布的资料后进行分析; 两组间采用t检验,多组间比较采用方差分析,若P<0.05, 则进一步采用LSD-t检验进行两两比较。采用多元回归分析进行相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
本研究共纳入116例IGT患者,其中110例患者为25 (OH)D不足,仅有6例患者25 (OH)D充足。2组的年龄、BMI、空腹血糖(FBG)、空腹胰岛素水平(FINS)、餐后2 h胰岛素水平(2 hINS)、糖化血红蛋白(HBA1c)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)比较,差异均无统计学意义(P>0.05), 但25 (OH)D不足组患者BMI、FBG、HBA1c等均高于25 (OH)D充足组。见表1。

表1 维生素D充足与维生素D缺乏IGT患者的一般资料比较
2.2 维生素D缺乏组治疗前一般情况比较
110例25(OH)D缺乏的IGT患者随机分为常规剂量组、双倍剂量组、对照组。在给予治疗前,对各组指标进行比较,其年龄、BMI、25 (OH)D、FBG、FINS、2 hINS、Ca、HBA1c、HOMA-IR、HOMA-β、LDL-C均无显著差异(P>0.05), 而HDL-C有显著差异(P<0.05)。见表2、3。
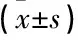
表2 维生素D缺乏组干预前各指标一般情况比较
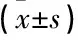
表3 维生素D缺乏组干预前临床指标比较
2.3 维生素D缺乏组治疗后各指标变化情况
常规剂量组和双倍剂量组分别每日给予钙尔奇D 1片/d和2片/d治疗,对照组不予钙尔奇D, 治疗1年后, 2组钙尔奇D治疗患者BMI、FBG、HBA1c、LDL-C、25 (OH)D、HOMA-IR、HOMA-β均较对照组有显著改善(P< 0.05)。双倍剂量组的25 (OH)D及HBA1c改善较常规剂量组更为显著(P<0.05), 其余指标在2组中未见显著性差异。见表4。
2.4 25(OH)D 与各指标相关性分析
以25(OH)D为因变量,以年龄、BMI、FBG、FINS、2 hINS、HBA1c、Ca、LDL-C、HOMA-IR、HOMA-β为自变量,行多元回归分析。结果显示,血25 (OH)D与FBG、HBA1c呈显著负相关(r=-0.248、-0.298,P<0.01), 与HOMA-β、Ca呈显著正相关(r=0.253、0.495,P<0.01), 见表5。

表4 维生素D缺乏组干预前后各指标变化情况
与治疗前比较, *P<0.05; 与常规剂量组比较, #P<0.05。

表5 25(OH)D与各指标的相关性分析
3 讨 论
当前社会糖尿病的发病越来越普遍,其中2型糖尿病约占糖尿病患者数的90%,且随年龄增长,其发病率逐渐增加[7]。目前认为,胰岛素抵抗是糖尿病早期表现,也是导致糖尿病的重要发病机制之一。维生素D是调节骨代谢和钙平衡的重要激素类物质,而流行病学研究[8]发现, 2型糖尿病患者普遍存在维生素D缺乏。有研究[8-9]发现,血清25 (OH)D水平与2型糖尿病及糖尿病前期的患病率呈负相关,补充维生素D可降低2型糖尿病的发生风险并能改善糖尿病患者的血糖水平[10]。研究发现,短时间(7 d)补充维生素D, 不能改善空腹血糖及胰岛素敏感性。
本研究发现, 116例IGT患者中有110例 25 (OH)D水平低于20 ng/mL, 占总人数的94%, 提示IGT患者出现维生素D缺乏的现象非常普遍。将维生素D不足组与维生素D充足组比较发现,维生素D不足组的BMI、HbA1C值均高于对照组,但差异无统计学意义(P>0.05)。有流行病学研究[11]提示,维生素D缺乏会增加机体胰岛素抵抗,损伤胰岛β细胞功能。有研究[12]指出许多2型糖尿病患者的体质量指数(BMI)增高,而血清25(OH)D水平与体内脂肪含量和BMI呈反比。
国外研究[13-15]发现,维生素D缺乏的人群中2型糖尿病的患病率明显增高,而维生素D有促进胰岛素分泌的作用,从而改善胰岛素抵抗、改善血糖水平。但既往研究鲜有补充不同剂量维生素D之间比较,故无法判断维生素D与血糖水平是否为剂量依赖性。本研究对维生素D缺乏的IGT患者补充钙尔奇D 1片(常规剂量组),治疗1年后, FBG、HbA1C、BMI、HOMA-IR、25 (OH)D均较治疗前有显著改善(P<0.05), 而维生素D缺乏的IGT患者补充钙尔奇D2片(双倍剂量组),治疗1年后FBG、HbA1C、BMI、HOMA-IR、LDL-C、25 (OH)D均较治疗前有显著改善(P<0.05)。与常规剂量比较,双倍剂量组的HbA1C、25 (OH)D改善更显著(P<0.05)。由此可见,补充维生素D可以降低胰岛素抵抗,促进患者血糖稳定,并提示血糖水平可能与维生素D剂量有关。但双倍剂量组与常规剂量组比较, HOMA-IR改善无显著差异,可能与研究时间及样本量有关。
本研究对已明确为 IGT 的患者血清 25 (OH)D 水平与代谢指标进行了相关性分析,结果发现25 (OH)D水平与 FBG、HBA1c呈负相关,而与 HOMA-B、Ca呈正相关,提示维生素D缺乏可能是导致胰岛素分泌减少及血糖紊乱的危险因素之一。这可能与胰岛素为钙依赖性分泌有关,活性维生素D可增加钙离子的吸收,而维生素D缺乏可使钙离子通道关闭,直接减少胰岛素的合成和分泌,使葡萄糖介导的胰岛素释放受损。本研究使用的钙尔奇D除了包含有活性的VitD以外,还包含一定量的钙剂。研究[16]指出,对有糖尿病高危因素的患者补充维生素D(2 000 IU/d)联合钙剂(800 mg/d), 与维生素D(2 000 IU/d)联合安慰剂,得出维生素D在改善HBA1c中起到关键性作用,而非钙剂。本研究发现,常规剂量组治疗前血钙水平2.28 mmol/L, 治疗后2.46 mmol/L, 双倍剂量组血钙水平2.25 mmol/L, 治疗后2.53 mmol/L, 治疗后血清钙均较前有所升高,但无显著差异。
综上所述,对于维生素D缺乏的IGT患者,补充钙尔奇D可以更好的改善胰岛素抵抗况,促进血糖的平稳,且钙尔奇D双倍剂量其改善血糖效果更显著。
[1] Göring H, Koshuchowa S. Vitamin D Deficiency in Europeans Today and in Viking Settlers of Greenland[J]. Biochemistry (Mosc), 2016, 81(12): 1492-1497.
[2] Lardner A L. Vitamin D and hippocampal development-the story so far [J]. Front Mol Neurosci, 2015, 8: 58-64.
[3] Harris S S. Does vitamin D deficiency contribute to increased rates of cardiovascular disease and type 2 diabetes in African Americans?[J]. Am J Clin Nutr, 2011, 93: 1175-1178.
[4] Ganji V, Zhang X, Shaikh N, et al. Serum 25-hydroxyvitamin D concentrations are associated with prevalence of metabolic syndrome and various cardiometabolic risk factors in US children and adolescents based on assay-adjusted serum 25-hydroxyvitamin D data from NHANES 2001-2006[J]. Am J Clin Nutr, 2011, 94: 225-233.
[5] Kim S M, Lutsey P L, Michos E D. Vitamin D and Cardiovascular Disease: Can Novel Measures of Vitamin D Status Improve Risk Prediction and Address the Vitamin D Racial Paradox[J]. Curr Cardiovasc Risk Rep, 2017, 11(1): 528-537.
[6] Khan H, Kunutsor S, Franco OH, et al. Vitamin D, type 2 diabetes and other metabolic outcomes: a systematic review and meta -analysis of prospective studies[J]. Proc Nutr Soc, 2013, 72(1): 89-97.
[7] Zhang R, Li B, Gao X, et al. Serum 25-hydroxyvitamin D and the risk of cardiovascular disease: dose-response meta-analysis of prospective studies[J]. Am J Clin Nutr, 2017: 140392-14039.
[8] Liu J, Tan H, Jeynes B. Serum 25 ( OH) vitamin D level, femurlength, and risk of type 2 diabetes among adults[J]. Appl Physiol Nutr Metab, 2011, 36( 2): 264-270.
[9] Nam H, Kim H Y, Choi J S, et al. Association between Serum 25-hydroxyvitamin D Levels and Type 2 Diabetes in Korean Adults[J]. Chonnam Med J, 2017, 53(1): 73-77.
[10] Nikooyeh B, Neyestani T R, Farovid M, et al. Daily consumption of vitamin D or vitamin D + calcium-fortified yogurt drink improve dglycemic control in patients with type 2 diabetes: a randomized clini-cal trial[J]. Am J Clin Nutr, 2011, 93( 4): 764-771.
[11] Khan H, Kunutsor S, Franco O H, et al. Vitamin D, type 2 diabetes and other metabolic outcomes: a systematic review and meta -analysis ofprospective studies[J]. Proc Nutr Soc, 2013, 72(1): 89-97.
[12] Vimaleswaran K S, Berry D J, Lu C, et al. Causal relationship between obesity and vitamin D status: bi-directional Mendelian randomization analysis of multiple cohorts[J]. PLo S Med, 2013, 10 (1): e1001383-1001389.
[13] Boucher B J. Vitamin D insufficiency and diabetes risks[J]. Current drug targets, 2011, 12(1): 61-87.
[14] Wimalawansa S J. Associations of vitamin D with insulin resistance, obesity, type 2 diabetes, and metabolic syndrome[J]. J Steroid Biochem Mol Biol, 2016: 30253-30259.
[15] Wang Y, He D, Ni C, et al. Vitamin D induces autophagy of pancreatic β-cells and enhances insulin secretion[J]. Mol Med Rep, 2016, 14(3): 2644-2650.
[16] Marques-Vidal P, Vollenweider P, Guessous I, et al. Serum Vitamin D Concentrations Are Not Associated with Insulin Resistance in Swiss Adults[J]. J Nutr, 2015, 145(9): 2117-2122.
EffectsofdifferentdosesofCaltrateDsupplementationoninsulinresistanceinpatientswithimpairedglucosetoleranceandvitaminDdeficiency
XIEYu,WANGChun,JIANGMing
(DepartmentofGeriatrics,AffiliatedDrumTowerHospitalofMedicalSchoolofNanjingUniversity,Nanjing,Jiangsu, 210008)
ObjectiveTo observe the effects of different doses of Caltrate D supplementation on insulin resistance in patients with impaired glucose tolerance(IGT) and vitamin D deficiency.MethodsA total of 116 IGT patients were divided into vitamin D sufficient group and vitamin D deficient group based on vitamin D level. And vitamin D deficient group were randomly divided into conventional dose group(Caltrate D for one tablet daily), double doses group(Caltrate D for tablet daily) and control group(without Caltrate D). The blood biochemical indicators was detected, HOMA-IR, HOMA-β were calculated, and the patients were reexamined after one year.ResultsAfter one year of treatment, FBG, HbA1C, BMI, HOMA-IR, 25 (OH) D were significantly improved compared with treatment before (P<0.05), and compared with the single dose, the double doses group had better improvement in HbA1C, 25 (OH) D. Taking the 25 (OH) D level as a dependent variable, BMI, HbA1C, and other indicators as independent variables, multiple regression analysis showed that blood 25(OH) D level was positively correlated with HOMA-β and Ca, and negatively correlated with HbA1C and FPG.ConclusionVitamin D supplementation can improve insulin resistance for patients with impaired glucose tolerance and vitamin D deficiency, and the degree of improvement is correlated with vitamin D doses.
vitamin D; impaired glucose tolerance; insulin resistance; dose
R 458
A
1672-2353(2017)19-059-04
10.7619/jcmp.201719017
2017-04-16
江苏省南京市医学科技发展项目(YKK12052)
姜敏

