头针联合川芎嗪对脑缺血再灌注模型大鼠脑组织MyD88和皮层神经元损伤的影响
吴明娟,孙晓伟,高延宏,卢金荣,赵岩,李锐,辛淑梅,程康陆
(1.黑龙江省中医药科学院,黑龙江 哈尔滨 150036;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3.哈尔滨一洲制药有限公司,黑龙江 哈尔滨 150066;4.黑龙江中医药大学,黑龙江 哈尔滨 150040)
头针联合川芎嗪对脑缺血再灌注模型大鼠脑组织MyD88和皮层神经元损伤的影响
吴明娟1,孙晓伟2*,高延宏3,卢金荣4,赵岩1,李锐1,辛淑梅1,程康陆1
(1.黑龙江省中医药科学院,黑龙江 哈尔滨 150036;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3.哈尔滨一洲制药有限公司,黑龙江 哈尔滨 150066;4.黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:观察头针联合川芎嗪(TMP)对脑缺血再灌注模型大鼠神经功能缺损、脑梗死体积、皮层神经元损伤及MyD88表达的影响,探讨头针联合川芎嗪对脑缺血再灌注模型大鼠的脑保护作用及可能的作用机制。方法:165只大鼠随机分为假手术组(A组)、模型组(B组)、头针组(C组)、TMP组(D组)、头针+TMP组(E组)五组。每组根据再灌注时间分为IR1d(n=13)、IR3d(n=10)、IR7d(n=10)三亚组。采用改良的 Zea Longa线栓法,制备右侧大脑中动脉缺血2 h再灌注(MCAO/R)大鼠模型;A组不中断大脑中动脉血流。C组和E组大鼠在右侧头部百会至曲鬓穴线进行透刺治疗;D组和E组分别给予腹腔注射TMP 20 mg/kg/次,每日一次。各组大鼠相应时间点进行神经功能评分测定;TTC染色检测再灌注1 d大鼠脑梗死体积;HE染色观察皮层神经元损伤及炎性细胞浸润情况;免疫组化、Western blot技术检测各组大鼠缺血侧脑组织MyD88表达水平。结果:E组大鼠在再灌注1 d、3 d、7 d,神经功能缺损程度均较其余四组明显减轻(P<0.05)。在再灌注1 d,E组大鼠相对脑梗死体积最小,与其余四组比较有统计学差异(P<0.05)。再灌注各个时间点,E组大鼠缺血侧皮层神经元损伤程度及炎性细胞浸润情况均较其余四组明显减轻;且缺血侧脑组织中MyD88阳性细胞数和相对蛋白含量均较其余四组明显降低(P<0.05)。结论:头针联合川芎嗪治疗可显著改善MCAO/R大鼠神经功能缺损,减少梗死体积,减轻皮层神经元损伤、炎性细胞浸润,具有脑保护作用,其机制可能与抑制缺血侧脑组织中MyD88蛋白表达、降低脑缺血再灌注后的炎症级联反应有关。
头针;川芎嗪;脑缺血再灌注损伤;髓样分化因子88
缺血性脑血管疾病具有高发病率、高死亡率、高致残率、较多并发症等特点,是严重威胁人类生命和生存质量的一类重大疾病[1-3]。近年来研究发现,髓样分化因子88(MyD88)在诱导炎性反应中发挥重要作用,是脑缺血再灌注级联损伤的病理关键之一。血中气药之川芎,其主要活性成分为川芎嗪(TMP),被临床广泛应用以防治缺血性脑血管疾病[4]。现代研究表明,TMP在防治脑缺血再灌注损伤方面,具有抗炎、清除氧自由基、抗氧化、钙拮抗、拮抗神经细胞凋亡等相关作用[5-7]。头针是通过针刺头部穴线治疗全身系统疾病的一种治疗方法,其治疗中风病具有多靶点、多途径、简便验廉、安全无副作用等特点,目前已得到国内外认可和广泛关注。因此,本研究建立大鼠局灶性大脑中动脉缺血再灌注(MCAO/R)模型,一方面采用神经功能评分、2,3,5-三苯基氯化四氮唑(TTC)和苏木素-伊红(HE)染色,观察头针联合川芎嗪对MCAO/R大鼠神经功能缺损、脑梗死体积、皮层神经元损伤的影响,探讨头针联合川芎嗪对MCAO/R大鼠的脑保护作用;另一方面应用免疫组化和Western blot方法观察头针联合川芎嗪对MCAO/R大鼠缺血脑组织MyD88的影响,探讨头针联合川芎嗪拮抗脑缺血再灌注损伤的可能作用机制。
1 材料与方法
1.1 材料
SPF级雄性SD大鼠165只,体质量260~300 g,购自于黑龙江中医药大学实验动物中心,动物许可证号:SCXK(黑)2013-0027。2,3,5-三苯基氯化四氮唑(TTC)(美国Amresco);盐酸川芎嗪注射液(2 mL:40 mg北京双鹤现代医药技术有限责任公司);MyD88一抗(美国Santa,sc-74532);辣根过氧化物酶山羊抗兔抗体(美国Abcam)。
1.2 动物分组、造模与处理
165只大鼠采用随机数字表法随机分为假手术组(A组)、模型组(B组)、头针组(C组)、TMP组(D组)、头针+TMP组(E组)五组。每组根据缺血2 h再灌注后的时间不同分为IR1d(n=13)、IR3d(n=10)、IR7d(n=10)三个亚组。采用改良的 Zea Longa线栓法[8],制备右侧大脑中动脉缺血2h再灌注大鼠模型;采用Zea Longa 5分法评价模型是否成功(1~3分者,为模型复制成功,纳入实验);假手术组仅将线栓插入12 mm,并不中断大脑中动脉的血流。各组干预方法:头针组和头针+TMP组在大鼠清醒后在其右侧头部百会至曲鬓穴线进行透刺治疗(百会和曲鬓穴的定位参考《实验动物穴位图谱》),进针角度为15°平刺,约0.8寸深,进针后给予快速小幅度提插捻转,其捻转速度达每分钟200转以上,持续5 min,每间隔5 min重复操作一次,留针30 min。TMP组和头针+TMP组在大鼠清醒后给予腹腔注射TMP 20 mg/kg/次,每日一次。假手术组大鼠和模型组大鼠不给予任何干预。
1.3 神经功能评分测定
采用Belayev[9]的12分评分法,在再灌注后不同时间点,对各组大鼠进行神经功能评分测定,损伤越重,得分越高。
1.4 脑梗死体积测定
采用TTC染色法测定各组大鼠脑缺血2 h再灌注24 h的脑梗死体积变化:各组大鼠在再灌注1 d,10%水合氯醛麻醉后,断头取脑,去除小脑和嗅脑,将大脑沿冠状面切成5~6片,每隔2 mm切一片。将切片置于2%TTC溶液中,用台灯进行加热,并不时翻动脑片,使其均匀接触到染色液。正常脑组织为红色,梗死部位为白色。相机拍照后,用Image-Pro Plus Analysis Software计算机图像分析系统计算脑梗死体积。首先计算出每个层面脑片的梗死面积,为避免因脑水肿产生数据误差,我们使用梗死面积=对侧半球面积-患侧正常脑组织面积。本研究中,我们计算相对梗死体积,即各层梗死体积之和占各层对侧半球体积之和的百分比[相对梗死体积=微梗死体积/总体积=(S1+S2+S3+…SN)H/(S1总+S2总+…SN总)H,SN表示每片的梗死面积,H表示每片厚度]。
1.5 HE染色观察皮层神经元损伤情况
各组大鼠在相应时间点,10%水合氯醛麻醉后,左心室依次灌注0.9%生理盐水和4%多聚甲醛固定后,断头取脑,固定于固定液中24 h,脱水透明、石蜡包埋,用于HE染色和免疫组化检测。将包埋的脑组织切片为4 μm、脱蜡、HE染色后,显微镜下观察脑组织病理形态学的变化。
1.6 免疫组化定位和半定量检测MyD88蛋白表达
将4 μm石蜡切片依次经过脱蜡、脱水、枸橼酸抗原修复、内源性过氧化物酶灭活、内源性抗原封闭后,将兔抗MyD88抗体1∶500滴在切片上,4℃湿盒孵育过夜,第二天室温复温后,加入二抗孵育30 min,进行DAB显色、苏木素复染、透明、封片,在显微镜下选择5个不同视野进行计算总的阳性细胞数。
1.7 Western blot半定量检测MyD88蛋白表达
10%水合氯醛腹腔注射麻醉大鼠,断头取脑。BCA蛋白定量、电泳、电转、特异性抗原封闭,兔抗MyD88一抗1∶500 4℃孵育过夜,羊抗兔IgGHRP1∶1 000室温孵育40 min,曝光,胶片扫描。
1.8 统计学处理

2 实验结果
2.1 神经功能评分测定(见表1)

表1 各组大鼠不同时间点神经功能缺损评分比较
注:在相同时间点:与A组比较,△P<0.05;与B组比较,★P<0.05;与C组比较,☆P<0.05;与D组比较,#P<0.05
假手术组大鼠没有神经功能缺损体征出现。其余四组大鼠在造模后均出现不同程度的神经功能缺损,神经功能评分均较假手术组明显升高,差异均有统计学意义(P<0.05)。模型组大鼠在再灌注1 d,神经功能缺损最为严重,随着再灌注时间的延长,神经功能缺损有所恢复,至再灌注7 d,神经功能评分降至7.72±0.91。而其余三个治疗组大鼠神经功能缺损程度均较模型组减轻,神经功能评分均较同期模型组降低,且随着治疗次数增多和治疗时间延长,头针组和TMP组大鼠在再灌注3 d、7 d,神经功能评分与同期模型组比较,差异有统计学意义(P<0.05);而头针+TMP组大鼠在三个时间点,神经功能评分均与同期模型组有统计学差异(P<0.05)。
2.2 相对脑梗死体积测定(见表2)
假手术组大鼠没有梗死灶形成。其余四组大鼠在再灌注1 d均出现大小不同的梗死灶。模型组大鼠梗死灶最大,梗死侧可见顶颞皮质、尾壳核的颜色均呈苍白色,相对梗死体积可达( 39.31±3.76) %。其余三个治疗组,其相对梗死体积均较模型组明显减小,差异均具有统计学意义(P<0.05)。三个治疗组之间相比:头针+TMP组大鼠相对梗死体积最小(31.58±3.14)%,梗死灶仅在纹状体区可见,与头针组和TMP组差异均有显著性(P<0.05);而头针组与TMP组两组相比,无统计学差异(P>0.05),两组疗效相当。

表2 各组大鼠再灌注1d相对脑梗死体积比较
注:与A组比较,△P<0.05;与B组比较,★P<0.05;与C组比较,☆P<0.05;与D组比较,#P<0.05
2.3 各组大鼠不同时间点皮层神经元损伤的动态变化
假手术组大鼠不同时间点皮层神经元形态完整,胞核居中呈蓝色,胞浆呈粉红色,且周围无水肿和炎性细胞浸润。模型组大鼠在再灌注1 d,可见皮层神经元肿胀、皱缩,表现为杆形外观,核深染,核仁消失,可见细胞坏死、坏死后留下的空泡及炎性细胞浸润。再灌注3 d,可见大量坏死细胞,核膜崩解、核仁消失,炎性细胞浸润明显增多。再灌注7 d,皮层神经细胞和间质肿胀减轻,可见少量神经元固缩深染。头针组、TMP组与头针+TMP组大鼠皮层神经元损伤均较相同时间点模型组明显减轻,神经元丢失减少;但头针+TMP组大鼠皮层神经元损伤程度及炎性细胞浸润轻于其他两个治疗组。
2.4 不同时间点各组大鼠缺血侧脑组织MyD88阳性细胞数比较(见表3)
假手术组大鼠缺血侧脑组织中仅见少量MyD88阳性细胞表达,MyD88蛋白主要表达于神经元及神经胶质细胞的胞膜以及胞浆,呈棕黄色。模型组大鼠MyD88阳性细胞表达在再灌注不同时间点呈动态变化:再灌注1 d,缺血侧脑组织中MyD88阳性细胞数较假手术组明显增加;在再灌注3 d达高峰,随后有所减低,但再灌注7 d时含量仍明显高于假手术组(P<0.05)。其他三个治疗组大鼠MyD88阳性细胞表达趋势与模型组相同,但头针+TMP组MyD88阳性细胞数均较同期模型组明显降低(P<0.05)。而头针组和TMP组,MyD88阳性细胞数仅在再灌注3 d、7 d较模型组显著降低(P<0.05);但在再灌注各时间点这两组之间比较均无统计学差异(P>0.05)。
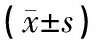
表3 各组大鼠缺血侧脑组织MyD88性细胞数比较
注:在相同时间点:与A组比较,△P<0.05;与B组比较,★P<0.05;与C组比较,☆P<0.05;与D组比较,#P<0.05
2.5 不同时间点各组大鼠缺血侧脑组织MyD88的Western blot检测结果比较(见表4)

表4 各组大鼠缺血侧脑组织MyD88相对蛋白含量比较
注:在相同时间点:与A组比较,△P<0.05;与B组比较,★P<0.05;与C组比较,☆P<0.05;与D组比较,#P<0.05
假手术组大鼠缺血侧脑组织中MyD88相对蛋白含量为0.38±0.008,含量较低。模型组大鼠MyD88蛋白表达在再灌注不同时间点呈动态变化:再灌注1 d,缺血侧脑组织中MyD88蛋白含量较假手术组明显增加;在再灌注3 d达高峰,随后有所减低,但再灌注7 d时含量仍明显高于假手术组(P<0.05)。其他三个治疗组大鼠MyD88蛋白表达趋势与模型组相同,但头针+TMP组MyD88蛋白含量均较同期模型组明显降低(P<0.05)。而头针组和TMP组,MyD88蛋白含量仅在再灌注3 d、7 d较模型组显著降低(P<0.05);但在再灌注各时间点这两组之间比较均无统计学差异(P>0.05)。
3 讨论
缺血性脑血管疾病是由于脑部血液供应障碍,导致缺血、缺氧,引起脑组织局灶性缺血坏死,目前现代医学常常采用降纤、溶栓等治疗手段恢复局部血供,但由此带来的再灌注却将进一步加重缺血组织的损伤,因此积极探讨脑缺血再灌注损伤的相关病理生理机制,寻找切实可行的药物治疗手段是当前亟需解决的难点和重点。
脑缺血再灌注损伤(CIRI)是一个较为复杂的病理生理过程,至今尚未完全明确。而近来研究表明,炎症反应是CIRI发生的重要病理机制之一。其中作为炎症反应操盘手的TLR4/MyD88/NF-κB细胞信号传导通路上所有关键信号分子均可直接或间接影响机体炎症的发生、发展。Toll受体(TLR)家族是哺乳类动物机体内唯一能将细胞外抗原向细胞内传递并引发炎症反应的跨膜蛋白,其胞外区作用是识别并结合相关病原分子,胞内区介导细胞应答的信号启动,进而诱导多种免疫应答,参与炎症瀑布效应或炎症病理反应[10]。髓样因子88(MyD88)属于TLR家族成员之一,可以同TLR4的TIR结构域结合。TLR4当与配体结合后,其胞内的TIR结构域连接胞内衔接蛋白MyD88,进而启动下游IRAK磷酸化,继而激活肿瘤坏死因子(TNF)、受体相关因子(TRAF)及激活核因子(NF)-κB,从而促进多种细胞因子和炎症因子的表达,启动炎症反应[11-12]。
头针疗法是指通过针刺头部穴线治疗全身系统疾病的一种治疗方法,其治疗中风的有效性早在古代就被人们所肯定和记载,早在《针灸大成·玉龙歌》中就有“中风不语最难医,发际顶门穴要知,更向百会明补泻,实时苏醒免灾危”的记载。从中医理论上讲,头为诸阳之会,五脏六腑之精气皆上注于头,因此,针刺头部腧穴可以治疗全身系统的疾病。而现代的神经功能定位区在头皮部投影理论表明,针刺头部输穴,可将刺激产生的效应传送到大脑皮层,从而改变脑皮质神经细胞的兴奋性,使被抑制的脑神经细胞的兴奋性逆转,使处于休克或休眠状态下的脑神经细胞得到觉醒,脑皮质功能区神经细胞的兴奋性恢复,脑代偿功能加强,大脑的机能从而得到改善。针刺“百会”透“曲鬓”是笔者在长期临床实践中总结出的治疗中风效果较为理想的经验要穴。百会透曲鬓:这一穴区横跨了顶、额、颞3区,又有督脉、足太阳膀胱经和足少阳胆经3条阳经贯穿,所以这一穴区经脉从头至足纵贯全身,具有统调一身之阳气、醒脑开窍的功能[13-15]。在百会至曲鬓穴区进行透刺,施以快速捻转手法,又可鼓动头部经气的运行,通达全身经络系统,使全身机能得到有效的改善。血中气药之川芎,其主要活性成分为川芎嗪(TMP),目前在临床上被广泛应用于缺血性脑血管疾病的防治[4]。多种体内外实验[16]证实TMP可阻断多个损伤级联事件,具有抗炎、清除氧自由基、抗氧化、钙拮抗、拮抗神经细胞凋亡等[5-7],可以拮抗CIRI。因此,本研究将头针与川芎嗪联合应用共同治疗脑缺血再灌注损伤,且与单纯头针和单用川芎嗪进行对照,探讨头针与川芎嗪联用拮抗CIRI的协同治疗作用及相关作用机制。
神经功能评分的行为学测定是评价缺血性脑损伤的重要指标之一,也是评价神经功能恢复的有效方法之一。而相对脑梗死体积测定则是评价脑梗死疗效的最可靠的客观指标。本研究结果发现:假手术组大鼠术后清醒后,没有神经缺损体征出现,没有梗死灶形成,并且皮层各层神经元排列整齐、形态完整。而模型组、头针组、TMP组和头针+TMP组大鼠,在脑缺血再灌注不同时间点均出现了不同程度的神经功能缺损,形成了大小不等的梗死灶,且皮层神经元均出现了不同程度的急性损伤改变和炎性细胞浸润。但与模型组相比,其余三个治疗组大鼠神经功能缺损程度、脑梗死体积和皮层神经元损伤、炎性细胞浸润情况均较模型组显著减轻,尤其是头针+TMP组大鼠效果最佳,且与头针组和TMP组均有统计学差异,疗效优于单用头针或单用TMP,具有正向的协同治疗效应。
另外,本研究以MyD88介导的炎症反应为切入点,应用免疫组化和Western blot方法观察头针联合川芎嗪对MCAO/R大鼠缺血脑组织中MyD88的影响,从而探讨头针联合川芎嗪拮抗CIRI的可能作用机制。结果发现:假手术组大鼠缺血侧脑组织中MyD88相对蛋白含量较低;其余四组大鼠MyD88蛋白在不同时间点均呈动态表达,再灌注1 d开始明显升高,再灌注3 d达高峰,随后有所减低,但再灌注7 d时含量仍明显高于假手术组(P<0.05)。且缺血侧脑组织中MyD88的这一动态变化规律与各组大鼠皮层神经元损伤、炎性细胞浸润和神经功能缺损的变化规律一致,说明脑缺血再灌注后MyD88分子启动了CIRI的炎症级联反应,导致了大鼠皮层神经元损伤,造成了大鼠神经功能缺损。而本研究结果显示,经过干预治疗后,三个治疗组大鼠MyD88蛋白含量均较同期模型组明显降低(P<0.05),尤其头针+TMP组降低最为明显,与其他两组有统计学差异(P<0.05)。此研究结果表明,头针联合TMP治疗较单用头针或单用TMP更能抑制缺血侧MyD88蛋白表达,从而阻断TLR4/MyD88/NF-κB细胞信号通路转导,拮抗该通路触发的炎症级联反应,进而保护受损的神经细胞、促进神经功能的恢复,这可能是头针联合TMP拮抗CIRI的相关的作用机制之一,为临床防治缺血性脑血管病提供了新的治疗和研究思路。
[1] Feigin VL.Stroke epidemiology in the developing world[J].Lancet.2005,365:2160-2161.
[2] Carolei A,Sacco S,De SF.Epidemiololgy of stroke[J].Clin Exp Hypertens.2002(24):479-483.
[3] 张婷婷,张树峰,滕尧,等.芪蛭胶囊对缺血性中风大鼠脑组织超微结构的影响[J].中医药信息,2016,33(1):22-24,62.
[4] Zhang H,Sun R,Liu XY,et al.A tetramethylpyrazine piperazine derivate cxc137 prevents cell injury in sh-sy5y cells and improves memory dys-function of rats with vascular dementia[J].Neurochem Res,2014,39(2):276-286.
[5] Cheng XR,Zhang L,Hu JJ,et al.Neuroprotective effects of tetrameth-ylpyrazine on hydrogen peroxide-induced apoptosis in pc12 cells[J].Cell Biol Int,2007,31(5):438-443.
[6] Jeyaseelan K,Lim KY,Armugam A. MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion[J].Stroke,2008,39(3):959-966.
[7] Li P,Teng F,Gao F,et al.Identification of circulating microRNAs as potential biomarkers for detecting acute ischemic stroke[J].Cell Mol Neuro-biol,2015,35(3):433-447.
[8] 吴浩,吉训明,赵喜庆,等.改良大鼠大脑中动脉阻塞模型的建立[J].中国脑血管病杂志,2006,12(3):550-553.
[9] Belayev L,Alonso OF,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture[J].Stroke,1996,27(9):1616-1623.
[10] Cordon S.Pattern recogruition receptors: doubling up for the in nate immune response[J].Cell,2012(111):927-930.
[11] Velayudham A,Hritz I,Dolganiuc A,et al.Critical role of Toll-like recep-tors and the common TLR adaptor,MyD88,in induction of granulomas and liver injur[J].J Hepatol,2006,45(6):813-824.
[12] Yang YX,Zhou HD,Yang YB,et al.Lipipolysaccharide(LPS)regulates TLR4 signal transduction in nasopharynx epithelial cell line 5-8F via NF-κB and MAPKs signaling Pathways[J].Mol Immunol,2007,44(5):984-992.
[13] 关瑞桥,邹伟,于学平,等.针刺“百会”透“曲鬓”对急性脑出血大鼠血清中P选择素(CD62p)的表达影响的实验研究[J].中医药学报,2017,45(4):74-78.
[14] 于学平,孙晓伟,邹伟.百会透曲鬓对脑缺血再灌注大鼠脑微血管纤维连接蛋白表达的影响[J].中医药学报,2016,44(5):71-73.
[15] 孔莹,邢继杰.头穴透刺对脑出血大鼠神经功能和gsk3β影响的研究[J].中医药学报,2014,42(3):100-102.
[16] 胡长鹏,唐勤,邢茂.川芎嗪抗脑缺血再灌注损伤作用机制的研究进展[J].中国中医急症,2014,23(9):1680-1682.
ImpactofScalp-acupunctureCombinedwithTMZonMyD88ExpressionandCorticalNeuronInjuryinRatswithCerebralIschemiaReperfusion
WUMing-juan1,SUNXiao-wei2,GAOYan-hong3,LUJin-rong4,ZHAOYan1,LIRui1,XINShu-mei1,CHENGKang-lu1
(1.HeilongjiangTCMAcademyofSciences,Harbin150036,China;2.TheFirstAffiliatedHospitalofHeilongjiangUniversityofChineseMedicine,Harbin150040,China;3.HarbinYizhouPharmaceuticalCoLtd,Harbin150066,China;4.HeilongjiangUniversityofChineseMedicine,Harbin150040,China)
Objective: To observe the effects of scalp-acupuncture combined with Tetramethylpyrazine(TMP) on neurological function, cerebral infarction size, cortical neuron injury and MyD88 expression in rats with cerebral ischemia reperfusion, and to explore the possible mechanism of its brain protection. Methods: 165 rats were randomly divided into sham operation group(group A), model group(group B), scalp-acupuncture group(group C), TMP group(group D), and scalp-acupuncture+TMP group(group E ). According to different reperfusion time, each group was divided into three sub-groups, i.e. IR1d(n=13), IR3d (n=10), and IR7d(n=10). The models were prepared by using the modified Zea Longa method of 2 h reperfusion(MCAO/R) in right medial cerebral artery. The blood flow of medial cerebral artery was not interrupted in group A; the rats in group C and E group were intervened with Baihui-Qubin scalp-acupuncture on the trouble side; and the rats in group D and group E were given 20 mg/kg TMP once daily. Scores of neural function at corresponding time points were evaluated; size of cerebral infarction was detected with TTC staining in 1 d rats; injury of cortical neurons and inflammatory cell infiltration were observed with HE staining; and expression of MyD88 was detected by immunohistoy chemistry and Western blot method. Results: The degrees of neurological impairment in group E were significantly less than those of the other groups respectively after 1 d, 3 d and 7d reperfusion(P<0.05). After 1 d reperfusion, the size of cerebral infarction was the smallest in group E, and there was a statistical difference compared to the other groups(P<0.05). The injury degrees of ischemic and inflammatory cell infiltration group E were significantly lower than those in the other four groups, also the levels of MyD88 positive cells and the relative protein in the ischemic lateral brain tissue were significantly lower than those of the other four groups(P<0.05). Conclusion: The therapy of scalp-acupuncture with TMP can significantly improve nerve function in the MCAO/R rats, reduce infarction size, decrease cortex neuron injury and inflammatory cells infiltration; it has the action of brain protection with the possible mechanism of inhibiting MyD88 expression and reducing inflammatory cascade reaction after brain ischemia reperfusion.
Scalp-acupuncture; Tetramethylpyrazine; Cerebral ischemia reperfusion injury; MyD88
R245.32+1
A
1002-2392(2017)05-0052-05
2017-08-15
2017-09-28
黑龙江省自然科学基金(H2016045) ;黑龙江省博士后资助项目(LHB-Z12248)
吴明娟(1964-),女,硕士,副主任医师,主要研究方向:针灸治疗神经及精神系统疾病的临床与机理研究。
*通讯作者:孙晓伟(1979-),女,博士,副主任医师,硕士研究生导师,黑龙江中医药大学在站博士后研究人员。主要研究方向:针灸治疗神经及精神系统疾病的临床与机理研究。

