饥饿和复投喂对金钱鱼四种igfbp基因表达的影响
王 妹,陈华谱,2,江东能,李广丽,朱春华,吴天利,邓思平
(1.广东海洋大学 水产学院海洋生态与养殖环境湛江市重点实验室, 广东 湛江 524088;2.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛266071)
饥饿和复投喂对金钱鱼四种igfbp基因表达的影响
王 妹1,陈华谱1,2,江东能1,李广丽1,朱春华1,吴天利1,邓思平1
(1.广东海洋大学 水产学院海洋生态与养殖环境湛江市重点实验室, 广东 湛江 524088;2.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛266071)
本文通过实时荧光定量PCR检测了igfbp-1、igfbp-3、igfbp-4、igfbp-5基因在金钱鱼(Scatophagusargus)下丘脑、脑垂体、性腺、鳃、心脏、肾、肝、脾、肠、肌肉组织中的表达量及经过饥饿和复投处理后在肝脏中的表达量差异.结果显示:4种igfbp在金钱鱼11种组织中均有表达,其中igfbp-1在脑垂体和肝脏中表达量最高,在下丘脑和鳃中次之,在肾脏中最低.igfbp-3在脑垂体和肌肉中表达量最高,而在脾脏、胃、肾脏、肠中相对较低;igfbp-4在下丘脑和心脏中表达量最高,在其他组织中较低;igfbp-5在肠、鳃、脾中表达量最高,在肌肉、下丘脑、心脏、肾脏和肝脏中较低.饥饿2d后,金钱鱼肝脏中igfbp-1和igfbp-3基因的表达量组显著升高,而igfbp-4和igfbp-5基因与对照组相比无显著差异;饥饿7d后,肝脏中igfbp-1、igfbp-3、igfbp-4、igfbp-5基因的表达量均较对照组显著升高;在饥饿7d后复投,igfbp-1、igfbp-3、igfbp-4、igfbp-5基因表达量均显著降低.结果表明igfbp-1、igfbp-3、igfbp-4、igfbp-5在金钱鱼的摄食调节中起着重要作用.
金钱鱼;类胰岛素生长因子结合蛋白;饥饿;复投喂
鱼类和其他脊椎动物的个体生长主要通过生长激素/类胰岛素样生长因子(GH/IGF)生长轴来调节[1].在这个生长轴中,类胰岛素生长因子(Insulin-like Growth Factor,IGF)信号系统在调节细胞的增殖、生长、分化 、凋亡等方面发挥其重要的生物学作用[2-3].IGF 信号系统由配体(Igf-1,Igf-2,Igf-3)、类胰岛素生长因子受体(Igf-1R,Igf-2R)和六种 类胰岛素生长因子结合蛋白(Igfbps)组成.在血清中,Igfbps与 Igf配体结合调节细胞的生长和代谢,即Igfbps作用在靶细胞上,对Igf-1,Igf-2和Igf-3的生物学活性进行调控[4-6],Igfbps和Igf配体的结合作用与Igf受体形成竞争,进而促进细胞的生长[7].
目前从哺乳动物中已经分离出 6 种Igfbps[2,8-11](igfbp-1、2、3、4、5、6),而在硬骨鱼中报道的 igfbps 至少有 3种[12].在硬骨鱼类中,不同组织中存在一种或多种Igfbps,大多数的Igfbps在各个组织都有不同程度的表达[13-15].在哺乳动物中,饥饿胁迫作用下igfbp-1表达量会增加[16].在黄鰤鱼中,饥饿可使肝脏igfbp-1,3,5基因水平显著增加[17].但至今为止igfbps基因在鱼类摄食调节中的作用尚不清楚,需要进一步的研究.
金钱鱼(Scatophagusargus)隶属鲈形目(Perciformes),金钱鱼科(Scatophagidae),金钱鱼属(Scatophagus) 广盐性鱼类,且杂食性,广泛分布于温带和亚热带及热带地区,具有极强的环境适应性和抗逆性,是一种具有观赏和食用价值的名贵海水经济鱼类.本研究通过荧光实时定量PCR技术(qPCR)分析金钱鱼igfbp-1,igfbp-3,igfbp-4,igfbp-5 四个基因在各组织中的分布状况,探讨饥饿和复投喂对四种igfbp表达的影响,从而分析IGF家族在金钱鱼摄食中的调控作用,同时也为将来金钱鱼养殖培育提供分子生物学依据.
1材料与方法
1.1实验鱼
组织表达所需的金钱鱼购自湛江市霞山区水产批发市场.饥饿和复投处理的金钱鱼采自于广东省湛江市广东海洋大学东海岛生物研究基地人工养殖的金钱鱼.
1.2样品处理
金钱鱼置于冰上麻醉后,分别取下丘脑、脑垂体、性腺、鳃、心脏、肾、肝、脾、肠、肌肉组织用于组织表达分布.选取体重为52N~60克的金钱鱼随机分为5组(n=8),每天定量(饵料按体重的2%投喂)、定时(上午9:00)投喂(饵料购于中国悦群海洋生物研究开发公司).经两周驯化后用于饥饿和复投实验.对照组分别为正常饲喂至2天和7天;饥饿组分别为饥饿2天和7天;复投组为饥饿7天后投喂,并在投喂3h后的实验鱼.所有组在实验完成时均取肝脏用于基因表达分析.用于组织分布的各组织以及饥饿和复投所取肝脏取出后立即投入液氮保存,随后转于-80℃低温冰箱保存以用于总 RNA的提取和反转录成cDNA.
1.3总RNA提取及cDNA的制备
根据Trizol® reagent试剂盒说明书的要求操作,利用注射器将各组织捣碎匀浆[18],获取金钱鱼各组织的总RNA.cDNA 利用PrimeScript TM RT reagent Kit with gDNA Eraser反转录酶(Takara) 合成.
1.4同源性分析与进化树的构建
在NCBI(http://www.ncbi.nlm.nih.gov)提供的BLAST程序中进行金钱鱼与其他物种的Igfbps氨基酸序列同源性对比,利用MEGA6.0 邻位相联法(Neighbor-joining,N-J)构建进化树[19].
1.5组织分布及qPCR
通过NCBI 数据库序列比对分析,以及转录组筛选获得的金钱鱼igfbps设计金钱鱼igfbp-1,3,4,5基因qPCR引物(表1).利用igfbp-1,3,4,5与β-actin内参引物(表1),采用qPCR检测各基因在组织中的分布、饥饿和复投中的变化(Bio-Rad 75000 CFX 96 实时荧光定量 PCR 仪).qPCR参照SYBR ® Green Real time PCR Master Mix (TOYOBO, Japan)试剂盒说明书进行反应体系构建,qPCR 反应体系:2 × Master mix 5 μL, (5 μM)上游引物 0.4 μL, (5 μM)下游引物 0.4 μL, cDNA 2 μL, ddH2O 2.2 μL, 总体系 10 μL.qPCR 反应程序:95℃预变性2min; 95℃变性15s,60℃退火1min,72℃延伸20s,84℃收集荧光10s,共40个循环;溶解曲线为95℃ 1min,60℃ 1min,95℃ continue.每个样品做2个技术重复.根据qPCR所显示的Ct 值,运用2-ΔΔCt计算法求出igfbps基因的相对表达量.所有数据均以平均值±标准误(means±S.E.M.)表示.采用SPSS1.8和Excel软件进行显著性差异的统计学分析,当P<0.05 时认为差异显著.

表1 用于金钱鱼igfbp-1、igfbp-3、igfbp-4和igfbp-5基因qPCR的引物
2实验结果
2.1进化树分析
根据本实验室已有3组卵巢、3组精巢及多种组织混合样本得到的8组转录组数据结合NCBI数据库blast分析筛选获得了金钱鱼含开放阅读框的igfbp-1、igfbp-3、igfbp-4和igfbp-5基因序列.进化树结果显示:在所选用物种中,Igfbp-1与Igfbp-4和Igfbp-3与Igfbp-5各自聚为一支,而金钱鱼Igfbp-1、Igfbp-3、Igfbp-4和Igfbp-5与其他鱼类Igfbp-1、Igfbp-3、Igfbp-4和Igfbp-5又分别聚为一小支(图1).金钱鱼Igfbp-1与尖吻鲈(Lates calcarifer)Igfbp-1同源性最高( 90%),与深裂眶锯雀鲷(Stegastespartitus)、南极鳕(Nototheniacoriiceps)、大黄鱼(Larimichthyscrocea)、红鳍东方鲀(Takifugurubripes)、斑马鱼(Daniorerio)、大西洋鲑(Salmosalar)、青鳉(Oryziaslatipe)的Igfbp-1同源性分别89%、88%、87%、81%、67%、63%和56%.金钱鱼Igfbp-3和大黄鱼、尖吻鲈、青鳉、大西洋鲑、斑马鱼、南极鳕、尼罗罗非鱼(Oreochromisniloticus)的Igfbp-3的同源性分别为 93%、91%、92%、75%、73%、60%、59%和58%.金钱鱼Igfbp-4和大黄鱼、尖吻鲈、深裂眶锯雀鲷、尼罗罗非鱼、大西洋鲑、青鳉、地山雀(Pseudopodoceshumilis)的Igfbp-4的同源性分别为 95%、 95%、93%、92%、85%、85%、62%和14%.金钱鱼Igfbp-5和深裂眶锯雀鲷、红鳍东方鲀、尖吻鲈、大黄鱼、南极鳕、尼罗罗非鱼、大西洋鲑、斑马鱼的Igfbp-5的同源性分别为91%、91%、88%、88%、86%、82%、72%和67%.

注:La-ca:尖吻鲈;St-pa:深裂眶锯雀鲷;No-co:南极鳕;La-cr:大黄鱼;Ta-ru:红鳍东方鲀;Sa-sa:大西洋鲑;Da-re:斑马鱼;Or-la:青鳉;Or-ni:尼罗罗非鱼;Ps-hu:地山雀图1 基于N-J法构建的金钱鱼和其他脊椎动物Igfbp-1,3,4,5的系统进化树
2.2igfbp-1,3,4,5基因组织表达分析
QPCR检测金钱鱼成鱼igfbp-1、igfbp-3、igfbp-4、igfbp-5基因于在各组织的表达结果显示:金钱鱼igfbp-1、igfbp-3、igfbp-4、igfbp-5基因在下丘脑、脑垂体、性腺、鳃、心脏、肾、肝、脾、肠、肌肉等11种组织中均有表达;igfbp-1在脑垂体和肝脏中表达量最高,在下丘脑和鳃中次之,在肾脏中最低;igfbp-3在脑垂体和肌肉中表达量最高,而在脾脏、胃、肾脏、肠中相对较低;igfbp-4在下丘脑和心脏中表达量最高,在其他组织中较低;igfbp-5在肠,鳃、脾中表达量最高,在肌肉、下丘脑、心脏、肾脏和肝脏中较低(图2).
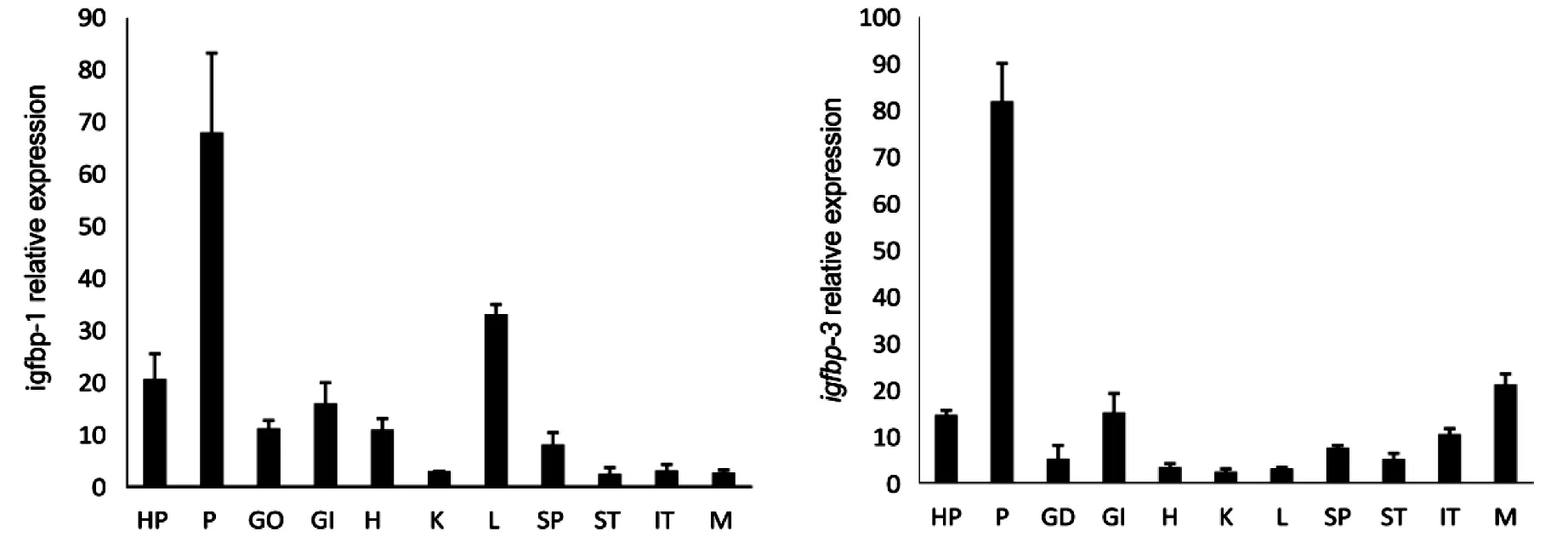

注: HP:下丘脑,P:脑垂体,GO:性腺,GI:鳃,H:心脏,K:肾脏,L:肝脏,SP:脾,ST:胃,IT:肠,M:肌肉图2 横坐标为组织,金钱鱼 igfbp-1,3,4,5基因的组织分布
2.3饥饿和复投对肝脏中igfbp-1,3,4,5基因表达的影响
饥饿2d、7d后,金钱鱼肝脏中igfbp-1和igfbp-3表达量显著升高,而饥饿7d复投后, 肝脏中igfbp-1和igfbp-3表达量恢复至对照组水平;而饥饿2d后,肝脏中igfbp-4和igfbp-5的表达量与对照组差异不显著,但饥饿7d后igfbp-4和igfbp-5表达量显著升高,饥饿7d复投发现肝脏中igfbp-4和igfbp-5表达量显著降低(图3).


注:字母不同表示同一时间内各组间存在显著差异图3 横坐标为天数/d,饥饿及复投处理对金钱鱼肝脏中igfbp-1,3 ,4,5表达的影响(P<0.05)
3讨论
3.1金钱鱼igfbp-1,3,4,5的同源性分析和系统进化树分析
系统进化树显示金钱鱼Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5都和其他硬骨鱼类中相应的Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5各聚为一支,这为金钱鱼中存在四种Igfbp提供了直接的证据,在亲缘关系上,Igfbp-1聚类分析发现金钱鱼与鲈形目尖吻鲈、深裂眶锯雀鲷和大黄鱼等鱼类同源性最高(90%、89%、88%);Igfbp-3聚类分析金钱鱼与鲈形目大黄鱼、尖吻鲈、青鳉等鱼类同源性最高(93%、91%、92%);Igfbp-4聚类分析金钱鱼与鲈形目大黄鱼、尖吻鲈、深裂眶锯雀鲷、尼罗罗非鱼等鱼类同源性最高(95%、 95%、93%、92%);Igfbp-5聚类分析金钱鱼与鲈形目深裂眶锯雀鲷、尖吻鲈、大黄鱼等鱼类同源性最高(91%、88%、88%).因此,金钱鱼与鲈形目鱼类的亲缘关系最近.综上所述,金钱鱼的Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5与鲈形目鱼类Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5具有较高的同源性,也进一步证明了金钱鱼为鲈形目鱼类的系统进化关系,系统进化树显示金钱鱼与其他物种聚类方式符合传统分类学地位.
3.2金钱鱼igfbp-1,3,4,5基因的组织分布分析
翟万营等[20]在牙鲆(Paralichthysolivaceus)中发现igfbp-1 基因在肝脏中表达量最高,且在性腺、鳃、心脏、肾、肝、脾、肠、肌肉和脑中均有表达;丁为群等[21]研究表明,鲢鱼igfbp-1在肌肉、心脏、脑、肾脏、肝脏、鳃和脾中均有表达,但肝脏中的表达量最高;Fiona等[22]也发现五条鰤鱼igfbp-1 在各个组织中均有分布.在本研究中,金钱鱼igfbp-1基因在下丘脑、垂体、性腺、鳃、心脏、肾、肝、脾、肠、肌肉组织中均有表达;其中igfbp-1在垂体和肝脏中表达量较高,在肝脏、下丘脑、鳃、性腺和心脏中相对较低;因此,鱼类肝脏是igfbp-1 的主要表达场所[20-23].而鲤鱼[24]中igfbp-3在心脏、后肠、红肌、脾脏和性腺与肝脏表达量相对较高,在脑垂体中表达量则相对较低;不同的是在本研究中igfbp-3在垂体、肌肉中表达量较高,在肌肉中次之,而在脾脏、胃、肾脏、肠中相对较低;同样,在罗非鱼和某些哺乳动物中igfbp-3的表达也存在差异,igfbp-3主要在肝脏表达[15,25-26];然而鰤鱼[17]igfbp-3主要在心脏和皮肤中表达;igfbp-4基因在下丘脑、垂体、性腺、鳃、心脏、肾、肝、脾、肠、肌肉组织中均有表达,在下丘脑、心脏中表达量较高,在肾脏和性腺表达最低.而Tran等在虹鳟中发现igfbp-4 在脾和鳃之外的其他组织中都有表达,且在脑中表达量较低.Rahman等[27]研究也发现大西洋大黄鱼igfbp-5在下丘脑、脑垂体、性腺、鳃、心脏、肾、肝、脾、肠、肌肉组织中均有表达.这与本实验结果相似,且igfbp-5在肠、鳃、脾、肌肉中表达量较高.结合前人研究结果发现,igfbp-1 主要在肝脏表达,而igfbp-3,4,5在不同物种的不同组织中存在差异表达,这可能与种属差异、生理及发育状态有关.
3.3饥饿和复投对肝脏中igfbp-1,3,4,5基因表达分析
IGF系统对细胞分化、迁移、增殖以及机体的生长、发育、成熟、代谢具有重要调控作用.研究表明营养条件变化会引起IGF系统相关基因差异表达[8].在本试验中,金钱鱼在经2d、7d饥饿后,igfbp-1和igfbp-3在肝脏中的表达量显著升高,而饥饿7d复投后,igfbp-1和igfbp-3在肝脏的表达量恢复至对照组水平;这种结果与鰤鱼研究结果相似[17].本实验结果中igfbp-4和igfbp-5在肝脏的表达量也受饥饿影响.Li等[28]研究发现河豚禁食会引起肝组织igfbp-4表达量显著增加;在草鱼[29]中饥饿2d后igfbp-5a和igfbp-5b在肝脏中表达水平显著上调;这些研究结果与本研究结果相似.但虹鳟[30]经饥饿处理后,igfbp-4在肝脏中表达量降低;大鼠[31]禁食后,igfbp-4在心脏、骨骼肌和肝脏的表达水平同样会降低;与本研究结果存在差异,可能是由于物种的差异导致,而饥饿对生长代谢过程的作用尚不清楚,有待深入研究.
[1]钱焜,温海深,迟美丽,等.海产花鲈IGFBP-1、2基因的克隆及表达分析[J].中国海洋大学学报,2014,44 (9):37-45.
[2]DUAN C,XU Q.Roles of insulin-like growth factor (IGF) binding proteins in regulating IGF actions[J].General & Comparative Endocrinology,2005,142(1/2):44-52.
[3]CLEMMONS D R.Modifying IGF1 activity:an approach to treat endocrine disorders,atherosclerosis and cancer[J].Nature Reviews Drug Discovery,2007,6(10):821-33.
[4]陶洋,邹曙明.草鱼胰岛素样生长因子结合蛋白IGFBP-1基因的全长cDNA克隆及表达[J].上海海洋大学学报, 2011,20(1):15-21.
[5]FLORINI J R,EWTON D Z,COOLICAN S A.Growth Hormone and the Insulin-Like Growth Factor System inMyogenesis[J].Endocrine reviews,1996,17 (5):481-517.
[6]MCGUIRE M A,VICINI L,BAUMAN D E,et al. Insulin-like growth factors and binding proteins in ruminants and their nutritional regulation[J].Journal of Animal Science,1992,70(9):2901-2910.
[7]王晶.牙鲆(Paralichthysolivaceus)胰岛素样生长因子结合蛋白(IGFBPs)基因的克隆和表达调控分析[D].青岛:中国海洋大学,2014.
[8]DUAN C.Specifying the cellular responses to IGF signals:roles of IGF-binding proteins[J].Journal of Endocrinology,2002,175(1):41-54.
[9]JONES J I,CLEMMONS D R.Insulin-like growth-factors and their binding-proteins-biological actions[J].Endocrine Reviews,1995,16 (1):3-34.
[10]于汪洋,张国梁,柳思源,等.草原红牛与天一冈山黑牛背最长肌igfbp-1、igfbp-2、igfbp-3、ig-fbp-4及igfbp-5基因表达差异[J].中国兽医学报,2011,31(8):1223-1227.
[11]HWA V,OH Y,ROSENFELD R G.Insulin-like growth factor binding proteins:a proposed superfamily[J].Acta Paediatrica Supplement,1999,88(428):37-45.
[12]章力,黄希贵,王德寿.鱼类胰岛素样生长因子(IGF)系统的研究进展 [J].动物学杂志,2005,40(2):99-105.
[13]FUKAZAWA Y,SIHARATH K,IGUCHI T,et al.In vitro secretion of insulin-like growth factor-binding proteins from liver of striped bass,Moronesaxatilis[J].General Comparative Endocrinology,1995,99(2):239-247.
[14]SIHARATH K,NISHIOKA R S,BDRN H A.In vitro production of IGF-binding proteins (IGFBP) by various organs of the striped bass,Moronesaxatilis[J].Aquaculture,1995,135(1-3):195-202.
[15]KAMANGAR B B,GABILLARD J C,BOBE J.Insulin-like growth factor-binding protein (IGFBP)-1,-2,-3,-4,-5,and -6 and IGFBP-related protein 1 during rainbow trout postvitellogenesis and oocyte maturation:molecular characterization,expression profiles,and hormonal regulation[J].Endocrinology,2006,147(5):2399-2410.
[16]LEE P D,GIUDICE L C,CONOVER C A,ET A L.Insulin-like growth factor binding protein-1:recent findings and new directions[J].Proceedings of the Society for Experimental Biology & Medicine Society for Experimental Biology & Medicine,1997,216:319-357.
[17]PEDROSO F L,FUKADA H,MASUMOTO T.Molecular characterization,tissue distribution patterns and nutritional regulation of igfbp-1,-2,-3 and -5 in yellowtail,Seriolaquinqueradiata[J].General and Comparative Endocrinology,2009,161(3):344-353.
[18]吴沅沅,贺超,洪广,等.泰国斗鱼神经肽Y基因的克隆及组织表达研究[J].海南热带海洋学院学报,2016,23(5):11-16.
[19]Lochmann R,Phillips H,Webster CD,et al.Nutrient requirements and feeding of finfish for aquaculture[J].Nutrient Requirements & Feeding of Finfish for Aquaculture,2002,78(2):161-164.
[20]翟万营,张俊玲,施志仪,等.牙鲆胰岛素样生长因子结合蛋白igfbp-1 cdna全长的克隆及+6表达分析[J].水产学报,2012,36(2):170-179.
[21]丁为群,梁宏伟,邹桂伟,等.鲢igfbp-1基因全长cDNA的克隆及表达分析[J].西北农林科技大学学报,2013,41(5):1-8.
[22]MCLELLAN K C,HOOPER S B,BOCKING A D,et al.Prolonged hypoxia induced by the reduction of maternal uterine blood flowalters insulin-like growth factor-binding protein-1(igfbp-1)andigfbp-2 gene expression in the ovine fetus[J].Endocrinology,1992,131(4):1619-1625.
[23]SHIMIZ M,DICKEY J T,FUKADA H,et al.Salmon serum 22 kda insulin-like growth factor-binding protein (igfbp) is igfbp-1[J].Journal of Endocrinology,?2005,184(1):267-276.
[24]CHEN W,LIN H,LI W.Molecular characterization and expression pattern of insulin-like growth factor binding protein-3 (igfbp-3) in common carp,Cyprinus carpio[J].Fish Physiology and Biochemistry,2012,38(6):1843-1854.
[25]BOOTHE B A,BAR R S,BOES M,et al.Intrinsic bioactivity of insulin-like growth factor-binding proteins from vascular endothelial cells[J].Endocrinology,1990,127(6):2630-2638.
[26]CHENG R,CHANG K M,WU J L.Different Temporal Expressions of Tilapia (Oreochromismossambicus) Insulin-like Growth Factor-I and IGF Binding Protein-3 After Growth Hormone Induction[J].Marine Biotechnology,2002,4(3):218-225.
[27]RAHMAN M S,THOMAS P.Characterization of threeigfbpmRNAs in Atlantic croaker and their regulation during hypoxic stress:potential mechanisms of their upregulation by hypoxia[J].American Journal of Physiology Endocrinology and Metabolism,2011,301(4):637-648.
[28]LI M,LI Y,LU L,et al.Structural,gene expression,and functional analysis of the fugu (Takifugurubripes) insulin-like growth factor binding protein-4 gene[J].American Journal of Physiology Regulatory Integrative and Comparative Physiology,2009,296(3):558-566.
[29]ZHENG G D,ZHOU C X,LIN ST,et al.Two grass carp (ctenopharyngodonidella) insulin-like growth factor-binding protein 5 genes exhibit different yet conserved functions in development and growth[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology?2017,204:69-76.
[30]GABILLARD J C,KAMANGAR B B,MONSTERRAT N.Coordinated regulation of the GH/IGF system genes during refeeding in rainbow trout (Oncorhynchusmykiss) [J].Journal of Endocrinology,2006,191(1):15-24.
[31]CHEN Y,ARNQVIST H J.Differential regulation of insulin-like growth factor binding protein-2 and -4 mRNA in muscle tissues and liver by diabetes or fasting[J].Journal of Endocrinology,1994,143(2):235.
EffectofHungerandRefeedingontheExpressionofScatophagusargus’sFourigfbpGenes
WANG Mei1,2,CHEN Hua-pu1,2,JIANG Dong-neng1,2,Li Guang-li1,2,ZHU Chun-hua1,2,WU Tian-li1,2,DENG Si-ping1,2
(1. Fisheries College, Guangdong Ocean University, Zhanjiang Guangdong 524088, China; 2. Marine ecology and aquaculture environment Key Laboratory of Zhanjiang City, Zhanjiang Guangdong 524088, China)
This paper detected by Real-time qPCR the expression ofigfbp-1,igfbp-3,igfbp-4 andigfbp-5 genes of hypothalamus, pituitary, gonad, gill, heart, kidney, liver, spleen, intestine and muscle inScatophagusargus, and the expression of those genes in liver processed by 2d's and 7d's starvation and re-feeding after 7d's starvation. The results showed that the four genes were expressed differently in 11 tissues inScatophagusargus, whereas,igfbp-1 has the highest expression in pituitary and liver, followed by the expression in hypothalamus and gill less, lowest expression in kidney.igfbp-3 has the highest expression in pituitary and muscle, while that in the spleen, stomach, kidney, intestine is relatively low.igfbp-4 has the highest expression in hypothalamus and heart, while that in the other tissues is low.igfbp-5 has the highest expression in the intestine, gill and spleen, while that in muscle, hypothalamus, heart, kidney and liver was low. After 2d's starvation, the genes expression ofigfbp-1 andigfbp-3 in the liver increased significantly, but that ofigfbp-4 andigfbp-5 in the lever showed no obvious discrepancy with the control groups. After 7d's starvation, the genes expression ofigfbp-1 ,igfbp-3,igfbp-4 andigfbp-5 in the liver all increased significantly with contrast to the control groups. Refeeding after 7d's starvation significantly reduced he genes expression ofigfbp-1,igfbp-3,igfbp-4 andigfbp-5 in the liver. The results showed thatigfbp-1,igfbp-3,igfbp-4 andigfbp-5 play an important role in the process of growth and metabolism of Scatophagus argus.
Scatophagusargus; hungry;igfbp
格式:王妹,陈华谱,江东能,等.饥饿和复投喂对金钱鱼四种igfbp基因表达的影响 [J].海南热带海洋学院,2017,24(5):1-7.
2017-06-26
广东省自然科学基金(2016A030313743);广东省海洋与渔业局科技攻关与研发及技术推广项目(A201608B01,2017A0012);广东省教育厅特色创新项目(2015KTSCX058);湛江市财政资金科技竞争性分配项目(2016A03017);青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室开放课题(2016LMFS-B12)
王妹(1992-),女,安徽宿州人, 广东海洋大学水产学院2016级水产养殖专业硕士研究生,研究方向为水产经济动物增养殖研究.
邓思平(1974-),男, 重庆合川人,广东海洋大学水产学院副教授,博士,研究方向为海洋生物学研究.
S965
A
2096-3122(2017) 05-0001-07
10.13307/j.issn.2096-3122.2017.05.01
(编校李由明)

