月季RhMYB61基因的克隆及表达特性分析
李绍翠,姜新强,丁爱琴,刘庆超,王奎玲,李 伟,刘庆华
(青岛农业大学 园林与林学院,山东 青岛 266109)
月季RhMYB61基因的克隆及表达特性分析
李绍翠,姜新强,丁爱琴,刘庆超,王奎玲,李 伟,刘庆华
(青岛农业大学 园林与林学院,山东 青岛 266109)
为了研究月季MYB类转录因子在月季花朵开放中的分子特征和表达特性,利用转录组测序获得的序列信息,结合RACE技术,从切花月季萨蔓莎中分离获得一个MYB类型的转录因子基因,命名为RhMYB61(登录号KY921844)。该基因ORF区包含1 323 bp,编码441个aa,分子量为49.1 kDa,等电点为7.66,公式C2123H3280N620O688S18。系统进化树分析表明,RhMYB61与桃树中的PpMYB86和枇杷EjMYB8聚为一类,属于R2R3-MYB类型转录因子,进一步的蛋白序列多重比较发现,RhMYB61在N端具有保守的R2-MYB和R3-MYB区域,包含有7个保守的基序,在R3-MYB区域包含有核定位序列。利用实时定量PCR技术分析了RhMYB61的时空表达模式,结果显示,随着开花级数的增加,RhMYB61的表达特性呈逐渐增加的趋势,在开花级数5级时表达倍数最高;失水12 h处理提高了RhMYB61的表达倍数;与对照相比较,乙烯处理6,12,24 h显著提高了RhMYB61的表达特性,1-MCP则显著抑制了其表达。上述结果为月季RhMYB61生物学功能的研究奠定了基础,同时也为今后月季的分子育种研究提供了理论参考。
切花月季;RhMYB61;qRT-PCR;表达特性
MYB转录因子是植物体内最大的转录因子基因家族之一,成员众多、功能多样,广泛参与了植物的次生代谢调控、激素和环境因子的应答,并对细胞分化、细胞周期、器官的形成以及植物叶片的形态建成具有重要的调节作用[1]。众多植物中均分离获得了与非生物胁迫应答相关的MYB类型转录因子,在草本植物拟南芥AtMYB32[2]、水稻[3]、菊花CmMYB1、CmMYB2[4],木本植物苹果MdSIMYB1[5]、杨树PtoMYB170[6]中的MYB转录因子均能够对非生物胁迫如高盐、干旱、冷胁迫等做出积极的响应,MYB转录因子在对非生物胁迫中的应答方面作用突出。
月季(Rosahybrida)是我国传统名花也是世界四大切花之一,其切花销售量和销售额在全球花卉贸易中均居切花之首[7]。因其花期长、花色丰富等特点,已逐渐成为花朵开放等方面研究的模式材料[8]。我国月季切花主产区为云南,主要消费区域集中在北京、上海和广州等城市,需要经历长时间长距离的干式运输,极易遭受失水胁迫和乙烯诱导的花朵开放,流通损耗在30%~50%,易造成僵花、僵蕾、花朵不能正常开放和衰老过速,制约了商品价值的发挥,对花卉生产者造成巨大的经济损失[9]。因此,系统研究月季切花失水胁迫耐性和乙烯作用调节的分子机理,对切花月季品质提高具有重要的理论和实践意义。
迄今为止,在月季中获得了3个MYB类型的转录因子,分别为RhMYB1[10]、RhMYBs4-1和RhMYBs6-1,它们在不同花色月季花青素合成和调控花瓣颜色方面发挥着调控作用[11],但对于数量众多、功能多样的月季MYBs还未充分挖掘。鉴于此,本试验选取切花月季萨曼莎为材料,结合前期转录组测序结果,从花瓣cDNA中克隆得到一个MYB基因,命名为RhMYB61。采用生物信息学的方法对该基因的氨基酸序列进行序列比对、理化性质和亲/疏水性和二级结构等方面的分析;并利用荧光定量PCR方法检测了RhMYB61在月季不同开花级数、失水胁迫和乙烯处理下的转录本水平变化。为进一步明确RhMYB61基因特性及其对非生物胁迫的响应机制提供了理论基础。
1 材料和方法
1.1试验材料
供试材料为切花月季萨蔓莎(RosahybridaSamantha),开花级数2级,按花枝长30 cm、留3复叶的基准剪切并插入蒸馏水中,复水1 h后备用。
1.2试验处理
开花级数参考马男等[12]对月季开花级数的划分并进行取样。
失水胁迫处理参照按照Dai等[13]进行,在温度为22~25 ℃、相对湿度为30%~50%、140 μmol/(m2·s)荧光灯(照光12 h/d)照光的条件下水平干置0~24 h。在0,1,3,6,12,24 h分别取样。
乙烯处理参照马男等[12]进行,将修剪后的花枝置于去离子水中进行处理。乙烯处理时,在64 L密闭容器内注入乙烯使其终浓度为10 μL/L,处理24 h,以密闭于不含乙烯气体的64 L密封箱中的花枝为对照。
各处理结束后将花瓣取下立即进行液氮冷冻,存于-80 ℃冰箱备用。
1.3试验方法
1.3.1 总RNA提取和cDNA的合成 以1.2中处理后的切花月季花瓣为材料,Hot borate法提取不同处理下花瓣总RNA[14]。利用Nanodrop(美国Effendorf公司)检测提取的RNA样品浓度,1.2%琼脂糖凝胶电泳检测提取质量。cDNA反转录采用PrimeScript RT reagent Kit With gDNA Erase(大连TaKaRa公司)试剂盒,将反转录产物稀释4倍后-20 ℃保存备用。
1.3.2RhMYB61基因的克隆 利用月季EST数据库[13]的Unigene序列为模板设计5′Race扩增和3′Race扩增特异性引物(表1)并进行PCR扩增。PCR反应体系为上下游引物 (10 μmol/L) 各 1 μL,ExTaq聚合酶 (5 U/μL) 0.1 μL,10×PCR Buffer 2 μL,dNTP(2.5 mmol/L) 1.6 μL,总cDNA (1 μg/μL) 1 μL,ddH2O补足20 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min,4 ℃保存。将PCR产物进行琼脂糖凝胶电泳检测,利用TaKaRa Mini BESTAgarose Gel DNA Extraction Kit试剂盒(大连TaKaRa公司)回收目的条带,并与pMD18-T载体连接。连接产物转化大肠杆菌,蓝白斑筛选,挑取白色单菌落鉴定,根据菌落PCR结果,将鉴定出的阳性克隆交由青岛擎科梓熙生物工程有限公司测序。
1.3.3 RhMYB61的生物信息学分析 采用ProtParam (http://web.Expasy.org/compute_pi/) 预测RhMYB61分子量和理论等电点。通过SignalP软件进行信号肽预测[15];利用ProtScale (http://web.Expasy.org/protscale/) 分析RhMYB61氨基酸序列的疏水性/亲水性;利用TMHMM Server v. 2.0软件(http://www.cbs.dtu.dk/services/TMHMM/)对RhMYB61进行蛋白跨膜性分析[16]。利用ProtFun(http://www.cbs.dtu.dk/services/ProtFun/) 和PRABI(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)对蛋白质功能和二级结构进行预测[17]。利用Motif分析工具[18]进行RhMYB61基序保守性分析。用DNAMAN软件进行序列比对及翻译,利用MEGA 6.0软件构建系统发育进化树[11]。

表1 切花月季RhMYB61基因表达检测引物Tab.1 Primers used to determine the expression of RhMYB61 in cut rose Samantha
1.3.4RhMYB61基因表达特性分析 采用实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)分析月季切花RhMYB61基因在不同开花级数及失水、乙烯和1-MCP处理下的表达模式。不同处理条件总RNA提取和cDNA的合成如1.3.1,按照SYBR PremixExTaq试剂盒(大连TaKaRa公司)的操作说明进行qRT-PCR,所有反应均在Setp One Plus荧光定量PCR平台(美国ABI公司)进行,RhUBI1为内参基因[19](表1)。反应条件为:95 ℃预变性60 s;95 ℃变性10 s,58 ℃退火20 s,72 ℃延伸15 s,共40个循环。Melt曲线从72 ℃至99 ℃,第1步维持45 s,以后每升高1 ℃维持5 s。采用2-ΔΔCT法分析数据[20]。
2 结果与分析
2.1RhMYB61克隆
以开花级数2级的切花月季萨蔓莎进行失水12 h处理,提取总RNA并反转录成cDNA模板,根据转录组EST序列信息设计5′和3′扩增引物(表1),分别进行3′RACE和5′RACE,将上述片段与pMD-18T载体连接、转化,并进行蓝白斑筛选,将鉴定正确的样品测序。所得结果如图1所示,月季RhMYB61登录号为KY921844,全长为1 727 bp,5′端非编码区(5′-UTR)为178 bp,开放阅读框为1 323 bp,编码441个氨基酸,3′端非编码区(3′-UTR)为226 bp。

M. DL2000 Marker;A. 3′RACE 产物;B.5′RACE 产物;C. RhMYB61开放阅读框片段克隆;D. RhMYB61全长片段克隆。M. DL2000 Marker;A. 3′RACE fragment;B.5′RACE fragment;C. Open reading frame of RhMYB61;D. Full length of RhMYB61.
2.2RhMYB61生物信息学分析
2.2.1 RhMYB61基本特性分析 利用生物信息学软件ProtParam等对RhMYB61的蛋白组成成分和理化性质进行了分析[21]。RhMYB61蛋白相对分子量49.1 kDa,理论等电点(pI)为7.66,公式C2123H3280N620O688S18,原子量6 729。RhMYB61蛋白为亲水蛋白,其N-端头部较亲水,中间氨基酸也表现出亲水性,蛋白在第81位疏水性最强,最高值为2.189,第177位亲水性最强,最低值为-3.111。蛋白峰值的分布在0.5以上的比在-0.5以下的要少,表明蛋白为亲水性蛋白。信号肽结果分析表明,RhMYB61不属于分泌蛋白。蛋白跨膜性分析显示RhMYB61氨基酸序列中未发现含有跨膜区域,不属于膜蛋白;对RhMYB61蛋白进行二级结构预测显示,其氨基酸组成α-螺旋(Hh)为137个(31.07%),延伸链(Ee)为53个(12.02%),无规则卷曲(Cc)为219个(49.66%),属于不规则结构。生物学功能预测显示RhMYB61具有合成辅酶因子、嘌呤、嘧啶和脂肪酸代谢等方面的功能(表2)。

表2 RhMYB61蛋白质功能预测Tab.2 Biological function prediction of RhMYB61
2.2.2 RhMYB61保守基序和氨基酸序列比对 选取拟南芥(Arabidopsisthaliana)、大豆(Glycinemax)、苹果(Malusdomestica)、枇杷(Eriobotryajaponica)、白桦(Betulaplatyphylla)、菊花(Chrysanthemummorifolium)、厚叶蒴苣苔(Boeacrassifolia)、黑杨(Populusnigra)、桃(Prunuspercica)、水稻(Oryzasativa)和小麦(Triticumaestivum)中的MYB蛋白序列与月季RhMYB61进行基序保守分析,结果如图2所示。由图可知,不同植物MYB蛋白保守基序数量和位置不尽相同,所有植物均含有基序1、基序2和基序3。RhMYB61与AtMYB61、PpMYB86、MdMYB、EjMYB8、PnMYB和GmMYB86氨基酸序列类似,包含有7个保守基序,在N-端含有5个保守基序,并呈串联排列,C-端含有2个保守基序,分别为基序4和基序8。基序7仅在TaMYB3R1和OsMYB3R2中有,其他植物中未发现。
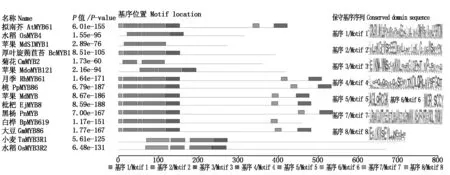
方框表示MYB蛋白的保守基序;灰线条显示非保守序列;标尺代表100个氨基酸。Each motif is represented by a number in the box and the grey lines represent the nonconserved sequences;The scale bar represents 100 amino acids.
进一步选取拟南芥、大豆、苹果、枇杷和白桦中的MYB蛋白与月季RhMYB61蛋白进行序列多重比对分析(图3)。结果显示,5个不同物种MYB蛋白氨基酸序列与月季RhMYB61的一致性分别为42.63%,47.78%,63.19%,62.61%和44.62%,在12-60 aa和61-111 aa处含有2个保守的MYB结构域,上述不同植物MYB蛋白序列都属于2R类型MYB转录因子,其N-端都含有非常保守的R2-MYB和R3-MYB结构域,具有 MYB家族典型的结构特征,SeqNLS[22]分析显示RhMYB61的R3-MYB结构域中还包含有3处核定位序列(NLS,图3方框部分),所有植物MYB蛋白C-端氨基酸序列高度分化,推测不同物种中MYB蛋白功能的多样性。

At.拟南芥;Gm.大豆;Md.苹果;Ej.枇杷;Bp.白桦;Rh.月季。箭头表示保守的R2和R3结构域;NLS表示核定位序列。At. Arabidopsis thaliana;Gm.Glycine max;Md.Malus domestica;Ej.Eriobotrya japonica;Bp.Betula platyphylla;Rh.Rosa hybrid.The two conserved MYB domain repeat (R2 and R3) are indicated with arrows;Nuclear localization sites was shown with boxed.
2.2.3 RhMYB61蛋白进化树分析 为进一步探究月季RhMYB61与其他物种的同源性进化关系,选用拟南芥、水稻、厚叶旋蒴苣苔、苹果、菊花、大豆、枇杷、桃、黑杨、白桦和小麦中的22个MYB蛋白质序列与月季RhMYB61构建系统进化关系图(图4)。结果显示,月季RhMYB61与桃PpMYB86、枇杷EjMYB8、苹果MdMYB、大豆GmMYB86、拟南芥AtMYB61亲缘关系较近,与水稻OsMYB4、苹果MdoMYB121、厚叶旋蒴苣苔BcMYB1亲缘关系较远,上述MYB蛋白均属于R2R3-MYB类蛋白。单子叶植物小麦TaMYB3R1和水稻OsMYB3R1、OsMYB3R2属于R1R2R3-MYB类蛋白,与月季RhMYB61亲缘关系较远。上述结果暗示了MYB类蛋白在双子叶植物和单子叶植物进化上的保守性和多样性。
2.3RhMYB61表达特异性分析
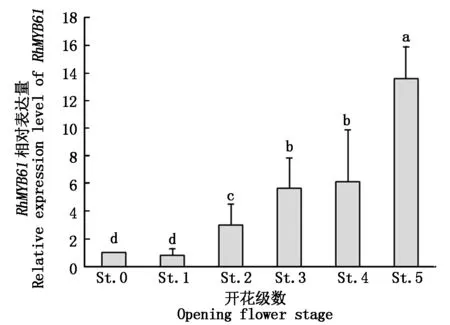
2.3.1RhMYB61在不同开花级数中的表达 为了明确RhMYB61在月季花朵发育中的作用,采用qRT-PCR的方法检测RhMYB61在月季不同开花级数中的表达情况(图5)。由图5可知,随着月季开花过程的进行,花瓣中RhMYB61的表达量呈现逐渐增高的趋势,在开花级数0级和1级时相对表达量差别不大,分别为1.00和0.81,开花级数2级时表达量升高至3.00,显著高于开花级数0级和1级,开花级数5级时相对表达量最高,为13.60,显著高于其他开花级数。RhMYB61在月季不同开花级数中的表达量暗示着其参与了花朵开放的过程。
2.3.2 不同处理对RhMYB61表达量的影响 用定量PCR检测了RhMYB61在转录本水平上对乙烯处理和失水胁迫处理的响应(图6)。结果表明,在正常瓶插条件下,花瓣RhMYB61瓶插1,6,12 h只有微弱的表达,表达量分别为0.73,1.50,1.80,瓶插24 h后表达量升高到5.69,乙烯处理明显诱导了RhMYB61的表达,乙烯处理6,12 h后,相对表达量分别为7.92,7.72,高于同一时间正常瓶插下的表达量,乙烯处理24 hRhMYB61相对表达量最高为8.37。乙烯抑制剂1-MCP处理降低了RhMYB61的表达水平,1-MCP处理1,6,12,24 h后RhMYB61表达量分别为0.21,0.46,0.57,1.07。

At.拟南芥;Gm.大豆;Md.苹果;Ej.枇杷;Bp.白桦;Cm.菊花;Pp.桃;Pn.黑杨;Bc.厚叶旋蒴苣苔;Ta.小麦;Os.水稻。At.Arabidopsis thaliana;Gm.Glycine max;Md.Malus domestica;Ej.Eriobotrya japonica;Bp.Betula platyphylla;Cm.Chrysanthemum morifolium;Pp.Prunus percica;Pn.Populus nigra;Bc.Boea crassifolia;Ta.Triticum aestivum;Os.Oryza sativa.
图中不同小写字母表示处理间差异显著(P<0.05)。图6-7同。Bars with different lowercase letters indicate significant differences by Turkey HSD test(P<0.05).The same as Fig.6-7.
对RhMYB61在不同失水情况下的表达特性进行了分析,结果如图7所示,随着失水胁迫时间的延长,RhMYB61的表达呈现出先上升后下降的趋势,与正常瓶插植株相比,失水胁迫1 h的RhMYB61转录本水平差异不大,失水胁迫3,6 h诱导了RhMYB61表达水平的提高,相对表达量分别为1.56和1.87,随后RhMYB61表达量逐渐降低,失水胁迫24 h表达量最低,为0.48。
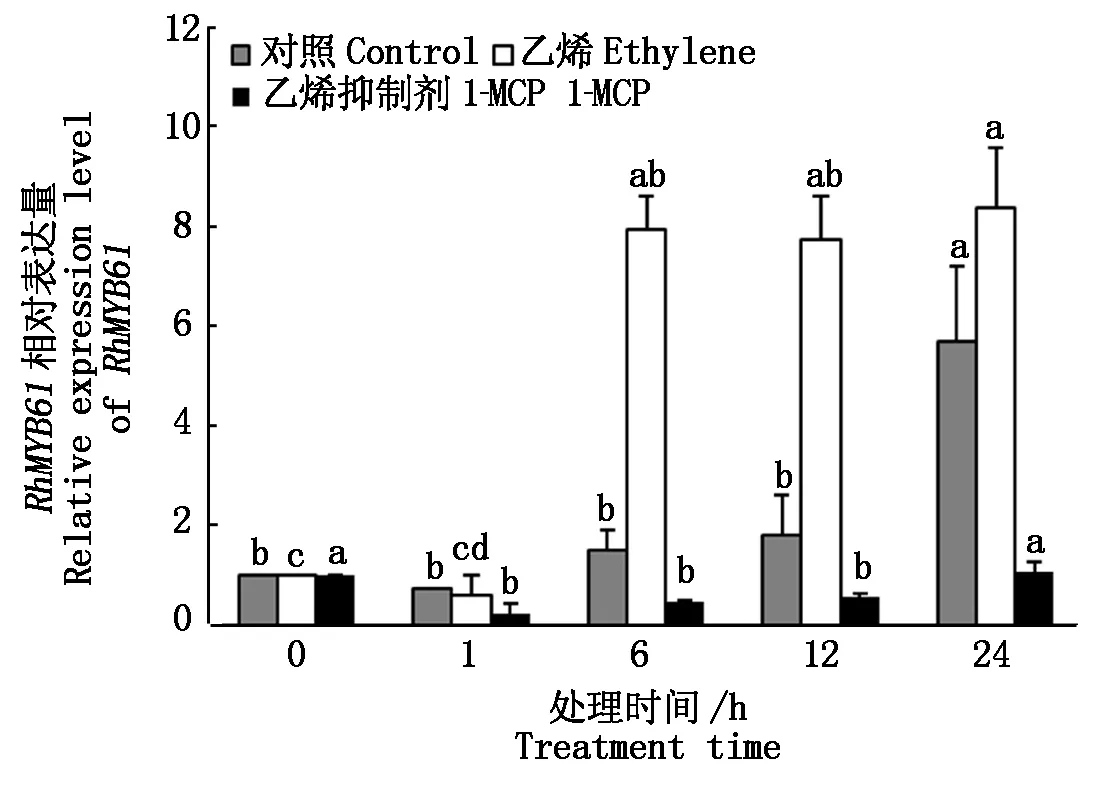
图6 不同时间乙烯处理RhMYB61的表达Fig.6 Expression analysis of RhMYB61 in response to ethylene in rose petals

图7 RhMYB61在切花月季不同失水处理的表达Fig.7 Expression analysis of RhMYB61 expression under different dehydration time
上述结果表明,乙烯处理显著诱导了RhMYB61的表达,失水胁迫处理对RhMYB61的表达影响不大。
3 讨论
已有研究表明,MYB是植物体内最大的一类转录因子家族之一,在植物次生代谢调控、激素和环境因子的应答、细胞分化、细胞周期、器官的形成以及植物叶片的形态建成中发挥了重要作用。对多种植物中的MYB转录因子的功能研究发现,R2R3类型MYB转录因子在植物响应非生物胁迫逆境方面发挥了非常关键的作用,拟南芥AtMYB61[23]、水稻OsMYB91[24]、小麦TaMYB3R1[25]和大豆GmMYBJ7[26]中报道的R2R3类型MYB转录因子均能够提高植株对干旱、高盐、低温等非生物逆境胁迫的抵抗能力。而在切花月季中,未见有对花瓣MYB转录因子参与非生物胁迫逆境的研究报道。本研究中,通过高通量测序和RACE技术克隆了月季切花中R2R3类型MYB转录因子RhMYB61,并利用定量PCR检测了其在不同开花级数、乙烯处理和失水胁迫过程中的表达变化。结果表明,RhMYB61广泛参与了切花月季花朵开放的过程,随着开花级数的逐渐增加,表达量逐渐升高,开花级数5级时表达量最高,暗示着RhMYB61在月季花朵开放和花瓣扩展方面发挥着重要的作用,特别是花朵开放后期,参与了月季花朵的衰老进程。对RhMYB61的生物信息学分析表明,其生物学功能多集中在参与合成辅酶因子、嘌呤、嘧啶和脂肪酸代谢等方面,其参与月季花瓣衰老进程是否通过上述过程进行还有待进一步研究。
切花月季在采收后,从花农生产者到消费者手中要经历长时间的干式远距离运输,运输过程中的外源乙烯积累和失水胁迫极易导致切花开放异常,对切花品质和商品价值产生影响,是月季切花采后损耗的重要因素,因此了解不同切花月季品种对外源乙烯和失水胁迫的响应机制,对于切花月季采后保鲜、提高流通质量、改良现代月季育种技术等均具有重要的现实意义。切花月季萨曼莎对外源乙烯非常敏感,外源乙烯处理能够促进月季花朵的开放,乙烯抑制剂1-MCP能够通过与乙烯受体的结合,阻断乙烯的感受,进而抑制花瓣内源乙烯的自我催化,延缓花瓣的衰老启动,有效抑制花朵乙烯的生成。本试验中,乙烯处理显著增加了RhMYB61的转录本水平表达,乙烯抑制剂1-MCP处理则抑制了RhMYB61的表达水平,暗示着RhMYB61参与了乙烯诱导的月季花朵开放过程。研究表明,月季乙烯生物合成关键基因(RhACSs和RhACO1)和乙烯信号转导关键基因(RhETRs和RhCTRs)在月季花朵开放过程中发挥着关键作用[27-28],RhMYB61是否通过调控上述基因或者通过调控其他功能蛋白进而参与对花瓣扩展的调控,明确RhMYB61在月季花朵开放中的调节机理将是后续研究中需要解决的重要问题。
前人研究表明,失水胁迫对乙烯具有诱导作用[29]。切花月季萨曼莎经过乙烯处理和失水胁迫处理后花朵开放状态非常类似,切花月季中可能存在水分胁迫和乙烯信号的交叉[30]。基于本试验结果,失水胁迫处理3,6 h提高了RhMYB61的转录本水平,而失水胁迫处理12,24 h则降低了其表达,说明RhMYB61至少在转录水平上未参与月季切花失水胁迫与乙烯信号的交叉。本研究克隆了月季RhMYB61基因,对其进行了初步研究,后期可进一步对RhMYB61的功能和在切花月季响应失水胁迫影响花瓣扩展中的作用机制进行研究,对于明确花瓣开放机理和参与非生物胁迫耐性,利用现代生物育种技术改良现代切花月季品质将具有一定的意义。
[1] 王 栋,李利红,陈志玲,等. 拟南芥根特异表达转录因子AtMYB305的鉴定及功能研究[J]. 科学通报,2001,46(21):1804-1809.
[2] 冯盼盼.AtMYB32对AtGA20ox1基因表达的调控及在植物抗胁迫中的作用研究[D]. 长沙:湖南大学,2016.
[3] Smita S,Katiyar A,Chinnusamy V,et al. Transcriptional regulatory network analysis of MYB transcription factor family genes in rice[J]. Frontiers in Plant Science,2015,6(682):1157.
[4] 单 红. 菊花CmMYB1和CmMYB2转录因子基因的克隆及功能鉴定[D]. 南京:南京农业大学,2011.
[5] Wang R K,Cao Z H,Hao Y J. Overexpression of a R2R3 MYB geneMdSIMYB1 increases tolerance to multiple stresses in transgenic tobacco and apples[J]. Physiologia Plantarum,2014,150(1):76-87.
[6] 刘 瑞. 杨树PtoMYB170转录因子在次生壁合成调控及抗旱中的功能研究[D]. 重庆:西南大学,2016.
[7] Zuker A,Tzfira T,Vainstein A. Genetic engineering for cut-flower improvement[J]. Biotechnology Advances,1998,16(1):33-79.
[8] Debener T,Linde M. Exploring complex ornamental genomes:the rose as a model plant[J]. Critical Reviews in Plant Sciences,2009,28(4):267-280.
[9] 吕培涛. HD-Zip I家族成员RhHB1在月季花瓣衰老过程中的功能分析[D]. 北京:中国农业大学,2014.
[10] Yan H,Zhang H,Wang Q,et al. Isolation and identification of a putative scent-related geneRhMYB1 from rose[J]. Molecular Biology Reports,2011,38(7):4475-4482.
[11] 赵 佳,刘 荣,杨 帆,等. 月季花青素苷相关R2R3-MYB 蛋白基因的克隆和表达分析[J]. 中国农业科学,2015,48(7):1392-1404.
[12] 马 男,蔡 蕾,陆旺金,等. 外源乙烯对月季(Rosahybrida)切花花朵开放的影响与乙烯生物合成相关基因表达的关联[J]. 中国科学C辑,2005,35(2):104-114.
[13] Dai F W,Zhang C Q,Jiang X Q,et al.RhNAC2 andRhEXPA4 are involved in the regulation of dehydration tolerance during the expansion of rose petals[J]. Plant Physiology,2012,160(4):2064-2082.
[14] Wan C Y,Wilkins T A. A modified hot borate method significantly enhances the yield of high-quality RNA from cotton (GossypiumhirsutumL.) [J]. Analytical Biochemistry,1994,223(1):7-12.
[15] Petersen T N,Brunak S,Von Heijne G,et al. SignalP 4.0:discriminating signal peptides from transmembrane regions[J]. Nature Methods,2011,8(10):785-786.
[16] 徐 丽,陈 新,宗晓娟,等. 甜樱桃砧木PcDHN1的克隆及其对非生物胁迫的响应[J]. 核农学报,2017,31(1):14-20.
[17] 董慧霞,理永霞,贾秀贞,等. 杨树SABP2基因的克隆与分析[J]. 西北农林科技大学学报:自然科学版,2017,45(3):82-88,95.
[18] Ma W,Noble W S,Bailey T L. Motif-based analysis of large nucleotide data sets using MEME-ChIP[J]. Nature Protocols,2014,9(6):1428-1450.
[19] Jiang X Q,Zhang C Q,Lu P T,et al.RhNAC3,a stress-associated NAC transcription factor,has a role in dehydration tolerance through regulating osmotic stress-related genes in rose petals[J]. Plant Biotechnology Journal,2014,12(1):38-48.
[20] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods,2001,25(4):402-408.
[21] 郑伶杰,马 宏,张 媛,等. 苹果矮化砧木GA20氧化酶基因的克隆及其表达分析[J]. 华北农学报,2017,32(1):53-59.
[22] Lin J R,Hu J. SeqNLS:nuclear localization signal prediction based on frequent pattern mining and linear motif scoring[J]. PLoS One,2013,8(10):e76864.
[23] 王 云,任永兵,杨 硕,等. 拟南芥AtMYB61基因的克隆及表达载体构建[J]. 合肥工业大学学报:自然科学版,2011,34(5):757-761.
[24] 朱 宁. MYB类转录因子OsMYB91在水稻发育和抗逆中的功能研究[D]. 武汉:华中农业大学,2014.
[25] Cai H,Tian S,Dong H,et al. Pleiotropic effects ofTaMYB3R1 on plant development and response to osmotic stress in transgenicArabidopsis[J]. Gene,2015,558(2):227-234.
[26] 杨文杰,吴燕民,唐益雄. 大豆转录因子基因GmMYBJ7的表达及功能分析[J]. 华北农学报,2012,27(6):24-29.
[27] Ma N,Cai L,Lu W,et al. Exogenous ethylene influences flower opening of cut roses (Rosahybrida) by regulating the genes encoding ethylene biosynthesis enzymes[J]. Science in China Series C-life Sciences,2005,48(5):434-444.
[28] 谭 辉. 外源乙烯通过调节乙烯受体和信号转导元件基因表达影响月季切花开放[D]. 北京:中国农业大学,2005.
[29] Nakano R,Ogura E,Kubo Y,et al. Ethylene biosynthesis in detached young persimmon fruit is initiated in calyx and modulated by water loss from the fruit[J]. Plant Physiology,2003,131(1):276-286.
[30] 王 婷,仝 征,马 男,等. 切花月季Rh-DREB1基因的克隆及其在乙烯和失水胁迫下的表达[J]. 园艺学报,2009,36(1):65-72.
CloningandExpressionCharacteristicsofRhMYB61GenefromRosahybrida
LI Shaocui,JIANG Xinqiang,DING Aiqin,LIU Qingchao,WANG Kuiling,LI Wei,LIU Qinghua
(College of Landscape Architecture and Forestry,Qingdao Agricultural University,Qingdao 266109,China)
In order to determine the molecular characterization and expression patterns of MYB transcription factors involved in flower opening in Rose. According to the expressed sequence tags from transcriptome assembly and RACE PCR methods,we obtained a new MYB transcription factor gene,and namedRhMYB61(GenBank accession number is KY921844 ),inRosahybridaSamantha petals. The ORF ofRhMYB61 was 1 323 bp,which encoded 441 amino acids. Bioinformatics analysis showed that the molecular weight and theoretical isoelectric point of RhMYB61 was 49.1 kDa and 7.66,respectively,and the formula of RhMYB61 was C2123H3280N620O688S18. Phylogenic tree analysis showed that RhMYB61 was clustered with PpMYB86 and EjMYB8,and belonged to the R2R3-MYB type transcription factor. Multi-alignment of RhMYB61 of several plants found that RhMYB61 had the seven characteristic conservative motifs.Two conserved domains,including R2-MYB domain and R3-MYB domain,were found in its N-terminal. The nuclear localization sites was found in R3-MYB domain. Qualitative PCR analysis showed thatRhMYB61 expression was induced as the rose flower opening.RhMYB61 expression was accumulated at 12 h dehydration treatment,compared with control. In addition,RhMYB61 transcript was rapidly and dramatically induced by 6,12,24 h ethylene treatment compared with control,and was inhibited following 1-methylcyclopropene (1-MCP) treatment.These results above gave a clear data for understanding the biological function ofRhMYB61, and provided a foundation for further research of molecular breeding of rose plant.
Cut roses;RhMYB61;qRT-PCR;Expression characteristics
2017-07-21
国家自然科学基金项目(31501798);山东省优秀中青年科学家科研奖励基金项目(2014BSB01563)
李绍翠(1992-),女,山东招远人,在读硕士,主要从事园林植物种质资源创新和利用研究。
刘庆华(1962-),男,山东乳山人,教授,博士,博士生导师,主要从事园林植物种质资源创新及园林植物种植设计研究。
Q78;S685.03
A
1000-7091(2017)05-0061-08
10.7668/hbnxb.2017.05.010

