鸭梨PbChiⅡ的克隆与表达分析
李朋朋,吴运东,叶 嘉,李丹花,乔莉娟,张玉星,董金皋
(1.邯郸学院 生命科学与工程学院,河北 邯郸 056005;2.河北农业大学,河北 保定 071001 )
鸭梨PbChiⅡ的克隆与表达分析
李朋朋1,吴运东1,叶 嘉1,李丹花1,乔莉娟1,张玉星2,董金皋2
(1.邯郸学院 生命科学与工程学院,河北 邯郸 056005;2.河北农业大学,河北 保定 071001 )
为明确几丁质酶在鸭梨抗病过程中的作用,以鸭梨为试材,提取总RNA,采用RT-PCR方法克隆几丁质酶基因PbChiⅡ,分析PbChiⅡ在梨黑星病菌诱导下的表达模式,构建原核表达载体pET30a-PbChiⅡ,在大肠杆菌BL21(DE3)菌株中表达PbChiⅡ蛋白,分析重组蛋白在非生物胁迫下的生长能力。结果表明:PbChiⅡ基因全长(基因登录号:KP876485)969 bp,实时定量PCR(Quantitative Real-time PCR,qRT-PCR)分析显示,PbChiⅡ基因的表达受病原菌的调控,在供试的96 h内,梨黑星病菌可诱导该基因表达,且表达量在48 h达到最高。将PbChiⅡ基因成功克隆到原核表达载体pET30a上,SDS-PAGE分析表明,该重组蛋白在37 ℃,1.0 mmol/L IPTG诱导2 h,表达量最大。转pET30a-PbChiⅡ载体的大肠杆菌BL21(DE3)菌株表达了分子量约35.53 kDa的重组蛋白。诱导的蛋白可增强菌体在NaCl、CuCl2、CdCl2和ZnSO4等非生物胁迫下的生长能力。为进一步探索PbChiⅡ基因的功能提供了基础资料。
鸭梨;几丁质酶基因;原核表达;非生物胁迫;表达模式
几丁质酶 (Chitinase,Chi)作为一类病程相关蛋白,是植物遭受生物因素和非生物因素后诱导并产生的[1-3]。
目前已知的植物几丁质酶都属于小分子蛋白,分子量为25~40 kDa,最适pH值为6.0,多数以单体形式存在,50 ℃下仍稳定存在并保持酶活性,等电点为3~10[4-6]。细胞内、外均有分布,等电点偏酸或偏碱,常被称为酸性几丁质酶或碱性几丁质酶。很多动物、植物、微生物都可产生几丁质酶。由于植物自身缺乏有效的免疫系统,因此容易受到外界环境影响。当植物受到病原菌侵染时,植物会产生一系列的防御反应来保护自身[7]。几丁质酶作为一类非常重要的病程相关蛋白,它能够降解真菌细胞壁中的几丁质[8-9]。
研究报道,几丁质酶在植物的防御机制中起着重要作用,体内外试验表明,单子叶植物和双子叶植物中的几丁质酶均能抑制真菌几丁质的生长,植物几丁质酶对真菌、细菌、病毒等生物胁迫和盐害、冷害、冻害等非生物胁迫均有一定的抗性。
把植物中的几丁质酶基因转入酵母、大肠杆菌中进行表达并对表达产物进行分析、利用是植物几丁质酶发展的一个重要方向。Fan等[10]从车前草中克隆得到几丁质酶基因,其纯化产物能水解几丁质并可抑制香蕉炭疽盘长孢菌的生长。Xayphakatsa等[11]将水稻ClassⅡ类几丁质酶基因转入大肠杆菌进行表达,表达产物对绿色木霉具有一定的抑制效果。Chen等[12]将水稻几丁质酶基因转入大肠杆菌进行表达,表达产物可以降解几丁质的活性。将植物几丁质酶在微生物中进行表达存在许多问题,如产生包涵体、无抑菌活性、表达产物无活性等,导致后续无法对表达产物进行继续研究。随着蛋白表达技术研究的不断深入,植物几丁质酶在大肠杆菌、酵母等中进行表达、应用的前景十分广阔。
本研究利用RT-PCR技术克隆鸭梨几丁质酶基因PbChiⅡ,分析其在梨黑星病菌处理下的表达情况,构建PbChiⅡ的原核表达载体并对PbChiⅡ在大肠杆菌(Escherichiacoli)中的表达情况和重组蛋白在非生物胁迫下的生长能力进行分析,为后续PbChiⅡ基因的功能研究奠定基础。
1 材料和方法
1.1试验材料
试验所用果实采自沧州市肃宁县鸭梨果园。 梨黑星病菌(Venturianashicola)由河北农业大学梨中心实验室分离保存。载体pET30α、T4DNA连接酶、限制性内切酶SacⅠ和XhoⅠ等均购自大连TaKaRa公司。
1.2试验方法
1.2.1 鸭梨PbChiⅡ基因的克隆 根据已克隆得到的PbChiⅡ序列设计特异引物,根据pET30a载体图谱上的酶切位点选择适宜的限制性内切酶,设计基因的上下游引物,上下游引物分别加酶切位点SacⅠ和XhoⅠ,引物序列如下:F:5′-CGAGCTCATG
GAGAAAAAATGGCTTCTG-3′(下划线部分是SacⅠ酶切位点,斜体为保护碱基);R:5′-CCGCTCGAGA
GAAGACGAAGACGAAGAAGATG-3′(下划线部分是XhoⅠ酶切位点,斜体为保护碱基)。
以鸭梨cDNA为模板,利用上述设计的特异引物进行PCR扩增。PCR体系为:cDNA 1.0 μL,10×Ex PCR Buffer 2.5 μL,上、下游引物各0.5 μL,dNTP(2.5 mol/L)2.0 μL,加ddH2O至25 μL。PCR反应程序:95 ℃预变性10 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30次循环;72 ℃延伸10 min。扩增产物于1.0%琼脂糖凝胶电泳进行检测。
1.2.2 病原菌接种方法 将梨黑星病菌分生孢子制成孢子悬浮液,浓度约为1×106个/mL,喷施于7,14,21 d的幼果及成熟期果实,于喷施后0,3,6,12,24,48,72,96 h取样,将样品迅速置于液氮中,带回实验室,于-80 ℃保存备用。对照果实取样时间及保存方法同上。
1.2.3 荧光定量PCR(qRT-PCR)分析 RNA的提取采用CTAB法进行[13]。用qRT-PCR分析仪进行实时荧光定量分析。以梨β-Actin(GenBank登录号:GU830958)为内参基因设计特异引物,上游引物:5′-TTGGGATGGGTCAGAAGG-3′,下游引物:5′-CTGTGAGCAGAACTGGGTG-3′。根据PbChiⅡ序列设计引物,上游引物:5′-ACTACAACTATGGAGAAACG
GGTG-3′和下游引物:5′-CAAAGACATCGTGGGCTG
AAG-3′。反应体系为TaKaRa公司的SYBR Master Mix 12.5 μL、cDNA 1 μL、上下游引物各1 μL,加ddH2O补至25 μL。按以下程序进行PCR扩增:95 ℃预变性1 min;95 ℃变性15 s,57 ℃退火15 s,72 ℃延伸45 s,40个循环。每处理重复3次,用2-ΔΔCt法对数据进行分析[14]。
1.2.4 原核表达载体构建 将带有酶切位点的PbChiⅡ连接到pMD19-T载体,转化大肠杆菌感受态,涂布于含氨苄的LB平板,培养12 h,随机挑取菌落接种于氨苄抗性的LB液体培养基进行培养,提取质粒,酶切鉴定后送上海生物工程有限公司测序。
将测序正确的PbChiⅡ片段连接载体pET30α,转化Trans5α后提取质粒做双酶切检测,将获得的PbChiⅡ片段与pET30α片段连接,构建表达载体pET30α-PbChiⅡ,提取质粒,将双酶切鉴定为阳性的克隆送上海生工测序。
1.2.5 IPTG诱导下重组菌株的生长速度测定 将正确的重组质粒转化到大肠杆菌BL21(DE3)中进行培养表达时,经终浓度为1 mmol/L的 IPTG诱导后,与没有进行诱导的菌体进行吸光度的比较。
1.2.6 目的蛋白的诱导表达 将测序正确的菌液接种于含卡那霉素的液体LB培养基中进行振荡培养至菌液OD600=0.5时,向培养基中加入IPTG,使其终浓度为1 mmol/L,37 ℃条件下振荡培养1,2 h,向菌体中加入50 μL 1×蛋白上样缓冲液,沸水浴15 min后将样品取出并冷却至室温,离心后取10 μL上清液于15%的分离胶和5%的浓缩胶中进行SDS-PAGE检测[15]。以重组菌未诱导、空载菌BL21(pET30a)诱导2 h、空载菌BL21(pET30a)未诱导为对照。
1.2.7 重组菌株抵抗非生物胁迫能力 将重组菌株在LB液体培养基于28 ℃,220 r/min的条件下进行振荡培养至OD600为0.6,加入IPTG至终浓度为1.0 mmol/L,37 ℃振荡培养2 h,将菌液浓度稀释成10-3和10-4,分别吸取10 μL菌液滴在含有NaCl(250,500,750 mmol/L)、CuCl2(250,500,750 μmol/L)、CdCl2(250,500,750 μmol/L)、ZnSO4(250,500,750 μmol/L)的LB平板上,10-3和10-42个不同浓度菌
液分别滴加在平板两边,以不添加NaCl、CuCl2、CdCl2、ZnSO4的LB平板作为对照。37 ℃静置培养过夜,拍照。
2 结果与分析
2.1鸭梨PbChiⅡ基因的克隆
利用RT-PCR方法,从果实的cDNA模板上扩增出一条约900 bp大小的条带,经进一步克隆测序得知片段大小为969个核苷酸,编码322个氨基酸,双下划线表示起始密码子。生物信息学分析发现,PbChiⅡ蛋白属于第Ⅱ类几丁质酶(图1,2)。
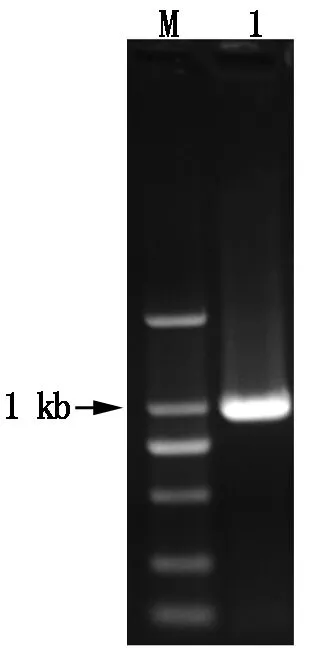
图1 PbChiⅡ基因的PCR扩增Fig.1 The PCR amplification of PbChiⅡ

图2 PbChiⅡ的核苷酸序列和推导的氨基酸序列Fig. 2 Nucleotide and deduced amino acid sequences of PbChiⅡ
2.2生物胁迫诱导鸭梨果实中PbChiⅡ的表达
对幼果和成熟期鸭梨果实进行病原菌处理,分析PbChiⅡ的表达情况。结果表明,从处理后3 h开始,PbChiⅡ的表达量开始升高,处理后48 h,PbChiⅡ的表达量达到最大值。7,14,21 d 的幼果和成熟期果实经黑星病菌处理后48 h,PbChiⅡ的表达量分别是同期对照的3.58,10.18,9.51,6.37倍。7 d幼果经黑星病菌处理后48 h,PbChiⅡ的表达量分别是处理后3,6,12,24,72,96 h的2.80,2.13,1.46,1.42,1.62,2.06倍,14 d幼果经黑星病菌处理后48 h,PbChiⅡ的表达量分别是处理后3,6,12,24,72,96 h的2.61,1.29,1.27,1.11,1.23,1.74倍,21 d幼果经黑星病菌处理后48 h,PbChiⅡ的表达量分别是处理后3,6,12,24,72,96 h的3.09,2.45,1.45,1.41,1.35,1.51倍,成熟期果实经黑星病菌处理后48 h,PbChiⅡ的表达量分别是处理后3,6,12,24,72,96 h的1.99,1.49,1.41,1.19,1.49,1.55倍(图3)。

A. 7 d幼果;B.14 d幼果;C.21 d幼果;D.成熟期果实。A. 7 d young fruit;B. 14 d young fruit;C. 21 d young fruit;D.Mature fruit.
2.3原核表达载体构建
将PbChiⅡ片段与pET30a质粒片段进行连接,转化后提取阳性菌液质粒,用限制性内切酶SacⅠ和XhoⅠ进行双酶切,得到约5 kb和1 kb的条带,表明PbChiⅡ已连接到pET 30a上。将重组质粒再次测序,结果表明,插入片段与克隆测序完全一致。表明pET30a-PbChiⅡ得以成功构建(图4)。
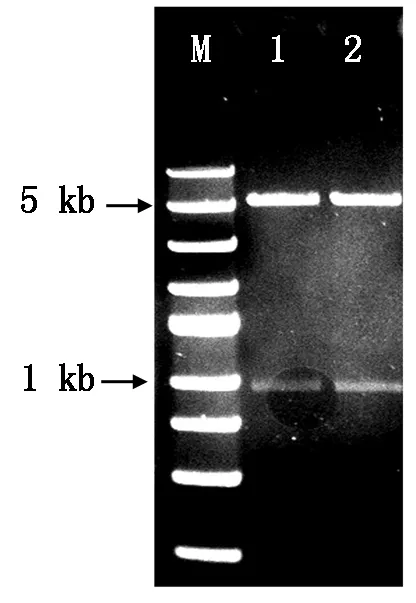
图4 PbChiⅡ基因原核表达载体的酶切验证Fig. 4 Digestion of PbChiⅡ prokaryotic expression vector by two restriction enzymes
2.4重组菌在IPTG诱导下的生长速度测定
将正确的重组质粒转化到大肠杆菌BL21(DE3)中进行表达,经1 mmol/L IPTG诱导后,与未诱导的菌体相比生长减慢。表明目的基因开始转录,使菌株生长减慢,目的基因得以表达(图5)。
2.5目的融合蛋白的表达
SDS-PAG分析表明,重组菌株经IPTG诱导后出现一条分子量约35.53 kDa的融合蛋白条带,重组菌未诱导、空载菌BL21(pET30a)未诱导及对应诱导的空载菌都未出现目的蛋白条带。由此表明PbChiⅡ蛋白得以成功表达(图6)。

图5 重组菌的生长速度测定Fig.5 Determination of the growth rate of recombinant isolate
2.6重组菌株在非生物胁迫下的生长情况
植物几丁质酶基因是一类与抗逆相关的基因,它受不同胁迫的诱导。本试验中,与BL21(DE3)+pET30a相比,BL21(DE3)+pET30a-PbChiⅡ在含有NaCl(250,500,750 mmol/L)、CuCl2(250,500,750 μmol/L)、CdCl2(250,500,750 μmol/L)、ZnSO4(250,500,750 μmol/L)等非生物胁迫因子的LB固体培养基中具有更强的生长能力(图7),但是由于原核生物与真核生物的基因表达系统存在很大差异,因此,该几丁质酶基因在真核生物中是否存在相同现象还需进一步研究。
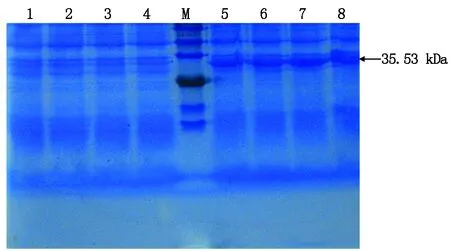
M.Protein molecular weight Marker;1.重组菌未诱导;2.空载菌BL21(pET30a)诱导2 h;3.空载菌BL21(pET30a)诱导1 h;4.空载菌BL21(pET30a)未诱导;5.诱导4 h;6.诱导3 h;7.诱导2 h;8.诱导1 h。
M.Protein molecular weight Marker;1. BL21(pET30a-PbChiⅡ ) without IPTG induction;2.BL21(pET30a) for 2 h cultivation with IPTG induction;3.BL21(pET30a) for 1 h cultivation with IPTG induction;4.BL21(pET30a) without IPTG induction;5.BL21(pET30a-PbChiⅡ ) for 4 h cultivation with IPTG induction;6.BL21(pET30a-PbChiⅡ) for 3 h cultivation with IPTG induction;7.BL21(pET30a-PbChiⅡ ) for 2 h cultivation with IPTG induction;8.BL21(pET30a-PbChiⅡ ) for 1 h cultivation with IPTG induction.
图6重组载体pET30a-PbChiⅡ诱导蛋白的SDS-PAGE分析
Fig.6TheinducedproteinofrecombinedvectorpET30a-PbChiⅡanalyzedbySDS-PAGE
3 讨论与结论
由真菌引起的植物病害是农业生产中的一类重要病害,诱导植物产生抗病性是一个复杂的机制,它涉及不同的免疫反应。包括PR蛋白在内的许多抗性基因已经从植物中克隆并在植物中得到了广泛应用,且在植物抗病中起了重要作用[16-17]。起初,仅在抗性植株和对真菌、细菌、病毒产生过敏反应的植株中发现了PR蛋白,后来,在被病原菌侵染的感病植株中和受非生物胁迫的植株中也发现了PR蛋白,在这些PR蛋白中,几丁质酶能够降解真菌几丁质,在自然界中广泛存在,且在植物抵抗病菌中起着重要作用[18]。几丁质酶基因在植物抗逆过程中也起着重要作用[19]。
外源基因在大肠杆菌中的表达受多种因素影响,如载体类型、外源基因结构及培养条件等,因此,若想使外源基因得到最大程度的表达,必须对诱导条件进行优化。本研究所用表达载体为pET30a,在IPTG终浓度为1 mmol/L,37 ℃诱导2 h的条件下成功获得了与预测蛋白分子量大小一致的蛋白条带,这为进一步研究PbChiⅡ蛋白的功能奠定了基础。

当菌液OD600=0.6时,分别向接种BL21(DE3)+pET30a-PbChiⅡ(A)和BL21(DE3)+pET30a(B)的LB液体培养基中加入IPTG以诱导融合蛋白的表达,将BL21(DE3)+pET30a-PbChiⅡ(A)和BL21(DE3)+pET30a(对照)(B)接种在含有NaCl、CuCl2、CdCl2和ZnSO4的LB平板上,LB平板上红线的左侧接种10-3的菌液,右侧接种10-4的菌液,培养基中含有NaCl(250,500,750 mmol/L)、CuCl2(250,500,750 μmol/L)、CdCl2(250,500,750 μmol/L)和 ZnSO4(250,500,750 μmol/L),以LB培养中不添加任何物质的为对照。
Isopropyl β-D-thiogalactoside (IPTG) was added to the cultures of BL21 (DE3)+pET30a-PbChiⅡ(A)and BL21(DE3)+pET30a (B)to induce the expression of recombinant protein. The cultures were adjusted to OD600=0.6. Spot assays of BL21(DE3)+pET30a-PbChiⅡ(A) and BL21(DE3)+pET30a (control) (B)on Luria-Bertani (LB) plates with NaCl,CuCl2,CdCl2and ZnSO4,Ten microliters from 10-3(left side of the red line on the plate) to 10-4(right side of the red line on the plate) dilutions were spotted onto LB plates without any supplement (CK) or with NaCl (250,500,50 mmol/L),CuCl2(250,500,750 μmol/L),CuCl2(250,500,750 μmol/L) and ZnSO4(250,500,750 μmol/L),respectively.
图7重组蛋白在非生物胁迫下的生长
Fig.7Thegrowthofrecombinantproteinunderabioticstresses
植物在被病原菌侵染初期就产生了防卫反应[20-22],本研究表明,梨黑星病菌侵染鸭梨果实3~96 h后,PbChⅡ的表达量均高于处理后0 h,表明PbChiⅡ在寄主被病原菌侵染的初期可能就开始发挥作用。
几丁质酶不但受生物胁迫的诱导,也受非生物胁迫的诱导[23]。本研究中,重组蛋白在4种非生物胁迫下(NaCl、CuCl2、CdCl2、ZnSO4)表现出良好的生长特性,有研究报道[24-25],在胁迫条件下,含有重组蛋白的E.coli在胁迫条件下生长良好,Chaurasia等[26]发现在盐胁迫、热胁迫等条件下,植物螯合态合成酶基因PCS在E.coli具有很好的表达特性。甘蔗dirigent蛋白基因SiDir的重组蛋白在NaCl和PEG胁迫下仍具有良好的生长特性[25]。甘蔗几丁质酶基因ScChiⅢ的重组蛋白在盐胁迫等条件下仍表现出良好的生长特性[27]。这表明在生物胁迫和非生物胁迫下,几丁质酶基因在原核生物和真核生物中的调控机制是类似的。
[1] 蒋选利,李振岐,康振生,等. 几丁质酶与植物的抗病性[J]. 西北农业学报,2002,11(3):71-75.
[2] 张福丽,王占斌,王志英. 几丁质酶在植物抗真菌病害中的作用[J]. 林业科技,2006,31(3):24-27.
[3] Guan Y,Ramalingam S,Nagegowda D,et al.Brassicajunceachitinase BjCHI1 inhibits growth of fungal phytopathogens and agglutinates Gram-negative bacteria[J]. Journal of Experimental Botany,2008,59(12):3475-3484.
[4] 高武军,孙 毅,王景雪,等. 植物几丁质酶及其基因工程研究进展[J]. 世界农业,1999,1(3):22-24.
[5] 陈 龙. 植物几丁质酶的生物学作用[J]. 生物学教学,2002,27(7):26-27.
[6] 朱雪峰,陈崇顺,郁志芳. 植物几丁质酶的生物功能[J]. 生命的化学,2000,20(1):36-37.
[7] Walters D,Walsh D,Newton A,et al. Induced resistance for plant disease control:maximizing the efficacy of resistance elicitors[J]. Phytopathology,2005,95(12):1368-1373.
[8] Neuhaus J-M.Plant chitinases (PR-3,PR-4,PR-8,PR-11) [M]//Datta S K.Muthukrishnan S (eds) Pathogenesis-related proteins in plants Boca Raton.CRC Press LLC,1999:77-105.
[9] Punja Z K.Genetic engineering of plants to enhance resistance to fungal pathogens[M].New York:Fungal Disease Resistance in Plants Biochemistry Molecular Biology and Genetic Engineering,2004:207-258.
[10] Fan J,Wang H,Feng D,et al. Molecular characterization of plantain class i chitinase gene and its expression in response to infection byGloeosporiummusarumCke and Massee and other abiotic stimuli[J]. Journal of Biochemistry,2007,142(5):561-570.
[11] Xayphakatsa K,Tsukiyama T,Inouye K,et al. Gene cloning,expression,purification and characterization of rice(OryzasativaL.)class Ⅱ chitinase CHT11[J]. Enzyme and Microbial Technology,2008,43(1):19-24.
[12] Chen A,Yu L,Fan J,et al. The expression,purification and activity analysis of the rice chitinase gene inEscherichiacoli[J]. Chinese Journal of Biotechnology,2008,24(2):188-192.
[13] 蔡斌华,张计育,高志红,等. 一种改良的提取草莓属叶片总RNA的方法[J]. 江苏农业学报,2008,24(6):875-877.
[14] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods,2001,25(4):402-408.
[15] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680-685.
[16] Hartl L,Zach S,Seidl-Seiboth V. Fungal chitinases:diversity,mechanistic properties and biotechnological potential[J]. Applied Microbiology and Biotechnology,2012,93(2):533-543.
[17] 陈冬阳,杨明明,高 翔,等. 普通小麦几丁质酶基因的克隆与表达分析[J]. 麦类作物学报,2016,36(5):539-548.
[18] Takken F W,Joosten M . Plant resistance genes:their structure,function and evolution[J]. European Journal of Plant Pathology,2000,106(8):699-713.
[19] Rawat S,Ali S,Mittra B,et al. Expression analysis of chitinase upon challenge inoculation toAlternariawounding and defense inducers inBrassicajuncea[J]. Biotechnology reports,2017,13:72-79.
[20] Mohamed F,Lydia F,Masumi I,et al. Expression of potential defense responses of Asian and European pears to infection withVenturianashicola[J]. Physiological and Molecular Plant Pathology,2004,64(6):319-330.
[21] 程 曦,田彩娟,李爱宁,等. 植物与病原微生物互作分子基础的研究进展[J]. 遗传,2012,34(2):134-144.
[22] Dodds P N,Rathjen J P. Plant immunity:towards an integrated view of plant-pathogen interactions[J]. Nature Reviews Genetics,2010,11(8):539-548.
[23] Viswanathan R,Samiyappan R. Antifungal activity of chitinases produced by some fluorescent pseudomonads againstColletotrichumfalcatumwent causing red rot disease in sugarcane[J]. Microbiological Research,2001,155(4):309-314.
[24] Gupta K,Agarwal P K,Reddy M K,et al. SbDREB2A,an A-2 type DREB transcription factor from extreme halophyteSalicorniabrachiataconfers abiotic stress tolerance inEscherichiacoli[J]. Plant Cell Reports,2010,29(10):1131-1137.
[25] Jin L G,Li P X,Jing P F,et al. A novel dirigent protein gene with highly stem-specific expression from sugarcane,response to drought,salt and oxidative stresses[J]. Plant Cell Reports,2012,31(10):1801-1812.
[26] Chaurasia N,Mishra Y,Rai L C. Cloning expression and analysis of phytochelatin synthase (pcs) gene fromAnabaenasp. PCC 7120 offering multiple stress tolerance inEscherichiacoli[J]. Biochemical and Biophysical Research Communications,2008,376(1):225-230.
[27] Su Y,Xu L,Fu Z,et al. ScChi,encoding an acidic class Ⅲ chitinase of sugarcane,confers positive responses to biotic and abiotic stresses in sugarcane[J]. International Journal of Molecular Sciences,2014,15(2):2738-2760.
CloningandExpressionAnalysisofPbChiⅡfromPyrusbretschneideriYali
LI Pengpeng1,WU Yundong1,YE Jia1,LI Danhua1,QIAO Lijuan1,ZHANG Yuxing2,DONG Jingao2
(1.College of Life Science and Engineering,College of Handan,Handan 056005,China;2.Agricultural University of Hebei,Baoding 071001,China)
To clarify the role of chitinase in the process of pear resistance disease, the total RNA of Yali was extracted and specific primers were designed to amplify the coding region of PbChi Ⅱ protein by RT-PCR,analysed the expression pattern ofPbChiⅡ after treatment with pathogens. The prokaryotic expression vector pET30a-PbChiⅡ was constructed and the recombinant protein was expressed inE.coliBL21 (DE3). The recombinant protein growth ability was analyzed under abiotic stress. The results showed that the length ofPbChiⅡ(GenBank accession Number:KP876485) gene was 969 bp,Quantitative Real-time PCR ( qRT-PCR) analysis revealed that the expression ofPbChiⅡ was regulated by pathogens,and enhanced up to the peak at 48 h after treatment withVenturianashicoladuring 96 h. ThePbChiⅡ gene was successfully subcloned into the expression vector pET30a. SDS-PAGE analysis showed that a specific recombinant protein of approximately 35.53 kDa was produced in the BL21 (DE3) with the prokaryotic expression vector pET30a-PbChiⅡ in 37 ℃ with 1.0 mmol/L IPTG for 2 hours. This protein enhanced the stress of isolate with NaCl,CuCl2,CdCl2and ZnSO4. This research provided basic references for further study the function ofPbChiⅡ.
PyrusbretschneideriYali;Chitinase gene;Prokaryotic expression;Abiotic stresses;Expression pattern
2017-07-19
邯郸学院自然科学基金项目(16101);邯郸市科技局项目(1627201054-2);河北省高校冀南太行山区野生资源植物应用技术研发中心
李朋朋(1987-),女,河北邯郸人,讲师,博士,主要从事植物病理学研究。
Q78
A
1000-7091(2017)05-0045-07
10.7668/hbnxb.2017.05.008

