籽瓜种子蛋白对肌原纤维蛋白功能的影响
王鹤霖
(黑龙江八一农垦大学食品学院,大庆 163319)
籽瓜种子蛋白对肌原纤维蛋白功能的影响
王鹤霖
(黑龙江八一农垦大学食品学院,大庆 163319)
本研究以籽瓜种子为原料,利用碱溶酸沉方法提取籽瓜种子蛋白,在40、60、80 ℃条件下获得不同籽瓜种子蛋白,分别进行分子质量、溶解度测定,并与肌原纤维蛋白形成凝胶,对凝胶作用力、弹性、回弹性、粘结性、水相分度、白度进行试验。结果表明,40~80 ℃范围内随着提取温度的升高,籽瓜种子蛋白溶解度先升高后降低差异显著(P<0.05),并获得4个吸收峰,峰1为699~103ku的大分子蛋白聚集体,峰2、峰3分别为340、212 ku的球蛋白,及10~54 ku部分清蛋白、球蛋白的亚基,随着碱溶温度继续升高,峰2、峰3逐渐消失。籽瓜种子蛋白与肌原纤维蛋白形成凝胶的三维网状结构稳定性通过疏水键、氢键、以及二硫键维持,其中疏水键、氢键为主要作用力。碱溶温度为60 ℃时,WPS与MP形成凝胶弹性较好、保水性较好,差异显著(P<0.05)。随着温度的增加,凝胶白度逐渐加,WPS结构发生改变、变性,差异显著(P<0.05)。由此可知,温度对籽瓜种子蛋白结构、功能影响较大,不同碱溶温度提取的籽瓜种子蛋白对肌原纤维蛋白功能影响差异显著,碱溶温度为60 ℃时,获得籽瓜种子蛋白与肌原纤维蛋白形成的凝胶有利于改善对肉制品品质,可作为非肉蛋白稳定剂添加到猪肉制品中。
分子质量 色泽 质构 籽瓜种子蛋白
籽瓜种子蛋白质(watermelon seed protein ,WSP)质量分数36%~40%,必需氨基酸(除赖氨酸)含量均达到或超过推荐的标准[1],并且氨基酸配比较适宜,而大豆中氨基酸配比显著低于FAO/WHO均衡模式,WPS作为一种优良的植物蛋白资源,目前国内相关应用报道较少,局限了WPS的使用。WPS中78%为球蛋白,由3个α酸性亚基和3个β碱性亚基通过双硫键相结合,大豆球蛋白是由α酸性亚基和β碱性亚基所组成,WPS与大豆作物种子储藏蛋白质可能具有同源性[2]。赖氨酸和蛋氨酸分别是小麦和豆类的限制性氨基酸,而籽瓜种子赖氨酸和蛋氨酸含量分别高于小麦和豆类,可补充禾谷类和豆类蛋白质的营养不足。
研究表明,WPS能够有效改善香肠质构,提高香肠品质[3]。肌原纤维蛋白(Myofibrillar proteins, MP),是动物肌肉中最重要的蛋白质,约占肌肉中蛋白质总量的50%~55%,MP经热诱导作用形成的三维网状凝胶结构有助于产品稳定性,非肉蛋白与肌肉蛋白连续介质彼此穿插共同形成混合连续相,能够改善肉制品的凝胶性、保水保油性,提高产品得率等[4]。
目前国内对籽瓜种子蛋白的研究较少,限制了籽瓜种子蛋白的使用及当地经济的发展,现有非肉蛋白种类少,籽瓜种子蛋白对肉制品中的应用尚不明确,急待开发使用。
由于温度对蛋白机构、聚集体大小有很大的影响,蛋白聚集体的大小对凝胶的形成具有重要影响。为更好将WPS应用于其他肉制品中,选取不同温度提取籽瓜种子蛋白,并对蛋白的溶解度、分子质量及对肌原纤维蛋白功能影响进行研究,为今后WPS在肉制品中推广使用奠定理论基础。
1 材料与方法
1.1 主要材料试剂
猪里脊:金锣冷鲜肉;籽瓜:内蒙古通辽市;乙二醇二乙醚二胺四乙酸(EGTA,分析纯)、甲状腺球蛋白、淀粉酶、乙醇脱氢酶、白蛋白标准品、盐酸胍(GuHCl,分析纯)、二硫苏糖醇(DTT,分析纯):美国sigma公司。
1.2 主要仪器设备
德国FA25均质机、5417R离心机、SPECORD-210plus分光光度计:德国公司;流变仪:Thermo Scientific公司;英国TA-XT2i质构仪:PQ001低场核磁共振仪:CR-410色差仪:1200S安捷伦高效液相色谱:TSKG2000SW凝胶柱:DBS-100电脑全自动部分收集器:Agilent公司。
1.3 方法
1.3.1 籽瓜种子蛋白提取
籽瓜种子蛋白提取 WPS 籽瓜种子粉碎,脱脂(乙醚用量1∶4(m∶m),50 ℃,通风橱中干燥8 h,再置于鼓风干燥机50 ℃干燥12 h)。按1∶10(m∶m)加入去离子水,调节pH 11,水浴加热1.5 h,机械搅拌,3 500 r/min下离心15 min,15 ℃冷冻离心,取上清液,调节pH 5.0,离心,获得沉淀,清洗沉淀至pH 7.0,冷冻干燥获得WPS[5]。
1.3.2 肌原纤维蛋白提取
参考陈洪生等[6]的方法,略有修改。选取猪背最长肌,除去脂肪和结缔组织,10 mmol/L Na3P04,0.1 mol/L NaC1,2 mmol/L MgCl2和1 mmol/L EGTA,调至pH 7.0,制备MP沉淀,利用0.1 mol/L NaCl溶液溶解,0.1 mol/L HCl提纯,获得MP。采用双缩脲法,以标准牛血清白蛋白为标准蛋白测定MP含量。
1.3.3 碱溶加热处理WPS
本研究选取碱溶温度分别为40、60、80 ℃,机械搅拌1.5 h,其他同1.3.1。得到碱溶加热处理的样品分别标记为WPS40、WPS60、WPS80。
1.3.4 籽瓜种子蛋白测定
1.3.4.1 籽瓜种子蛋白溶解度测定:用去离子水配制籽瓜种子蛋白溶液(蛋白质量浓度20 mg/mL, pH 7.0,并磁力搅拌溶解1 h,然后离心(3 500 r/min下冷冻离心15 min ,15 ℃)。参照GB/T 5009.5—2010的凯氏定氮法分别测定原液和上清液中蛋白质的含量。
S蛋白=m1/m2×100%
(1)
式中:S蛋白为蛋白溶解度/%;m1为上清液蛋白含量/g/100 mL;m2为原液中蛋白含量/g/100 mL。
1.3.4.2 不同温度碱溶蛋白分子质量分布:利用超滤排阻103ku蛋白质,取2.000 g 于10 mL 容量瓶中,用流动相定容至刻度,超声振荡10 min,使样品充分溶解,混匀,用孔径为0.2~0.5 μm 聚四氟乙烯膜过滤后,上机进样。利用C18凝胶柱,将标准品甲状腺球蛋白(669 ku ),淀粉酶(200 ku)、乙醇脱氢酶(150 ku)、白蛋白(66 ku)分别用流动相配制成质量分数为0.1%的不同分子质量蛋白标准品溶液,用孔径为0.2~0.5 μm 聚四氟乙烯膜过滤后,分别取20 μL上机进样,利用磷酸盐缓冲溶液pH 7.0为洗脱液,流速为1.0 mL/min,柱温26 ℃,吸收波长为220 nm条件下,进行检测,绘制标准曲线。
1.3.4.3 复合凝胶的制备[7]:WPS与MP按照1∶1(m∶m)制备凝胶,分别用0.6 mol/L的NaCl溶解调至pH 6.25,配制成50 mg/mL溶液,将其在室温下保持2 h,取15 mL加入3.0×5.0 cm称量瓶中,盖上盖,置于水浴中,从25 ℃开始加热,当中心温度达到目标温度75 ℃时开始计时,加热30 min,随后取出放入冰浴中30 min , 4 ℃保存过夜,备用[7]。
1.3.5 复合凝胶的检测
1.3.5.1 复合胶溶解度测定:根据检测非共价键和二硫键作用的需要,配制以下4种凝胶溶解液:含0.6 mol/L NaCl的50 mmol/L PBS,pH 6.25用WP表示没有参与形成凝胶蛋白;6 mol/L盐酸胍(GuHCl)用WG表示非共价键对凝胶稳定性的作用,10 mol/L 二硫苏糖醇(DTT)分别溶解在含0.6 mol/L NaCl的50 mmol/L PBS中(pH 6.25) 用WD表示二硫键对凝胶稳定的作用,6 mol/L GuHCl+10 mol/L DTT用WT表示为WP、WG、WD 3个的总和。分别取2 g蛋白凝胶用玻璃棒捣碎溶解在8 mL凝胶溶解液中,在80 ℃水浴加热3 h后冷却、离心(3 500r/min,15 min,4 ℃)。复合凝胶溶解度即上清液蛋白占凝胶中总蛋白量百分比。
1.3.5.2 凝胶的质构测定:参照董庆利等[8]的测定方法,并稍作修改进行测定,采用TA-XT2i型质构仪对凝胶进行分析,包括黏结性、弹性、回弹性。先将凝胶22 ℃,放置30 min,连同称量瓶一起放入置物盘上,用物性测试仪进行测定。测定参数:探头型号为P/50,测前速度2 mm/s,测中速度1 mm/s,测后速度2 mm/s,触发力5 g,样品高度为20 mm,压缩距离为凝胶50%。
1.3.5.3 凝胶水分相态的测定:测量前先将凝胶22 ℃,放置30 min后,用生料带包好进行核磁共振试验,每个试验平行3次,使用纽迈NM120-Analyst通过CPMG序列测定横向弛豫时间T2。磁体温度为恒温32 ℃,质子共振频率SF=19.00 MHz,采样点数TD=170 400,重复采样等待时间TW=2 000.00 ms,累加次数NS=32,回波个数NECH=4 000,时延DL1=0.200。CPMG序列使用纽迈电子公司的核磁共振分析应用软件进行反演,得到T2值。
1.3.5.4 凝胶白度测定:色差计测定凝胶的白度值,参考Zhu等[9]的方法计算,其中L*、a*、b*值分别为亮度指数、色调和彩度指数。L*=0为黑色,L*=100为白色。a*值越大,颜色越接近红色;a*值越小越接近绿色。b*值越大,颜色越接近黄色;b*值越小越接近蓝色。凝胶白度按公式(2)计算。
(2)
1.4 数据统计分析
数据结果表示为平均值±标准差(SD)。采用SPSS 16.0软件中One-Way ANOVA进行差异性分析,P<0.05认为具有统计学显著性差异,P>0.05认为具有统计学差异不显著,利用Simga公司的sigma Plot 10.0软件绘图。
2 结果与分析
2.1 不同碱溶温度对WPS溶解度的影响
图1表示籽瓜种子蛋白提取工艺的碱溶阶段,选取不同的温度提取对WPS溶解度的影响。结果表明,随着温度的升高,溶解度呈现下降趋势,当温度为50 ℃,溶解度下降6%,差异显著(P<0.05)。相关报道表明,当加热温度小于100 ℃,加热可以使蛋白展开、聚集形成可溶蛋白和不溶的蛋白大分子聚集体,温度较高时会引起不溶蛋白聚集体增多从而导致溶解度的降低[10]。

注:不同字母表示差异显著(P<0.05)。图1 碱溶温度对WPS溶解度的影响
2.2 不同碱溶温度对WPS分子质量分布的影响
图2不同碱溶温度提取WPS分子质量分布图。如图所示,碱溶温度40 ℃时获得4个吸收峰,峰1为分子质量大于669 ku小于103ku的大分子蛋白聚集体,相关资料显示,籽瓜种子蛋白主要分为清蛋白和球蛋白,球蛋白质量分数占78%,由此推测峰2和峰3分别为不同沉降系数球蛋白,分子质量分别约为340、212 ku。峰4为其他蛋白、部分清蛋白,以及球蛋白的亚基,分子质量范围为54~10 ku。随着处理温度的升高,峰1面积增大,峰2、峰3降低,峰4含量逐渐降低。当温度升到80 ℃,峰1面积继续增大,峰2、峰3几乎消失不见。当温度较高时,蛋白质分子之间形成大分子聚集体,随着加热时间延长,聚集体逐渐增大,不溶性聚集体含量增多,可溶性聚集体含量降低,导致蛋白溶解度降低,与图1试验结果吻合,碱溶温度80 ℃时,WPS溶解度差异显著。

图2 碱溶温度对WPS分子质量分布的影响
2.3 碱溶温度对WPS与MP复合胶溶解度的影响
图3为不同碱溶温度提取WPS,分别在3种变性剂(WP、WD、WG)中的溶解度测定结果图。维持蛋白质结构构象的作用力主要有氢键、静电作用、共价键、疏水作用力、范德华力。没形成凝胶的蛋白,将溶解在WP试剂中。由图3可知,WPS40、WPS60、WPS80都有溶解,溶解度均小于20%,其中WPS60溶解性最差,差异显著(P<0.05),说明碱溶温度60 ℃时,80%以上WPS参与三维网状结构的形成。WD溶液中的还原剂DTT,具有-SH基,能使蛋白质分子中存在的二硫键还原,从而改变蛋白质的原有构象,造成蛋白质的不可逆变性。3种复合凝胶均发生溶解,但溶解度较低,说明二硫键对凝胶的三维网状结构具有稳定性的作用,但不是维持网结构的主要作用力。GuHCl能够破坏稳定蛋白构象的疏水作用力,或者直接与蛋白会分子作用而破坏氢键,3种复合凝胶在WG中的溶解度较大,说明氢键、疏水作用力为保证三维结构稳定性的主要作用力,在当加热时,包埋在蛋白分子内部的疏水基团暴露,增进了临近分子非极性片段间的疏水作用力,增强了凝胶的稳定性。WPS60溶解度与WPS40差异不显著,与WPS80差异显著(P<0.05)。由此推测,当温度较高时,蛋白变性,维持蛋白构象的作用力发生改变。在WT中,3种复合凝胶均全溶解,溶解度为100%。

注:字母A~B表示不同碱溶温度复合凝胶在WP中溶解度的差异显著性;字母X-Z表示不同碱溶温度复合凝胶在WD中溶解度的差异显著性;字母a-b表示不同碱溶温度复合凝胶在WG中溶解度的差异显著性(P<0.05)。图3 WPS-MP复合凝胶在WP、WD、WG中的溶解度测定
2.4 碱溶温度对WPS与MP凝胶质构的影响
图6为不同碱溶温度提取WPS对MP凝胶质构的影响,由图6可知WPS60的黏结性最大,加热导致WPS构象发生改变或部分伸展,大量的亲水基团、疏水基团暴露出来,亲水基团和水分子发生结合,使互不溶的相态体系紧密相连,能更好地形成统一整体。当碱溶温度为60 ℃时,提取WPS60与MP形成凝胶的弹性较好,当碱溶温度继续升高,导致维持蛋白结构功能键断裂,结构破坏,凝胶弹性下降。

图6 不同碱溶温度提取蛋白对MP凝胶质构的影响
2.5 碱溶温度对WPS与MP凝胶水相分布的影响
肌肉中的水分大约占总水分的75%,主要存在于肌原纤维内的粗细丝、肌原纤维、肌原纤维与细胞膜及肌细胞与肌束之间,根据其存在的状态不同可分为结合水、不易流动水和自由水。根据T指数衰减曲线进行拟合绘制图7,3种不同碱溶蛋白获得3个峰,T21、T22、T23,分别代表了水中的3种形态,结合水、不易流动水、以及自由水部分[11]。弛豫时间的长短,决定水与底物的紧密程度[12]。凝胶形成过程中,T23峰面积最大,凝胶形成过程中,水添加量大于凝胶内部形成需求量,大部分水分以自由水形式存在,导致T23峰面积最大。比较发现WPS80与MP形成的凝胶T21弛豫时间最长,WPS60与MP形成的凝胶T21弛豫时间最短,T21弛豫越短说明蛋白质与结合水紧密度较高,稳定性较好。WPS60的T22弛豫时间最短,不易流动水较稳定,保水性越好。同时由表1可以看出,WPS60的结合水和不易流动水的峰面积最大,含量最高。因此,当碱溶温度为60 ℃时,提取WPS60与MP形成的凝胶更适合应用于香肠制品中。

图7 不同碱溶WPS对MP凝胶水相分布的影响
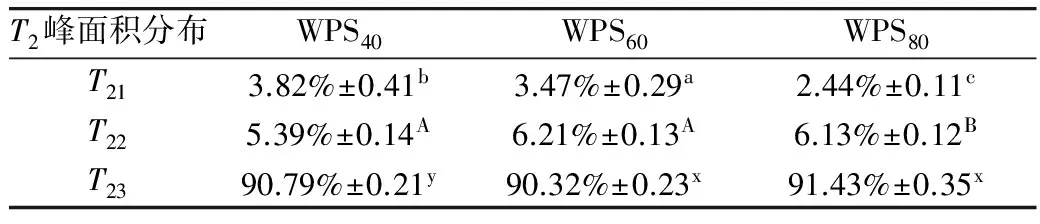
表1 复合凝胶在中低场核磁弛豫峰面积百分数(T2)变化
注:字母a-c相同表示不同碱溶温度复合凝胶T21差异不显著(P>0.05),不同表示差异显著(P<0.05);字母A-B相同表示不同碱溶温度复合凝胶T22差异不显著(P>0.05),不同表示差异显著(P<0.05);字母x-y相同表示不同碱溶温度复合凝胶T23差异不显著(P>0.05),不同表示差异显著(P<0.05)。
2.6 碱溶温度对WPS与MP凝胶白度的影响
图8为不同碱溶WPS与MP形成凝胶白度的测定,凝胶的白度和蛋白质的变性程度具有相关性[13]凝胶的白度值变化越大,蛋白的结构变化越大。由图8可知,3种WPS与MP形成凝胶,白度均较低,由于在WPS提取过程中,籽瓜种子皮中的色素部分溶解导致提取的蛋白颜色发暗,导致凝胶白度较低。随着温度的增加,凝胶白度逐渐加,差异显著(P<0.05)。说明凝胶对温度较为敏感,随着提取温度的改变,WPS结构发生改变,变性,温度越高,变性程度越大。由此可看出,碱溶温度对凝胶三维网状结构的形成有着重要的影响。
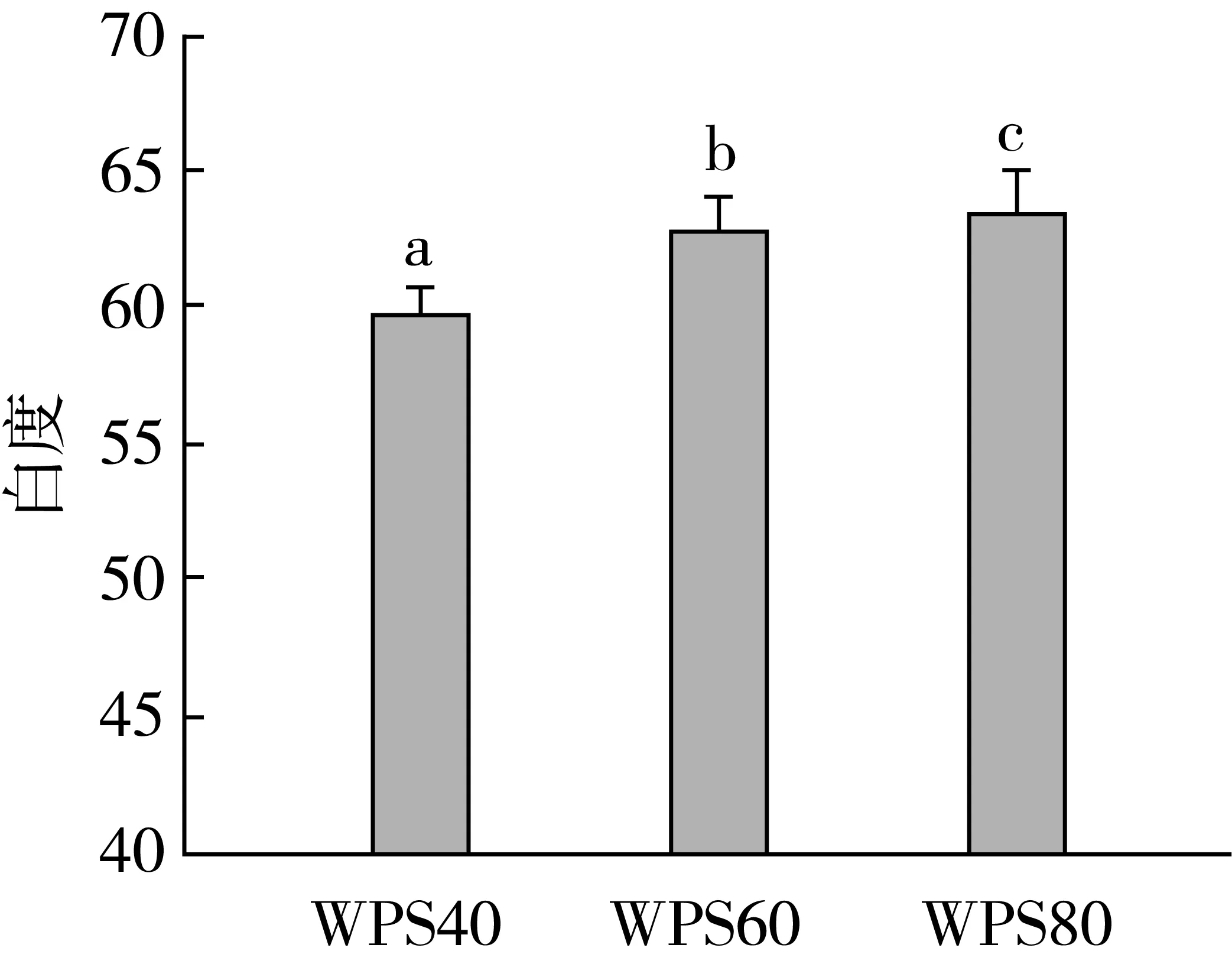
注:不同字母表示差异显著(P<0.05)。图8 不同碱溶WPS对MP凝胶白度的影响
3 结论
籽瓜种子蛋白作为一种新型蛋白,由于种植地方局限性,限制了籽瓜种子蛋白的使用。本研究利用不同碱溶温度提取籽瓜种子蛋白,温度对籽瓜种子蛋白结构、功能影响较大,不同碱溶温度提取的籽瓜种子蛋白对肌原纤维蛋白功能影响差异显著,WPS提取温度为60 ℃时提取的WPS与MP形成WPS-MP复合凝胶具有很好的弹性、保水性较好。因此,利用60 ℃提取的籽瓜种子蛋白适合应用于肉制品加工中。由于提取籽瓜种子蛋白颜色较暗,适合用于对颜色要求较低猪肉制品中。
[1]El-Adawy T A,Taha K M.Characteristics and composition of different seed oils and flours [J] . Food Chemistry,2001,74(1):47-54
[2]Katyna B,Leon D.The globulin seed storage proteins of flowering plants are derived from two ancestral genes[J]. Plant Molecular Biology, 1987,8(2):113-31
[3]王鹤霖.籽瓜种子蛋白对香肠品质的影响[J].中国食品添加剂,2016,147(5):106-110
Wang Helin.Effects of protein extracted from watermelon seed on the sensory and Physico-Chemical properties of sausage[J].China Food Additives,2016,147(5):106-110
[4]Lanier T C, Carvajal P, Yongsawatdigul J. Surimi and surimi seafood[M]. New York: Marcel Dekker,2004: 78-96
[5]张超,郭晓飞,李武,等. 籽瓜种子蛋白质组成及其提取工艺优化的研究[J].中国粮油学报,2013,28(9):119-123
Zhang Chao,Guo Xiaofei,Li Wu,et al.Composition and extraction of watermelon seed protein[J]. Journal of the Chinese Cereals and Oils Association,2013,28(9): 119-123
[6]陈洪生,孔保华,王宇. 蛋清蛋白对猪肉肌原纤维蛋白功能性的影响[J].中国食品学报,2014,14(5):80-84
Chen Hongsheng,Kong Baohua,Wang Yu. Effect of egg white protein on functional properties of porcine myofibrillar protein[J]. Journal of Chinese Institute of Food Science and Technology, 2014,14(5):80-84
[7]孔保华,王宇,夏秀芳.加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J].食品科学,2011, 32(5):50-54
Kong Baohua,Wang Yu,Xia Xiufang.Influence of heating temperature on gel properties of porcine myofibrillar protein[J].Food Science,2011,32(5):50-54
[8]董庆利,罗欣,屠康. 熏煮香肠中脂肪、食盐、淀粉和水分含量对其质构的影响[J]. 食品与发酵工业,2005(5):139-142
Dong Qingli ,Luo Xin,Lu Kang.Studies on the effect of texture of smoked by adding different contents of fat, salt and cooked sausage starch and water[J].Food and Fermentation in Industries, 2005(5):139-142
[9]Zhu K R, Kanu P J,Claver I P,et al. A method for evaluating Hunter whiteness of mixed powders[J].Advanced Powder Technology, 2009,20 (2):123-126
[10]Shen L,Tang C H.Microfluidization as a potential technique to modify surface properties of soy protein isolate[J].Food Research International,2012,48(1):108-118
[11]Bertram H C,Purslow P P,Andersen H J.Relationship between meat structure, water mobility,and distribution:a low-field nuclear magnetic resonance study[J].Journal of Agricultural & Food Chemistry,2002,50,824-829
[12]杨慧娟,韩敏义,邹玉峰.低场核磁共振研究高压处理对乳化肠特性的影响[J].食品科学,2014,35(17):53-57
Yang Huijuan,Han Minyi,Zou Yufeng. A low-field nuclear magnetic resonance (LF-NMR) study of effect of high pressure processing on the characteristics of emulsion type sausages[J].Food Science, 2014,35(17):53-57
[13]Hwang J S,Lai K M,Hsu K C.Changes in textural and rheologicail properties of gels from tilapia muscle proteins induced by high pressure and setting[J].Food Chemistry,2007,104(2):747-753.
The Effect of Watermelon Seed Protein on the Function of Myofibrillar
Wang Helin
(College of Food Science of Heilongjiang Bayi Agricltural University, Daqing 163319)
The watermelon seed was selected as the raw material to extract the watermelon seed protein by alkali-solution and acid-isolation method. Under the temperature of 40,60 and 80 ℃,different watermelon seed protein could be gained. The molecular weight, solubility test was conducted and fibrillin formed gelate. Experiments were conducted on gel acting force, elasticity, rebound resilience, caking property, aqueous phase degree and whiteness. The studies showed that solubility of the WPS increases with the following decrease as the increasing temperature. There were four absorption peaks as follows. The Mw of peak 1 was 699~103ku as the macromolecule protein aggregation. The Mw of peak 2 and peak 3 were 340 and 212 ku, respectively, as the different sedimentation coefficient of globulin. The Mw of peak 4 was 10~54 ku as the subunit of some albumin and globulin. The peak 2 and 3 disappeared gradually as the increasing temperature. The stability of the three-dimensional network structure was held by the disulfide bond, and especially the hydrophobic bond, hydrogen bond. The WPS and MP form a gel as the alkali liquor temperature 60 ℃, of which elasticity and water distribution was suitable for the application of pork products. The temperature of alkali liquor was important for the protein denaturation. Taken together, the WPS could be added to the pork products as the non meat proteins stabilizer.
molecular weight, colour, texture profile, watermelon seed protein
TS210
A
1003-0174(2017)09-0075-06
2016-04-18
王鹤霖,女,1983年出生,硕士,食品科学与工程

