牛羊乳蛋白质粒度对其热处理沉淀率的影响
李林强, 王 亮, 田苏辉, 朱莉莉, 田万强
(1.陕西师范大学 食品工程与营养科学学院,陕西 西安 710119;2.西安宏兴乳业公司,陕西 临潼710600;3.杨凌职业技术学院 动物工程分院,陕西 杨凌 712100)
牛羊乳蛋白质粒度对其热处理沉淀率的影响
李林强1, 王 亮1, 田苏辉2, 朱莉莉1, 田万强3
(1.陕西师范大学 食品工程与营养科学学院,陕西 西安 710119;2.西安宏兴乳业公司,陕西 临潼710600;3.杨凌职业技术学院 动物工程分院,陕西 杨凌 712100)
研究牛羊乳蛋白质粒度大小对其热处理沉淀率的影响。采用离心沉淀、原子力显微镜、激光粒度仪和SDS-PAGE分析热处理后(95℃,15 min)牛羊乳蛋白质沉淀率、表面形貌、牛羊鲜乳蛋白质粒度和酪蛋白组成。结果表明:羊乳热处理后沉淀率显著高于牛乳(p<0.05);羊乳蛋白质粒子明显大于牛乳,其蛋白质热处理片状凝聚程度(35 858.15 nm2)大于牛乳(18 215.18 nm2);鲜牛乳蛋白质粒度大小主要集中在1 nm以下,鲜羊乳蛋白质粒度在1 nm以下相对较少,主要分布在1~1 000 nm之间;牛羊鲜乳酪蛋白主要有β-酪蛋白和αs1-酪蛋白两种,相对分子质量分别为34 000和26 000左右。牛乳的热稳定性高于羊乳;蛋白质粒度大小是影响其热稳定性的直接因素;原子力显微镜结合激光粒度仪是分析乳蛋白粒度的有效手段。
牛乳;羊乳;蛋白质;粒度;沉淀率
液态乳是乳制品中消费量最大的一类,但其在货架期会出现蛋白质沉淀现象[1],引起消费者的安全顾虑。羊乳热处理后沉淀现象较牛乳更为严重,这就成为液态羊乳生产的技术瓶颈,因此市场羊乳产品主要以羊奶粉为主,产品单一,影响其消费量的增加和奶山羊产业的发展。
影响乳蛋白质稳定性的因素有:酪蛋白组成[2-3]、乳清蛋白和酪蛋白的比例[4-5]、酸度[6-7]、处理温度[8-12]等,无论何种因素均可能导致乳蛋白质粒子增大,从而导致冷藏期或货架期出现蛋白质沉淀现象。热处理是乳加工必不可少的一个关键控制点,处理温度影响蛋白质胶粒的大小。在pH 6.5~6.7范围内,随着处理温度的升高,蛋白质胶粒越大[13-15]。蛋白质胶粒大小是影响蛋白质沉淀率的直接物理因素,而关于牛羊乳蛋白质粒度的现有研究报道难以解释羊乳稳定性低于牛乳的事实。因此,蛋白质粒度对热处理乳蛋白质沉淀率的影响需继续研究。
蛋白质粒度测定多采用激光粒度仪、纳米粒度仪、沉降式粒度仪等,缺乏直观表征,导致测定参数设置有可能存在一定盲目性,测定结果出入较大,甚至相互矛盾。原子力显微镜(AFM)利用样品与探针之间的相互作用力[16],表征样品表面的三维形貌[17]。AFM可以观察绝缘体,因此对生物类样品检验有特殊优势[18]。基于原子力显微镜的这些优点,作者使用原子力显微镜表征牛羊乳热处理后蛋白质粒子微观形貌,并结合激光粒度仪,从微观和直观两个方面分析牛羊乳蛋白质粒子大小,更客观地反映牛羊乳蛋白胶粒大小差异,以揭示其对乳蛋白沉淀率的影响。
1 材料与方法
1.1 材料
1.1.1 材料 牛羊乳分别采自于西北农林科技大学畜牧站荷斯坦奶牛和萨能奶山羊。
1.1.2 主 要 试 剂 蛋 白 质 Mark:#SM0671,Fermentas公司;干酪素:01-010,北京奥博星生物技术有限责任公司;三羟甲基氨基甲烷(Tris)、硝酸银、丙烯酰胺、N,N-甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、N,N,N,N-四甲基乙二胺(TEMED)、甘氨酸、甘油、β-巯基乙醇、溴酚蓝、盐酸、氯化钠、三氯乙酸、戊二醛、碳酸钠、甲醛、柠檬酸、醋酸钠、氢氧化钠、醋酸、乙醚:均为分析纯。
1.1.3 主要仪器 台式离心机:800B,上海安亭科学仪器厂;原子粒显微镜:Veeco-Bruker;电泳系统:PowerPacTM Universal,美国 Bio-Rad;凝胶成像系统:Universal Hood II,XRS,美国 Bio-Rad。
1.2 方法
1.2.1 蛋白质沉淀率测定 牛羊乳样分别于水浴锅中95℃加热15 min,热处理乳样于2~4℃冷却保存,每12小时取样,400 g离心15 min,倾出上清液,称重沉淀蛋白质,每次平行测定3个样,共测定5次,按下式计算蛋白质沉淀率百分率。
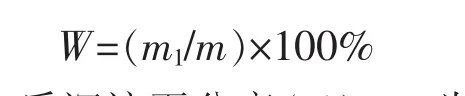
式中W为蛋白质沉淀百分率(%);m1为沉淀蛋白质质量(g);m 为样液质量(g)。
1.2.2 热处理蛋白质粒子原子力显微镜形貌观察取10 mL热处理乳400 g离心15 min,除去上层脂肪,然后加入等体积乙醚通过分液漏斗进一步脱脂。取脱脂乳样1 mL,稀释25倍,超声处理10 min,取样1 μL液滴于云母片上,自然风干,用Veeco Bruker原子力显微镜J探头进行形貌观察、粒度大小测定和剖面分析。
1.2.3 粒度测定 取鲜牛羊乳各50 mL,加入等体积乙醚,静置10 min,1 200 g离心 15 min,倾去上层脂肪,用激光粒度分析仪(MS2000,英国马尔文仪器公司)测定其粒度。
1.2.4 酪蛋白组成SDS-PAGE分析 取鲜牛羊乳各30 mL,200 g离心5 min,弃去上层脂肪;下层液体加入等体积0.2 mol/mL醋酸-醋酸钠缓冲液(pH 4.6),摇匀,加热至40℃,冷却至室温,放置5 min,200 g离心5 min,倾出上层液体,沉淀物用蒸馏水洗涤,200 g离心5 min,洗涤重复3次。所得沉淀物即为粗酪蛋白。将粗酪蛋白置于30 mL 95%乙醇中洗涤2次,200 g离心5 min,再用乙醚冲洗涤2次,抽滤,将所得沉淀物摊开在表面皿上,使乙醚完全挥发,所得即为酪蛋白。
取酪蛋白1 mg溶于1 mL样品缓冲液中,沸水处理5 min。配制12 g/dL分离胶加入凝胶板中,凝固40 min,加入3 g/dL浓缩胶,凝固40 min,加样孔中加入样品10 μL,80 V电泳40 min,然后100 V电泳2.5 h,20%三氯乙酸浸泡凝胶板8 h,用150 mL去离子水冲洗凝胶板,弃去洗涤液,加150 mL去离子水充分洗涤20 min,洗涤重复3次,加入1%戊二醛溶液150 mL,避光洗涤6 h,弃去戊二醛溶液,去离子水洗涤10 min,洗涤重复3次,弃去离子水,加入氨银染液100 mL,避光染色20 min,弃去氨银染液,加去离子水150 mL洗涤凝胶表面两次,每次1 min。加入显色液,至显色清晰,弃去显色液,去离子水洗涤2次,每次1 min,加入终止显色液终止显色。
1.2.5 数据处理 运用 SPSS软件进行数据处理,结果以平均值±标准差(X±SD)表示。
2 结果与分析
2.1 牛羊乳蛋白质沉淀率
图1表明,热处理(95℃,15 min)的牛羊乳在2~4℃随着时间的延长,蛋白质均有一定程度的沉淀,但牛乳无显著性变化(p>0.05),而羊乳蛋白质沉淀率显著高于牛乳(p<0.05),这与 Raynal-Ljutovac(2007)[19]、Bouhallab(2002)[20]、周强(2007)[21]等研究结果一致。结果提示羊乳蛋白热稳定性远低于牛乳。
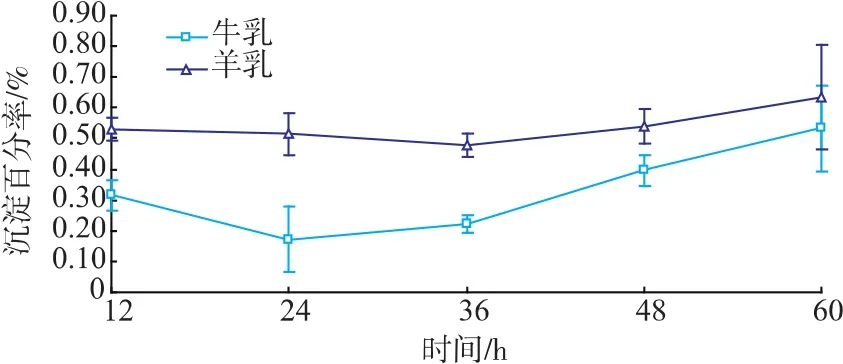
图1 牛羊乳热处理后沉淀率动态变化Fig.1 Dynamic changes of sedimentation rate of cow milk and goat milk after heat treatment
2.2 牛羊乳蛋白质粒子原子力显微镜观察
图2-3是牛羊乳热处理后蛋白质粒子形貌及其剖面图。结果表明:牛羊乳蛋白质粒子数目分别为 78、77,蛋白质粒子密度分别为 3.12 个/μm2、3.08个/μm2,极为接近;羊乳蛋白质粒子直径(93.91 nm)明显大于牛乳(71.52 nm);羊乳热处理蛋白质片状凝聚程度 (35 858.15 nm2) 大于牛乳 (18 215.18 nm2);剖面图分析显示,羊乳蛋白质颗粒表面起伏程度(5.92~23.79 nm)大于牛乳(3.15~9.49 nm)。 上述结果表明:热处理后羊乳蛋白质粒度大于牛乳。
2.3 牛羊鲜乳蛋白质粒度测定
由图4可知,鲜牛乳蛋白粒度大小主要集中在1 nm以下。由图5可知,鲜羊乳蛋白粒度只有少部分在1 nm以下,主要分布在10~1 000 nm之间,其中100 nm左右最多,表明鲜羊乳蛋白粒度大于牛乳,结合上文羊乳在95℃、15 min处理后,在2~4℃随着时间的延长,可明显观察到沉淀现象,表明羊乳蛋白质粒度大是其热稳定性低于牛乳的直接原因。

图2 牛乳热处理后蛋白质粒子形貌及其剖面图Fig.2 Morphology and profile of protein particle of cow milk after heat treatment
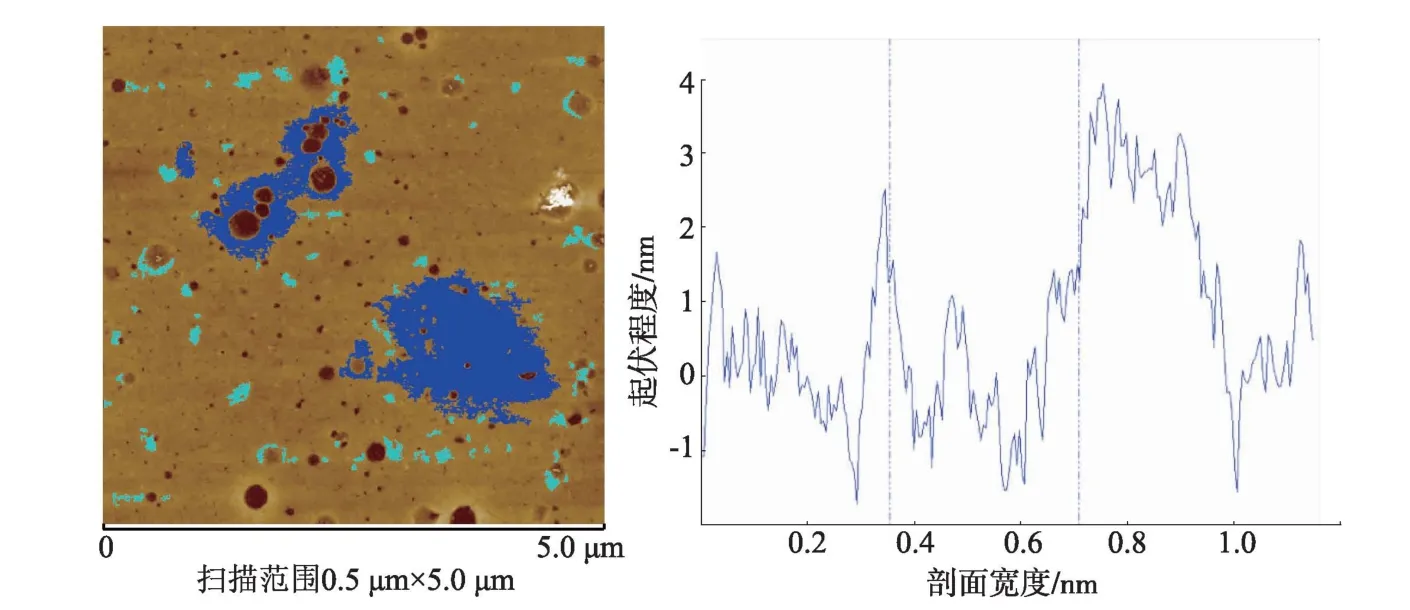
图3 羊乳热处理后蛋白质粒子形貌及其剖面图Fig.3 Morphology and profile of protein particle of goat milk after heat treatment

图4 鲜牛乳蛋白质粒度大小分布范围Fig.4 Particle size range of protein from fresh cow milk

图5 鲜羊乳蛋白质粒度大小分布范围Fig.5 Particle size range of protein from fresh goat milk
2.4 牛羊乳酪蛋白SDS-PAGE
由图6可知,牛羊乳酪蛋白主要有β-酪蛋白和αs1-酪蛋白两种,依据标准蛋白质Mark,β-酪蛋白和αs1-酪蛋白相对分子质量分别为34 000和26 000左右。结果表明,牛羊乳酪蛋白分子组成和大小基本相同,与二者稳定性差异相关性不大。

图6 牛羊鲜乳酪蛋白SDS-PAGEFig.6 SDS-PAGE of casein of fresh milk from cow and goat
3 讨 论
3.1 乳蛋白质粒度与其稳定性
乳是一种胶体,其蛋白质颗粒处于布朗运动,如果蛋白质颗粒增大则可能出现沉淀。李子超等(2013)[13]采用纳米粒度仪对酪蛋白粒径测量结果表明,巴氏杀菌牛乳集中分布于105.7~1 106.0 nm之间,UHT牛乳粒径在 105.7~164.2 nm和 255.0~458.7 nm的体积分数分别为58.8%和41.1%,结合本研究热处理后牛乳蛋白质粒度增大,可见牛乳热处理出现沉淀的直接原因是蛋白质胶粒增大。
本研究结果表明,牛乳蛋白质热稳定性高于羊乳,而粒度却低于羊乳。 Fava(2013)、Jenness(1980)和李子超(2012)等研究报道常温羊乳蛋白质粒子平均直径小于牛乳[22-24],这与本研究结果相异,虽然难以解释常温羊乳稳定性小于牛乳的事实,但也表明热处理后羊乳蛋白质胶粒增大程度可能更大,蛋白质热变性沉淀现象更为严重。
3.2 牛羊乳热稳定性差异
本研究结果表明,牛羊乳酪蛋白主要有β-酪蛋白和αs1-酪蛋白两种,这与Bramanti(2003)[25]、Crudden(2005)[26]和 Veloso(2002)[27]等的研究结果相同,而且牛羊乳这两种酪蛋白相对分子质量几乎相同,所以酪蛋白结构可能是影响其热稳定性的基础性因素。 章宇斌 (2007)[28]、 李子超(2013,2012)[13,24]等研究结果表明,热处理后牛羊乳酪蛋白胶束结构有很大差异,乳酪蛋白二级结构的α-螺旋、β-转角和β-折叠数目均发生不同程度的变化。牛羊乳酪蛋白热处理结构的变化是基于二者本身结构的差异还是仅仅是由于热处理所致,尚待进一步研究。
4 结语
牛乳的热稳定性优于羊乳,羊乳蛋白质粒子明显大于牛乳,蛋白质粒子大小是影响其热稳定性的直接因素,原子力显微镜结合激光粒度仪是分析乳蛋白粒度的有效手段。
[1]LI Linqiang,TIAN Wanqiang,ZAN Linsen.Studies on physicochemical properties change of ultra-high temperature sterilization milk during shelf-life and role of ultrafiltration on its quality stability[J].Journal of Northwest A&F University(Nat.Sci.Ed.),2011,39(5) :185-189.(in Chinese)
[2]TZIBOULA A.Casein diversity in caprine milk and its relation to technological properties:heat stability[J].International Journal of Dairy Technology,1997,50(4):134-138.
[3]HORNE D S,MUIR D D.Alcohol and heat stability of milk protein[J].Journal of Dairy Science,1990,73(12):3613-3626.
[4]MORGAN F,MICAULT S,FAUQUANT J.Combined effect of whey protein and αS1-casein genotype on the heat stability of goat milk[J].International Journal of Dairy Technology,2001,54(2):64-68.
[5]LAURENCE D,FANNY G.Formation and properties of the whey protein/κ-casein complexes in heated skim milk-a review[J].Dairy Science Technology,2009,89(1):3-29.
[6]ZHAO Zhengtao,LI Quanyang,ZHAO Hongling,et al.Research on the characteristic of caseins at different pH[J].Journal of Dairy Science and Technology,2009,134(1):26-29.(in Chinese)
[7]QIAO Xing,ZHANG Fuxin,WU Su,et al.Heat stability factors of goat's milk[J].Academic Periodical of Farm Products Processing,2012,268(1):46-48.(in Chinese)
[8]HARJINDER S.Heat stability of milk[J].International Journal of Dairy Technology,2004,57(2-3):111-119.
[9]ZHOU Jiejin,ZHANG Liebing,LIANG Jianfen.Effect of heating and storage on aggregation of fat globule and protein in milk[J].Food Science and Technology,2010,35(5):72-76.(in Chinese)
[10]HEILIG A,CELIK A,HINRICHS J.Suitability of dahlem cashmere goat milk towards pasteurisation,ultrapasteurisation and UHT-heating with regard to sensory properties and storage stability[J].Small Ruminant Research,2008,78(1-3):152-161.
[11]ELFAGM A A,WHEELOCK J V.Heat interactions between α-lactalbumin,β-lactoglobulin and casein in bovine milk[J].Journal of Dairy Science,1978,61(2):159-163.
[12]HAQUE Z K,JOHN E.Interaction between heated κ-casein and β-lactoglobulin:Predominance of hydrophobic interactions in the initial stages of complex formation[J].Journal of Dairy Research,1988,55(1):67-80.
[13]LI Zichao,XU Mingfang,XIANG Mingxia,et al.Research on the structural differences of the casein from milk by pasteurization and ultrahigh temperature sterilization[J].Journal of South China Agricultural University,2013,34(2):192-196.(in Chinese)
[14]ANEMA S G,LI Y.Association of denatured whey proteins with casein micelles in heated reconstituted skim milk and its effect on casein micelle size[J].The Journal of Dairy Research,2003,70(1):73-83.
[15]ANEMA S G,LI Y.Effect of pH on the association of denatured whey proteins with casein micelles in heated reconstituted skim milk[J].Journal of Agricultural and Food Chemistry,2003,51(6):1640-1646.
[16]陈明.原子力显微镜及其在ZAO薄膜等材料研究中的应用[D].大连:大连理工大学,2008.
[17]邱晗.基于原子力显微镜的纳米梁谐振器振动特性的测试技术研究[D].天津:天津大学,2009.
[18]WEI Xiangyi,ZHANG Wenhua,SHI Bi.Detection of collagen and its assembly structures by atomic force microscope[J].Leather Science and Engineering,2013,23(6):5-11.(in Chinese)
[19]RAYNAL L K,PARK Y W,GAUCHERON F,et al.Heat stability and enzymatic modifications of goat and sheep milk[J].Small Ruminant Research,2007,68(1-2):207-220.
[20]BOUHALLAB S,LECONTE N,GRAET Y L,et al.Heat-induced coagulation of goat milk:modification of the environment of the casein micelles by membrane processes[J].Dairy Science and Technology,2002,82(6):673-681.
[21]周强.羊乳理化特性及其胶体稳定性研究[D].西安:陕西师范大学,2007:12-14.
[22]FAVA L W,SERPA P B S,KULKAMP G I C,et al.Evaluation of viscosity and particle size distribution of fresh,chilled and frozen milk of Lacaune ewes[J].Small Ruminant Research,2013,113(1):247-250.
[23]JENNESS R.Composition and characteristics of goat milk:review 1968-1979[J].Journal of Dairy Science,1980,63(10):1605-1630.
[24]LI Zichao,WANG Lina,LI Yunkai,et al.Differences in particle size and structure of casein micelle from different milk sources[J].Food Science,2012,33(5):58-61.(in Chinese)
[25]BRAMANTI E,SORTINO C,ONOR M,et al.Separation and determination of denatured αs1-,αs2-,β-and κ-caseins by hydrophobic interaction chromatography in cows’,ewes’ and goats’ milk,milk mixtures and cheeses[J].Journal of Chromatography,2003,994(1-2):59-74.
[26]CRUDDEN A,AFOUFA B D,FOX P F,et al.Effect of hydrolysis of casein by plasmin on the heat stability of milk[J].International Dairy Journal,2005,15(10):1017-1025.
[27]VELOSO A C A,TEIXEIRA N,FERREIRA I M P L V O.Separation and quantification of the major casein fractions by reverse-phase high-performance liquid chromatography and urea-polyacrylamide gel electrophoresis:Detection of milk adulterations[J].Journal of Chromatography A,2002,967(2):209-218.
[28]章宇斌.酪蛋白多级结构及聚集行为的多尺度研究[D].天津:天津大学,2007.
欧盟就胭脂树橙提取物作为食品添加剂的暴露风险评估发布意见
据欧盟食品安全局(EFSA)消息,应欧盟委员会的要求,欧盟食品安全局就胭脂树橙提取物(annatto extracts)作为食品添加剂的暴露风险评估发布意见。
胭脂树橙是从红木籽中提取的一种食用天然黄橙色素,主要色素成分为红木素(bixin)、降红木素(norbixin)。
欧盟专家组经评估认为,对于所有人群来讲,红木素的膳食暴露量低于ADI数值,然而对于儿童来讲,在最高水平下,膳食暴露量会超过ADI数值。
[信息来源]食品伙伴网.欧盟就胭脂树橙提取物作为食品添加剂的暴露风险评估发布意见
[EB/OL].(2017-7-28).http://news.foodmate.net/2017/08/439739.html
欧盟就活性炭去除鱼油中的二恶英与二恶英类多氯联苯发布意见
据欧盟食品安全局消息,应欧委会的要求,欧盟食品安全局污染物专家组就活性炭去除鱼油中的二恶英与二恶英类多氯联苯发布意见。
按照欧盟规定,所有的饲料去污工艺需要符合 (EU)2015/786中的要求。专家组对饲料企业提供的数据进行了评估,评估了工艺的有效性以及确保工艺不会影响产品品质的信息。经评估,专家组认为,饲料企业用活性炭去除鱼油中中的二恶英与二恶英类多氯联苯的工艺符合 (EU)2015/786中的要求。
[信息来源]食品伙伴网.欧盟就活性炭去除鱼油中的二恶英与二恶英类多氯联苯发布意见 [EB/OL].(2017-8-1).http://news.foodmate.net/2017/08/438234.html
Influence of Protein Particles Size on Milk Sedimentation Rate from Cow and Goat after Heat Treatment
LI Linqiang1, WANG Liang1, TIAN Suhui2, ZHU Lili1, TIAN Wanqiang3
(1.College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi'an 710119,China;2.Xi'an Hongxing Dairy Company,Lintong 710600,China;3.Animal Engineering Department,Yangling Vocational and Technical College,Yangling 712100,China)
In the paper influence of particles size on protein sedimentation rate from cow and goat after heat treatment (95 ℃ ,15 min)were explored.Centrifugal sedimentation,atomic force microscope,laser particle size analyzer,and SDS-PAGE methods were used to determine protein precipitation rate,and protein surface morphology after heat treatment,casein composition,and protein particle size of fresh milk respectively.The results showed that protein sedimentation rate of goat milk was significantly higher than that of cow milk(P < 0.05),protein particles size of goat milk were significantly bigger than that of cow milk,the clumping together degree (35 858.15 nm2) of goat milk protein were bigger than that(18 215.18 nm2) of cow milk,fresh cow milk protein particle size mainly focused on 1 nm or less,that of fresh goat milk protein mainly distributed during therange of 1~1 000 nm,fresh cow milk and goat milk have two kinds of casein mainly,beta casein and alpha s1-casein,and their molecular weight are 34 000 and 26 000 respectively.Thermal stability of cow milk is better than that of goat milk.Protein particle size is the direct influence factor on the thermal stability of milk protein.Atomic force microscopy combined with laser particle size analyzer is an effective way to analyze the particle size of milk protein.
cow milk,goat milk,protein,particle size,sedimentation rate
TS 252.1
A
1673—1689(2017)09—1002—06
2015-04-21
陕西省科学技术发展计划项目(2014K13-20,2011K01-09)。
李林强(1971—),男,陕西扶风人,理学博士,副教授,主要从事畜产品及功能食品方面的研究。E-mail:lilinq@snnu.edu.cn
李林强,王亮,田苏辉,等.牛羊乳蛋白质粒度对其热处理沉淀率的影响[J].食品与生物技术学报,2017,36(09):1002-1007.

