维持性血液透析患者:高血磷、高血钙、高甲状旁腺素伴心血管钙化
陈佩玲 龚德华
·临床集锦·
维持性血液透析患者:高血磷、高血钙、高甲状旁腺素伴心血管钙化
陈佩玲 龚德华
2例中年男性维持性血液透析患者,在透析充分性、贫血、营养状况等指标方面无明显差异,而钙、磷、血清全段甲状旁腺激素(iPTH)指标的控制情况,两者形成鲜明对比,透析龄短的患者A血钙、磷、iPTH持续高于上限,而年龄较大的患者B透析龄长,血钙、磷、iPTH控制持续达标。经过长期随访,对比两者心血管钙化情况,慢性肾脏病矿物质与骨异常(CKD-MBD)相关血清学指标控制持续达标的患者B心血管钙化进展缓慢,血清指标持续不达标的患者A心血管钙化严重,且进展迅速。
慢性肾脏病矿物质与骨异常 心血管钙化
慢性肾脏病矿物质与骨异常(CKD-MBD)是CKD 5D期患者常见并发症之一,心血管钙化发生率高。本文回顾了2例维持性血液透析(MHD)患者的长期随访资料,分析CKD-MBD相关血清学指标的控制达标与患者心血管钙化进展的相关性。
病史摘要
患者A
现病史 45岁男性患者,MHD治疗8年余。
患者2000年发现尿检异常,尿蛋白+++、隐血++,血清肌酐(SCr)141.11 mmol/L,未重视,2009年至南京总医院国家肾脏疾病临床医学研究中心就诊,查SCr 1 788.33 μmol/L,肾脏超声提示:LK/RK 100 mm×43 mm/96 mm×41 mm,双肾皮质变薄,皮髓界限不清楚,肾内结构不清楚;于2009年1月开始行MHD治疗,血管通路为左侧前臂动静脉内瘘,3次/周,4h/次,透析液钙浓度1.5 mmol/L。透析之后身高无明显变化,透析期间血压控制在120/80 mmHg左右,目前未使用促红细胞生成素。患者平素体力正常,活动耐力可,偶有皮肤瘙痒、骨痛等表现。
既往史 无吸烟史,2009年戒酒,否认早发性心血管疾病家族史,否认糖尿病病史,否认心脑血管疾病史,“高血压”病史20年余,长期服用硝苯地平控制片、美托洛尔控制血压在130/80 mmHg左右。未用降脂药。
体格检查 体温36.5℃,脉搏 80次/min,呼吸18次/min,血压134/86 mmHg,体质量指数(BMI) 24.2 kg/m2。神志清,精神可,心肺无异常;腹软,无压痛、反跳痛;左前臂动静脉内瘘可触及震颤。
实验室及辅助检查 定期监测患者A血红蛋白、尿素清除指数(Kt/V)、血脂、血钙、血磷、血清全段甲状旁腺激素(iPTH)等指标变化情况(表1),依据检测结果调整相关用药(图1);定期进行心脏超声检查评估心脏瓣膜钙化情况,通过冠状动脉CT、腹部侧位X片(图2)分别评估冠状动脉钙化积分(CACS)(Agatston法[1]计算)、腹主动脉钙化积分(AACS)(Kauppila法[2]计算)(表2)。

表1 患者A随访期间kt/V及主要血液指标
Kt/V:尿素清除指数;iPTH:全段甲状旁腺激素
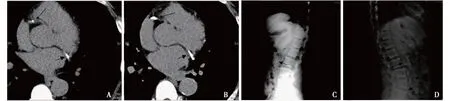
图2 患者A 冠状动脉CT检测冠状动脉钙化和腹部侧位片检测腹主动脉钙化情况(A、C:2013年,B、D:2016年)
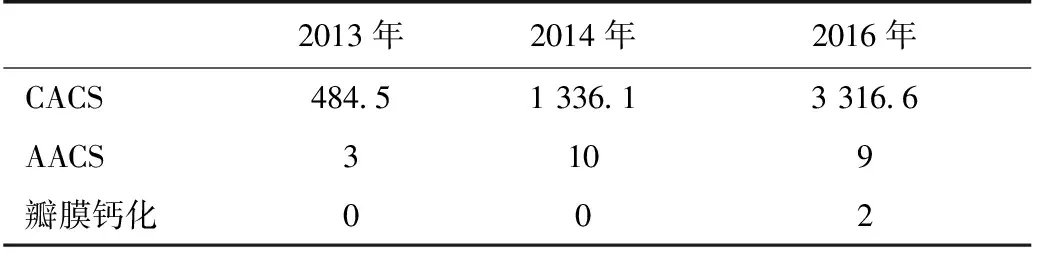
2013年2014年2016年CACS484 51336 13316 6AACS3109瓣膜钙化002
CAC:冠状动脉钙化;AAC:腹主动脉钙化;CACS:冠状动脉钙化积分;AACS:腹主动脉钙化积分
病史摘要
患者B
现病史 52岁男性患者,MHD治疗20年余。
患者于1997年10月检查发现SCr升至1 000.69 μmol/L,伴贫血(血红蛋白79 g/L),至我科就诊,肾脏超声提示肾脏体积缩小,未行肾活检术,病理不详,结合患者病史特点及相关检查结果考虑“慢性肾功能不全”。于同年10月份开始行MHD治疗。血管通路为:左侧前臂动静脉内瘘,常规HD 3次/周,每次透析4h,透析液钙浓度1.5 mmol/L。病程中无皮疹、关节痛等肾外表现。患者目前血压110/70 mmHg左右,未服用降压药物和降脂药。透析之后身高无明显变化,目前未使用促红细胞生成素。平素体力正常,活动耐力可,无明显皮肤瘙痒、骨痛症状。
既往史 否认糖尿病、冠心病等病史,无吸烟、饮酒史,否认心脑血管疾病史;既往有高血压病史20余年,服用CCB类(具体不详)控制血压在120/80 mmHg左右。
体格检查 体温36.5℃,脉搏74次/min,呼吸14次/min,血压122/74 mmHg,BMI 23.1 kg/m2。神志清,精神可,心肺无异常;腹软,无压痛、反跳痛;左前臂动静脉内瘘可触及震颤。
实验室及辅助检查 定期监测患者B血红蛋白、Kt/V、血脂、血钙、血磷、血iPTH等指标变化情况(表3),依据检测结果调整相关用药(图3);定期进行心脏超声检查评估心脏瓣膜钙化情况,通过冠状动脉CT、腹部侧位X片(图4)分别评估冠状动脉钙化积分(CACS)、腹主动脉钙化积分(AACS)(表4)。
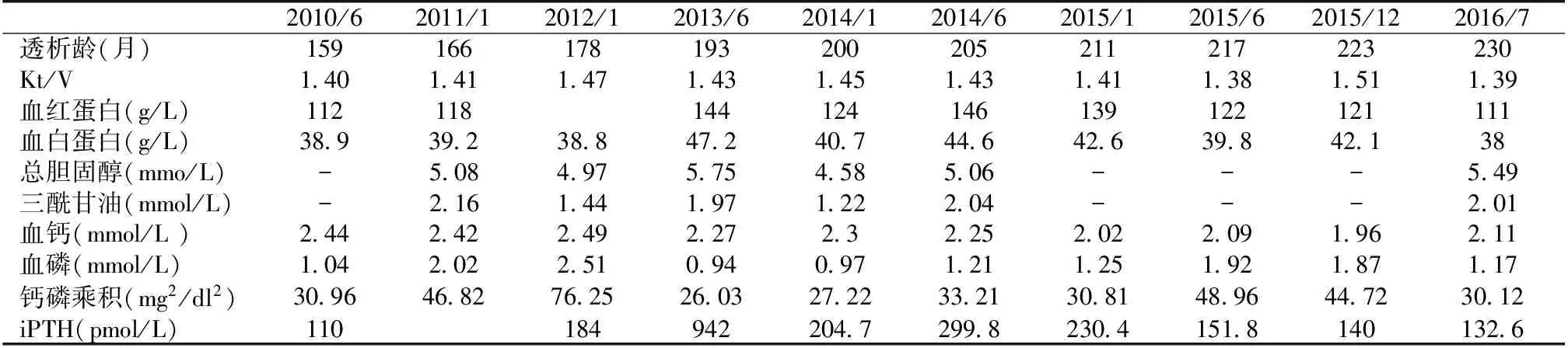
表3 患者B随访期间kt/V及主要血液指标
Kt/V:尿素清除指数;iPTH:全段甲状旁腺激素
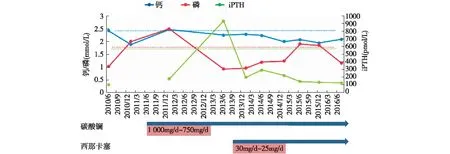
图3 患者B血钙、磷、全段甲状旁腺激素(iPTH)变化及治疗
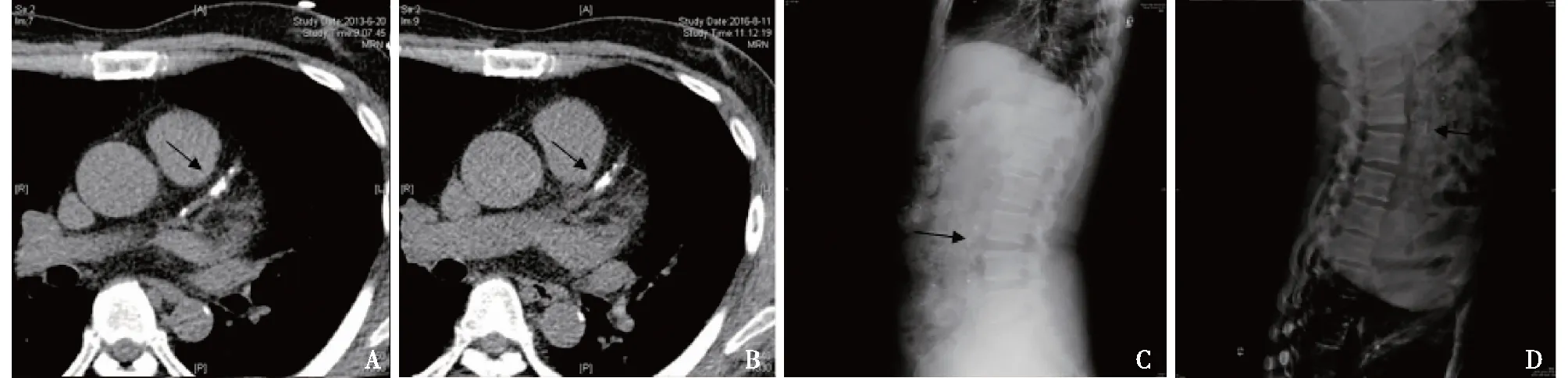
图4 患者B冠状动脉CT检测冠状动脉钙化和腹部侧位片检测腹主动脉钙化情况(A、C:2013年,B、D:2016年)
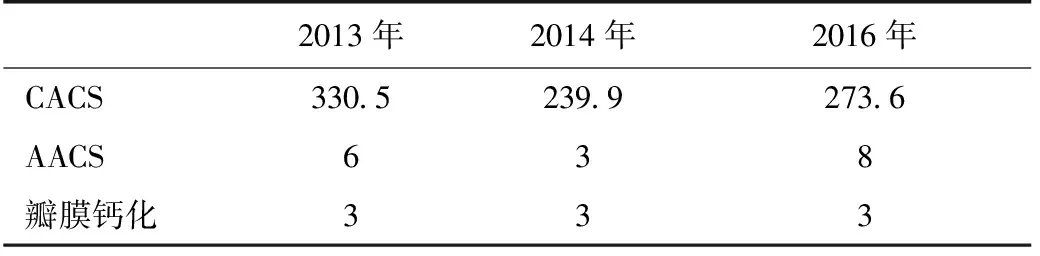
表4 患者B随访期间CAC、AAC、心脏瓣膜钙化积分情况
CAC:冠状动脉钙化;AAC:腹主动脉钙化;CACS:冠状动脉钙化积分;AACS:腹主动脉钙化积分
诊疗分析两例长期MHD患者,在临床随访过程中发现两者在心血管钙化方面存在显著差异,患者A存在多处心血管钙化,且钙化积分值逐渐上升,患者B心血管钙化积分较低,且相对稳定,未进行性升高。回顾性分析两者临床指标及诊治情况,发现如下特征:
共同点:两例均为MHD患者,在透析充分性、营养状况、贫血、血压控制等方面均达标,均未合并糖尿病、血脂异常、吸烟、超重等经典心血管疾病危险因素。
不同之处:患者A透析龄相对短,年龄轻,而患者B透析龄相对较长,近20余年,且年龄相对患者A而言较大;两者在钙、磷、PTH等指标控制方面有着明显的差异,患者A长期随访持续高钙、高磷、PTH进行性升高,长期服用含钙磷结合剂及骨化三醇,形成恶性循环,高钙、高磷无法纠正,继发性甲状旁腺功能亢进持续进展,偶有皮肤瘙痒、骨痛等症状;而患者B无明显皮肤瘙痒、骨痛等表现。
透析龄是CKD 5D期患者心血管钙化危险因素之一,但透析龄相对较短的患者A心血管钙化积分明显高于透析龄较长的患者B。通过上述比较分析发现,两者在CKD-MBD相关血清学指标控制方面存在明显差异;结合患者相关血清学指标及临床诊治经过,考虑高钙、高磷、高PTH在患者A的心血管钙化进程中起着重要的推动作用。
讨 论
近年来,随着肾脏替代治疗技术的发展与普及,如何早期诊断和处理好CKD患者的各种并发症已经成为影响其生命和生活质量的主要因素。CKD-MBD是CKD患者常见并发症之一,CKD 5D期患者发病率更高,而心血管钙化问题尤其突出,导致患者全因和心血管死亡率明显增加[3]。有研究显示,长期接受血液透析的患者,冠状动脉钙化发生率高达90%[3]。
CKD-MBD的病理生理机制早在1943年,我国刘世豪和朱宪彝两位教授率先在国际上提出了肾性骨营养不良的概念[4],随着对CKD病理生理机制研究的深入,肾脏病学家开始认识到这些患者骨骼成分和结构的改变,往往与钙磷代谢、继发性甲状旁腺功能亢进和血管及软组织钙化同时存在。2005年改善全球肾脏疾病预后组织(KDIGO)召开专题讨论会,将这一组病理生理改变命名为CKD-MBD。明确指出它是慢性肾功能不全引起的一组综合征,可表现为钙、磷、PTH和(或)维生素D代谢异常;骨转换、骨矿化、骨容积、骨线性生长或骨强度异常,或者血管、心脏瓣膜和其他软组织的钙化[5]。
随着CKD病情进展,患者的肾小球滤过率进行性下降,导致肾脏磷的清除减少,血磷升高,随之机体出现一系列连锁病理生理反应来应对高血磷,进而构成CKD-MBD发生和发展的恶性循环;血磷的升高将刺激PTH和成纤维细胞生长因子23(FGF-23)分泌增加,尽管PTH会增加1α羟化酶的活性,但FGF-23及高磷均会抑制1α羟化酶的活性,总体效应是1α羟化酶水平及活性下降,使1,25(OH)2VitD3生成减少,导致肠道和肾脏近曲小管对钙的吸收下降,血钙水平降低。高PTH还会促进成骨细胞活性,增加破骨细胞数量,最终使骨钙和磷释放入血,导致纤维性骨病,骨量和骨强度下降,骨折风险增加。同时高磷血症和高PTH会促使血钙平滑肌细胞向成骨样细胞转化,引起血管钙化,心脏瓣膜钙化和软组织钙化增加CKD患者心力衰竭和心血管死亡风险,严重影响患者生活质量。其中,高磷血症是始动因素,但其后续的一系列改变,都可以增加CKD患者,尤其是透析患者骨折、心力衰竭、心血管死亡或全因死亡等严重临床事件的风险[6]。
CKD患者心血管钙化的危险因素近年来,有研究表明[7],血管钙化形成过程是一个与骨发育相似的主动地、可逆的、高度可调控的生物学过程。主要特征是血管平滑肌细胞发生骨样变化的主动调节。心血管钙化是CKD高发且后果严重的并发症,与心血管疾病发病率、病死率密切相关,经典心血管疾病的危险因素有:高龄、高血压、糖尿病、吸烟、超重、血脂异常、高尿酸等[8];但这些并不能完全解释CKD患者心血管钙化的高发病率,CKD特征性的危险因素如:透析龄、钙磷代谢异常、继发性甲状旁腺功能亢进、慢性炎症状态等,是CKD患者心血管事件发生的更为重要因素[9]。尤其是高磷血症是血管钙化的独立危险因素,与CKD患者的病死率呈正相关。血磷每上升0.32 mmol/L,相对死亡危险性增加6%[10]。
现今有许多方法用于评估心血管钙化。目前临床中CACS通过多层螺旋CT(Agatston法[1])检测,AACS通过腹部侧位片(Kauppila法[2])检测;心脏超声检测二尖瓣、主动脉瓣钙化。
CKD-MBD的治疗进展
控制高磷血症 KDIGO指南建议[11],CKD 5D期患者血磷水平超过目标值时,饮食控制是基础。建议限制每日磷摄入量为800~1 000 mg。建议选择磷吸收率低,磷/蛋白比值低的食物,如肉类中选择牛羊肉,鸡胸肉等,限制摄入含有大量磷酸盐添加剂的食物,如咖啡、碳酸饮料、香肠、咖喱粉等。充分透析,调整透析方案。CKD 5D期患者应首先达到充分透析,若血磷水平仍超过正常值,HD患者可考虑增加透析频率和延长透析时间增加血磷的清除。磷结合剂的使用,食物是磷的主要来源,磷结合剂可在胃肠道中结合食物中的磷,减少磷的吸收,从而降低血磷,与不含钙磷结合剂相比,含钙磷结合剂引起血管钙化的危险性更高。当存在以下情况时,建议选择非含钙磷结合剂降磷治疗:(1)CKD 5D期伴高磷血症,血清校正钙>2.5 mmol时;(2)CKD 5D期患者伴高磷血症,血清校正钙<2.5 mmol/L,予足量含钙磷结合剂后(钙元素量1 500 mg),血清磷仍高于目标值;(3)CKD 5D期患者伴高磷血症,同时伴血管钙化,和(或)iPTH持续降低(低于正常上限的2倍)和(或)低转运骨病。非含钙的磷结合剂如碳酸镧、司维拉姆,可降低血磷而不升高血钙,减轻钙负荷,减少肠道钙吸收。本例患者B长期口服非含钙磷结合剂,严格限制饮食磷摄入,血钙、磷持续达标,心血管钙化无明显进展;而患者A长期口服碳酸钙、骨化三醇,未严格控制饮食磷摄入,血磷长期不达标,血钙持续高于上限,iPTH进行性升高。钙-磷-PTH不是相互独立的,能够有效治疗其中一种而对其他指标控制无效的疗法可能不会带来净获益。如活性维生素D会降低PTH但提高血清磷、血清钙水平,含钙磷结合剂可降低血磷,但会带来钙负荷的增加。
控制甲状旁腺功能亢进(SHPT) CKD 5D期患者出现SHPT时,应首先控制血磷及血钙水平达标[11]。如果通过控制血钙和血磷水平后,患者的iPTH水平仍不能达标,应合理应用维生素D,使PTH控制在合适的范围,对于严重的继发性甲状旁腺功能亢进,可行甲状旁腺部分切除术;另外,拟钙剂可增加CaR活性,降低钙磷和PTH水平,从而对血管钙化起到保护作用[11]。患者A长期高钙、高磷,iPTH进行性升高,但仍持续口服骨化三醇抑制SHPT,效果不佳,形成恶性循环,高钙、高磷无法纠正,继发性甲状旁腺功能亢进持续进展,且随访心血管钙化进行性加重。虽目前未出现心血管事件,但有研究显示,心血管钙化是心血管事件的独立危险因素,应警惕该例患者心血管事件的发生。
血管钙化的防治 对合并血管钙化的高磷血症患者,建议使用非含钙磷结合剂。对高钙血症持续存在的高磷血症患者,不建议使用含钙磷结合剂。防治继发性甲状旁腺功能亢进应避免长期大剂量使用活性维生素D及其类似物,引起体内维生素D水平过高或过度抑制iPTH水平。治疗过程中应注意监测血清学指标,避免高钙或高磷血症的发生[11]。本文中患者B相较于患者A透析龄长,但临床控制血钙、血磷、iPTH持续达标,长期随访结果显示血钙钙化进展缓慢。
近来,国外有研究资料表明[12-14],肾移植能减缓、阻止血管钙化进展。其机制可能是恢复肾功能及血清钙调节蛋白水平、调节矿物质代谢、炎症指标的下降、清除血管钙化相关因子,改善肾性贫血、脂质代谢紊乱、肾性骨营养不良等。
小结:两例患者的临床随访观察结果显示,在CKD-MBD相关指标控制不佳时,透析患者的心血管钙化会快速进展,如患者A长期高钙、高磷、高iPTH,心血管钙化进行性加重;而患者B长期持续控制血钙、磷、iPTH等指标达标,心血管钙化进展一定程度上得到了遏制。在临床工作中,针对CKD患者,应早期、持之以恒、有效地对CKD-MBD相关指标控制达标。随着透析技术不断发展,透析患者的生存期逐渐延长,应提高对CKD-MBD的进一步认知,减少心血管钙化发生率,从而降低心血管事件发生率,提高血液透析患者的生活质量,延长其生存期。
1 Agatston AS,Janowitz WR,Hildner FJ,et al.Quantification of coronary artery calcium using ultrafast computed tomography.J Am Coll Cardiol,1990,15(4):827-832.
2 Kauppila LI,Polak JF,Cupples LA,et al.New indices to classify location,severity and progression of calcific lesions in the abdominal aorta:a 25year followup study.Atherosclerosis,1997,132(2):245-250.
3 Block GA,Klassen PS,Lazarus JM,et al.Mineral metabolism,mortality,and morbidity in maintenance hemodialysis.J Am Soc Nephrol,2004,15(8):2208-2218.
4 Moorthi RN,Moe SM.Recent advances in the noninvasive diagnosis of renal osteodystrophy.Kidney Int,2013,84(5):886-894.
5 Kidney Disease:Improving Global Outcomes(KDIGO)CKD-MBD Work Group.KDIGO clinical practice guideline for the diagnosis,evaluation,prevention,and treatment of Chronic Kidney Disease-Mineral and Bone Disorder(CKD-MBD).Kidney Int Suppl,2009,(113):S1-130.
6 刘志红,李贵森.重视慢性肾脏病-矿物质和骨异常的诊断和治疗.肾脏病与透析肾移植杂志.2013,22(6):501-503.
7 Fang Y,Ginsberg C,Sugatani T,et al.Early chronic kidney disease-mineral bone disorder stimulates vascular calcification.Kidney Int,2014,85(1):142-150.
8 Fujii H,Joki N.Mineral metabolism and cardiovascular disease in CKD.Clin Exp Nephrol,2017,21(Suppl 1):53-63.
9 Nigwekar SU,Wenger J,Thadhani R,et al.Hyponatremia,mineral metabolism,mortality in incident maintenance hemodialysis patients:a cohort study.Am J Kidney Dis,2013,62(4):755-762.
10 Shobeiri N,Adams MA,Holden RM.Phosphate:an old bone molecule but new cardiovascular risk factor.Br J Clin Pharmacol,2014,77(1):39-54.
11 KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease.KidneyInt Suppl,2013,3(1):19-62.
12 D′Marco L,Bellasi A,Mazzaferro S,et al.Vascular calcification,bone and mineral metabolism after kidney transplantation.World J Transplant,2015,5(4):222-230.
13 Bargnoux AS,Dupuy AM,Garrigue V,et al.Evolution of coronary artery calcifications following kidney transplantation:relationship with osteoprotegerin levels.Am J Transplant,2009,9(11):2571-2579.
14 Abedi SA,Tarzamni MK,Nakhjavani MR,et al.Effect of renal transplantation on coronary artery calcification in hemodialysis patients.Transplant Proc,2009,41(7):2829-2831.
Hyprecalcemia、hyperphosphatemia、hyperparathyroidismandcardiovascularcalcificationinmaintenancehemodialysispatients
CHENPeiling,GongDehua
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Two middle-aged men with maintenance hemodialysis,with no significant differences in dialysis adequacy,anemia and nutritional status,has sharp contrast in the control of calcium,phosphate and iPTH.The calcium,phosphate and iPTH of the patient A continued to be higher than the upper limit,while the older patient B with longer vintage keep continuous qualified serum level of calcium,phosphate and iPT.After a long-term follow-up,comparing the cardiovascular calcification of the two patients,the patient B experienced slow progression of cardiovascular calcification,while the patient A with severe cardiovascular calcification,and progressed rapidly.
chronic kidney disease-mineral and bone disorder cardiovascular calcification
2017-08-31
(本文编辑 律 舟)
10.3969/j.issn.1006-298X.2017.05.022
南京大学医学院附属金陵医院(南京总医院) 硕士研究生(陈佩玲)国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)

