甲状旁腺癌8例的诊治及围术期PTH、Ca水平分析
谭 屾,崔爱民,柏 楠,张自琴
(北京积水潭医院普通外科,北京 100035;*通讯作者,E-mail:tanpaula@163.com)
甲状旁腺癌8例的诊治及围术期PTH、Ca水平分析
谭 屾*,崔爱民,柏 楠,张自琴
(北京积水潭医院普通外科,北京 100035;*通讯作者,E-mail:tanpaula@163.com)
目的 总结甲状旁腺癌(PTC)的诊治体会,分析围手术期甲状旁腺激素(PTH)、血钙(Ca)变化。 方法 回顾性分析北京积水潭医院普通外科2009-02~2017-03期间收治8例PTC患者临床资料。 结果 8例患者均有原发性甲状旁腺功能亢进症的表现,PTH升高者占100.0%,血Ca升高占87.5%,血磷降低占100%,碱性磷酸酶升高占87.5%。术前8例影像学检查均发现肿物,且其定位与术中定位相符;8例均行首次手术治疗,其中4例行甲状旁腺肿瘤切除+同侧腺叶全切或部分切除术,另外4例加行中央区淋巴结清扫术,有1例于术后3年复发,再次手术。肿物切除后30 min及术后1,3,7 d血PTH值与术前相比,差异均有统计学意义(P<0.01);肿物切除后30 min及术后1,3,7 d血Ca值与术前相比,差异均有统计学意义(P<0.01)。 结论 PTC诊断应结合临床表现、影像资料、实验室资料、术中探查、术后病理等综合分析。手术应完整切除肿瘤,复发者可再手术治疗。术中肿物切除后30 min血PTH及血Ca的变化明显,可作为手术切除的监测指标,术后2 d内低钙血症发生率高,需重视治疗。
甲状旁腺癌; 原发性甲状旁腺功能亢进; 甲状旁腺激素; 血钙
原发性甲状旁腺功能亢进(primary hyperparathyroidism,PHPT)是一种较常见的内分泌疾病,是由于甲状旁腺腺瘤、增生、腺癌等引起的甲状旁腺激素(parathyroid hormone,PTH)分泌过多,造成钙、磷和骨代谢紊乱,继而引起全身多脏器病变。其中,甲状旁腺癌(parathyroid carcinoma,PTC)仅占PHPT的1%左右[1],是一种罕见的内分泌系统恶性肿瘤。随着检验水平和人们对该病重视程度的提高,发病率逐年升高,但仍有很多方面诊治欠规范,且国内围手术期血PTH、血钙(Ca)具体数值变化的分析资料较少。现回顾性分析北京积水潭医院2009-02~2017-03期间收治的8例PTC患者的临床资料,总结诊治体会,着重分析围手术期血PTH及Ca的变化,以供临床参考。
1 资料和方法
1.1 一般资料
北京积水潭医院2009-02~2017-03收治PHPT患者共170例。其中PTC患者8例,占4.7%。男4例,女4例,男女比例为1 ∶1,年龄23-78岁,平均年龄46.5岁。
1.2 临床表现
病程为6个月至9年,平均病程3.4年。主要临床表现:关节疼痛(双下肢为主)、乏力8例;恶心、呕吐、纳差1例。伴肾结石2例,病理性骨折2例。查体:触及颈部肿块5例,肿块均随吞咽活动。
1.3 统计学方法
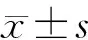
2 结果
2.1 实验室检查
术前血PTH、血钙、血磷、血AKP水平见表1。术前血PTH值升高者占100.0%(8/8);术前血Ca值升高者占87.5%(7/8);术前血磷(P)值降低者占100%(8/8);术前碱性磷酸酶(AKP)值升高者占87.5%(7/8)。
表1PTC患者8例术前血PTH、血Ca、血P、血AKP结果
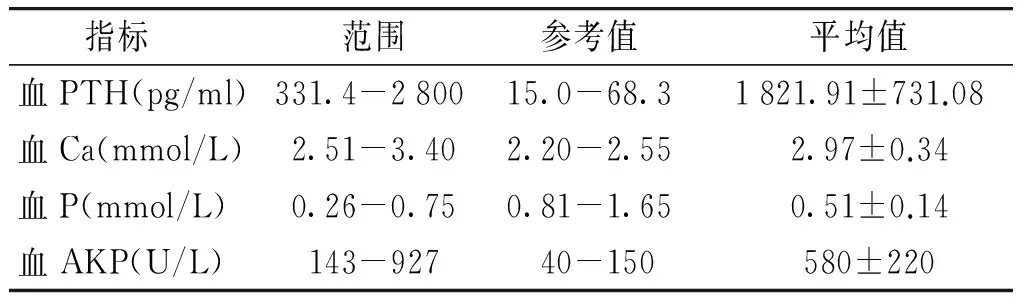
指标范围参考值平均值血PTH(pg/ml)331.4-2800 15.0-68.31821.91±731.08血Ca(mmol/L)2.51-3.402.20-2.55 2.97±0.34血P(mmol/L)0.26-0.750.81-1.65 0.51±0.14血AKP(U/L)143-927 40-150 580±220
2.2 影像学检查
术前8例均行甲状旁腺B超,颈部CT平扫,锝-甲氧基异丁基异腈(99Tcm-MIBI)甲状旁腺双时相扫描:均发现肿物,且其定位与术中定位相符。行锝-亚甲基二膦酸盐(99TcmMDP)全身骨扫描8例,均表现为全身代谢性骨病特征。8例患者均行骨密度检查,均提示骨质疏松。8例均行泌尿系B超检查,2例发现泌尿系结石。
2.3 手术情况
8例均行首次手术治疗,术中发现肿瘤位于左上甲状旁腺1例,左下甲状旁腺3例,右下甲状旁腺4例,其中1例右下PTC患者,同时合并左上甲状旁腺腺瘤。4例行甲状旁腺肿瘤切除+同侧腺叶全切或部分切除术;4例加行中央区淋巴结清扫术。术中见肿瘤质地质韧或质硬,实性为主;肿瘤直径2.0-4 cm,平均直径2.9 cm。瘤湿重1.5-11.2 g,平均瘤湿重6.66 g。肿瘤剖面呈棕灰或灰白色6例,2例呈棕红色。有1例于术后3年肿瘤复发,再次手术。
2.4 围术期PTH变化
分别计算术前、肿物切除后30 min及术后1 d,3 d,7 d静脉血PTH水平,术后各时点PTH水平与术前相比,差异均有统计学意义(P<0.01,见表2)。
2.5 围术期血Ca变化
分别计算术前、肿物切除后30 min及术后1 d,3 d,7 d静脉血钙水平,术后各时点血Ca水平与术前相比,差异均有统计学意义(P<0.01,见表2)。
表2围术期血PTH及血Ca变化
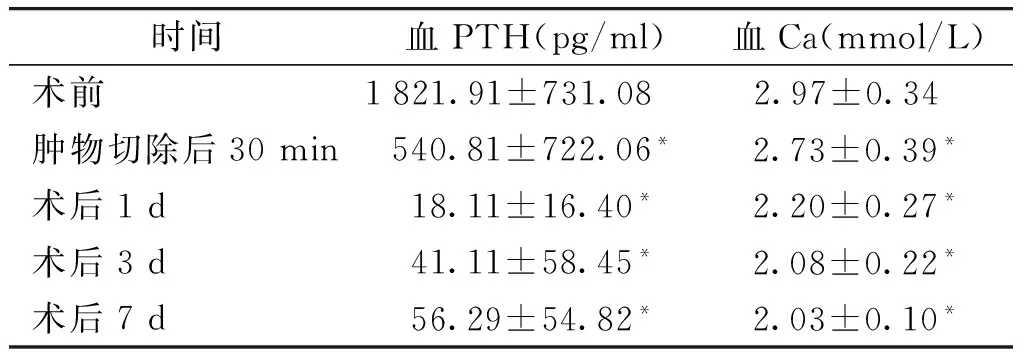
时间血PTH(pg/ml)血Ca(mmol/L)术前1821.91±731.08 2.97±0.34 肿物切除后30min540.81±722.06*2.73±0.39*术后1d18.11±16.40*2.20±0.27*术后3d41.11±58.45*2.08±0.22*术后7d56.29±54.82*2.03±0.10*
与术前比较,*P<0.01
2.6 术后结果及随访
8例手术均成功,术后出现四肢及口唇麻木7例(87.5%),抽搐0例,及时给予钙剂及骨化三醇治疗,短期均缓解。本组8例患者均获随访,随访时间6个月-8年,平均16个月。1例术后3年肿瘤复发,行再次手术治疗,患者随访至今无复发。
3 讨论
甲状旁腺癌是非常少见的恶性肿瘤之一。自1904年De Quervai首次报道甲状旁腺癌以来,英文文献共报道甲状旁腺癌不到1 000例[2]。Koea等[3]报道良性PHPT多发于女性,男女比例为1 ∶4。而PTC的男女发病率相近。PTC平均发病年龄一般较良性PHPT年轻10岁,有文献报道在44-54岁之间[4]。本组男女比例为1 ∶1,平均发病年龄46.5岁,与文献报道相符。甲状旁腺癌发病原因目前尚不清楚,可以是散发,亦可能是遗传综合征的一部分。有报道与甲状旁腺癌有关的遗传综合征包括甲状旁腺功能亢进症-下颌肿瘤综合征(HPT-JT),MEN1,MEN2A和孤立的家族性甲状旁腺功能亢进症[5]。有学者回顾性研究报道,甲状旁腺癌的发生与曾有甲状腺癌和甲状旁腺瘤病史有关[6]。而且有研究报道甲状旁腺癌可以与甲状旁腺瘤和甲状旁腺增生同时或先后发生[7]。但没有直接证据表明甲状旁腺癌是由这些良性病变转化而来。本研究有1例PTC同时合并甲状旁腺腺瘤。
临床上PTC患者,除少数无症状外,多表现为甲状旁腺功能亢进[8,9],具体表现为高钙低磷血症和高甲状旁腺素血症,以及由此引起的组织损伤和代谢性疾病。PTC导致的高血钙症状通常比良性甲状旁腺肿瘤导致的高血钙症状更为严重。临床上主要表现为肾脏和骨骼受累的症状。肾脏受累主要表现为多尿、肾绞痛、肾钙化和肾结石。骨骼表现主要为骨痛、骨质疏松和病理性骨折。无功能的甲状旁腺癌主要表现为肿瘤增大导致的压迫症状,如侵犯喉返神经导致的声音嘶哑。40%-70%的甲状旁腺癌在体格检查时颈部能够触到肿块[10]。本研究8例均伴有骨痛,其中伴肾结石2例,病理性骨折2例,5例可触及颈部肿物。
PTC患者PTH、血Ca及AKP异常升高,血P降低。PTH异常增高,常比正常高值高3-10倍,血Ca明显升高,常高于3.5 mmol/L[11],AKP也较PHPT者明显升高[12]。本组患者PTH较正常高值增高明显,平均1 821.9 pg/ml。本组血Ca平均值为2.97 mmol/L,较正常值明显增高。本组AKP同样增高明显。
由于PTC与甲状旁腺良性肿瘤均表现为原发性甲状旁腺机能亢进,因此术前确诊甲状旁腺癌是非常困难的。甲状旁腺癌的诊断通常是结合术前临床表现、术中探查和术后病理学检查来确诊。但手术前进行影像学的检查从而对肿瘤进行定位是需要的。几种方法联合能够提高检查的敏感性和准确性。一般建议至少两种方法联合,如颈部超声和99mTc放射性扫描等。影像学检查通常有助于发现和定位肿瘤,但对于判断肿瘤的良恶性意义不大[13]。本研究8例均进行术前影像学定位分析,且影像学定位与术中定位相符。
国外术中监测主要包括放射引导和PTH监测等[14]。PTH的代谢半衰期<5 min,可迅速反映病灶是否准确切除[15]。有研究表明依靠术中PTH监测评价手术效果的错误率约为1.4%,且其与PTH降低比例呈负相关[16]。国内关于围手术PTH具体数值的文献较少。本研究发现肿物切除后PTH便明显下降,以肿物切除30 min后为观察点,PTH较术前明显下降(P<0.01),所有病例术后1周内会维持较低水平,但观察到术后第3天略有回升,部分病例会高于正常值,然后逐渐下降至正常值范围内。术中PTH监测时间点多有争论,国内有学者[17]以PTHPT病人为研究对象,认为术中肿物切除后10 min PTH的变化明显,适宜作为监测指标。结合本研究及出于对手术时间和病人创伤的考虑,取肿物切除前及切除后30 min血PTH已足够作为手术是否成功切除的观察指标,其下降的比例具有明显临床意义。
本研究8例患者术后血Ca均降至正常或以下。本研究发现肿物切除后血Ca便下降,以肿物切除30 min后为观察点,血Ca较术前明显下降(P<0.01)。术后部分患者会出现一过性低血钙(术后第1天3例出现,术后第2天7例出现),及时发现并治疗,一般2周内恢复正常,症状不明显。有学者发现术后低钙的发生与术前的临床表现是相关的,骨型症状明显的病人,术后发生低钙的概率较大,而无症状型术后发生低钙的概率较小,考虑这与骨型病人的明显“骨饥饿综合征”相关[17]。笔者认为单纯大剂量的静脉补钙效果欠佳,应合并口服钙剂及维生素D类药物治疗,一般2 d内便出现低血钙,需把握好补钙时机。
术前针刺细胞学检查(FNA)并不推荐,因为通过细胞学形态很难区分甲状旁腺肿瘤的良恶性[18]。PTC手术中肉眼观察,通常是单发的,常发生于甲状旁腺的左或右下叶,肿瘤一般较大,平均直径大小为3 cm,重2-10 g,肿瘤颜色一般是浅灰色到白色,肿瘤通常是坚硬的。本研究术中见肿瘤质地质韧或质硬,实性为主;肿瘤平均直径2.9 cm,平均瘤湿重6.66 g。肿瘤剖面呈棕灰或灰白色6例,2例呈棕红色。有学者[19]提出,出现下述情况提示是甲状旁腺癌:①肿瘤中有形成小梁结构的纤维组织带;②包膜浸润;③侵犯血管;④肿瘤细胞内存在有丝分裂活动。但是上述情况并不是PTC所特有的,甲状旁腺良性肿瘤亦可能出现以上表现,故PTC的诊断需要结合病理学与临床资料。
肿瘤完整切除是PTC目前唯一有效的治疗方法[20],多数患者可获得临床治愈。多数学者认为,应完整切除包括肿瘤在内的同侧甲状腺、同侧中央组淋巴结及周围被侵犯组织,术后复发病例仍应积极考虑再次手术。本研究4例行甲状旁腺肿瘤切除+同侧腺叶全切或部分切除术;4例加行中央区淋巴结清扫术。其中有1例于术后3年肿瘤复发,再次手术。
与其他恶性肿瘤相比,甲状旁腺癌的预后较好,研究显示甲状旁腺癌的总体生存率为85%左右,5-10年的生存率约为49%-77%,术后死亡病例直接死亡原因多为心脑血管意外、肿瘤转移及肿瘤晚期导致的多器官衰竭[22]。但本组术后无死亡病例,可能与样本偏小有关。
综上所述,PTC是一种临床少见的内分泌肿瘤,要求首次手术完整切除肿瘤,以减少局部复发率[8],术后长期、规律监测血清钙水平可以及早发现肿瘤复发或转移[21],以便尽早治疗,提高生存率。
[1] Duan K, Mete Ö. Parathyroid carcinoma:diagnosis and clinical implications [J]. Turk Patoloji Derg,2015,31(Suppl 1):80-97.
[2] Givi B, Shah JP. Parathyroid carcinoma[J]. Clin Oncol (R Coll Radiol), 2010, 22 (6): 498-507.
[3] Koea JB, Shaw JH. Parathyroid cancer: biology and management [J]. Surgoncol,1999,8(3):155-165.
[4] Kleinpeter KP, Lovato JF, Clark PB,etal. Is parathyroid carcinoma indeed a lethal disease?[J]. Ann Surg Oncol,2005,12(3): 260-266.
[5] Sharretts JM, Simonds WF. Clinical and molecular genetics of parathyroid neoplasms[J]. Best Pract Res Clin Endocrinol Metabol, 2010, 24(3): 491-502.
[6] Fallah M, Kharazmi E, Sundquist J,etal. Nonendocrine cancers associated with benign and malignant parathyroid tumors[J]. J Clin Endocrinol Metab, 2011, 96(7): 1108-1114.
[7] Harari A, Waring A, Fernandez-Ranvier G,etal. Parathyroid carcinoma: a 43-year outcome and survival analysis[J]. J Clin Endocrinol Metabol, 2011, 96(12): 3679-3686.
[8] Asare EA, Sturgeon C, Winchester DJ,etal. Parathyroid carcinoma: An update on treatmentoutcomes and prognostic factors from the National Cancer Data Base (NCDB) [J].Ann Surg Oncol, 2015,22(12):3990-3995.
[9] DoCao C, Aubert S,Trinel C,etal. Parathyroid carcinoma:dia-gnostic criteria, classification,evaluation [J]. Ann Endocrinol, 2015,76(2):165-168.
[10] Gao WC, Ruan CP, Zhang JC,etal. Nonfunctional parathyroidcarcinoma[J]. J Cancer Res Clin Oncol, 2010, 136(7): 969-974.
[11] 徐少明.应重视甲状旁腺癌的诊治[J].中华外科杂志,2010,48(17):1281-1284.
[12] Silverberg SJ, Shane E, Jacobs TP,etal. Nephrolithiasis and bone involvement in primary hyperparathyroidism[J]. Am J Med, 1990, 89(3): 327-334.
[13] Patel CN, Salahudeen HM, Lansdown M,etal. Clinical utility of ultrasound and 99mTc sestamibi SPECT/CT for preoperative localization of parathyroid adenoma in patients with primary hyperparathyroidism[J]. Clin Radiol, 2010, 65(4): 278-287.
[14] Stack BC, Moore ER, Belcher RH,etal. Hormone, relationships of parathyroid gamma counts, and adenoma mass in minimally invasive parathyroidectomy[J]. Otolaryngol Head Neck Surg, 2012, 147(6):1035-1040.
[15] Sokoll LJ, Wians FH, Remaley AT. Rapid intraoperative immunoassay of parathyroid hormone and other hormones: a new paradigm for point-of-care testing[J]. Clin Chem, 2004, 50(7): 1126-1135.
[16] Lee S, Ryu H, Morris LF,etal. Operative failure in minimally invasive parathyroidectomy utilizing an intraoperative parathyroidhormone assay[J]. Ann Surg Oncol,2014,21(6):1878-1883.
[17] 张萌,田伟军.71例原发性甲状旁腺功能亢进诊治及PTH、Ca分析[J].天津医科大学学报,2015,21(4):338-341.
[18] Kassahun WT, Jonas S. Focus on parathyroid carcinoma[J]. Int J Surg, 2011, 9(1): 13-19.
[19] Schantz A, Castleman B. Parathyroid carcinoma. A study of 70 cases[J]. Cancer, 1973, 31(3): 600-605.
[20] Diaconescu MR, Glod M,Costea I,etal. Clinicopathological phenotype of parathyroid carcinoma:therapeutic and prognostic aftermaths [J]. Chirurgia (Bucur),2015,110(1):66-71.
[21] Cao C, Dou C, Chen F,etal. An unusual mediastinal parathyroid carcinoma coproducing PTH and PTHrP:a case report [J]. Oncol Lett, 2016, 11(6):4113-4116.
R736.2
A
1007-6611(2017)10-1066-04
10.13753/j.issn.1007-6611.2017.10.019
谭屾,女,1978-11生,博士,住院医师,E-mail:tanpaula@163.com
2017-09-10

