CD36在糖尿病肾病患者肾组织中的表达及调控Wnt/β- catenin信号通路对人肾小管上皮细胞增殖凋亡的实验研究
韩昕健,郝伟,孙秀燕,刘晔,李明明
(枣庄矿业集团中心医院 内分泌科,山东 枣庄 277000)
·论著·
CD36在糖尿病肾病患者肾组织中的表达及调控Wnt/β-catenin信号通路对人肾小管上皮细胞增殖凋亡的实验研究
韩昕健,郝伟,孙秀燕,刘晔,李明明
(枣庄矿业集团中心医院 内分泌科,山东 枣庄 277000)
目的探讨CD36在糖尿病肾病患者肾组织中的表达及调控Wnt/β- catenin信号通路对人肾小管上皮细胞增殖凋亡的影响。方法Western blot检测CD36在糖尿病肾病中的表达;CD36小干扰RNA(CD36- siRNA)和阴性对照(siRNA- NC)转染人肾小管上皮细胞HKC,以空脂质体转染的细胞作为对照组,Western blot检测转染48 h后各组细胞中CD36蛋白表达;将后续实验分为低糖组、高糖组、siRNA- NC+高糖组、CD36- siRNA+高糖组,各实验组细胞培养48 h后,CCK8试验检测细胞增殖,流式细胞术检测细胞凋亡,Western blot检测B细胞淋巴瘤/白血病- 2(Bcl- 2)、Bcl2- Associated X的蛋白质(Bax)、p53、β- 连环蛋白(β- catenin)、细胞周期素D1(CyclinD1)蛋白表达。结果CD36在糖尿病肾病的表达显著高于正常肾组织(P<0.01);CD36- siRNA组CD36蛋白表达水平显著低于对照组(P<0.01);高糖组细胞存活率及Bcl- 2、β- catenin、CyclinD1蛋白表达显著低于低糖组,细胞凋亡率及Bax、p53蛋白表达显著高于低糖组(P<0.01),siRNA- NC+高糖组细胞存活率、细胞凋亡率及Bcl- 2、Bax、p53、β- catenin、CyclinD1蛋白表达与高糖组比较差异无统计学意义(P>0.05);CD36- siRNA组细胞存活率及Bcl- 2、β- catenin、CyclinD1蛋白表达显著高于高糖组,细胞凋亡率及Bax、p53蛋白表达显著低于高糖组(P<0.01)。结论CD36在糖尿病肾病中高表达,高糖能抑制人肾小管上皮细胞HKC的增殖,促进细胞凋亡,而沉默CD36基因的表达能减弱这种效果,其机制与Wnt/β- catenin信号通路的调控有关。
CD36基因; 糖尿病肾病; 人肾小管上皮细胞; Wnt/β- catenin信号通路; 增殖; 凋亡
糖尿病肾病(DN)是1型和2型糖尿病常见的和严重的慢性并发症之一,据统计,有30%~40%的1型糖尿病患者和5%~10%的2型糖尿病患者在终末期会发展为慢性肾功能衰竭,而肾功能衰竭是引起糖尿病患者死亡的重要原因[1- 2]。因此,深入探究引起DN的发病机制并寻找延缓和预防DN的有效措施,对于DN的治疗具有重要意义。
CD36是B族清道夫受体家族细胞表面的一种糖蛋白,可以与多种配体结合发挥生物学作用[3]。已有研究证实CD36参与糖尿病、动脉粥样硬化、胰岛素抵抗等疾病的病理过程, 而CD36在DN中的作用尚不清楚[4- 6]。Wnt信号通路在器官发生、胚胎发育及维持组织器官的稳定等方面发挥重要作用,且有研究显示Wnt/β- catenin信号通路与糖尿病的发生有关[7- 8]。因此,本研究的目的是证实CD36在DN患者肾组织中的表达及调控Wnt/β- catenin信号通路对人肾小管上皮细胞增殖凋亡的影响,以期为DN的治疗研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 组织和细胞 收集枣庄矿业集团中心医院2011年3月至2016年9月DN患者的肾组织石蜡切片,经肾活检病理检查确诊为DN,其中男25例,女15例,平均年龄(54.6±6.2)岁。对照组为2011年3月至2016年9月保存的肾癌患者手术切除的肾脏病灶以远的正常肾组织的石蜡切片,其中男15例,女10例,平均年龄(44.6±7.2)岁,术前肾功能、血糖、尿蛋白均正常,且无心、肝疾病。人肾小管上皮细胞HKC购自上海信裕生物科技有限公司。
1.1.2 试剂和仪器 胎牛血清、胰蛋白酶、青链霉素、RPMI 1640培养基均购自美国Gibco公司;siRNA- NC、CD36- siRNA购自上海生工生物工程有限公司;p53、B细胞淋巴瘤/白血病- 2(B cell lymphoma/lewkmia- 2,Bcl- 2)、Bcl2- Associated X的蛋白质(Bax)、β- 连环蛋白(β- catenin)、细胞周期素D1(CyclinD1)单克隆抗体及辣根过氧化物标记的二抗均购于美国 Abcam公司;CCK- 8细胞增殖试剂盒和BCA蛋白浓度检测试剂盒购自美国Promega生物技术有限公司;Annexin V- FITC凋亡试剂盒及流式细胞仪购自美国BD公司;酶标仪购自美国BIO- RAD公司;倒置荧光显微镜购于日本Olympus公司;CO2细胞培养箱购自美国SIM公司。
1.2 方法
1.2.1 DN患者中CD36的表达检测 将40例DN患者的肾组织及25例肾癌患者肾脏病灶以远的正常肾组织放入预冷的研钵中,在液氮中将组织研磨成粉末。加入适量的裂解液冰上裂解反应30 min,4 ℃、12 000 r·min-1离心5 min,收集上清。按照BCA试剂盒说明测定提取的蛋白浓度。蛋白样品在100 ℃变性3~5 min,取80 μg变性蛋白与上样缓冲液充分混匀,恒压电泳。当行浓缩胶时把电压调成90 V,行分离胶时把电压调成120 V,当电泳至距离分离胶下端约1 cm处时停止电泳。取出凝胶,转膜,转膜完成后用5%的脱脂奶粉封闭2 h,依次加入稀释后的一抗(CD36单克隆抗体,1∶1000稀释)、二抗(辣根过氧化物酶标记的羊抗鼠IgG,1∶1000稀释)中反应后,滴加显色液,转移至暗室中,曝光,以甘油醛- 3- 磷酸脱氢酶(glyceraldehyde- 3- phosphate dehydrogenase,GAPDH)为内参,分析蛋白水平。
1.2.2 细胞培养 取出保存于液氮罐中的人肾小管上皮细胞HKC,水浴锅中溶解,转移融化的冻存细胞至无菌的离心管中,加入37 ℃预热的低糖培养基,1 000 r·min-1离心5 min,再加入含有10%FBS、100 μg·ml-1链霉素和100 U·ml-1青霉素的RPMI1640低糖培养基,1 200 r·min-1离心5 min,去除上清。向细胞沉淀中加入细胞培养液悬浮细胞,接种到细胞培养皿中,置于37 ℃、5%CO2的培养箱中培养。待细胞融合度达到80%以上时,弃去培养液。胰酶消化细胞,细胞收缩变圆后加入完全培养基终止消化,传代。待细胞进入对数生长期后再用于实验研究。
1.2.3 细胞转染 按照2×105个·ml-1的浓度将生长至对数期的细胞接种到6孔细胞培养板中,每孔加2 ml细胞悬浮液,培养过夜。按照对照组(空脂质体转染组)、siRNA- NC组(转染100 nmol·L-1的NC- siRNA)、CD36- siRNA组(转染100 nmol·L-1的CD36- siRNA)的分组进行转染后,放置室温下静置20 min后形成转染复合物。取500 μl转染复合物加入到细胞中,放在37 ℃、5% CO2的培养箱中培养6 h,更换细胞培养液继续培养。
1.2.4 转染效果检测 取转染48 h的1.2.3中各组细胞,按照细胞蛋白提取试剂盒步骤提取细胞中的总蛋白。按照1.2.1方法检测CD36蛋白表达。
1.2.5 实验分组 将实验分为5组:(1)低糖组:细胞中加入5.5 mmol·L-1的葡萄糖;(2)高糖组:细胞中加入25 mmol·L-1的葡萄糖;(3)siRNA- NC+高糖组:细胞中加入100 nmol·L-1的NC- siRNA和25 mmol·L-1的葡萄糖;(4)CD36- siRNA组+高糖组:细胞中加入100 nmol·L-1的CD36- siRNA和25 mmol·L-1的葡萄糖。
1.2.6 CCK- 8 检测细胞增殖 将细胞以每孔200 μl、密度3×103个·ml-1接种到96孔细胞培养板上,细胞贴壁24 h后吸除上清,加入200 μl无血清的培养基再孵育24 h,使细胞同步化。按照1.2.5分组加入各组细胞,每组设置6个重复孔,置于37 ℃、5%CO2的培养箱中培养48 h,每孔加入 CCK- 8试剂10 μl,37 ℃孵育4 h后,酶标仪在490 nm波长处测定并记录各组的吸光度(OD)值。计算细胞增殖率。
1.2.7 流式细胞术检测细胞凋亡 将生长至对数期的细胞以1×106个·ml-1接种于96孔细胞培养板中,细胞培养48 h后按照1.2.5分组加入各组细胞,每组设置6个重复孔,置于37 ℃、5%CO2的培养箱中培养48 h,取1 ml细胞悬液至离心管中,4 ℃、1 000 r·min-1离心5 min,弃上清,两次洗涤细胞后在细胞沉淀中加入200 μl缓冲液,充分混匀后分别加入5 μl 碘化丙锭(PI)和膜联蛋白(Annexin- V),室温避光静置20 min,加300 μl缓冲液,流式细胞仪检测细胞凋亡率。
1.2.8 Western blot检测蛋白表达 取培养48 h的1.2.5分组的各组细胞,按照细胞蛋白提取试剂盒步骤提取细胞中的蛋白。按照1.2.1方法检测Bcl- 2、Bax、p53、β- catenin、CyclinD1蛋白表达。
1.3 统计学处理
所有实验数据采用SPSS 21.0软件进行分析,结果用均数±标准差表示,多组比较采用单因素方差分析,两组比较采用t检验,以P<0.01为差异有统计学意义。
2 结 果
2.1 CD36在DN中的表达
DN肾组织中CD36的蛋白表达显著高于正常肾组织(P<0.01)(图1)。
2.2 CD36- siRNA沉默效果检测
siRNA- NC组CD36蛋白表达水平与对照组比较差异无统计学意义(P>0.05),CD36- siRNA组CD36蛋白表达水平显著低于对照组(P<0.01)(图2)。
2.3 CD36基因对人肾小管上皮细胞HKC增殖的影响
高糖组细胞存活率显著低于低糖组(P<0.01),siRNA- NC+高糖组细胞存活率与高糖组比较差异无统计学意义(P>0.05),CD36- siRNA+高糖组细胞存活率显著高于高糖组(P<0.01)(图3)。
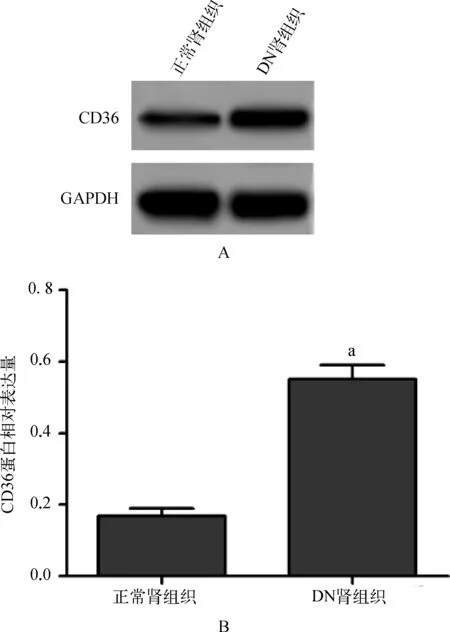
与正常肾组织比较,aP<0.01
A.Western blot检测结果图;B.CD36蛋白相对表达量
图1CD36在DN及正常肾组织中的表达
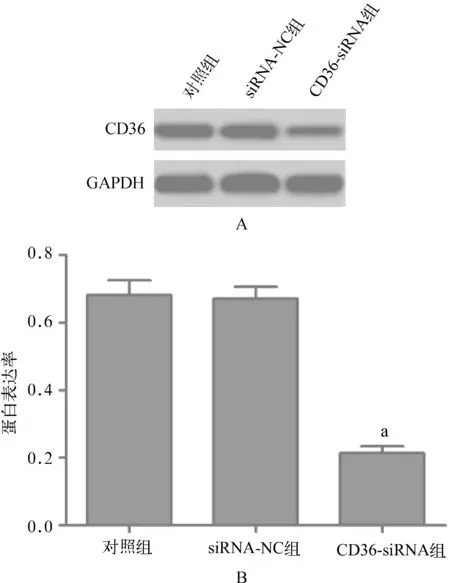
与对照组比较,aP<0.01
A.Western blot检测结果图;B.蛋白表达率
图2转染后各组细胞中CD36蛋白表达水平
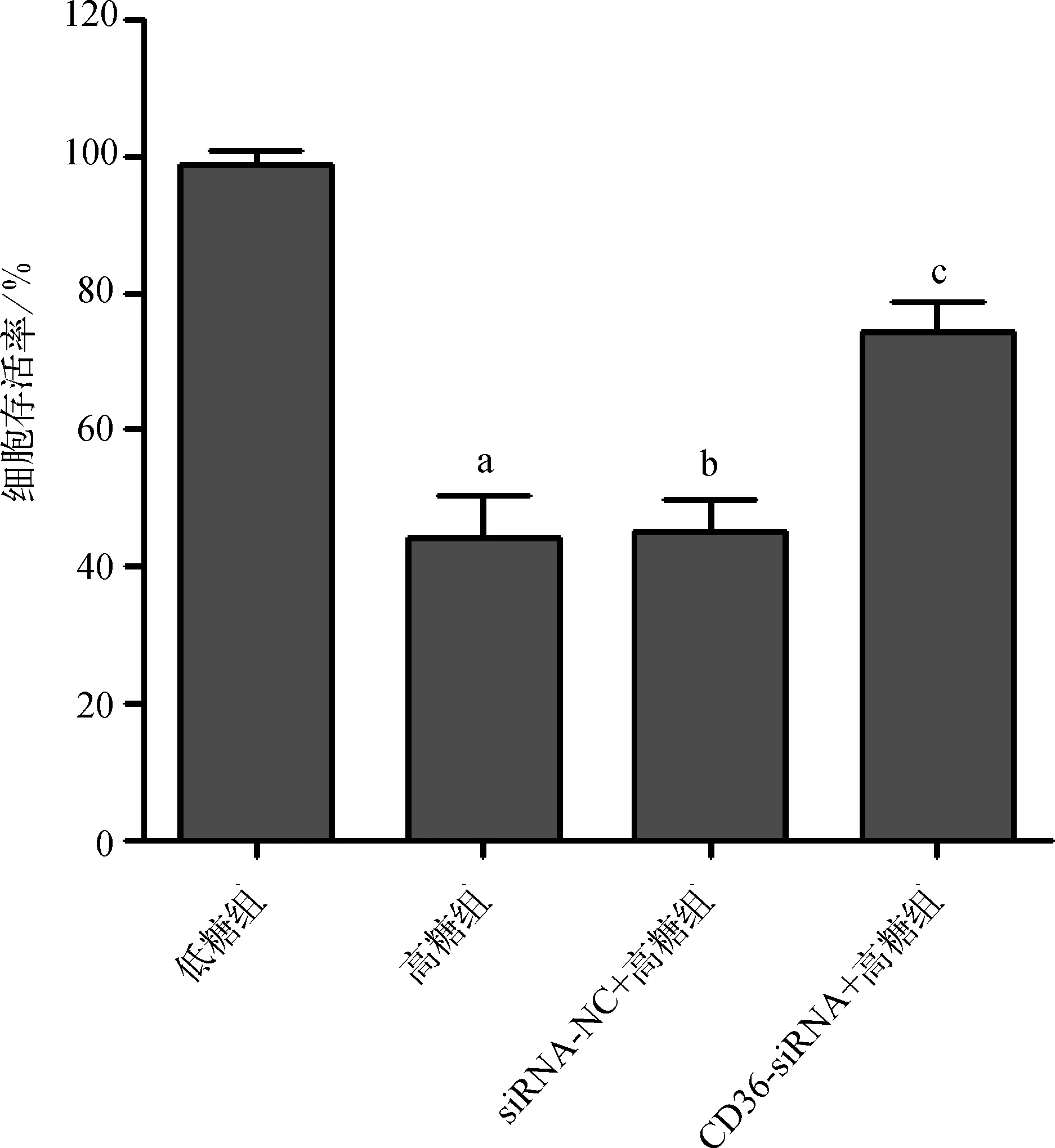
与低糖组比较,aP<0.01;与高糖组比较,bP>0.05,cP<0.01
图3CD36基因对人肾小管上皮细胞HKC增殖的影响
2.4 CD36基因对人肾小管上皮细胞HKC凋亡的影响
高糖组细胞凋亡率及p53和Bax蛋白表达显著高于低糖组,Bcl- 2蛋白表达显著低于低糖组(P<0.01);siRNA- NC+高糖组细胞凋亡率及Bcl- 2、Bax、p53蛋白表达与高糖组比较差异无统计学意义(P>0.05);CD36- siRNA组细胞凋亡率及p53和Bax蛋白表达显著低于高糖组,Bcl- 2蛋白表达显著高于高糖组(P<0.01)(图4)。
2.5 CD36基因对β- catenin、CyclinD1蛋白表达的影响
高糖组β- catenin、CyclinD1蛋白表达显著低于低糖组(P<0.01),siRNA- NC+高糖组β- catenin、CyclinD1蛋白表达与高糖组比较差异无统计学意义(P>0.05),CD36- siRNA组β- catenin、CyclinD1蛋白表达显著高于高糖组(P<0.01)(图5)。
3 讨 论
CD36是一种糖蛋白,位于多种细胞表面,在内皮细胞、脂肪细胞、巨噬细胞等都有表达。其功能包括与TSP- 1等膜蛋白一起诱导细胞凋亡、去除血浆中被氧化的低密度脂蛋白等[9- 10]。有研究指出,CD36的表达可能参与肾组织的损伤[11]。在研究DN的机制中发现CD36的表达伴随肾小管上皮细胞变性及凋亡,高糖刺激可上调CD36的表达[12]。本研究中我们首先确定CD36在DN中的表达,并进一步研究沉默CD36的表达对高糖诱导的人肾小管上皮细胞增殖及凋亡的影响,将实验分为低糖组、高糖组、siRNA- NC+高糖组、CD36- siRNA组+高糖组,结果显示,高糖能诱导人肾小管上皮细胞凋亡,而沉默CD36的表达能减弱这种作用。
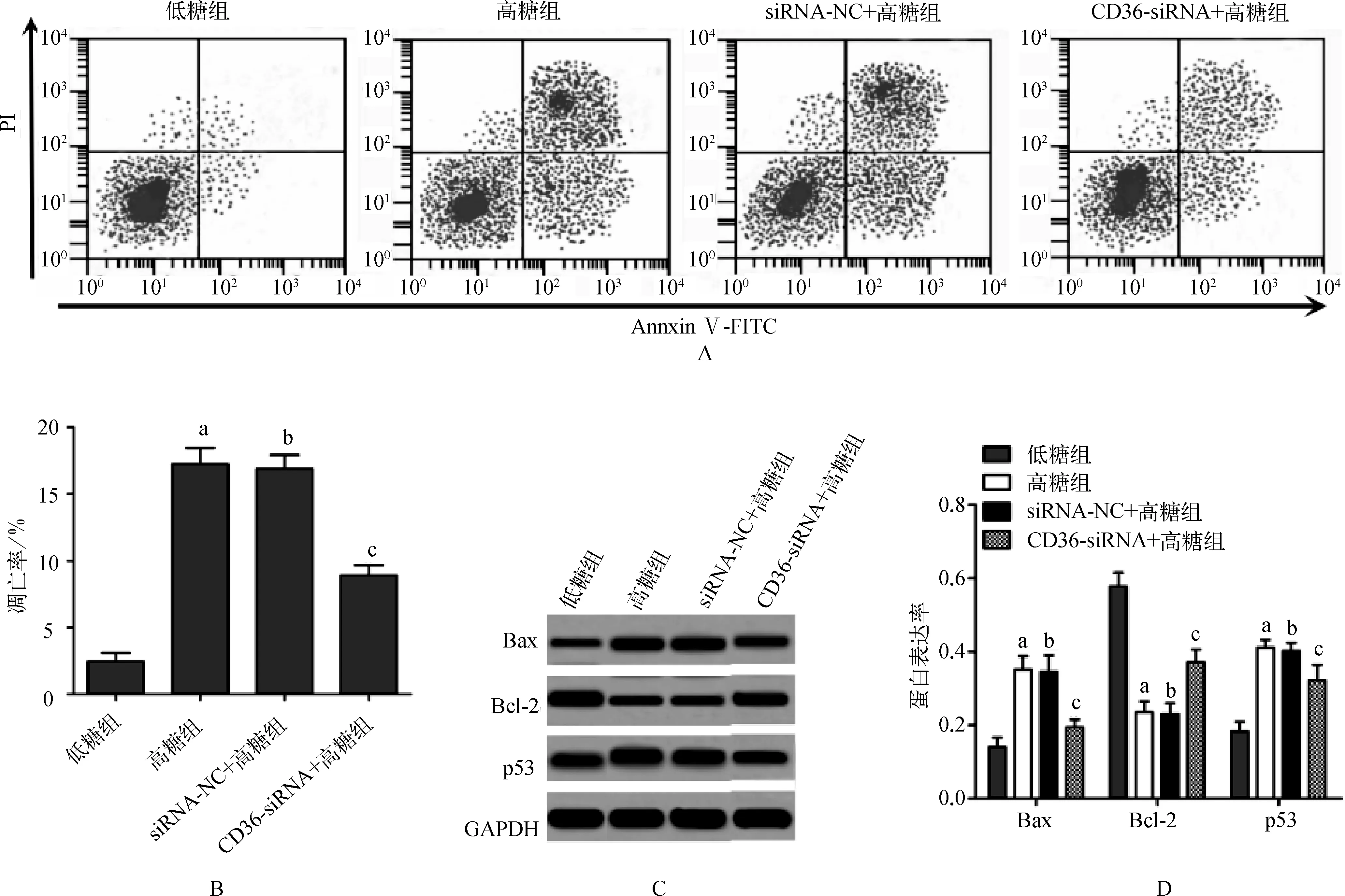
与低糖组比较,aP<0.01;与高糖组比较,bP>0.05,cP<0.01
A.流式细胞术检测结果;B.细胞凋亡率;C.Western blot检测结果图;D.蛋白表达率
图4CD36基因对人肾小管上皮细胞HKC凋亡的影响
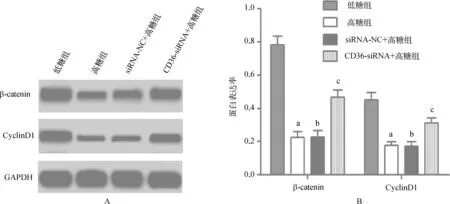
与低糖组比较,aP<0.01;与高糖组比较,bP>0.05,cP<0.01
A.Western blot检测结果图;B.蛋白表达率
图5CD36基因对β-catenin、CyclinD1蛋白表达的影响
细胞凋亡是指机体在一系列基因的调控作用下所引起的细胞的程序性死亡过程,对于维持机体的稳定发挥重要作用。若调控细胞凋亡的机制发生紊乱,可诱导多种疾病的发生[13]。目前证实有多种基因参与调控细胞的凋亡过程。p53可抑制肿瘤发生,参与调控细胞周期、DNA转录过程及一些代谢途径[14]。有研究显示,p53活化后能启动与凋亡相关的基因,从而诱导细胞的凋亡[15]。Bax、Bcl- 2是Bcl- 2家族两个重要的调节蛋白,分别发挥促凋亡和抑凋亡作用。且Bcl- 2/Bax的比例是启动细胞凋亡的关键因素。当两者之间的比率上调时,可抑制细胞凋亡,当两者之间的比率下调时,可诱导细胞的凋亡[16- 17]。本研究中检测p53、Bax、Bcl- 2蛋白表达,结果显示,高糖组p53、Bax蛋白表达显著高于低糖组,Bcl- 2蛋白表达显著低于低糖组(P<0.01),CD36- siRNA组p53、Bax蛋白表达显著低于高糖组,Bcl- 2蛋白表达显著高于高糖组。这说明沉默CD36的表达可通过调控p53、Bax、Bcl- 2蛋白表达抑制细胞凋亡。
Wnt/β- catenin信号通路是研究较多的Wnt信号转导通路的一个分支,当Wnt信号通路被激活时,β- catenin在胞质内积累进而进入细胞核,与核内Tcf/Lef转录因子形成复合体,激活下游的CyclinD1、c- myc等一系列靶基因,当这些靶基因被激活后可对多种基因的表达进行调控,对细胞的增殖、凋亡等过程发挥重要作用[18- 19]。研究显示,在正常肾脏中Wnt信号是静默的,胞质中也仅有很少的β- catenin,当肾发生损伤后可引起肾小管上皮及间质细胞中β- catenin的活化[20]。本研究中检测β- catenin、CyclinD1蛋白表达,结果显示,高糖组β- catenin、CyclinD1蛋白表达显著低于低糖组(P<0.01),CD36- siRNA组β- catenin、CyclinD1蛋白表达显著高于高糖组(P<0.01)。
综上所述,CD36在DN患者肾组织中高表达,高糖能抑制人肾小管上皮细胞HKC的增殖,促进细胞凋亡,而沉默CD36基因的表达能减弱这种效果,其机制与Wnt/β- catenin信号通路的调控有关。本研究为DN的治疗提供了理论依据。
[1] NISHIKAWA T,BROWNLEE M,ARAKI E.Mitochondrial reactive oxygen species in the pathogenesis of early diabetic nephropathy[J].J Diabetes Investig,2015,6(2):137- 139.
[2] MARCHANT V,DROGUETT A,VALDERRAMA G,et al.Tubular overexpression of Gremlin in transgenic mice aggravates renal damage in diabetic nephropathy[J].Am J Physiol Renal Physiol,2015,309(6):F559- F568.
[3] GARCIA- BONILLA L,RACCHUMI G,MURPHY M,et al.Endothelial CD36 contributes to postischemic brain injury by promoting neutrophil activation via CSF3[J].J Neurosci,2015,35(44):14783- 14793.
[4] GAUTAM S,AGRAWAL C G,BANERJEE M.CD36 gene variants in early prediction of type 2 diabetes mellitus[J].Genet Test Mol Biomarkers,2015,19(3):144- 149.
[5] BROWN P M,KENNEDY D J,MORTON R E,et al.CD36/SR- B2- TLR2 Dependent Pathways Enhance Porphyromonas gingivalis Mediated Atherosclerosis in the Ldlr KO Mouse Model[J].PloS One,2015,10(5):e0125126.
[6] STENEBERG P,SYKARAS A G,BACKLUND F,et al.Hyperinsulinemia enhances hepatic expression of the fatty acid transporter CD36 and provokes hepatosteatosis and hepatic insulin resistance[J].J Biol Chem,2015,290(31):19034- 19043.
[7] WANG M T,HOLDERFIELD M,GALEAS J,et al.K- Ras promotes tumorigenicity through suppression of non- canonical Wnt signaling[J].Cell,2015,163(5):1237- 1251.
[8] XI X H,WANG Y,LI J,et al.Activation of Wnt/β- catenin/GSK3β signaling during the development of diabetic cardiomyopathy[J].Cardiovasc Pathol,2015,24(3):179- 186.
[9] TARHDA Z,IBRAHIMI A.Insight into the mechanism of lipids binding and uptake by CD36 receptor[J].Bioinformation,2015,11(6):302- 306.
[10] NATH A,LI I,CHAN C.Elevated uptake of free fatty acids via CD36 promotes epithelial- mesenchymal transition in hepatocellular carcinoma[J].Sci Rep,2015,75(15 Supplement):5157.
[11] PENNATHUR S,PASICHNYK K,BAHRAMI N M,et al.The macrophage phagocytic receptor CD36 promotes fibrogenic pathways on removal of apoptotic cells during chronic kidney injury[J].Am J Pathol,2015,185(8):2232- 2245.
[12] SHIJU T M,MOHAN V,BALASUBRAMANYAM M,et al.Soluble CD36 in plasma and urine:a plausible prognostic marker for diabetic nephropathy[J].J Diabetes Complications,2015,29(3):400- 406.
[13] 陈东.胃黏膜组织 TNF- α 及 iNOS 表达水平与胃炎发病及细胞凋亡的相关性研究[J].东南大学学报:医学版,2016,35(3):370- 373.
[14] 翟雅娜.MK,p53,bcl- 2 在乳腺癌患者中的表达及其相关性分析[J].现代医学,2016,44(12):1702- 1705.
[15] FOLLIS A V,LLAMBI F,MERRITT P,et al.Pin1- induced proline isomerization in cytosolic p53 mediates BAX activation and apoptosis[J].Mol Cell,2015,59(4):677- 684.
[16] 张淑芳,方芳,李琼书,等.FTY720 对乳腺癌 MCF- 7 细胞增殖及 Bax/Bcl- 2 基因表达的影响[J].中国老年学杂志,2015,35(1):141- 143.
[17] ZHAO B,HE T.Chidamide,a histone deacetylase inhibitor,functions as a tumor inhibitor by modulating the ratio of Bax/Bcl- 2 and P21 in pancreatic cancer[J].Oncol Rep,2015,33(1):304- 310.
[18] TAKASE H M,NUSSE R.Paracrine Wnt/β- catenin signaling mediates proliferation of undifferentiated spermatogonia in the adult mouse testis[J].Proc Natl Acad Sci U S A,2016,113(11):E1489- E1497.
[19] LIN X,KONG L N,HUANG C,et al.Hesperetin derivative- 7 inhibits PDGF- BB- induced hepatic stellate cell activation and proliferation by targeting Wnt/β- catenin pathway[J].Int Immunopharmacol,2015,25(2):311- 320.
[20] YANG Z,SUN L,NIE H,et al.Connective tissue growth factor induces tubular epithelial to mesenchymal transition through the activation of canonical Wnt signalinginvitro[J].Ren Fail,2015,37(1):129- 135.
ExpressionofCD36indiabeticnephropathyandregulationofWnt/β-cateninsignalingexperimentalstudyonproliferationandapoptosisofhumanrenaltubularepithelialcells
HANXin-jian,HAOWei,SUNXiu-yan,LIUYe,LIMing-ming
(DepartmentofEndocrinology,CentralHospitalofZaozhuangMiningGroup,Zaozhuang277000,China)
Objective: To investigate the expression of CD36 in diabetic nephropathy and regulation of Wnt/β- catenin signaling experimental study on proliferation and apoptosis of human renal tubular epithelial cells.MethodsThe expression of CD36 in diabetic nephropathy was detected by Western blot; CD36 small interfering RNA (CD36- siRNA) and negative control (siRNA- NC) were transfected into human renal tubular epithelial cells HKC, and empty liposome transfected cells as the control group; the expression of CD36 protein after transfected for 48 h was detected by Western blot; the subsequent experiments were divided into low glucose group, high glucose group, siRNA- NC+high glucose group, and CD36- siRNA+high glucose group, the experimental group cell were cultured for 48 h, cell proliferation was detected by CCK8 test, apoptosis was detected by flow cytometry, the expression of p53, Bax, Bcl- 2, β- catenin and CyclinD1 protein were detected by Western blot.ResultsThe expression of CD36 in diabetic nephropathy was significantly higher than that in normal renal tissue (P<0.01); the expression level of CD36 protein in CD36- siRNA group was significantly lower than the control group (P<0.01); cell survival rate and Bcl- 2, β- catenin and CyclinD1 protein expression in high glucose group was significantly lower than in low glucose group, while the apoptosis rate and the expression of Bax and p53 protein was significantly higher than low sugar group (P<0.01); cell survival rate, apoptosis rate and Bcl- 2, Bax, p53, β- catenin and CyclinD1 protein expression in siRNA- NC+high glucose group compared with high glucose group had no significant difference (P>0.05); the survival rate and Bcl- 2, β- catenin and CyclinD1 protein expressionin in CD36- siRNA+high glucose group was significantly higher than in high glucose group, while the expression of Bax and p53 protein and the apoptosis rate was significantly lower than the high glucose group (P<0.01).ConclusionThe expression of CD36 in diabetic nephropathy is higher, high glucose can inhibit cell proliferation of human renal tubular epithelial cells HKC, promote cell apoptosis , and Silencing the expression of the CD36 gene could attenuate this effect, and its mechanism is related to the regulationof Wnt/β- catenin signaling pathway.
CD36 gene; diabetic nephropathy; human renal tubular epithelial cells; Wnt/β- catenin signaling pathway; proliferation; apoptosis
2016- 11- 24
2017- 06- 23
韩昕健(1983- ),男,山东枣庄人,主治医师,医学硕士。E- mail:qiuqiuli133@126.com
韩昕健,郝伟,孙秀燕,等.CD36在糖尿病肾病患者肾组织中的表达及调控Wnt/β- catenin信号通路对人肾小管上皮细胞增殖凋亡的实验研究[J].东南大学学报:医学版,2017,36(5):704- 710.
Q255;R692.6
A
1671- 6264(2017)05- 0704- 07
10.3969/j.issn.1671- 6264.2017.05.005
(本文编辑:何彦梅)

