灰葡萄孢毒素对产后蒜薹的致病性及其毒素基因的检测
王勇,张春祥,高苇,孔庆学,阎瑞香,张娜
(1.天津市植物保护研究所,天津 300381;2. 天津农学院,天津 300384;3. 国家农产品保鲜工程技术研究中心(天津)/农业部农产品贮藏保鲜重点实验室,天津 300381)
灰葡萄孢毒素对产后蒜薹的致病性及其毒素基因的检测
王勇1,张春祥1,高苇1,孔庆学2,阎瑞香3,张娜3
(1.天津市植物保护研究所,天津 300381;2. 天津农学院,天津 300384;3. 国家农产品保鲜工程技术研究中心(天津)/农业部农产品贮藏保鲜重点实验室,天津 300381)
为明确灰葡萄孢毒素对产后蒜薹的致病性及其毒素基因的检测方法,本研究运用蒜薹灰霉病强致病菌株灰葡萄孢霉BC-3,通过蒜薹悬滴接种法、系统侵染法和毒素浸渍法,测定灰葡萄孢毒素对蒜薹薹条和薹苞组织损伤及细胞叶绿素降解的活性。结果表明,灰葡萄孢毒素是导致产后蒜薹灰霉病的重要因素,可造成蒜薹组织细胞损伤、叶绿素降解,并可由输导组织传导造成蒜薹组织系统侵害。同时建立了灰葡萄孢毒素BcBOT2基因特异性检测方法,可用于其引起的蒜薹灰霉病早期检测。
灰葡萄孢霉;蒜薹;毒素;致病性;毒素基因
由灰葡萄孢霉(Botrytiscinerea)引起的产后蒜薹灰霉病,多在蒜薹入库2~3个月后发生,导致蒜薹烂梢、烂基、断条[1],已成为蒜薹贮藏保鲜的重要限制性因素之一[2]。灰葡萄孢霉常在植物发育早期阶段侵入宿主,并在相当长时间内保持沉默,直到宿主植物生理发生变化有利于其生长时,便快速引发宿主软腐,造成成熟或衰老组织的严重破坏。究其原因是由于植物病原真菌在与宿主植物相互识别、相互作用的过程中所产生的次生代谢产物——真菌毒素导致产后蒜薹灰霉病的发生,而且在致病过程中起着决定因子的作用[3,4]。由灰葡萄孢霉中分离鉴定出的二环倍半萜烯毒素Botrydial毒性最高[5],被认为是致病的关键因素,可引发辣椒、菜豆等黄萎和组织细胞破裂[6],其余多为其前体或衍生物[7]。近年来,合成Botrydial的基因簇及其编码的蛋白序列已经鉴定出来,其中BcBOT2基因负责编码Botrydial合成途径中关键酶——倍半萜合酶[8],敲除BcBOT2基因的灰葡萄孢霉失去合成Botrydial和相关化合物的能力,菌株毒力基本丧失[9]。因此笔者从蒜薹灰霉病菌毒素对产后蒜薹组织的致病作用及毒素BcBOT2基因检测入手,探索灰霉病菌毒素对蒜薹的致病性及其检测方法,为产后蒜薹灰霉病的绿色防控提供依据。
1 材料与方法
1.1供试菌株
产后蒜薹灰霉病强致病力菌株BC-3,经鉴定为灰葡萄孢霉(Botrytiscinerea),由天津市植物保护研究所种苗室分离、鉴定和保存。
1.2产后蒜薹灰霉病菌毒素滤液的制备
试验采用PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂粉18 g,加蒸馏水至1 L)和PD培养液。在250 mL三角瓶中分别加入PD培养液150 mL,共制备30瓶。
将供试蒜薹灰霉病菌BC-3移至PDA培养基上,于25℃下培养4 d,用直径4 mm的打孔器在长势一致的菌落边缘打取菌饼,接种到装有PD培养液的三角瓶中,每瓶接种5块菌饼,在黑暗条件下25℃、120 r/min摇床振荡培养。培养第0、3、6、7、9、12、14、15、18、21 d分别取一瓶培养液,将培养液通过双层灭菌滤纸过滤除去菌丝体和孢子后,用0.22 μm微孔滤膜加压抽滤,获得无菌滤液,即蒜薹灰霉病菌毒素滤液。4℃冰箱中保存备用。
1.3蒜薹灰霉病菌毒素对产后蒜薹组织的致病作用
1.3.1 蒜薹灰霉病菌毒素对蒜薹细胞损伤的活性 采用毒素悬滴接种法。选取同一生长期的蒜薹薹条和薹苞,将其放在铺有两层浸湿滤纸的大培养皿中,在蒜薹薹条和薹苞表面采用接种针制造伤口,悬滴接种20 μL毒素滤液(分别为PD培养第0、3、6、9、12、15、18、21 d菌液毒素)于伤口表面,每处理重复3次,每重复3皿,每皿放入5个蒜薹薹条或薹苞,以接种20 μL无菌水为清水对照。同时用无菌水将毒素滤液稀释10、100倍,以1、10、100倍液分别悬滴接种蒜薹薹条。将处理的蒜薹组织,于25℃培养箱中(光周期为12 h)保湿培养3 d后,调查毒素接种点的细胞损伤情况。
1.3.2 蒜薹灰霉病菌毒素对蒜薹组织系统影响的活性 采用毒素系统侵染法。取各毒素滤液5 mL加入到20 mL烧瓶中,将采集的同一生长期的蒜薹薹条和薹苞一端浸入滤液中,每处理重复3次,以浸入5 mL无菌水为清水对照。25℃培养箱中培养3 d后(光周期为12 h),调查蒜薹薹条和薹苞的黄变程度。蒜薹黄变程度标准为:-,薹条或薹苞无显著变化;+,薹条或薹苞部分失绿;++,薹条或薹苞整体失绿;+++,薹条或薹苞组织变黄。
1.3.3 蒜薹灰霉病菌毒素对蒜薹细胞叶绿素降解的活性 采用毒素浸渍法。取6 mm平皿,分别加入7、14、21 d获得的毒素滤液3 mL,将采集的同一生长期的蒜薹薹条和薹苞切成10 mm苔段,浸入3 mL毒素滤液中,每处理重复3次,以浸入3 mL无菌水为清水对照。25℃培养箱中处理24、48 h后(光周期为12 h),每处理蒜薹组织采用滤纸吸干毒素汁液后,采用10 mL丙酮乙醇溶液(丙酮∶无水乙醇=1∶1,V/V)室温萃取,用紫外可见分光光度计测量OD663和OD645,计算叶绿素含量。毒素会对蒜薹细胞内叶绿素产生影响,通过检测灰霉病菌毒素作用下蒜薹叶绿素降解程度,来确定毒素对蒜薹细胞叶绿素降解的活性。叶绿素含量计算方法:
叶绿素含量(mg/g)=(8.02×OD663+2.02×OD645×V)/(100×W)。
式中:V为毒素滤液体积;W为蒜薹质量。
1.4蒜薹灰霉病菌毒素基因的检测
以灰葡萄孢霉Botrydial毒素BcBOT2基因6 781~8 807 bp区段为模板,采用Primer Premier 5.0软件设计特异性引物(见表1),由金维智公司合成。采用扩增体系:总体系25 μL(Master Mix 12.5 μL,引物F 1 μL,引物R 1 μL,DNA 1 μL,ddH2O 9.5 μL)进行PCR扩增。条件为:94℃预变性5 min;94℃变性45 s,53℃退火45 s,72℃延伸45 s,32个循环后,72℃延伸10 min。PCR产物由金维智公司测序,测序结果在GenBank数据库中进行同源序列搜索比对。同时选取PCR扩增效果较好的引物,分别以蒜薹灰霉病菌BC-3、葱鳞葡萄孢霉、链格孢、青霉P1、青霉P2、粉红单端孢、镰刀菌的DNA为模板进行PCR扩增和电泳以检测引物的特异性。

表1 灰葡萄孢霉Botrydial毒素BcBOT2基因6 781~8 807 bp表达区段的特异性引物
2 结果与分析
2.1蒜薹灰霉病菌毒素对产后蒜薹组织的致病作用
2.1.1 蒜薹灰霉病菌毒素对蒜薹细胞损伤的活性 由毒素悬滴接种试验结果(表2)可知,蒜薹灰霉病菌毒素可导致蒜薹薹条和薹苞细胞损伤,自接种点位置褪绿变黄,并扩展形成病斑,随着培养时间的延长,接种点细胞坏死、黄变、扩展程度逐渐加重,明显造成蒜薹组织细胞损伤,且毒素对蒜薹薹苞的损伤较薹条严重。
由悬滴接种法测定不同稀释浓度毒素滤液对接种点细胞损伤试验结果(表3)可知,由PD培养液培养3~21 d获得毒素滤液,均可导致蒜薹薹条细胞损伤,使蒜薹自接种点位置褪绿变黄,并扩展形成病斑。且随着蒜薹灰霉病菌培养时间的延长,薹条接种点细胞坏死、黄变、扩展程度逐渐加重。毒素滤液稀释后对接种点细胞损伤下降,培养9~21 d毒素滤液稀释10倍仍对蒜薹接种点细胞造成损伤;稀释100倍毒素,仅15~21 d毒素滤液对蒜薹有损伤,且随着稀释倍数的增加,毒素对蒜薹组织细胞损伤明显下降。
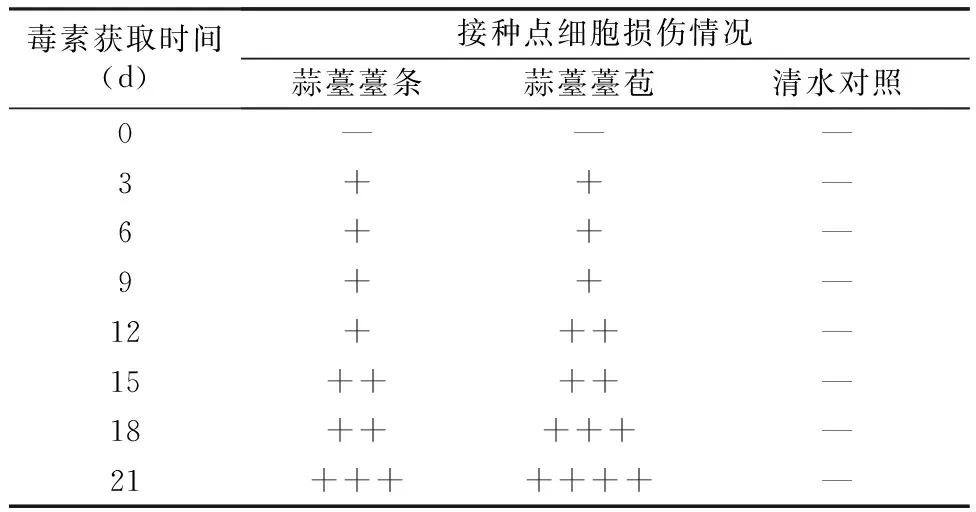
表2 蒜薹灰霉病菌毒素对蒜薹薹条和薹苞接种点细胞损伤的情况
注:“—”,接种点无显著变化;“+”,接种点失绿;“++”,接种点失绿变黄;“+++”,接种点失绿变黄逐步扩展;“++++”,接种点失绿变黄扩展较大。下同。
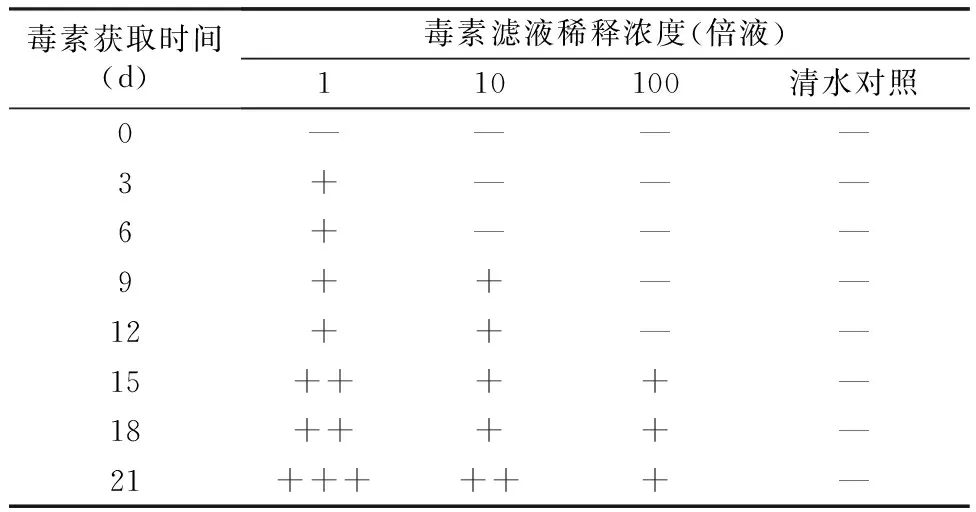
表3 蒜薹灰霉病菌毒素的浓度变化对蒜薹薹条接种点细胞损伤的情况
2.1.2 蒜薹灰霉病菌毒素对蒜薹组织系统损伤的活性 由毒素系统侵染试验结果(表4)可知,蒜薹灰霉病菌毒素可导致蒜薹薹条和薹苞系统损伤,造成薹条和薹苞整体褪绿变黄。说明毒素可通过蒜薹输导系统传导使蒜薹上部发生褪绿、黄化,对蒜薹产生毒性影响。且随着PD培养获取毒素时间的延长,由3~21 d获取毒素导致蒜薹薹条和薹苞系统褪绿、黄变程度逐渐加重,明显造成蒜薹组织系统损伤,且毒素对蒜薹薹苞的损伤较薹条严重。
2.1.3 蒜薹灰霉病菌毒素对蒜薹组织细胞叶绿素降解的活性 由毒素浸渍法测定不同稀释浓度毒素滤液处理蒜薹薹条组织细胞叶绿素降解试验结果(表5)可知,PD培养液培养7、14、21 d所获取毒素滤液与清水对照相比,均可导致蒜薹薹条细胞叶绿素下降,且随着蒜薹灰霉病菌培养时间的延长,薹条褪绿程度逐渐提高。毒素随着培养时间的缩短以及稀释倍数的提高,对蒜薹薹条组织叶绿素的降解能力降低,其中培养21、14、7 d后毒素滤液原液对蒜薹薹条组织细胞叶绿素降解率分别为72.83%、59.78%和47.83%,下降显著;培养21、14、7 d毒素稀释100倍后,降解率分别为29.35%、27.17%和26.09%,降解无显著差异。
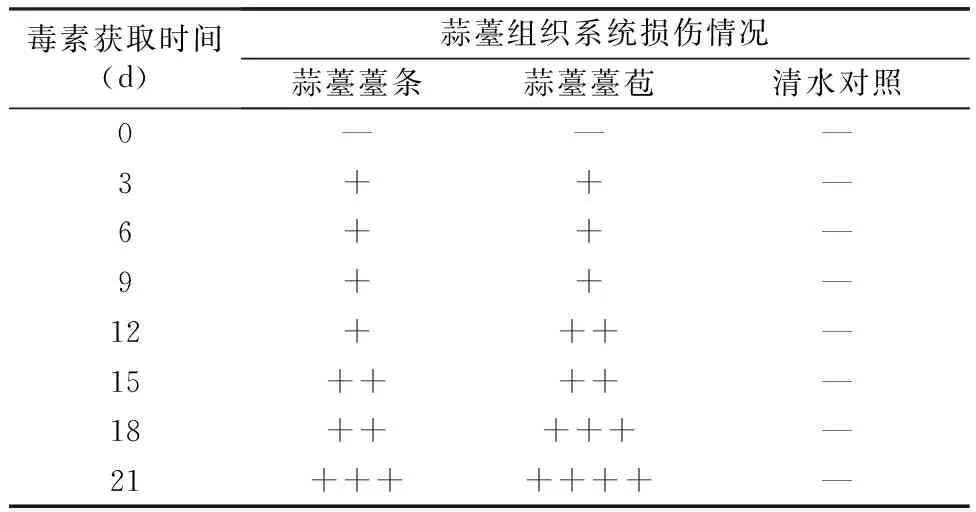
表4 蒜薹灰霉病菌毒素对蒜薹组织系统损伤的情况
注:蒜薹黄变程度标准为:—,薹条或薹苞无显著变化;+,薹条或薹苞部分失绿;++,薹条或薹苞整体失绿;+++,薹条或薹苞组织变黄。
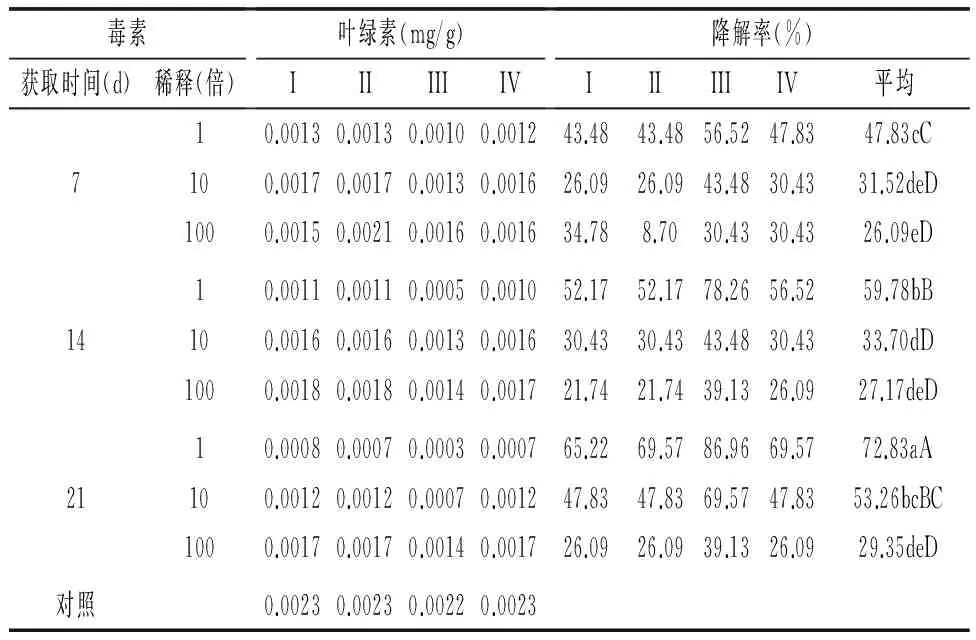
表5 蒜薹灰霉病菌毒素对蒜薹薹条组织细胞叶绿素降解的情况
由毒素滤液对蒜薹薹苞组织细胞叶绿素降解试验结果(表6)可知,PD培养液培养7、14、21 d所获取毒素滤液与清水对照相比,均可导致蒜薹薹苞细胞叶绿素下降,且与对薹条影响类似,随着蒜薹灰霉病菌培养时间的延长,所获毒素对薹苞褪绿程度也逐渐提高。毒素随着培养时间的缩短以及稀释倍数的提高,对蒜薹薹苞组织叶绿素的降解能力降低,其中培养21、14、7 d后毒素滤液原液对蒜薹薹苞组织细胞叶绿素降解率为57.74%、60.18%和40.93%,21 d和14 d之间无显著差异,降解率显著高于7 d的处理;培养21、14、7 d毒素稀释100倍后,降解率分别为36.95%、30.09%和23.45%,随着培养时间的缩短毒素对薹苞细胞叶绿素的降解显著降低。
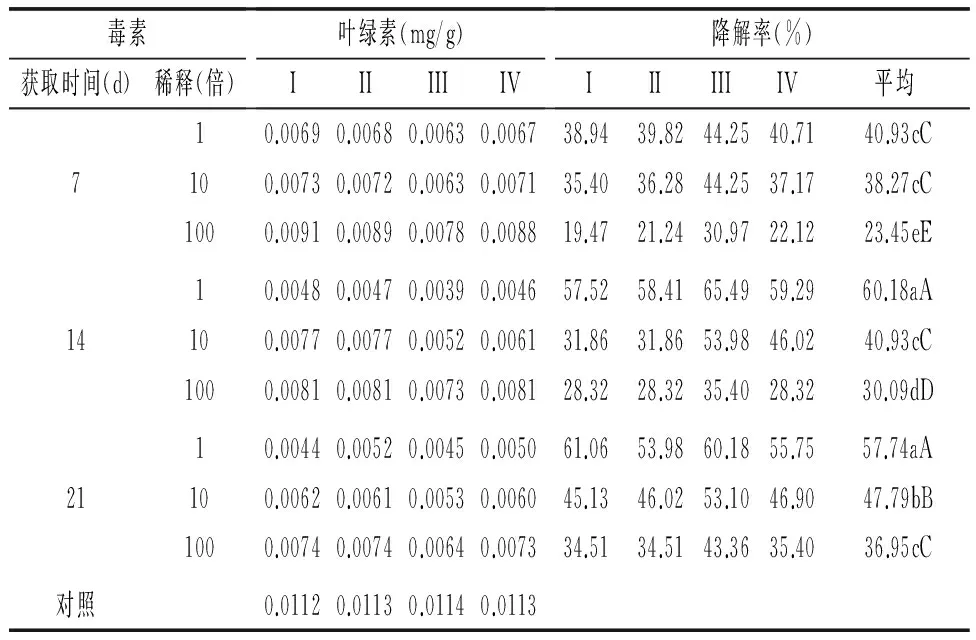
表6 蒜薹灰霉病菌毒素对蒜薹薹苞组织细胞叶绿素降解的情况
2.2蒜薹灰霉病菌毒素基因的检测
以灰葡萄孢霉Botrydial毒素BcBOT2基因6 781~8 807 bp区段为模板,采用特异性引物(见表1)进行PCR扩增和电泳,其中引物对BCbot2-F2和BCbot2-R2可获得较好扩增条带,对PCR产物进行测序和比对,所获PCR产物长337 bp,经比对,扩增区段包括灰葡萄孢霉Botrydial毒素BcBOT2基因7 156~7 410 bp区段序列。
进一步以蒜薹灰霉病菌BC-3、葱鳞葡萄孢霉、链格孢、青霉P1、青霉P2、粉红单端孢、镰刀菌的DNA为模板,进行PCR扩增和电泳,由图1可知,所获引物可以特异性扩增灰葡萄孢霉Botrydial毒素BcBOT2基因。

1:灰葡萄孢霉BC-3;2:葱鳞葡萄孢霉;3:链格孢;4:青霉P1;5:青霉P2;6:粉红单端孢;7:镰刀菌;M:DNA Marker
3 讨论与结论
灰葡萄孢霉是引起产后蒜薹灰霉病的重要病原之一,其多为田间侵染于贮藏期危害,造成蒜薹烂梢、烂基和断条。因此灰葡萄孢霉的早期检测,对于蒜薹灰霉病的早期监测和防控有着重要意义。以毒素BcBOT2基因[10]7 156~7 410 bp区段序列为模板,以BCbot2-F2和BCbot2-R2为引物,可以特异性地检测灰葡萄孢霉Botrydial毒素基因。BcBOT2基因是灰葡萄孢霉Botrydial毒素表达的重要基因,通过对BcBOT2的检测可有效监测灰葡萄孢霉Botrydial毒素的形成,为由灰葡萄孢霉引起的蒜薹灰霉病提供早期检测依据。
本研究通过蒜薹悬滴接种法、系统侵染法和毒素浸渍法测定,蒜薹灰霉病菌毒素对蒜薹薹条和薹苞组织损伤及蒜薹细胞叶绿素降解的活性比较,说明蒜薹灰霉病菌毒素对产后蒜薹组织有较强破坏作用,可导致蒜薹薹苞和薹条组织细胞损伤、叶绿素降解,并可由输导组织传导造成蒜薹组织的系统危害。同时发现随着培养时间的延长,所获毒素对蒜薹薹条和薹苞组织的损伤均逐渐加强,且随着毒素浓度的降低,对蒜薹组织细胞损伤显著下降。经验证蒜薹灰霉病菌毒素是导致产后蒜薹灰霉病的重要因素之一。
[1] 宋茂树,阎瑞香,杜孟学,等. 蒜薹贮藏过程中“烂窝病”发生的原因与对策[J].保鲜与加工,2010,10(4):37-40.
[2] 赵淑艳,李喜宏,陈丽,等. 蒜薹采后致病菌种类及侵染规律研究[J].中国农学通报,2005,21(9):74-78.
[3] 石凤梅. 植物病原真菌毒素研究进展[J]. 黑龙江农业科学,2006,26(2):70-73.
[4] Aksenova V A.Toxicity of polysaccharide fraction of toxin ofBotrytiscinerea[J]. Doklady.,1963,147:1426.
[5] Rebordinos L, Cantoral J M, Prieto M V, et al. The phytotoxic activity of some metabolites ofBotrytiscinerea[J]. Phytochemistry, 1996, 42(2):383-387.
[6] Deighton N, Muckenschnabel I, Colmenares A J, et al. Botrydial is produced in plant tissues infected byBotrytiscinerea[J]. Phytochemistry, 2001,57(5):689-692.
[7] 刘莎莎,陈小龙. 与灰葡萄孢致病性相关的真菌毒素及胞外酶[J]. 浙江农业科学, 2010(4):859-864.
[8] Pinedo C, Wang C M, Pradier J M, et al. Sesquiterpene synthase from the botrydial biosynthetic gene cluster of the phytopathogenBotrytiscinerea[J]. ACS Chemical Biology, 2008, 3(12):791-801.
[9] Wang C M, Hopson R, Lin X, et al. Biosynthesis of the sesquiterpene botrydial inBotrytiscinereamechanism and stereochemistry of the enzymatic formation of presilphiperfolan-8β-ol [J]. Journal of the American Chemical Society, 2009, 131(24):8360-8361.
[10] Culter H G, Jacyno J M, Harwood J S, et al. Botcinolide: a biologically active natural product fromBotrytiscinerea[J].Bioscience, Biotechnology and Biochemist, 1993, 57(11):1980-1982.
PathogenicitytoGarlicScapeandGeneDetectionofToxinfromBotrytiscinerea
Wang Yong1,Zhang Chunxiang1, Gao Wei1, Kong Qingxue2, Yan Ruixiang3, Zhang Na3
(1.TianjinInstituteofPlantProtection,Tianjin300381,China; 2.TianjinAgriculturalUniversity,Tianjin300384,China; 3.NationalEngineeringTechnologyResearchCenterforPreservationofAgriculturalProducts/KeyLaboratoryofStorageofAgri-Products,MinistryofAgriculture,Tianjin300381,China)
To make clear the pathogenicity of toxin fromBotrytiscinereato garlic scape and the detection method to toxin gene, theBotrytiscinereastrain BC-3 with high pathogenicity was selected as target. The bioassay of mycotoxin to tissue damage and cell chlorophyll degradation activity were tested by garlic scape droplet inoculation, systemic infection and toxin dipping. The results showed that the toxin ofBotrytiscinereawas the important pathogenic factor leading to garlic gray mold. The toxin could lead to tissue injury, chlorophyll degradation and garlic conducting tissue damage. At the same time, the specific detection method to toxin geneBcBOT2 was established. The method could be used to the early detection of garlic gray mold caused byBotrytiscinerea.
Botrytiscinerea; Garlic scape; Toxin; Pathogenicity; Toxin gene
S436.33
A
1001-4942(2017)10-0076-05
10.14083/j.issn.1001-4942.2017.10.016
2017-02-06
国家科技支撑计划课题“物流蒜薹绿色防腐与安全保鲜技术综合示范”(2015BAD16B00);农业部农产品贮藏保鲜重点实验室开放基金项目“灰霉菌毒素对采后蒜薹的致病机制及检测、控制研究”(20150901)
王勇(1971—),女,研究员,主要从事植物病害及其生物-生态防治研究。E-mail:wangyongwb@126.com

