球孢白僵菌甘露醇1-磷酸脱氢酶cDNA克隆及生物信息学分析
李凯月,郑长英,燕霞飞,王俊平
(青岛农业大学农学与植物保护学院/山东省植物病虫害综合防控重点实验室,山东 青岛 266109)
球孢白僵菌甘露醇1-磷酸脱氢酶cDNA克隆及生物信息学分析
李凯月,郑长英,燕霞飞,王俊平
(青岛农业大学农学与植物保护学院/山东省植物病虫害综合防控重点实验室,山东 青岛 266109)
本研究利用RT-PCR技术克隆获得了球孢白僵菌(Beauveriabassiana)甘露醇1-磷酸脱氢酶(BbMPD)基因的cDNA序列,并对其氨基酸序列进行生物信息学分析,明确其蛋白典型特征。结果显示,BbMPD基因cDNA序列长1 176 bp,编码391个氨基酸,分子量约为42.9 kD,理论等电点为5.09;不具有信号肽,属于非分泌蛋白;无跨膜结构,是亲水性蛋白;亚细胞定位预测显示BbMPD蛋白主要位于细胞质;具有典型的甘露醇1-磷酸脱氢酶保守结构域;α螺旋和无规则卷曲是BbMPD蛋白主要的二级结构。该结果为进一步研究BbMPD基因及其功能奠定了基础。
球孢白僵菌;甘露醇1-磷酸脱氢酶;基因克隆;生物信息学分析
球孢白僵菌(Beauveriabassiana)是一种昆虫病原真菌,在侵染过程中能够分泌白僵菌交酯、白僵菌素、毒蛋白酶等物质[1],加速害虫的死亡过程,除此之外,避免了化学防治过程中带来的药物残留、危害生态环境、污染环境等问题,因此在农林害虫的微生物防治中发挥着重要作用[2]。分生孢子是昆虫病原真菌最重要的侵染单位,分生孢子的数量和质量是成功侵染的关键因素。田间的分生孢子只有不受高温、干旱以及紫外线等逆境环境的影响,才能够侵染寄主并萌发。侵入昆虫体内的病原真菌不仅要抵抗寄主的免疫反应,还需克服寄主体内的高渗环境,才能成功定殖[3]。
多元糖醇在调节微生物抗逆性中发挥着重要作用,其合成途径受阻会导致真菌对多种逆境环境的适应力下降[4]。甘露醇是真菌中的一种多元醇,其主要有调节渗透压[5]、清除自由基以及逆境环境保护等作用[6]。在丝状真菌中,以磷酸果糖为底物,在磷酸甘露醇脱氢酶的催化下形成磷酸甘露醇,然后去磷酸化形成甘露醇[7]。整个合成过程受甘露醇1-磷酸脱氢酶(MPD)基因的调控与催化,并且需要NADH辅酶协助。大部分真菌MPD属于多元醇特异性的长链脱氢还原酶家族(long-chain dehydrogenases and reductases,LDRs),在蛋白的N端存在一个保守的辅酶结构域和一个与底物识别和催化相关的结构域[8,9]。
在单胞锈菌(Uromycesfabae)侵染寄主的过程中会分泌大量的甘露醇,可能与抵制寄主的ROS反应有关[10]。在黑曲霉(Aspergillusniger)中,MPD基因调控甘露醇的生物合成,使分生孢子具有抵抗高温、冰冻等不良环境的能力[11]。在新型隐球菌(Cryptococcuneoformans)中,甘露醇与病原菌的致病力有关,甘露醇减少后导致病原菌对氧胁迫较为敏感[12]。在球孢白僵菌的分生孢子中,甘露醇是含量较高的一种多元醇,在一些逆境条件下孢子通过此类物质来维持细胞膜的完整性以及酶的生物活性。本研究拟通过RT-PCR技术克隆球孢白僵菌BbMPD基因的cDNA序列,并利用生物信息学方法对其编码的蛋白质进行一系列的理化性质及功能预测,包括蛋白质的理化性质、信号肽、跨膜结构域、亚细胞定位以及保守功能域等,以期为进一步研究球孢白僵菌BbMPD基因功能奠定基础,以及为明确该基因在真菌抗逆机制中起到的作用提供理论依据。
1 材料与方法
1.1材料与试剂
球孢白僵菌Bb33A由本实验室保存;Trizol、DEPC购自索莱宝生物科技有限公司;RT-PCR试剂盒、pMD18-T载体购自宝生物工程(大连)有限公司;质粒提取试剂盒购自北京康为世纪生物科技有限公司;大肠杆菌DH5α购自生工生物工程(上海)股份有限公司。
1.2试验方法
1.2.1 RNA提取和RT-PCR扩增 收集球孢白僵菌孢子粉,置于液氮预冷的研钵中研磨成粉末,将粉末移至DEPC处理的EP管中并加入1 mL Trizol。提取步骤按照相关说明书进行,琼脂糖电泳检测提取的RNA并用分光光度计定量。按照反转录试剂盒说明书合成cDNA。
根据球孢白僵菌基因组数据库(http://genome.jgi.doe.gov/Beaba1/Beaba1.home.html)中BbMPD基因序列,设计特异性引物F:5′-ATGGCTCCCAAGGCTGTTCATTT-3′和R:5′-TCACTCGCTGTCGGCCTGAA-3′,以反转录的cDNA为模板,通过PCR扩增BbMPD基因片段。50 μL PCR反应体系:10×LA PCR buffer 5 μL,dNTP 4 μL (2.5 mmol/L each),上、下引物各1.5 μL (10 μmol/L),LATaq酶0.5 μL (5 U/μL),cDNA模板1 μL,ddH2O 补齐至50 μL。PCR反应条件为:94℃预变性 5 min;94℃变性40 s,55℃退火40 s,72℃延伸1 min,32个循环;72℃延伸10 min。琼脂糖电泳,回收目标片段,连接pMD18-T,转化DH5α感受态细胞,PCR鉴定阳性克隆,提取质粒并测序。
1.2.2 BbMPD蛋白的生物信息学分析 利用在线工具ProtParam(http://web.expasy.org/protparam/)对BbMPD蛋白进行氨基酸序列组成、相对分子质量、等电点等理化性质进行分析[13];利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对目标蛋白进行信号肽预测;利用TMHMM Server v. 2.0工具(http://www.cbs.dtu.dk/services/TMHMM-2.0/)对蛋白质进行跨膜结构预测;利用PSORT Ⅱ(https://psort.hgc.jp/form2.html)进行亚细胞定位预测;利用在线工具Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白质保守结构域[14];利用ProtScale工具(http://web.expasy.org/cgi-bin/protscale/protscale.pl)分析蛋白质氨基酸序列的亲/疏水性;利用在线工具PSIpred(http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白质的二级结构。
2 结果与分析
2.1BbMPD基因的克隆
以球孢白僵菌cDNA为模板,用特异性引物进行PCR扩增反应,经琼脂糖凝胶电泳检测(图1),在1 100 bp处有一条亮带,与预测基因片段大小相符,产物回收纯化后连接pMD18-T载体,对阳性克隆测序得知其片段大小为1 176 bp,与已测序菌株BbMPD基因的cDNA序列大小一致,但存在部分碱基的差异。

M:DL2000 DNA Marker;1:BbMPDPCR产物
图1BbMPD基因PCR扩增
2.2 BbMPD蛋白理化性质分析
BbMPD基因cDNA序列编码391个氨基酸,其蛋白质的分子式为C1896H3022N524O593S8,分子量约为42.9 kD,总计由6 043个原子组成;等电点为5.09;不稳定系数为39.79,未超过理论阀值40,故推断该蛋白质稳定。其中丙氨酸、谷氨酸、缬氨酸和异亮氨酸含量较多,而甲硫氨酸与色氨酸含量相对较少。
2.3 BbMPD蛋白的信号肽及跨膜区域分析
利用SignalP 4.1 Server对BbMPD蛋白进行信号肽预测,由图2可知,C值最大切割点在第33个氨基酸,分值为0.261;综合剪切点Y值最高也在第33个氨基酸,分值为0.211;信号肽最大值(S值)在第2个氨基酸位置,分值为0.345,因此推断BbMPD蛋白无信号肽,属于非分泌蛋白。利用TMHMM Server v. 2.0工具对BbMPD蛋白进行跨膜结构预测,由图3可知,该蛋白不存在跨膜结构,为非膜蛋白。
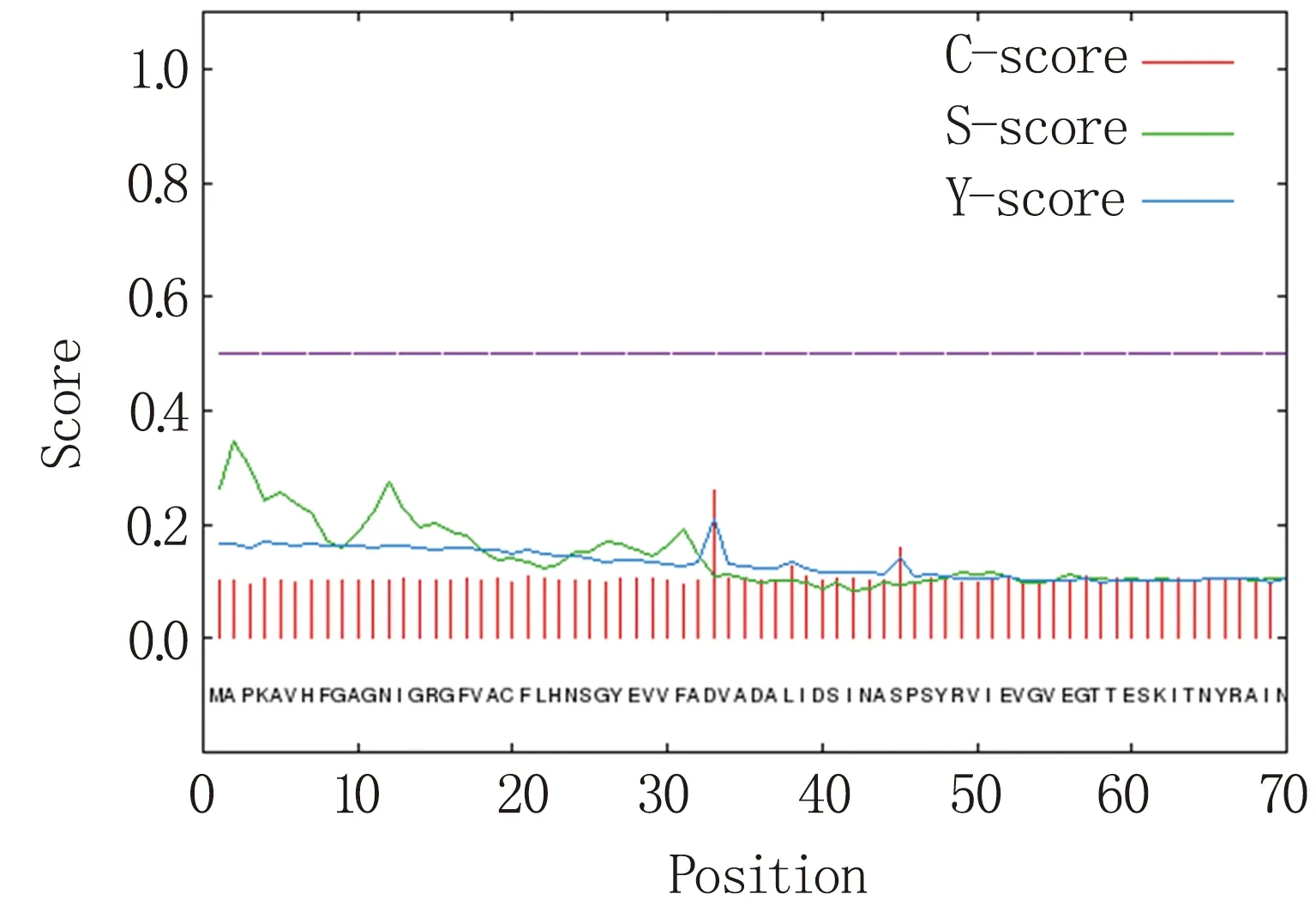
图2 BbMPD蛋白信号肽预测

图3 BbMPD蛋白跨膜结构预测
2.4 BbMPD蛋白的亚细胞定位预测
利用PSORT Ⅱ在线软件对BbMPD蛋白进行亚细胞定位预测,可以为进一步预测蛋白质功能提供基础。结果表明,BbMPD蛋白分布在细胞质中的概率为73.9%,线粒体中的概率为13%,细胞核中的概率为4.3%,囊泡分泌系统中的概率为4.3%,液泡中的概率为4.3%。
2.5 BbMPD蛋白保守功能域分析
利用NCBI中的Conserved Domains程序对BbMPD蛋白进行功能结构域分析,由图4可知,BbMPD蛋白第4~387位氨基酸组成了典型的甘露醇1-磷酸脱氢酶保守结构域,属于多元醇特异性的长链脱氢还原酶(LDRs)家族[15]。

图4 BbMPD蛋白保守结构域分析
2.6 BbMPD蛋白氨基酸序列亲水性/疏水性分析
用ProtScale工具预测了球孢白僵菌BbMPD蛋白氨基酸序列亲水性/疏水性,结果(图5)表明,蛋白第233位的天冬氨酸(N)具有最低的分值-3.011,第100位氨基酸异亮氨酸(I)具有最高的分值2.256。根据氨基酸分值越低亲水性越强和分值越高疏水性越强的规律可知,233位的天冬氨酸亲水性最强,第100位异亮氨酸疏水性最强。由图5可知,亲水性氨基酸均匀分布于整个蛋白,且多于疏水性氨基酸,因此推测BbMPD蛋白为亲水蛋白。
2.7 BbMPD蛋白的二级结构预测
对BbMPD蛋白进行二级结构预测,由图6可知,BbMPD蛋白含有α螺旋、β折叠和无规则卷曲结构,其中α螺旋结构含量较多,其次是无规则卷曲。可见,α螺旋和无规则卷曲是BbMPD蛋白主要的二级结构,分布于整个肽链。

图5 BbMPD蛋白氨基酸序列亲水性/疏水性预测

图6 BbMPD蛋白二级结构预测
3 讨论与结论
球孢白僵菌作为一种广谱性杀虫真菌,能够有效控制害虫数量,同时不伤害天敌昆虫与有益生物,因而得到广泛应用[16]。分生孢子是昆虫病原真菌最重要的侵染单位,甘露醇可以作为一种储能碳源或保护剂降低孢子活性以延长其存活寿命[17],此外,甘露醇可以提高分生孢子对热激、氧化等不良环境的适应能力[18]。甘露醇在真菌中的代谢途径是一个生物学循环过程,在辅因子的作用下,经过一系列催化作用形成。球孢白僵菌中BbMPD基因的表达受高渗环境的诱导,并对其具有一定的适应性,该适应性受到Hog1信号途径的调节,在高渗环境下会积累较高的多元醇来维持细胞内的膨压[19]。
本研究克隆了球孢白僵菌BbMPD基因的cDNA序列并对其进行测序,结果显示本研究克隆的BbMPD基因的cDNA序列与已经完成测序的球孢白僵菌ARSEF 2860菌株的基因组序列存在着部分碱基的差异[20],这主要是由于菌株的差异造成的。另外,进一步对BbMPD蛋白进行了生物信息学分析,结果表明该蛋白没有信号肽,不属于分泌蛋白;不具有跨膜结构域,属于亲水性蛋白;具有典型的甘露醇1-磷酸脱氢酶保守结构域;BbMPD蛋白主要的二级结构是α螺旋和无规则卷曲,预测其与蛋白质活性有关。本研究可为下一步BbMPD蛋白的诱导表达及纯化,以及试图通过结构生物学的方法来探究BbMPD蛋白的功能奠定基础。
[1] 杨运华,杜开书,石明旺.虫生真菌的生物防治研究进展[J]. 河南科技学院学报(自然科学版), 2011, 39 (1):34-37.
[2] 徐进,杨茂发,狄雪塬,等.球孢白僵菌YS03菌株对稻水象甲的田间防治效果[J].西南农业学报, 2015,28(4):1630-1633.
[3] Wang C S, Duan Z B, Leger R J. MOSI osmosensor ofMetarhiziumanisopliaeis required for adaptation to insect host hemolymph[J]. Eukaryotic Cell,2008,7(2):302-309.
[4] Vries R P, Flitter S J, Vondeervoort P J, et al. Glycerol dehydrogenase, encoded by gldB is essential for osmotolerance inAspergillusnidulans[J]. Molecular Microbiology,2001,49:131-141.
[5] Clark A J, Blissett K J, Oliver R P. Investigating the role of polyols inCladosporiumfulvumduring growth under hyper-osmotic stress and in planta [J]. Planta, 2003,216(4):614-619.
[6] Fillinger S, Chaveroche M K, Van Dijck P, et al. Trehalose is required for the acquisition of tolerance to a variety of stresses in the filamentous fungusAspergillusnidulans[J]. Microbiology, 2001,147:1851-1862.
[7] Hult K, Gatenbeck S. Production of NADPH in the mannitol cycle and its relation to polyketide formation inAlternariaalternata[J]. European Journal of Biochemistry,1978,88(2):607-612.
[8] Persson B, Krook M, Jörnvall H. Characteristics of short-chain alcohol dehydrogenases and related enzymes[J]. European Journal of Biochemistry,1991,200(2):537-543.
[9] Krahulec S, Armao G C, Weber H, et al. Characterization of recombinantAspergillusfumigatusmannitol-1-phosphate 5-dehydrogenase and its application for the stereoselective synthesis of protio and deuterio forms of D-mannitol 1-phosphate [J]. Carbohydrate Research,2008,343(9):1414-1423.
[10] Voegele R T, Hahn M, Lohaus G. Possible roles for mannitol dehydrogenase in the biotrophic plant pathogenUromycesfabae[J]. Plant Physiology,2005,137:190-198.
[11] Ruijter G J, Bax M, Patel H, et al. Mannitol is required for stress tolerance inAspergillusnigerconidiospores [J]. Eukaryotic Cell,2003,2(4):690-698.
[12] Chaturvedi V, Flynn T, Niehaus W G, et al. Stress tolerance and pathogenic potential of a mannitol mutant ofCryptococcusneoformans[J]. Microbiology,1996,142 (4):937-943.
[13] Gasteiger E, Hoogland C, Gattiker A, et al. The proteomics protocols handbook [M]. Totowa, New Jersey: Humana Press,2005:571-607.
[14] Marchler-Bauer A, Lu S, Anderson J B, et al. CDD: a conserved domain database for the functional annotation of proteins [J]. Nucleic Acids Research,2011,39:D225-D229.
[15] Wang Z L, Ying S H, Feng M G. Gene cloning and catalysis features of a new mannitol-1-phosphate dehydrogenase (BbMPD) fromBeauveriabassiana[J]. Carbohydrate Research, 2010, 345(1):50-54.
[16] 罗志兵,金凯,张永军,等.球孢白僵菌高渗适应性相关基因Bbmpd的克隆与表达分析[J].微生物学报,2010,50(6):724-728.
[17] Witteveen C F, Visser J. Polyol pools inAspergillusniger[J]. Fems. Microbiology Letters,1996,134(1):57-62.
[18] Velez H, Glassbrook N J, Daub M E. Mannitol metabolism in the phytopathogenic fungusAlternariaalternate[J]. Fungal Genetics & Biology, 2007,44(4):258-268.
[19] Zhang Y, Lamm R, Pillonel C, et al. Osmoregulation and fungicide resistance: theNeurosporacrassaos-2 gene encodes aHOG1 mitogen-activated protein kinase homologue[J]. Applied and Environmental Microbiology,2002,68(2):532-538.
[20] 罗成, 应盛华, 冯明光. 球孢白僵菌对斜纹夜蛾高毒菌株筛选与制剂的研发[J]. 中国生物防治学报,2011,27(2):188-196.
CloningandBioinformaticsAnalysisofMannitol1-PhosphateDehydrogenasecDNAinBeauveriabassiana
Li Kaiyue, Zheng Changying, Yan Xiafei, Wang Junping
(CollegeofAgronomyandPlantProtection,QingdaoAgriculturalUniversity/KeyLabofIntegratedCropDiseaseandPestManagementofShandongProvince,Qingdao266109,China)
The cDNA sequence of mannitol 1-phosphate dehydrogenase (MPD) fromBeauveriabassianawas cloned using RT-PCR. The bioinformatics analysis of amino sequences was performed, and the protein typical characteristics were identified. The results showed that the cDNA sequence ofBbMPDgene was 1 176 bp, which encoded 391 amino acids;its molecular weight was 42.9 kD and the theoretical isoelectric point was 5.09. It was a non-secretory protein without a signal peptide and a hydrophilicity protein without transmembrane domain. The subcellular location results indicated that the BbMPD protein was mainly located in cytoplasm. It possessed the conserved domains of mannitol 1-phosphate dehydrogenase superfamily. The α-helix and random coil were the major secondary structure of BbMPD protein. This method laid the foundation for further studying theBbMPDgene and its function.
Beauveriabassiana; Mannitol 1-phosphate dehydrogenase; Gene cloning; Bioinformatics analysis
S182
A
1001-4942(2017)10-0010-05
10.14083/j.issn.1001-4942.2017.10.002
2017-06-13
国家自然科学基金项目(31201577);青岛农业大学高层次人才科研基金项目(630609);山东省蔬菜创新团队——病虫害防治岗位科学家(6682216020);青岛农业大学应用型人才培养特色名校建设工程大学生科技创新项目
李凯月 (1991—),女,山东东营人,在读硕士研究生,研究方向:农业昆虫与害虫防治。E-mail: 1491730863@qq.com
王俊平(1976—),女,河北南皮人,博士,副教授,研究方向:害虫生物防治。E-mail: junpingwang@qau.edu.cn

