禽源呼肠孤病毒S1基因节段分子生物学研究进展
吴巧梅,刘光清,陈宗艳
(中国农业科学院上海兽医研究所,上海 200241)
禽源呼肠孤病毒S1基因节段分子生物学研究进展
吴巧梅,刘光清,陈宗艳
(中国农业科学院上海兽医研究所,上海 200241)
呼肠孤病毒广泛的宿主性以及自身基因组的结构特征使其在进化过程中呈现遗传多样性,新型禽源呼肠孤病毒在此过程中不断出现,引起家禽和水禽养殖业的严重经济损失。其中,关于S1基因节段的科学研究对于理解病毒致病性改变以及疫苗开发有关键作用。因此,本文拟就禽源呼肠孤病毒的发生、S1基因的结构及其编码的非结构蛋白P10、P17和结构蛋白σC的生物学功能最新研究进展作一概述。
禽源呼肠孤病毒;S1基因节段;P10蛋白;P17蛋白;σC蛋白
Abstract:There are considerable genetic diversities within reoviruses due to their wide range hosts and special genome structures.The emergence of novel strains of Avian reoviruses causes highly contagious and economically most important diseases for poultry and waterfowl industry. The study on S1 genome segment is beneficial to pathogenesis and vaccine development. This mini-review summarizes major advances of recently occurred Avian reoviruses, focusing on the genome structures of S1 gen segment and function of P10, P17 and σC.
Key words:Avian reoviruses; S1 gene segment ; P10; P17;σC
呼肠孤病毒(Reovirus)是目前已知分布范围最广的病毒之一,可以感染哺乳动物、禽类、鱼类、植物、真菌等,其独特的多节段双链RNA(double strand RNA,dsRNA)基因组使其成为研究病毒基因组复制及遗传变异的好材料。正呼肠孤病毒包含3个亚群,分别为非融合基因哺乳动物正呼肠孤病毒(Mammalian orthoreovirus,MRV);融合基因正呼肠孤病毒,包括禽源呼肠孤病毒(Avian reovirus,ARV)和内尔森海湾病毒(Nelson bBay reovirus,NBV);从狒狒体内分离到的呼肠孤病毒(Baboon orthoreovirus,BRV)。
禽源呼肠孤病毒属于呼肠孤病毒科(Reoviridae),正呼肠孤病毒属(Orthoreovirus),可以感染各种禽类,并且传播范围广,致病性强,可以造成养禽业严重的经济损失。S1基因节段编码产物与病毒复制、致病性及宿主谱相关。本文对禽源呼肠孤病毒的发生、S1基因节段的结构及其编码产物的生物学功能研究进展作一概述。
1 禽源呼肠孤病毒概况
ARV能够感染各种禽类,包括鸡、火鸡、鸭、鹅、鸽子、鹦鹉、鸵鸟和野鸟等,并且在世界各地均有感染病例的报道。在家禽养殖业中,ARV最早引起鸡和火鸡病毒性关节炎、鞘腱炎、吸收障碍综合症、矮小综合症、免疫抑制等疾病。近年来,ARV新毒株不断出现于肉鸡、生产鸭中,目前是危害肉鸡、鸭养殖业最主要的危害因素之一。
ARV为线性双链RNA(dsRNA)病毒,无囊膜,呈二十面体对称的结构(图1),病毒的核酸由双层蛋白质衣壳包裹,直径为60~80 nm,其基因组有10个片段组成,分别为3个长节段(L1,L2,L3),3个中节段(Ml,M2,M3)和4个小节段(Sl,S2,S3,S4)(图2)。

图1 ARV电镜照片Fig. 1 ARV electron microscipic photos of ARV
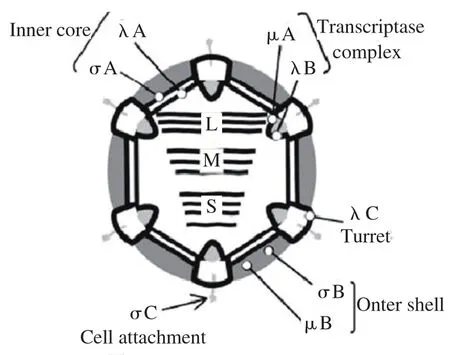
图2 病毒粒子结构示意图Fig.2 Schemmatic representation of ARV
1.1 鸡呼肠孤病毒鸡呼肠孤病毒首次于1954年由Fahey和Crawley从患病的雏鸡体内分离得到,患病鸡表现为慢性呼吸道疾病,吸收不良综合征,肝脏坏死及腿部滑膜炎;1957年,西弗吉尼亚大学的Olson等[1]发现一种对氯霉素、呋喃哩酮不敏感并能导致滑膜炎的病原体;1959年Olson[2]发现这种特别的病原体对链霉素也不敏感;1972年,Walke等[3]通过电镜观察这种病毒后将其命名为呼肠孤病毒;王锡坤等[4]于1985年首次证实我国存在呼肠孤病毒感染引起的疾病,现至少有11个血清型出现;2011年,Banyai等[5]报道了新ARV突变株(AVS-B)可引起矮小-发育综合征(runting-stunting syndrome,RSS)。如今,ARV已是造成养禽业经济损失最主要的病因之一,其感染遍及南非、法国、以色列、美国和中国等。
1.2 番鸭呼肠孤病毒ARV感染水禽的报道最初仅见于番鸭,称为番鸭呼肠孤病毒病,其致病因子称为番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)。研究表明MDRV对我国的北京鸭以及其他地方品种鸭不具有感染性[6]。该病主要发生于45日龄内的番鸭,以软脚、腹泻生长障碍为主要症状,以肝、脾表面坏死、纤维素性心包炎为主要病变[7]。该病最初发现于南非,之后法国、德国、意大利、芬兰、以色列等国家也相继报道了该病并分离到MDRV,是番鸭养殖业的一种主要病毒性传染病[8]。自1997年以来,我国每年都有MDRV感染疫情的报道,对我国的番鸭养殖业构成了严重威胁[9]。Yun等[10]发现在中国浙江省某地区出现的MDRV致病性已经发生一定程度变异,且此病毒不能引起合胞体产生。2014年,Woźniakowski等[11]报道波兰西南部发生MDRV的疫情。Yun等[12]在中国发现新的MDRV疫情,对其基因序列分析及电泳迁移率分析发现,所分离到的MDRV为新型MDRV。
1.3 鸭呼肠孤病毒随着养鸭业的不断发展,ARV感染多品种鸭也见报道,但是由于流行区域、发病种群和发病时间的不同,呼肠孤病毒感染鸭表现出不同程度的差异。程安春等[13]报道了1998年四川省、云南省等地的“鸭病毒性肿头出血症”疫情,后续研究表明是由鸭呼肠孤病毒所致。2008年,刘红等[14]对广东省某鸭场一种以肿头、软脚、流泪,拉黄绿色稀便,肝出血和坏死及食道泄殖腔溃疡和结痂为主要特征的疫情进行病因调查时,分离到多株病毒,其中包括1株鸭呼肠孤病毒(Duck reovirus,DRV-GZ)。2009年,陈少莺等[15]报道了福建省一种以肝脏出血和坏死为主要病变特征的半番鸭和麻鸭呼肠孤病毒病,之后通过对该毒株(NP03株)的感染性和免疫原特性研究,发现这是一株与番鸭呼肠孤病毒存在明显差异的新型呼肠孤病毒。2011年,Liu等[16]从北京鸭体内也分离到了1株呼肠孤病毒(HC株),其动物回归实验表明,DRV-HC株在15 d内引起未能引起鸭的死亡,但能引起SPF鸡的死亡,说明该毒株的致病力并不太强。同年,我国华东地区的一些养鸭场陆续发生了1种以软脚和肝脏、脾脏坏死为主要特征的传染病,发病率约20%~50%,病死率在80%以上,给养鸭业造成了较为严重的经济损失。对该病的病原进行了分离和鉴定,试验证明此次疫情是由呼肠孤病毒引起,所分离到的病原称为DRV-TH11株[17]。值得指出的是,与以往报道的鸭呼肠孤病毒相比,新发鸭呼肠孤病毒的宿主谱更广,致病性更强,它可感染包括麻鸭、北京鸭、樱桃谷鸭等在内的多个品种的鸭,而且感染鸭的病死率为50%~80%,提示TH11株是一株致病力发生变异了的新型鸭呼肠孤病毒(Novel duck reovirus, NDRV)[18]。进化树分析显示,新型鸭呼肠孤病毒与番鸭呼肠孤病毒的亲缘关系较近,与禽呼肠孤病毒亲缘关系较远;而通过基因组同源性分析显示,新型鸭呼肠孤病毒与禽呼肠孤病毒经典株S1133株同源性较高,与番鸭呼肠孤病毒经典株89026同源性较低,其中S1基因同源性最低。根据其他呼肠孤病毒的研究成果,可以推测S1基因与病毒感染、致病性和免疫保护等密切相关,因此从该基因入手有可能为阐明新型鸭呼肠孤病毒的跨种传播和致病力变异等提供有价值的线索。
2 S1基因节段基因结构特征
ARV由10个基因大小不同的片段组成病毒的基因组,根据基因组在PAGE电泳中迁移率的不同,可将10个基因节段分成3组:3个长节段(L1,L2,L3),3个中节段(Ml,M2,M3)和4个小节段(Sl,S2,S3,S4),编码10个结构蛋白(λA、λB、λC、μA、μB、σA、σB)和4个非结构蛋白(μNS、P10、P17、σNS)。大多数分离株基因组在PAGE胶中的迁移模式类似,但不同毒株之间各节段的迁移率却存在一定差异,电泳图会表现出多态性,其中尤以Sl基因节段的差异更为显著(图3)。呼肠孤病毒每个基因片段在5'末端和3'末端存在着保守序列,为5'-GCUUUUU和3'-UCAUC,其中S1节段包含3个ORF(open reading frame),其余剩下的每个节段只包含一个ORF[19],并且如表1所示,分别编码不同的蛋白,包括10个结构蛋白和4个非结构蛋白。

图3 禽呼肠孤病毒基因组SDS-PAGE电泳图谱Fig.3 The SDS-PAGE of different reovirus1: ARV; 2: MDRV; 3: NDRV1: ARV; 2: MDRV; 3: NDRV
ARV和新型鸭呼肠孤病毒(NDRV)相类似,其S1基因包含3个部分重叠的开放读码框(opening reading frame,ORF),依次编码p10蛋白、p17蛋白和σC蛋白(表1、表2);但NDRV对应ARV P17蛋白的大小为18 kDa,因此称为P18蛋白。而经典的番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)S1基因为双顺反子,依次编码p10蛋白和σC蛋白,缺少编码P17蛋白的基因,2013年有学者从患病番鸭体内分离出1株新型番鸭呼肠孤病毒(N-MDRV ZJ00M),具有保守末端序列5'-GCUUUUU......UUCAUC-3',但是不同于经典的MDRV,其S1节段编码p10蛋白、p17蛋白和σC蛋白,S4基因编码σNS蛋白;同时,此株病毒不能引起细胞形成合胞体(表1、表2)。

表1 禽源呼肠孤病毒不同节段编码蛋白及其分布Table 1 The proteins encoded by different segments of Avian reovirus

表2 不同种类呼肠孤病毒编码蛋白的差异Table 2 The difference of reovirus encoding protein
3 S1基因节段编码蛋白
S1基因节段具有高度变异性的特征,其编码两个非结构蛋白P10、P17和一个结构蛋白σC。P10是由S1基因第1个ORF编码,由98个氨基酸组成;P17由S1基因的第2个ORF编码,由146个氨基酸组成;σC蛋白是由S1基因第3个ORF编码,包含326个氨基酸(图4)。
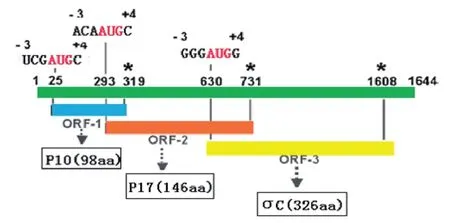
图4 禽源呼肠孤病毒S1基因编码蛋白示意图Fig.4 Diagrammatic representation of the avian reovirus S1 protein
3.1 P10蛋白P10是由S1基因第一个ORF编码,是由97个氨基酸组成的非结构蛋白,一般存在细胞膜上。P10蛋白在功能上可以分为3个区域:中央跨膜结构区域、近N端保守的外功能序列区域和近N端的内膜基本区域,P10蛋白的3个区域与膜结合的程度非常高[20]。
P10蛋白是目前已知的最小的“跨膜融合小蛋白”(fusion-associated small transmembrane,FAST)。P10蛋白的半胱氨酸序列需要经过棕榈酰化,棕榈酰化对于P10蛋白的结合功能是必需的。中央跨膜结构区域、近N端保守的外功能序列区域能够使细胞膜融合,形成合胞体。P10蛋白能够特异性地介导细胞与细胞之间的细胞膜融合过程,而不能诱导病毒与细胞之间的膜融合,并且P10蛋白可以决定病毒的毒力强弱。Roy Duncan研究发现,禽呼肠孤病毒(ARV)的P10蛋白上含有一种大小约为36~40个残基的依靠分子内的二硫键相连接的融合肽,这种融合肽能够促进复杂的细胞膜融合的发生,促使同源的P10蛋白聚集,形成合胞体。通过大量的突变分析实验确定这种融合肽是由两个功能性区域组成。在P10蛋白N端存在一个拥有25个残基的序列,能够影响胱氨酸茎环(loop)结构的形成。表面免疫荧光染色,荧光共振能量转移分析和胆固醇枯竭/饱食研究确定的胱氨酸环序列是通过2个残基连接到13个残基的近膜胞外区(memebraneproxomal ectodomain region MPER)[21]。MPER构成拥有二级独立管理能力的体系,可以促进合胞体形成。
这种36~40个残基组成的融合肽对于细胞-细胞之间的膜融合和混合脂质体形成都是必不可少的。胱氨酸疏水性的茎环结构的形成需要两个半胱氨酸侧面连接,这种茎环结构的功能是作为一个绞索(noose),促使P10蛋白中疏水性残基的暴露。胱氨酸绞索的形成需要脂质体分裂和融合的过程,但是脂质体融合过程不需要脂质体管,胆固醇可以促进融合肽的形成[22]。P10蛋白是细胞毒力的决定因素,能够诱导细胞融合,增加细胞膜的通透性,使病毒颗粒更容易进入细胞,促进合胞体形成。
3.2 P17蛋白P17蛋白由S1基因的第二个ORF编码,是由146个氨基酸组成的非结构蛋白,分子量大小约为17 kDa。P17蛋白对于细胞的生命活动,例如基因转录、DNA合成,细胞生长调控等具有重要影响。NDRV与之对应推导的P18蛋白,是由162个氨基酸组成的非结构蛋白,分子量大小约为18 kDa,关于该蛋白的鉴定还需要实验进一步证实。
P17蛋白与其他蛋白没有序列相似性,在感染细胞的细胞核与细胞质中积累,并且能够不停地在细胞核和细胞质之间穿梭,为穿梭蛋白(shuttle protein),其靠近C端的第119位至128位氨基酸之间存在着一段功能性的核定位信号(nuclear localization signal,NLS),P17蛋白进出细胞核需借助运输蛋白CRM1[23]。关于禽呼肠病毒(ARV)P17蛋白对于细胞周期进程和宿主细胞蛋白翻译的影响一直在研究当中。感染或者转染的细胞在G2/M期积累[24],并且G2/M期蛋白ATM,P53,P21,Cdc2,细胞周期蛋白B1,Chk1,Chk2,和Cdc25C含量上升以及蛋白的磷酸化水平也上升,这表明P17蛋白对细胞周期的影响是通过激活上述的G2/M期的蛋白的途径,同时,其自噬蛋白Beclin 1和LC3-II的含量明显上升,说明P17蛋白可以诱导细胞产生自噬作用。P17蛋白可以导致G2/M期宿主细胞蛋白翻译关闭,同时真核翻译延伸因子2(eEF2)和起始因子(eIF2α)的磷酸化水平上升,与此相反的是在P17转染的细胞中,真核翻译起始因子eIF4E、eIF4B,和eIF4G,以及4E-BP1和MnK-1磷酸化水平下降,由此可见,P17蛋白翻译起始因子和翻译延伸因子导致宿主细胞蛋白翻译停滞。通过雷帕霉素抑制细胞的mTOR信号通路显示eIF4B,eIF4G磷酸化水平下降,eEF2磷酸化水平上升,但不影响病毒复制,这说明抑制帽依赖性蛋白的翻译不影响病毒的复制[25]。因此呼肠孤病毒P17蛋白诱导的G2/M期停滞和宿主细胞蛋白翻译关闭导致病毒复制增加。
ARV系列自噬实验发现,P17蛋白可以通过激活p53/PTEN(phosphatase and tensin homolog deleted on chromosome ten)信号通路调控细胞周期和自噬现象的产生。P17的功能是作为一个核孔蛋白Tpr(tetratricopeptide repeat)抑制器,激活P53、P21和PTEN信号通路。P17蛋白上存在一段序列119-IAAKRGRQLD-128,与Tpr相结合做为核定位信号(nuclear localization signal,NLS )抑制Tpr转录水平;同时,激活P53基因可以上调PTEN信号通路,这也说明P17蛋白可以作为PTEN信号通路的一个正向调控因子。P17蛋白激活PTEN信号通路是通过刺激细胞质中PTEN基因的磷酸化,提高Rak-PTEN连接水平,从而阻止泛素连接酶E3 NEDD4-1与其相连接。依靠Rock-1蛋白,PTEN可以从细胞质到细胞膜发生易位,P17蛋白促进β-arrestin介导的PTEN的易位作用。在细胞核中P53的积累导致细胞周期蛋白D1(cyclin D1)和CDK4的下调。如果敲除Tpr和CDK4,则增加了病毒的产量;与此相反,P53,PTEN和LC3的损耗则减少病毒复制[26]。因此,p17介导的Tpr的抑制作用可以促进p53,PTEN和p21的表达,抑制P13K/AKT/mTOR和ERK信号通路,促进病毒复制和细胞自噬。
3.3 σC蛋白σC蛋白是由S1基因第3个ORF编码,包含326个氨基酸,由多聚体(multimer)构成,单体为34.9 kDa,形成同源三聚体(homotrimer)后,分子量会增加到107 kDa,σC蛋白是一种结构蛋白,位于病毒衣壳的表面,主要包含2个区域:位于C末端的“头部”和位于N端的“轴”[27]。
在不同地区、不同血清型的呼肠孤病毒毒株中,通过进化树分析显示,S1片段相对于其他基因序列,具有显著地突变特性,而S1基因编码的σC蛋白,通过基因突变、基因重组等参与了病毒感染细胞、病毒自我复制的过程[28]。Zheng等[29]发现1株鸭呼肠孤病毒,通过序列比对发现其在σC基因上有一段18个氨基酸的缺失,进化树分析显示其为2型水禽呼肠孤病毒,接种之后发现鸭脾脏出血性坏死,并且具有明显的坏死斑,其在接种后前7 d的死亡率为20%~30%,证明此株病毒为高致病性的水禽呼肠孤病毒。因此,在不同的呼肠孤病毒毒株中,为了适应外界环境等一系列变化,σC蛋白经常发生突变,具有高度变异性的特征。
σC蛋白是细胞黏附蛋白,其N端存在着七肽(heptapeptide)的重复序列,其中第一位和第四位氨基酸是疏水性的,形成典型的α-螺旋(α-helical)结构,α-螺旋折叠形成卷曲的超螺旋结构(coiled-coil)[30];其C端存在着类似于罩衫的保护性结构,为保守区域。σC蛋白是多聚体形式存在于细胞中,这使得σC蛋白结构异常稳定。σC蛋白亚基不是通过共价二硫键连接,而是通过非共价的相互作用结合在一起,其182位至222位之间的半胱氨酸残基之间的二硫键降低了蛋白的稳定性。σC蛋白的重要性体现在以下2个方面:σC蛋白是一个具有高度变异性的蛋白,其氨基酸第1位至122位和196位至326为高度变异区域;σC蛋白可以特异性结合到细胞,使机体产生具有高度特异性中和抗体,激发机体粘膜和全身性的免疫反应的发生[31],诱导合胞体产生,因此,可以使用σC蛋白比较不同病毒株之间的差异。
通过siRNA敲除真核细胞延长因子alpha1(EEF1A1)基因,发现σC蛋白不能继续诱导细胞周期停滞,并且caspase-9、caspase-3和细胞色素C(cytocmome C)的释放减少,导致病毒在宿主细胞中增殖加快,EEF1A1对于σC蛋白诱导的细胞周期停滞和产生重要作用[32]。因此,σC蛋白在病毒感染以及病毒致病性方面具有重要作用。
呼肠孤病毒的σC蛋白为了适应外界环境,经常发生突变,具有高度变异的特性,因此可以用σC蛋白来分离鉴定不同的呼肠孤病毒毒株,比较不同毒株之间的序列差异,分析其序列差异与毒株致病力、免疫原性的关系,研究不同毒株之间的交叉保护性,可为基因工程疫苗的制备提供重要依据。
4 小结与展望
近几年来,除了新发ARV突变株可引起鸡矮小-发育综合征外[5],在我国安徽省、广东省、四川省和浙江省等陆续报道鸭群发生一种鸭呼肠孤病毒病,所分离的毒株与以往的禽源呼肠孤病毒相比,该病毒致病性更强、宿主范围更广、流行的区域逐年扩大,现已成为危害水禽养殖业的重要传染病原之一,这应该引起我们的高度关注。
结合其他呼肠孤病毒的研究成果,发现新发鸭呼肠孤病毒与经典的禽类呼肠孤病毒的主要差异在于S1基因节段编码的蛋白。就ARV而言,S1节段编码σC蛋白、P10蛋白、P17蛋白;经典MDRV对应的S4节段仅编码 σC蛋白和P10蛋白两个蛋白;而DRVS1节段编码σC蛋白、P10蛋白、P18蛋白。那么,禽源呼肠孤病毒毒力改变和宿主谱范围的扩大与S1节段编码蛋白的关系需要进一步用实验确定。
反向遗传操作平台可以实现在DNA水平上对RNA病毒进行加工或修饰,进而研究病毒基因组的结构和功能、病毒的转录、表达机制、以及病毒的致病机理等。然而,由于呼肠孤病毒具有多层衣壳蛋白组成的三维空间的结构和由10~12个节段的双链RNA的基因组结构以及呼肠孤病毒其独有的基因组节段特异性重新分配等原因,呼肠孤病毒的反向遗传操作平台晚于其他病毒,直至2011年,Kabayashi及其研究小组成员Boehme等[33]更细化和总结了MRV感染性克隆的构建,使得呼肠孤病毒的反向遗传学走向成熟,并且逐步应用到基础研究之中。作者所在实验室也率先成功构建鸭呼肠孤病毒的反向遗传操作平台,这为解析S1节段编码蛋白的功能、阐明病毒遗传变异规律及导致宿主谱变异和致病性改变的机制提供了可能,其研究结果将为禽源呼肠孤的疫病预防及控制提供新的思路。
[1] Fathey J E, Crawley J F. Studies on chronic respiratory disease of chickens II isolation of a Virus[J]. Can J Comp Med,1954,18∶13-21
[2] Olson N O, Shelton D C, Munro D A. Infectious synovitis control by medication; effect of strain differences and pleuropneumonia-like organisms[J]. Am J Vet Res, 1957,18(69)∶ 735-739.
[3] Walker E R, Friedman M H, Olson N O. Electron microscopic study of an avian reovirus that causes arthritis[J]. J Ultrastruct Res, 1972, 41(1)∶ 67-69.
[4] 王锡堃, 唐秀英, 刘庆祥, 等. 应用琼扩试验检查鸡病毒性关节炎[J]. 家畜传染病, 1985, 3∶ 26-27.
[5] Bányai K, Dandár E, Dorsey,et al. The genomic constellation of anovel avian orthoreovirus strain associated with runting-stunting syndrome in broilers[J].Virus Genes, 2011, 42(1)∶ 82-89.
[6] Malkinson M, Perk K, Weisman Y, Reovirus infection of young Muscovy ducks (Cairina moschata)[J]. Avian Pathol, 1981, 10(4)∶433-440.
[7] Marius J V, Le M Y. Histological data associated with muscovy duck reovirus infection[J]. Vet Rec, 1988,123(1)∶ 32-33.
[8] Ursula H R, Müllera H, Kaletaa E F. Structural and biological characteristics of reoviruses isolated from Muscovy ducks (Cairina moschata)[J]. Avian Pathol,1992, 21(3)∶481-491.
[9] 胡奇林, 陈少莺, 江斌, 等. 一种新的番鸭疫病(暂名番鸭肝白点病)病原发现[J]. 福建畜牧兽医, 2000, 22(6)∶1-3.
[10] Yun T, Yu B, Ni Z,et al.Genomic characteristics of a novel reovirus from Muscovy duckling in China [J]. Vet Microbiol, 2014,168(2-4)∶ 261-271.
[11] Woźniakowski G, Samorek-Salamonowicz E, Gaweł A. Occurrence of reovirus infection in Muscovy ducks(Cairina moschata) in south western Poland.Pol[J].Vet Sci, 2014, 17(2)∶ 299-305.
[12] Yun T, Yu B, Ni Z,et al. Isolation and genomic characterization of a classical Muscovy duck reovirus isolated in Zhejiang, China [J]. meegid, 2013(12)∶ 444.
[13] 程安春, 汪铭书, 陈孝跃, 等. 一种新发现的鸭病毒性肿头出血症的研究[J]. 中国兽医科技, 2003, 33(10)∶ 15-21.
[14] 刘红, 郁宏伟, 朱朝辉, 等. 鸭源呼肠孤病毒DRV-GZ株S2基因的序列分析及其表达[J]. 中国兽医科学, 2008,38(3)∶ 224-228.
[15] 陈少莺, 陈仕龙, 林锋强, 等. 一种新的鸭病(暂名鸭出血性坏死性肝炎)病原学研究初报[J]. 中国农学通报,2009(16)∶ 28-31.
[16] Liu Q F, Zhang G, Huang Y,et al. Isolation and characterization of a reovirus causing spleen necrosis in Pekin ducklings [J].Vet Microbiol, 2011, 148(2-4)∶ 200-206.
[17] 陈宗艳, 朱英奇, 王世传, 等. 一株新型鸭源呼肠孤病毒(TH11株)的分离与鉴定[J]. 中国传染病学报, 2012,20(1)∶ 10-15.
[18] Chen Z Y, Zhu Y Q, Li C F,et al. Outbreak-associated novel duck Reovirus, China, 2011[J]. Emerg Infect Dis,2012, 18(7)∶ 1209-1211.
[19] Javier B, Jose M C. Avian reovirus∶ structure and biology[J]. Virus Res, 2006, 123 (2007)∶ 105-119
[20] Shmulevitz M, Salsman J, Duncan R. Palmitoylation,membrane-proximal basic residues, and transmembrane glycine residues in the reovirus p10 protein are essential for syncytium formation[J]. Virology, 2003,77(18)∶ 9769-9779.
[21] Key T, Duncan R. A compact, multifunctional fusion module directs cholesterol-dependent homomultimerization and syncytiogenic efficiency of reovirus p10 FAST proteins[J]. PLoS Pathog, 2014, 10(3)∶ e1004023.
[22] Key T, Sarker M, de Antueno R,et al. The p10 FAST protein fusion peptide functions as a cystine noose to induce cholesterol-dependent liposome fusion without liposome tubulation[J]. BBA-Biomembranes, 2014,1848(2)∶ 408-416.
[23] Costas C, Martinez-Costas J, Bodelon G,et al. The second open reading frame of the avian reovirus S1 gene encodes a transcription-dependent and CRM1-independent nucleocytoplasmic shuttling protein[J]. J Virol, 2005, 79(4)∶ 2141-2150.
[24] Julius L C, Wei R, Huang L,et al. Avian reovirus nonstructural protein p17-induced G2/M cell cycle arrest and host cellular protein translation shutoff involve activation of p53-dependent pathways[J]. J Virol, 2014,88(3)∶1856.
[25] Chi P I, Huang W R., Lai I H,et al. The p17 nonstructural protein of avian reovirus triggers autophagy enhancing virus replication via activation of phosphatase and tensin deleted on chromosome 10 (PTEN) and AMP-activated protein kinase (AMPK), as well as dsRNA-dependent protein kinase (PKR)/eIF2alpha signaling pathways[J]. J Biol Chem, 2013, 288(5)∶ 3571-3584.
[26] Huang W R, Chiu H C, Liao T L,et al. Avian Reovirus Protein p17 Functions as a Nucleoporin Tpr Suppressor Leading to Activation of p53, p21 and PTEN and Inactivation of PI3K/AKT/mTOR and ERK Signaling Pathways[J]. PLoS One, 2015, 10(8)∶ e0133699.
[27] Grande A, Costas C, Benavente J.Subunit composition and conformational stability of the oligomeric form of the avian reovirus cell-attachment protein sigmaC[J]. J Gen Virol, 2002, 83(Pt 1)∶ 131-139.
[28] Liu H J, Lee L H, Hsu H W,et al. Molecular evolution of avian reovirus∶ evidence for genetic diversity and reassortment of the S-class genome segments and multiple cocirculating lineages[J]. Virology, 2003, 314(1)∶336-349.
[29] Zheng X, Wang D, Ning K,et al. A duck reovirus variant with a unique deletion in the sigma C gene exhibiting high pathogenicity in Pekin ducklings[J]. Virus Res,2016, 215∶ 37-41.
[30] Grande A, Costas C, Benavente J. Subunit composition and conformational stability of the oligomeric form of the avian reovirus cell-attachment protein sigmaC[J]. J Gen Virol, 2002, 83(Pt 1)∶ 131-139.
[31] Lin K H, Hsu A P, Shien J H,et al. Avian reovirus sigma C enhances the mucosal and systemic immune responses elicited by antigen-conjugated lactic acid bacteria[J].Vaccine, 2012, 30(33)∶ 5019-5029.
[32] Zhang Z, Lin W, Li X,et al. Critical role of eukaryotic elongation factor 1 alpha 1 (EEF1A1) in avian reovirus sigma-C-induced apoptosis and inhibition of viral growth[J]. Arch Virol, 2015, 160(6)∶ 1449-1461.
[33] Boehme K W, Ikizler M, Kobayashi T,et al. Reverse genetics for mammalian reovirus[J]. Methods, 2011,55(2)∶ 109-113.
PROGRESS ON MOLECULAR BIOLOGY OF S1 GENE SEGMENT OF AVIAN REOVIRUSES
WU Qiao-mei, LIU Guang-qing, CHEN Zong-yan
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
S852.659.4
A
1674-6422(2017)04-0074-08
2016-05-13
自然科学基金(31502068);国家重点研发计划(2016YFD0500800);上海市科委科技创新(13391901602)
吴巧梅,女,硕士研究生,预防兽医学专业
陈宗艳,E-mail:zychen@shvri.ac.cn

