单增李斯特菌inlK基因缺失株的构建及其生物学特性分析
王少辉,刘萍萍,魏建超,邵东华,赵秋华,史子学,马志永
(1. 中国农业科学院上海兽医研究所,上海 200241;2.上海市闵行区动物疫病预防控制中心,上海 201109)
单增李斯特菌inlK基因缺失株的构建及其生物学特性分析
王少辉1,刘萍萍1,魏建超1,邵东华1,赵秋华2,史子学1,马志永1
(1. 中国农业科学院上海兽医研究所,上海 200241;2.上海市闵行区动物疫病预防控制中心,上海 201109)
为了分析内化素InlK对单增李斯特菌(Listeria monocytogenes,LM)生物学特性及致病性的影响,利用自杀性质粒进行同源重组构建LM标准菌株10403s的inlK基因缺失株,然后比较分析野生株、inlK基因缺失株的生长特性、生物被膜形成能力、细胞侵袭能力、动物致病力等差异。结果显示,inlK基因缺失不影响LM的生长速度,但可导致LM的生物被膜形成能力下降。细胞感染试验表明基因缺失株ΔinlK对RAW264.7细胞的侵袭及胞内存活能力分别下降了18%和31%。动物感染试验显示野生株和基因缺失株ΔinlK对小鼠的致死率分别为80%(4/5)和40%(2/5),且基因缺失株ΔinlK的体内定殖能力显著低于野生株。本研究表明内化素InlK在LM感染过程中发挥着重要作用,为了解LM的致病作用提供参考。
单增李斯特菌;inlK基因;致病性
Abstract:To determine the biological role of internalin InlK of Listeria monocytogenes (LM), the inlK gene mutant strain ΔinlK was constructed from the virulent strain 10403s by the homologous recombination technology. The growth curve, bio fi lm formation, adhesion and invasion capacity to RAW264.7 cells and and pathogenicity in mice of wild-type strain, and mutant strain were determined. The results showed that inactivation of the inlK gene did not affect the growth but the bio fi lm formation decreased. Moreover, the invasion and intracellular survival capacities of mutant ΔinlK reduced by 18% and 31% as compared with the wild-type strain. In the mouse infection experiment, the mortality rate of wild-type strain and mutant ΔinlK was 80% (4/5) and 40% (2/5), respectively. Moreover, mutant strain ΔinlK displayed signi fi cant decreased colonization capacity in mice. These data indicated that internalin InlK was involved in the LM infection, indicating its contribution to pathogenicity.
Key words:Listeria monocytogenes; inlK gene; pathogenicity
单核细胞增多性李斯特菌(Listeria monocytogenes,LM)又称单增李斯特菌,是一种胞内寄生的革兰阳性杆菌。LM是重要的人兽共患病原菌,广泛存在于自然界,由于LM耐受环境能力强,近年来,由单增李斯特菌引起的食物中毒的情况日趋严重,在欧美等地由LM造成的食物污染程度和病例已大大超过沙门菌[1-3],对食品安全已形成严重威胁。LM经污染食物进入人和动物体内后,入侵肠道上皮细胞,扩散至全身从而引起败血症、脑膜炎及孕妇孕畜流产等。李斯特菌病虽发病率不高,但其致死率(20%~30%)远高于其他常见食源性病原菌[4,5]。
LM侵入宿主后,毒力因子在黏附、侵袭等致病过程中发挥重要作用,因此研究LM毒力因子的分子致病机理,有助于李斯特菌病的防控。内化素在LM侵袭宿主细胞过程中发挥重要作用,目前在LM基因组中发现了25种内化素,其中,内化素InlA和InlB在介导LM穿越宿主血脑屏障、血胎屏障的过程中都起着重要的作用[6-9]。其他内化素的具体作用机制尚不清楚。Glaser等[10]通过比较基因组学分析发现lmo1290(inlK)基因仅存在于LM中,不存在于非致病性李斯特菌中,且LM感染过程中其表达明显上升,提示lmo1290(inlK)基因参与LM致病过程。David等[11]通过蛋白结晶分析了InlK具有内化素的保守序列。Laurent等[12]阐明了内化素InlK在LM逃避自噬过程中的作用。然而,inlK基因对LM的生物学特性的影响尚不十分清楚。因此,本文构建LM菌株10403s的inlK基因缺失株,并对其生物学特性进行研究。
1 材料与方法
1.1 菌株与质粒单增李斯特菌标准菌株10403s由浙江大学方维焕教授惠赠;大肠杆菌DH5α感受态细胞购自天根(北京)生化科技有限公司;温度敏感性穿梭质粒pKSV7由本实验室保存;pMD18T载体购自大连TaKaRa公司。
1.2 主要试剂和仪器脑心浸液培养基(Brain Heart Infusion,BHI)购自青岛海博生物科技有限公司;质粒提取试剂盒购自天根(北京)生化科技有限公司;2×PCR Mix、DNA Marker购自北京康为世纪生物科技有限公司;限制性内切酶购自大连TaKaRa公司;PCR仪为ABI公司产品;核酸电泳仪购自北京市六一仪器厂;全自动凝胶成像系统为Bio-Rad公司产品。
1.3 引物设计根据单增李斯特菌10403s基因组序列,设计inlK基因上游同源臂扩增引物、下游同源臂扩增引物、缺失鉴定引物及互补引物(表1),由英潍捷基(上海)贸易有限公司合成。
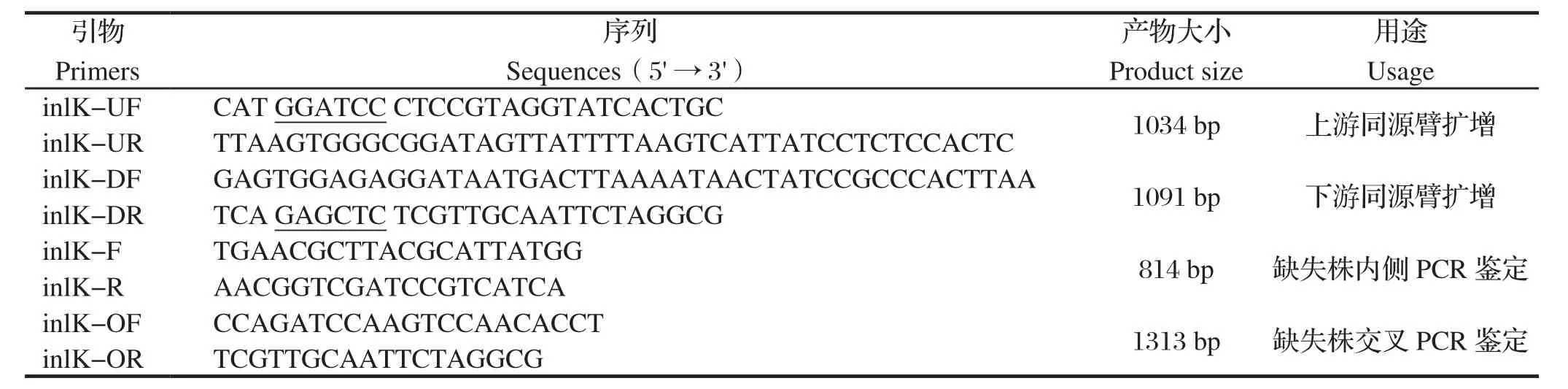
表1 本研究中使用引物Table 1 Primers used in this study
1.4 基因缺失株的构建根据同源重组原理构建LM10403sinlK基因缺失株。以细菌基因组为模板,分别PCR扩增inlK基因的上下游同源臂片段,回收PCR产物。然后以PCR产物为模板进行融合PCR将inlK基因上下游同源臂连接,并克隆至pMD18T载体测序。提取测序正确的质粒,双酶切后克隆至自杀性质粒pKSV7。然后将重组自杀性质粒pKSV7-inlKUD转化至LM10403s中,通过温度和氯霉素抗性压力进行同源重组,然后在无抗性压力下传代,使载体丢失,经PCR和测序鉴定基因缺失株,获得的基因缺失株命名为ΔinlK株。
1.5 生长曲线测定测定LM10403s和基因缺失株ΔinlK的生长速度,分析inlK基因是否影响LM的生长特性。将菌液按1∶100接种于LB培养基,于37℃、200 r/min振荡培养,每小时取样并测定菌液的OD600,记录并绘制生长曲线图。
1.6 生物被膜形成能力测定将LM10403s和基因缺失株ΔinlK在相同条件下培养,调节OD600至1.0,按1∶100比例稀释至BHI培养基中,分别加入96孔聚苯乙烯微孔板,每孔200 μL,37℃静置培养24 h。弃去培养液,用无菌PBS洗涤3次后加入200 μL结晶紫染色1 h。然后用PBS洗涤5次,自然风干后加入200 μL 95%乙醇,作用5~10 min,测定OD595,以无菌培养基作为阴性对照。
1.7 细胞侵袭试验在BHI培养基中培养LM10403s及ΔinlK至对数生长期,收集菌体,用DMEM洗涤重悬。按10 MOI感染RAW264.7细胞,于37℃、5%CO2的细胞培养箱中感染1 h,以DMEM作为阴性对照。用无菌PBS洗涤3次,用含有庆大霉素(100 μg/mL)的DMEM作用1 h和3 h,用无菌PBS洗涤3次,然后用0.5% Triton-X 100裂解细胞并倍比稀释,涂BHI平板,进行菌落计数。
1.8 动物致病性测定将对数生长期细菌用无菌PBS洗涤3次,重悬。以攻毒剂量为1×104CFU感染6~8周龄BALB/c小鼠,每组5只,连续观察14 d,观察并记录小鼠死亡情况。
1.9 体内载菌量测定将对数生长期细菌用无菌PBS洗涤3次,然后重悬,以腹腔方式感染8周龄BALB/c小鼠,攻毒剂量为1×105CFU/只,每组6只。24 h后,无菌采取脾脏,加入PBS匀浆,倍比稀释涂布平板,37℃培养过夜后进行菌落计数,测定不同菌株在脾脏中的定殖生存能力。
2 结果
2.1 基因缺失株、互补株的构建及鉴定将重组自杀性质粒pKSV7-inlKUD电转化至LM感受态细胞后,挑取疑似基因缺失株进行PCR鉴定,结果显示缺失株内侧鉴定引物无法扩增出inlK基因。交叉PCR鉴定显示野生株可以扩增出目的条带,而缺失株则无目的条带(图1)。PCR产物测序结果表明,基因缺失株ΔinlK构建成功。
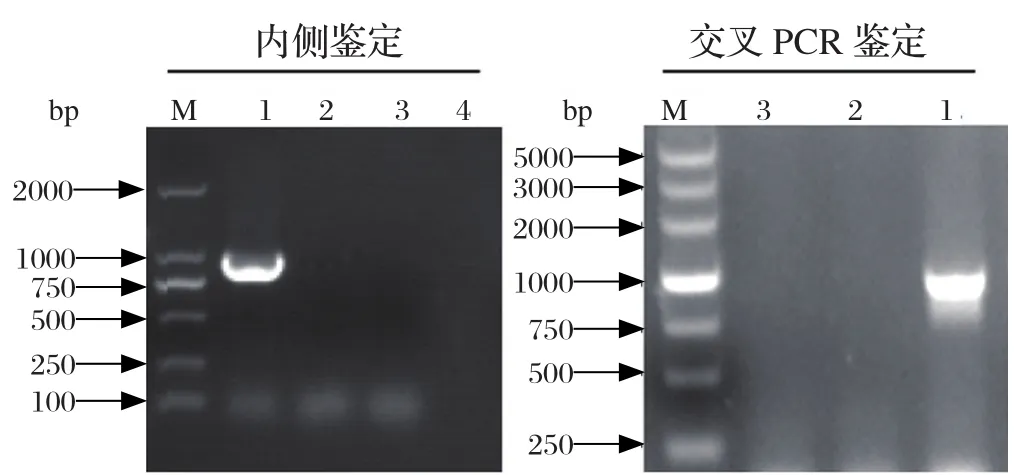
图1 基因缺失株ΔinlK的PCR鉴定Fig.1 Identi fi cation of mutant strain ΔinlK by PCR
2.2 生长曲线测定生长曲线结果显示,基因缺失株ΔinlK的生长速度与野生株相比无显著变化,表明inlK基因不影响LM的生长(图2)。
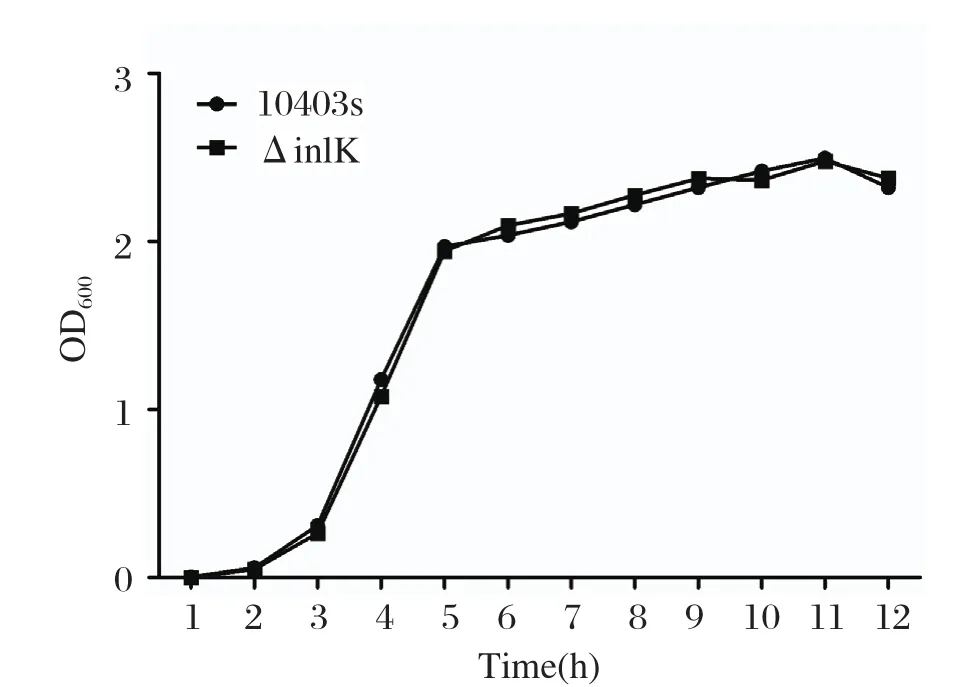
图2 基因缺失株与野生株的生长曲线测定Fig.2 Bacterial growth curve of mutant ΔinlK and wild-type strain
2.3 生物被膜形成能力测定生物被膜在细菌抵抗外界不利环境过程中发挥作用,由图3可见,缺失株ΔinlK与野生株相比,生物被膜形成能力显著下降(P< 0.01),表明inlK基因对于LM形成生物被膜具有重要作用。
2.4 侵袭能力测定分析显示inlK基因编码内化素,可能参与LM侵袭细胞及胞内存活。细胞侵袭试验结果显示,缺失株ΔinlK对RAW264.7细胞的侵袭及胞内存活能力均显著低于野生株(P< 0.01),表明inlK基因在LM侵袭细胞过程中发挥重要作用(图4)。
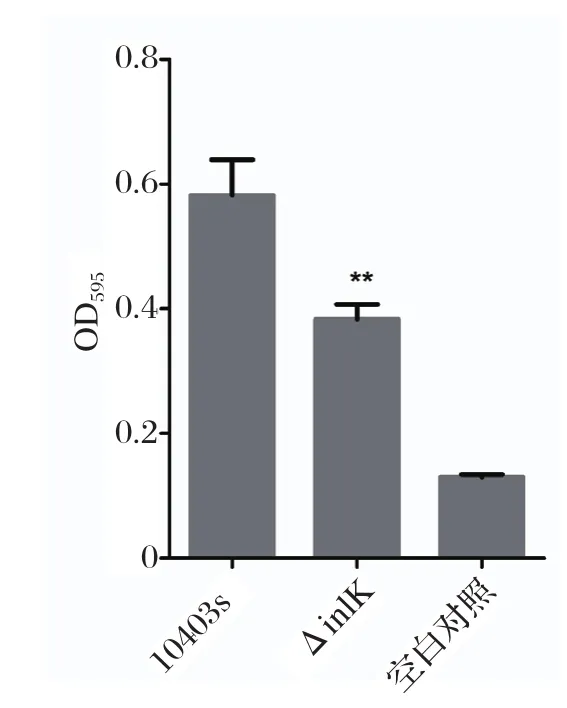
图3 生物被膜形成能力测定Fig.3 Determination of bio fi lm formation capacity of LM
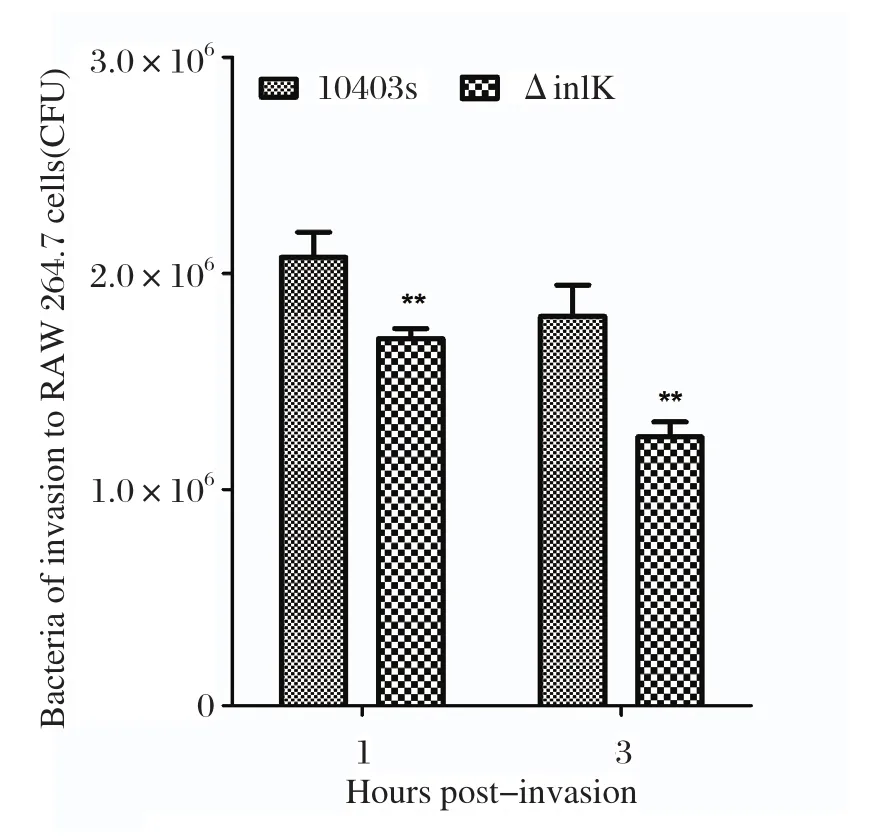
图4 细胞侵袭试验结果Fig.4 Invasion capacity of LM to RAW264.7 cells
2.5 致病性测定动物攻毒试验结果显示,LM10403s和基因缺失株ΔinlK对BALB/c小鼠的致死率分别为80%(4/5)和40%(2/5)(图5),表明inlK基因缺失导致LM致病力明显降低。
2.6 体内载菌量测定体内载菌量统计结果显示缺失株ΔinlK感染小鼠后,其在脾中的定殖能力均明显低于野生株(P<0.05)(图6),表明缺失株ΔinlK对小鼠的感染能力下降,毒力降低。
3 讨论
LM能引起人、畜李斯特菌病,感染后主要表现为败血症、脑膜炎和单核细胞增多等症状。近年来,由单增李斯特菌引起的食物中毒的情况日趋严重,在欧美等地由此菌造成的食物污染程度和病例已大大超过沙门菌[1,3-5]。LM在体内感染及胞内感染过程中,其毒力因子相互协作,从而有利于LM感染及致病。目前,LM的毒力相关基因主要为毒力岛Ⅰ和毒力岛Ⅱ[5]。由于LM是典型的胞内寄生病原菌,内化素对于LM侵袭细胞及胞内存活至关重要。目前,已经鉴定了25个内化素,其中InlA、InlB的功能研究较为透彻,在LM穿透血脑屏障和血胎屏障过程中发挥重要作用。利用InlC作为探针进行DNA杂交,发现了一些新的内化素InlC2、InlD、InlE和InlF,然而其具体作用有待进一步研究[6-8]。研究表明,InlJ在感染小鼠的过程中发挥作用,但是其具体作用机制尚不清楚[13]。前期研究结果表明,inlK基因编码内化素,且有助于LM逃避自噬,从而发挥致病作用。然而,inlK基因对LM的生物学特性的影响尚不十分清楚。
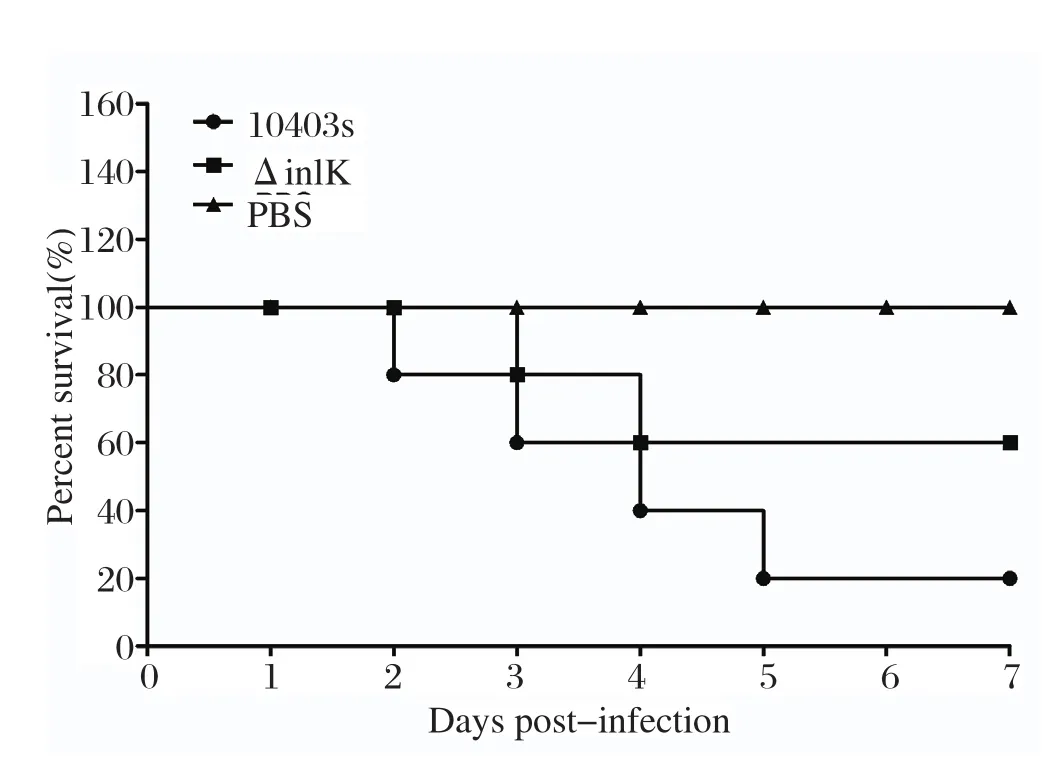
图5 基因缺失株与野生株存活曲线Fig.5 Survival curve of mutant ΔinlK and virulent strain
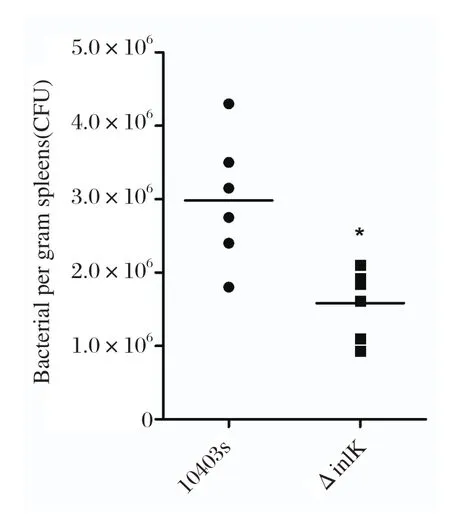
图6 单增李斯特菌感染小鼠脾脏载菌量测定Fig.6 Bacterial loads in spleens of mice infeted with LM
LM的内化素均含有亮氨酸重复序列,位于细菌表面,可以识别细胞受体和帮助LM逃避自噬[6,11]。本研究构建了LM标准菌株10403s的inlK基因缺失株,生长曲线结果表明内化素InlK不影响LM的生长速度。生物被膜是细菌为适应外界环境变化而选择的一种与浮游形式不同的生长方式,可增强细菌对抗生素及宿主的免疫反应,因此有利于细菌存活。缺失内化素InlK导致LM的生物被膜形成能力显著降低。内化素InlK位于LM细胞膜外,可能与细菌胞外蛋白或组织表面物质发生相互作用,有助于LM吸附于组织表面,这可能是野生株比缺失株生物被膜形成能力强的原因之一。
由于内化素在LM侵袭细胞过程中发挥重要作用[8],因此本研究分析了内化素InlK对LM侵袭RAW264.7细胞的影响,结果显示缺失株对RAW264.7细胞的侵袭率及胞内存活能力均明显低于野生株,表明内化素InlK有助于LM的侵袭及胞内存活。以小鼠为模型进行的体内感染试验结果显示,缺失内化素InlK导致LM在脾脏中的定殖能力显著降低,从而导致缺失株的致病力下降。LM的其他内化素,包括InlA、InlB、InlJ的基因缺失株在感染小鼠后,其在体内定殖能力亦显著低于野生株,从而降低致病力及致死率。另外,InlK可以招募穹窿体蛋白促进LM逃避自噬,增强其在体内定殖及存活能力,发挥致病作用。因此,缺失InlK可能降低了LM的胞内存活能力及致病力。
本研究成功构建了LM内化素inlK基因缺失株,并开展了InlK对LM生长特性、生物被膜形成能力、细胞侵袭能力、小鼠致病性的影响,为进一步研究LM的致病机理及防控李斯特菌病提供参考。
[1] Gombas D E, Chen Y, Clavero R S,et al. Survey ofListeria monocytogenesin ready-to-eat foods[J]. J Food Prot, 2003, 66(4)∶ 559-569.
[2] Liu D. Identification, subtyping and virulence determination ofListeria monocytogenes, an important foodborne pathogen[J]. J Med Microbiol, 2006, 55(Pt 6)∶645-659.
[3] Soto B M, Gerba C P, Porto F A,et al. Prevalence and characterization ofListeria monocytogenes, Salmonella and Shiga toxin-producingEscherichia coliisolated from small Mexican retail markets of queso fresco[J]. Int J Environ Health Res, 2015, 25(2)∶ 140-148.
[4] Mammina C, Aleo A, Romani C,et al. Characterization ofListeria monocytogenesisolates from human listeriosis cases in Italy[J]. J Clin Microbiol, 2009, 47(9)∶ 2925-2930.
[5] Mostowy S, Cossart P. From pathogenesis to cell biology and back[J]. Cell Host Microbe, 2009, 5(6)∶ 510-513.
[6] Bierne H, Sabet C, Personnic N,et al. Internalins∶ a complex family of leucine-rich repeat-containing proteins inListeria monocytogenes[J]. Microbes Infect,2007, 9(10)∶ 1156-1166.
[7] Braun L, Dramsi S, Dehoux P,et al. InlB∶ an invasion protein ofListeria monocytogeneswith a novel type of surface association[J]. Mol Microbiol, 1997, 25(2)∶ 285-294.
[8] Cabanes D, Dehoux P, Dussurget O,et al. Surface proteins and the pathogenic potential ofListeria monocytogenes[J]. Trends Microbiol, 2002, 10(5)∶ 238-245.
[9] Cossart P, Toledo-Arana A.Listeria monocytogenes,a unique model in infection biology∶ an overview[J].Microbes Infect, 2008, 10(9)∶ 1041-1050.
[10] Glaser P, Frangeul L, Buchrieser C,et al. Comparative genomics of Listeria species[J]. Science, 2001, 294(5543)∶849-852.
[11] Neves D, Job V, Dortet L,et al. Structure of internalin InlK from the human pathogenListeria monocytogenes[J].J Mol Biol, 2013, 425(22)∶ 4520-4529.
[12] Dortet L, Mostowy S, Samba-Louaka A,et al.Recruitment of the major vault protein by InlK∶ aListeria monocytogenesstrategy to avoid autophagy[J]. PLoS Pathog, 2011, 7(8)∶ e1002168.
[13] Sabet C, Toledo-Arana A, Personnic N,et al. TheListeria monocytogenesvirulence factor InlJ is specifically expressedin vivoand behaves as an adhesin[J]. Infect Immun, 2008, 76(4)∶ 1368-1378.
CONSTRUCTION AND CHARACTERIZATION OF INLK GENE MUTANT STRAIN OF LISTERIA MONOCYTOGENES
WANG Shao-hui1, LIU Ping-ping1, WEI Jian-chao1, SHAO Dong-hua1, ZHAO Qiu-hua2, SHI Zi-xue1,MA Zhi-yong1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Minhang Center of Animal Disease Prevention and Control in Shanghai, Shanghai 201109, China)
S852.615
A
1674-6422(2017)04-0019-05
2016-08-10
国家自然科学基金(81201266)
王少辉,男,汉族,副研究员,主要从事畜禽细菌性传染病研究
马志永, E-mail:zhiyongma@shvri.ac.cn

