蝙蝠在冠状病毒传播中的作用
(1.辽宁省本溪市桓仁畜产品安全监察所,桓仁 117200;2.河北省唐山市乐亭县畜牧兽医局,乐亭 063600)
宫 婷1,张英海2
·综述·
蝙蝠在冠状病毒传播中的作用
(1.辽宁省本溪市桓仁畜产品安全监察所,桓仁 117200;2.河北省唐山市乐亭县畜牧兽医局,乐亭 063600)
严重性急性呼吸系统综合症(severe acute respiratory syndrome,SARS),又名非典型性肺炎,虽爆发已经10年过去了,恐惧依旧笼罩在人们心中,近日,中东呼吸系统综合症(middle east respiratory syndrome,MERS)又强势来袭,再次引发了人们对冠状病毒的强烈关注。近年来研究证明,蝙蝠在冠状病毒的传播中具有重要作用。本文对冠状病毒的多样性和蝙蝠在冠状病毒传播中作用进行了比较系统综述。
冠状病毒;蝙蝠;病毒传播
宫 婷1,张英海2
Abstract:Despite severe acute respiratory syndrome (SARS, also known as atypical pneumonia) has passed for more than a decade,worries caused by this disease still exist. What’s worse, the middle east respiratory syndrome (MERS) also broke out recently,which causes a strong concern for coronavirus again. Recent studies have shown that bats play an important role in the transmission of coronavirus. In this paper, the diversity of coronavirus and the role of bats in the transmission of coronavirus are systematically summarized and analyzed by reviewing relative literatures.
Key words:Coronavirus; bats; virus transmission
2013年10月30日,国际著名学术期刊《Nature》发表了一篇关于成功分离鉴定到使用血管紧张素转换酶Ⅱ(Angiotensin cinverting enzymeⅡ,ACE 2)作为受体的蝙蝠源SARS样冠状病毒的文章[1],该工作由中国科学院武汉病毒所病毒学国家重点实验室完成,而《Nature reviews microbiology》于2013年11月11日再次对该研究成果进行了报道[2]。尽管在此之前,蝙蝠已经被认为是严重急性呼吸系统综合症冠状病毒(Severe acute respiratory syndrome coronavirus,SARS-CoV)和中东呼吸系统综合症冠状病毒(Middle east respiratory syndrome coronavirus,MERSV-CoV)的天然宿主[3],但从蝙蝠中分离冠状病毒始源病毒的尝试一直没有成功,该研究成果在世界上首次报道了使用VERO E6细胞成功分离到活的SARS样冠状病毒(bat SLCoV-WIV1),该病毒使用ACE 2受体,为菊头蝠是SARS-CoV天然宿主而且人感染SARS-CoV可能不需要中间宿主提供了强有力的证据,也再次引发了人们对于蝙蝠在冠状病毒传播中作用的关注。
SARS是21世纪发生的第一个世界范围内流行的传染病。该病在2012年11月爆发于华南地区,并迅速传播至超过33个国家和地区,共计引起了8096人感染,并造成774人死亡,致死率高达9.6%,并造成了巨大的经济损失[4]。SARS的病原体SARSCoV最先由德国人Drosten C等[5]于2003年发现,并于2003年4月10日在《The New England Journal of Medicine》杂志上发表。为了追寻SARS-CoV的来源,多个研究小组开展了分子流行病学研究,并于2003年从广东省野生动物交易市场的果子狸和其他两种动物体内分离到了SARS-CoV,中国SARS分子流行病学协作组认为早期的SARS-CoV毒株可能来自于野生动物[6]。2005年,包括香港大学和中国科学院动物研究所的研究小组先后从菊头蝠中发现了SARS样冠状病毒,为蝙蝠是SARS-CoV自然宿主的观点提供了证据[7,8]。这一发现与当时从非洲狐蝠中发现埃博拉病毒一起引发了研究人员对于蝙蝠作为新出现病原体宿主这一课题的巨大兴趣。这也导致了自SARS爆发之后,Genbank中蝙蝠源冠状病毒序列信息的持续增加,尤其是二代测序技术的成熟及Genbank对于提交序列要求的变化,导致了2009年之后蝙蝠源冠状病毒序列信息剧增(图1)。而蝙蝠源冠状病毒相关文章的数量也在SARS之后猛增至每年700多篇(图2)。随着SARS-CoV影响的减退,蝙蝠源冠状病毒的序列信息增加有所放缓,而且相关文章数量也有所减少,但2012年中东地区MERSCoV的出现及其后续研究证明其可能来源于蝙蝠[9,10],让许多研究小组重新意识到了蝙蝠在冠状病毒传播中的重要性,蝙蝠源冠状病毒的序列信息和文章数量开始了新一轮的剧增[11],同时也让人们开始重新审视蝙蝠这一古老而又庞大的物种在冠状病毒传播中作用。
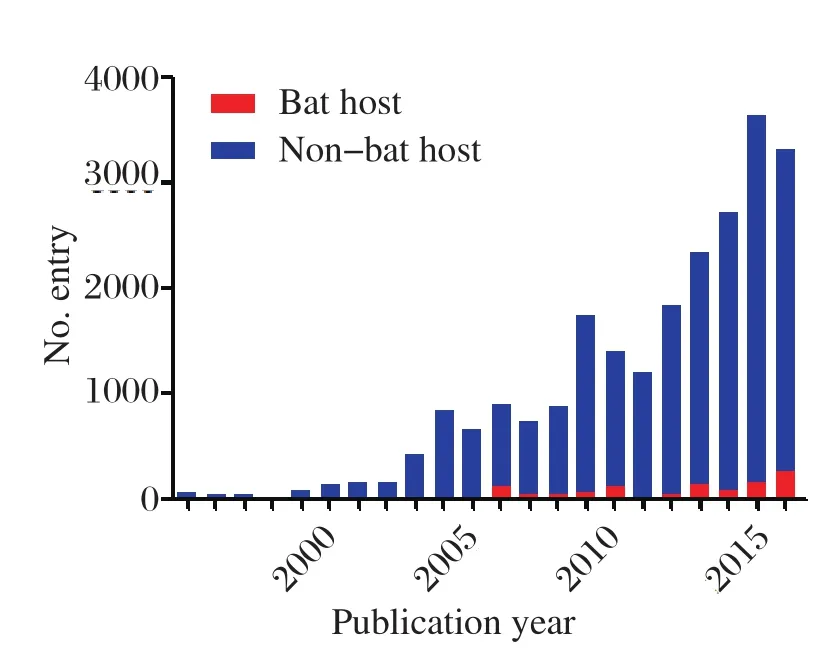
图1 截止2017年3月26日Genbank数据库中冠状病毒相关的序列信息数量Fig.1 The numbers of coronavirus-related sequence information in Genbank database as of March 26, 2017
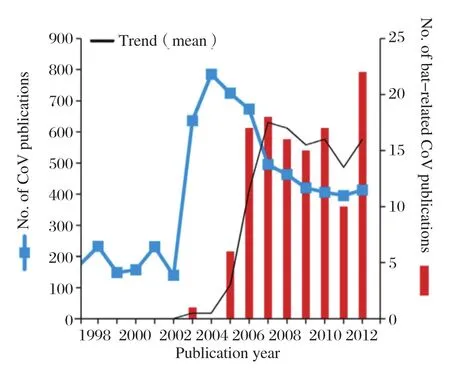
图2 截止2013年7月16日PubMed数据库冠状病毒相关的文章数量Fig.2 The numbers of coronovirus-related articles in PubMed database as of July 16, 2013
1 冠状病毒的特征及研究进展
冠状病毒在系统分类上属于套式病毒目、冠状病毒科的成员,病毒表面有囊膜,囊膜表面覆有纤突,纤突末端呈球形,由于囊膜纤突规则的排列成皇冠状,冠状病毒的名称由此而来。冠状病毒的基因组为不分节段的单股正链RNA,基因组大小为26.4~31.7 kb,是所有RNA病毒中最大的。在其结构蛋白中,刺突蛋白(S,180~200 kDa)是构成病毒表面冠状结构的主要成分,也是病毒与宿主细胞受体结合并介导包膜与细胞膜融合引起病毒入侵的主要结构蛋白。冠状病毒的自然宿主范围广泛,从鸟类到人都可以感染冠状病毒[12,13],甚至有报道白鲸也感染冠状病毒[14]。根据国际病毒分类委员会(ICTV)2013年3月5日公布的分类标准,冠状病毒亚科分为4个属:阿尔法冠状病毒属,包括阿尔法冠状病毒1、人冠状病毒229E(HCoV 229E)、人冠状病毒NL63(HCoV NL63)、长翼蝙蝠冠状病毒1、长翼蝙蝠冠状病毒HKU8、猪流行性腹泻病毒、菊头蝠冠状病毒HKU2和黄蝠属蝙蝠冠状病毒512;贝塔冠状病毒属,包括贝塔冠状病毒1、人冠状病毒HKU1、小鼠冠状病毒、伏翼蝙蝠冠状病毒HKU5、果蝠冠状病毒HKU9、SARS相关冠状病毒(SLCoV)和扁颅蝠冠状病毒HKU4;德尔塔冠状病毒属,包括HKU11、HKU13和HKU12;伽马冠状病毒属,包括禽冠状病毒和白鲸冠状病毒SW1[15]。
造成冠状病毒多样性的原因有很多,综述近年来相关的报道,可能有以下原因:首先,冠状病毒RNA依赖的RNA聚合酶不具备纠错能力,导致其复制过程中的突变率非常高,大约为10~4核苷酸替换/位点/年[16]。虽然有研究表明冠状病毒中含有校正读码酶,但仍然有一部分病毒的突变率非常高,SARS-CoV和MERS-CoV的宿主转换就是很好的证明。其次,在RNA复制期间,由“复制选择”介导的独特的随机模板转换机制导致了非常高的同源RNA重组频率,Woo等[17]通过对22株HCoVHKU1进行了全基因组测序和进化分析,发现基因组不同部分的广泛重组产生了3种基因型的HCoVHKU1。第三,冠状病毒还可以通过异源重组从非冠状病毒的RNA病毒中获得新的基因,一个很著名的例子就是从C型流感病毒中获得了血凝素酯酶(haemagglutinin esterase,HE)基因。第四,冠状病毒的基因组是所有RNA病毒中最大的(26.4~31.7 kb),使得冠状病毒在调整基因和修饰基因方面具有更高的可塑性。第五,冠状病毒的宿主谱非常广泛,从哺乳动物(包括人)到鸟类甚至白鲸,作为目前研究热点的宿主—蝙蝠,由其组成的翼手目是哺乳纲中的第二大目,大约有1000多种,占哺乳纲总物种的20%[18],哺乳纲第一大目—啮齿目中也有冠状病毒感染的存在,而鸟类中同样有冠状病毒的感染存在,全世界范围内有接近10 000种鸟类存在,是陆生脊椎动物中数量最多的以纲;而且蝙蝠和鸟类具有飞行能力,能够比陆地动物到达更远的地方,这使他们能够与不同的物种进行遗传物质的交换;对于不同种类的蝙蝠和鸟类中的冠状病毒,不同的环境给予了他们不同的选择压力;蝙蝠的栖息特征和鸟类的群居性使得大量的蝙蝠和鸟类能够聚集起来,这也有利于不同蝙蝠和鸟类个体中病毒的交流。以上原因不仅导致了冠状病毒毒株和基因型多样性的产生,还形成了能够适应新的宿主和生态龛位的新病毒的出现,这些病毒甚至引起了灾难性人兽共患病的爆发[14],例如有研究表明HCoVOC43和HCoV-229E很有可能来自于动物宿主,通过对刺突蛋白的分子钟分析表明HCoV-43可能在1890年左右从牛冠状病毒(Bovine coronavirus, BCoV)进化而来,而HCoV-229E可能在200年前左右从蝙蝠的阿尔法冠状病毒中进化而来[19]。
尽管对于冠状病毒的研究取得了巨大的进展,但仍然面临着许多未解之谜。冠状病毒具有高度的多样性,但蝙蝠源冠状病毒却表现出高度的宿主限制性,有研究表明2种不同的冠状病毒不能感染同一种蝙蝠,更不会感染同一只蝙蝠(一个例外的情况,马铁菊头蝠感染了两种不同的病毒)[20],产生这种现象的原因至今尚未明确。此外,冠状病毒的分离、冠状病毒跨种传播的分子机制、冠状病毒感染后引起的免疫病理学原理及冠状病毒逃避先天性免疫反应的机制等均有待进一步的研究[21]。
2 蝙蝠与冠状病毒
蝙蝠是包括狂犬病病毒、马尔堡病毒、尼帕病毒、亨德拉病毒等多种人类病毒的储存宿主[20]。蝙蝠可以持续感染许多病毒而不表现出临床症状。蝙蝠的这些特性及华南和亚洲其他地区食品和传统药物市场中蝙蝠和蝙蝠产品出现的持续增多,促使人们在研究SARS-CoV及其他病毒天然宿主的过程中开始关注蝙蝠。
有研究表明,人冠状病毒中至少3种可能来源于动物宿主,其中包括SARS-CoV,可能来源于中国菊头蝠(菊头蝠科);HCoV-OC43,可能来源于牛冠状病毒(BCoV);HCoV-229E,通过分子钟分析表明在二百多年前可能与叶鼻蝠中发现的冠状病毒具有最近的共同祖先,蝙蝠与人冠状病毒之间的紧密联系形成了一个推论:所有的人类冠状病毒甚至是哺乳动物的冠状病毒均来自于蝙蝠[22]。
蝙蝠与冠状病毒之间存在联系是一个世界性的现象,2005年中国学者最先报道了在中国蝙蝠中发现了冠状病毒,后续的研究证实在北美、拉丁美洲、欧洲及大洋洲均存在这种现象[23]。图3显示了世界范围内所有53株新鉴定的蝙蝠源冠状病毒的地理分布情况[11]。
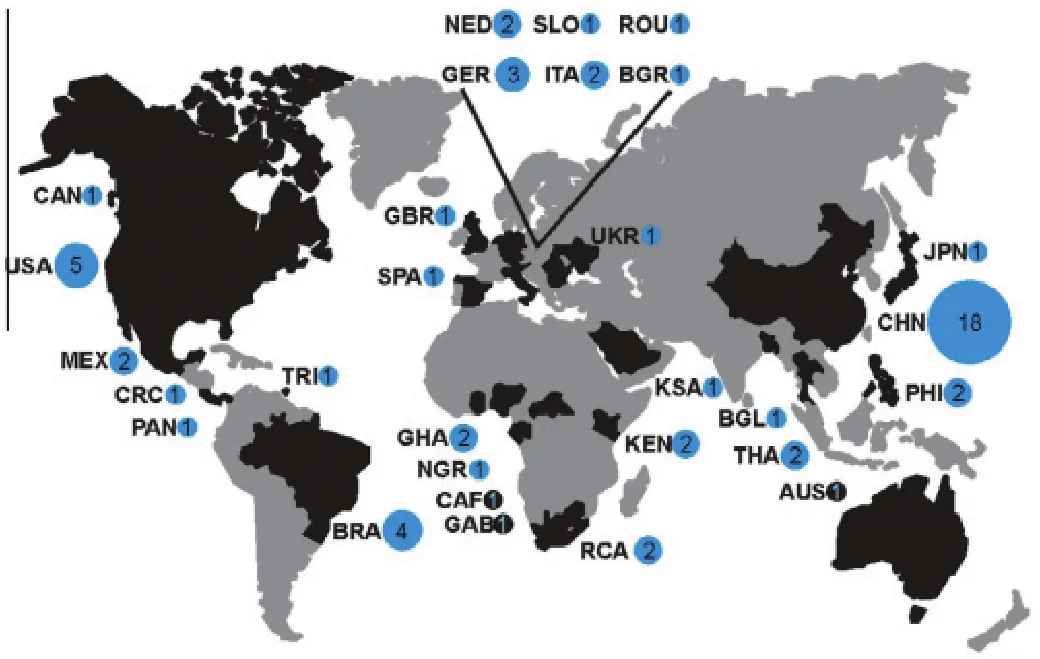
图 3 蝙蝠源冠状病毒世界范围内的分布Fig 3. The worldwide distribution of coronavirus derived from Bats
蝙蝠(翼手目)是哺乳动物中比较古老的一支,可能也是种间差异最大的一个目。蝙蝠的起源较早(50~52万年前),与其他类群的哺乳动物相比,不同种类蝙蝠随时间的变化较小。蝙蝠(翼手目)分为两个亚目,大蝙蝠亚目和小蝙蝠亚目。大蝙蝠亚目仅包含一个科——狐蝠科,分布于东半球热带和亚热带地区;而小蝙蝠亚目有17个科,包括了大多数的小蝙蝠,分布于除南极洲和一些海洋岛屿之外的所有大陆。
蝙蝠之所以能够感染多种病毒,并向包括人类在内的其他动物传播病毒,是由于蝙蝠的生物学和生态学特性决定的。主要包括以下几个方面:首先,高度的群体密度及栖息环境为病毒的感染和快速传播提供了机会,为病原体通过直接接触、气溶胶和节肢动物媒介实现跨种传播和蝙蝠群体中的种内传播提供了机会。许多蝙蝠的栖息地是人为形成的,如矿山、墓穴、建筑物和桥梁等,蝙蝠在这些环境中栖息使得他们与人类、伴侣动物和家畜的接触机会更加频繁,由此增加了蝙蝠中的病原体跨种传播给人和家畜的可能性。其次,蝙蝠的食性相当广泛,分为食虫性、食果性、食肉性、杂食性和吸血性。肉食性蝙蝠可以通过鸟类或者昆虫等其它物种感染病原体,而蝙蝠同时也是其它物种的食物,因此也可能将病毒传播给其它捕食者。第三,蝙蝠具有飞行能力,有些蝙蝠会进行长距离迁徙,且飞行距离最远达2000 km,这使得蝙蝠的分布能够扩散至很远的地区。蝙蝠的这种迁徙特性为正常情况下不会发生直接接触的物种中的病毒克服距离问题和地理屏障提供了机会。第四,翼手目中的蝙蝠科和菊头蝠科能够在寒冷的夜晚和冬季进入日麻痹和冬眠状态以保存能量。蝙蝠的冬眠习性使得病毒能够在蝙蝠体内过冬,有利于病毒在环境中的持续存在,促进了病毒的扩散[18]。第五,始新世中前期的蝙蝠翼膜已经与现代类型相近,其起源可以追溯到更早的时期,翼手目可能起源于类似食虫目的最原始的真兽类[24,25]。蝙蝠在进化上的特殊性可能使其机体具有结构和功能上的独特性,进而影响病毒对其的感染过程,例如有的蝙蝠寿命长达35年,如此长的寿命使得蝙蝠能够持续感染某种病毒,长期作为保毒宿主将有效增加病毒的传播机会[26]。第六,蝙蝠体内可能同时感染多种病毒,除了上述的狂犬病病毒、马尔堡病毒、尼帕病毒等,研究人员还从蝙蝠体内分离到了带有一种新的血凝素基因-H17的新型流感病毒[27],这些病毒同时存在于同一宿主体内,很可能对病毒的遗传变异及进化产生特殊作用。上述原因可能共同作用使得蝙蝠成为各种病毒有效的储存宿主。
有研究表明,蝙蝠可能是阿尔法冠状病毒属和贝塔冠状病毒属的基因库,并进而推断现有冠状病毒的祖先感染了一只蝙蝠,而后又感染了其他种类的蝙蝠,最终进化形成了这两个病毒属,随后跨种传播给人或者其他哺乳动物[14]。所有的研究结果均表明,蝙蝠在冠状病毒的进化及传播过程中发挥着重要作用[28,29]。
3 总结
经过SARS和MERS之后,虽然人们对冠状病毒以及蝙蝠在冠状病毒传播中的作用有了更加深入的了解,但依然面临许多未解的难题。首先,正如本文开始时提到了,截止目前为止,科研人员最近才实现了第1株冠状病毒的分离培养—蝙蝠源SL-CoVW1V1在VERO E6细胞中的成功培养,而病毒的组织培养对于病毒研究的意义不言而喻。因此,寻找其他冠状病毒培养的方式就显得非常急迫。其次,目前虽然在蝙蝠中分离到了大量冠状病毒,但是相比于动物如有蹄类动物和鸟类等,从蝙蝠中分离到的冠状病毒依然只是一小部分,而蝙蝠在物种数量上又是如此之庞大。因此,非常有必要对蝙蝠中的冠状病毒进行更加深入、全面、系统的调查。第三,病毒的作用与宿主的特点密不可分,因此有必要对蝙蝠在病毒入侵过程中的反应进行更加深入的研究,如蝙蝠对于病毒感染的免疫反应、病毒在蝙蝠中的免疫逃避机制、病毒在蝙蝠中的持续感染以及病毒从蝙蝠群体中实现跨种传播的分子机制等。这些机制的研究,将会使我们对冠状病毒本身有一个更加全面的了解,同时为研究SARS和MERS等传染病的病原体来源提供更加全面的参考材料,尤其是在SARS发生10年之后的今天,人们依然对于其病原体来源没有一个合理的解释。而所有的这些研究成果最终将会有效提高人们对于冠状病毒引起的传染病的预警、应对和防控能力,避免类似SARS和MERS等传染病暴发后对于公共卫生造成巨大影响的情况再次出现[30]。
[1] Ge X Y, Li J L, Yang X L,et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor[J]. Nature, 2013, 503(7477)∶ 535-538[2] Kåhrström C T. Virology∶ SARS-CoV ancestor found in Chinese bats[J]. Nat Rev Microbiol, 2013,11(12)∶ 821.
[3] Yang L, Wu Z, Ren X,et al. Novel SARS-like betacoronaviruses in bats, China, 2011[J]. Emerg Infect Dis, 2013,19(6)∶ 989-991.
[4] Wang M, Hu Z. Bats as animal reservoirs for the SARS coronavirus∶ hypothesis proved after 10 years of virus hunting[J]. Virol Sin, 2013, 28(6)∶ 315-317.
[5] Drosten C, Günther S, Preiser W,et al. Identification of a novel coronavirus in patients with severe acute respiratory syndrome[J]. N Engl J Med, 2003, 348(20)∶1967-1976.
[6] 李南玲, 沈海凡. 溯源SARS 病毒, 深港专家联合攻关纪实[N] . 云南日报, 2003-05-25.
[7] Lau S K, Woo P C, Li K S,et al. Severe acute respiratory syndrome coronavirus-like virus in Chinese horseshoe bats[J]. Proc Natl Acad Sci USA, 2005, 102(39)∶ 14040-14045.
[8] Li W, Shi Z, Yu M,et al.Bats are natural reservoirs of SARS-like coronaviruses[J]. Science, 2005, 310(5748)∶676-679.
[9] Zaki A M, van Boheemen S, Bestebroer T M,et al.Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia[J]. N Engl J Med, 2012,367(19)∶ 1814-1820.
[10] Annan A, Baldwin H J, Corman V M,et al. Human betacoronavirus 2c EMC/2012-related viruses in bats,Ghana and Europe[J]. Emerg Infect Dis, 2013,19(3)∶ 456-459.
[11] Drexler J F, Corman V M, Drosten C. Ecology, evolution and classification of bat coronaviruses in the aftermath of SARS[J]. Antiviral Res, 2014, 101∶ 45-56.
[12] Smith C S, de Jong C E, Meers J,et al. Coronavirus Infection and Diversity in Bats in the Australasian Region[J]. Ecohealth. 2016, 13(1)∶ 72-82.
[13] 金奇. 医学分子病毒学[M]. 北京∶ 科学出版社, 2001.
[14] Woo P C, Lau S K, Huang Y,et al. Coronavirus diversity,phylogeny and interspecies jumping[J]. Exp Biol Med(Maywood), 2009, 234(10)∶ 1117-1127.
[15] ICTV. ICTV-Master-Species[S]. List-2012_v2.
[16] Vijgen L, Keyaerts E, Moës E,et al. Complete genomic sequence of human coronavirus OC43∶ molecular clock analysis suggests a relatively recent zoonotic coronavirus transmission event[J]. J Virol, 2005, 79(3)∶ 1595-1604.
[17] Yip C C, Lam C S, Luk H K,et al. A six-year descriptive epidemiological study of human coronavirus infections in hospitalized patients in Hong Kong[J]. Virol Sin, 2016,31(1)∶ 41-48.
[18] Balboni A, Battilani M, Prosperi S. The SARS-like coronaviruses∶ the role of bats and evolutionary relationships with SARS coronavirus[J]. New Microbiol,2012, 35(1)∶ 1-16.
[19] Bolles M, Donaldson E, Baric R. SARS-CoV and emergent coronaviruses∶ viral determinants of interspecies transmission[J]. Curr Opin Virol, 2011, 1(6)∶ 624-634.
[20] Tang X C, Zhang J X, Zhang S Y,et al. Prevalence and genetic diversity of coronaviruses in bats from China[J]. J Virol, 2006, 80(15)∶ 7481-7490.
[21] Perlman S, Netland J. Coronaviruses post-SARS∶ update on replication and pathogenesis[J]. Nat Rev Microbiol,2009, 7(6)∶ 439-450.
[22] Wu Z, Yang L, Ren X,et al. Deciphering the bat virome catalog to better understand the ecological diversity of bat viruses and the bat origin of emerging infectious diseases[J]. ISME J, 2016, 10(3)∶ 609-620.
[23] Li W, Shi Z, Yu M,et al. Bats are natural reservoirs of SARS-like coronaviruses[J]. Science, 2005, 310(5748)∶676-679.
[24] Ng O W, Tan Y J. Understanding bat SARS-like coronaviruses for the preparation of future coronavirus outbreaks - Implications for coronavirus vaccine development [J]. Hum Vaccin Immunother, 2017, 13(1)∶186-189.
[25] Teeling E C, Springer M S, Madsen O,et al.A molecular phylogeny for bats illuminates biogeography and the fossil record[J]. Science, 2005, 307(5709)∶ 580-584.
[26] Rodhain F. Bats and Viruses∶ complex relationships[J].Bull Soc Pathol Exot, 2015, 108(4)∶ 272-289.
[27] Tong S , Li Y , Rivailler P,et al. A distinct lineage of influenza A virus from bats[J]. Proc Natl Acad Sci USA,2012, 109(11)∶ 4269-4274.
[29] Hu B, Ge X, Wang LF,et al. Bat origin of human coronaviruses[J]. Virol J, 2015, 22(12)∶ 221.
[30] Menachery V D, Yount B L J r, Debbink K,et al.A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence[J]. Nat Med, 2015, 21(12)∶1508-13.
THE ROLE OF BATS IN THE TRANSMISSION OF CORONAVIRUS
GONG Ting1, ZHANG Ying-hai2
(1. Huanren City Bureau of Livestock Product Safety Supervision, Huanren 117200, China; 2.Leting Animal Husbandry and Veterinary Bureau, Leting 063600, China)
S852.659.6
A
1674-6422(2017)04-0068-06
2016-12-19
宫婷,女,硕士研究生,预防兽医学专业
宫婷,E-mail:gongting2010@126.com

