表没食子儿茶素没食子酸酯对心肌细胞缺氧/复氧损伤的抑制作用及其机制
郑晓佳,余 婷,张 华,李春凤,陈叶霞,阳勇珍,李晨昕,简 洁
(桂林医学院1.药学院、2.附属医院感控科,广西 桂林 541004)
表没食子儿茶素没食子酸酯对心肌细胞缺氧/复氧损伤的抑制作用及其机制
郑晓佳1,余 婷1,张 华1,李春凤2,陈叶霞1,阳勇珍1,李晨昕1,简 洁1
(桂林医学院1.药学院、2.附属医院感控科,广西 桂林 541004)
目的探讨表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)对H9c2心肌细胞缺氧/复氧损伤的抑制作用及其机制。方法体外培养H9c2心肌细胞,随机分为正常(N)、缺氧/复氧(H/R)、EGCG低剂量(L)、中剂量(M)和高剂量组(H),共5组(n=6)。建立细胞缺氧/复氧模型,给予EGCG预处理,用CCK-8 法测定细胞存活率;Annex V-FITC/PI双染法检测细胞凋亡率;按照试剂盒说明书检测细胞培养液T-AOC、TNF-α含量;用Western blot 法检测Akt蛋白及磷酸化水平;用荧光定量PCR法检测PI3K、Akt、caspase-3基因表达。结果与模型组相比,EGCG能增加H9c2心肌细胞缺氧/复氧损伤后的存活率,减少细胞凋亡,提高T-AOC水平,降低TNF-α含量,增加PI3K、Akt和p-Akt表达,减少caspase-3的表达。结论EGCG通过影响PI3K/Akt信号通路,减少细胞凋亡,保护心肌细胞。
EGCG;H9c2心肌细胞;缺氧/复氧损伤;细胞凋亡;PI3K/Akt;caspase-3
表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)为绿茶中的抗氧化活性成分[1],具有清除氧自由基、抗肿瘤等多种生物学活性。有文献报道[2],EGCG为肿瘤多药耐药逆转剂,可逆转肿瘤的多药耐药。近期研究发现[3],EGCG可通过激活PI3K/Akt通路来减少心脏、肾脏、肠等缺血/再灌注损伤,但是EGCG的上述研究大多是体内研究,体外研究少有报道。因此,本实验以大鼠H9c2心肌细胞为研究对象,探讨EGCG对心肌细胞缺氧/复氧损伤的抑制作用及机制。
1 材料
1.1细胞株与分组H9c2心肌细胞株,购自中科院上海细胞库。细胞培养融合至80%~90%后,将培养的H9c2心肌细胞随机分为5组:正常对照组(Normal组)、缺氧/复氧组(H/R组)、EGCG 12 mg·L-1组(L组)、EGCG 18 mg·L-1组(M组)、EGCG 24 mg·L-1组(H组)。
1.2药物EGCG购自美国Sigma公司,批号:E4 143,纯度≥95%。
1.3试剂与仪器DMEM培养液(Gibco,货号:116467);特级胎牛血清(四季青,货号11011-8611);CCK-8试剂盒(日本同仁,批号:CK04);Annexin V-FITC/PI细胞凋亡试剂盒(广州BD生物科技有限公司,批号:35562);肿瘤坏死因子α(tumor necrosis factor α,TNF-α)试剂盒(达科维公司,批号:E3720-1207-2);总抗氧化力(total antioxidant capacity,T-AOC)试剂盒(南京建成生物工程研究所,批号:A015);Akt和p-Akt抗体(CST公司,批号:4685和4060);逆转录试剂盒(Invitrogen,批号:CKD8025032)。CO2孵箱(日本SANYO公司,型号:MCO-15AC);酶联免疫检测仪(瑞士TECAN公司,型号:Infinite M200 PRO);流式细胞仪(美国BD公司,型号:Accuri C6);凝胶成像仪(美国Bio-Rad公司,型号:ChemiDocTMXRS+);荧光定量PCR仪(美国Bio-Rad公司,型号:CFX96TMReal-Time System)等。
2 方法
2.1模型建立预先用高纯氮气(999 mL·L-1)饱和无糖DMEM液,通气持续时间≥40 min, 即为低氧液;用高纯氧(999 mL·L-1)饱和高糖DMEM液,通气持续时间≥40 min,即为复氧液。细胞培养融合至80%~90%后,用低氧液置换正常培养液,并将培养板置于密封保鲜袋中,充入高纯氮气造成缺氧培养环境, 封口培养4 h;4 h后,以复氧液置换低氧液,排出氮气并充以高纯氧,继续培养4 h即为心肌细胞复氧。除Normal组和H/R组外,各组细胞均于造模前4 h加入相应药物预处理。
2.2测定指标
2.2.1CCK-8法测定细胞存活率 取对数生长期细胞接种于96孔板中,每孔细胞数约5 000个,将培养板在培养箱预培养(37℃,95%空气+5% CO2),待细胞融合至80%~90%后进行处理。每个实验组的处理按照上述对应建模方法,每组设6个复孔。细胞处理结束后,按CCK-8试剂盒说明书操作,重复测定3次。
2.2.2流式细胞术检测细胞凋亡 按不同的实验要求处理细胞后,按照凋亡试剂盒说明书操作,并用 Flowjo 7.6软件处理分析,计算细胞凋亡率。
2.2.3细胞培养液T-AOC、TNF-α含量测定 按不同的实验要求处理细胞后,按照试剂盒说明书检测细胞培养液中T-AOC及TNF-α的含量。
2.2.4Western blot法检测p-Akt及Akt蛋白表达 按不同的实验要求处理细胞后,用蛋白提取试剂盒按操作说明提取细胞总蛋白,以BCA蛋白定量试剂盒进行蛋白定量,煮沸变性,SDS-PAGE凝胶电泳。电转移至硝酸纤维素(PVDF)膜上,5% BSA封闭2 h,用TBST清洗3次,分别加入p-Akt、Akt 抗体(1 ∶1 000),4℃孵育过夜,TBST 清洗3次,加入相应二抗室温孵育1 h,TBST清洗3次,ECL显色。将PVDF膜放入凝胶扫描系统曝光及图片扫描成像。采用ImageJ软件计算分析各蛋白条带和对应的内参蛋白(GAPDH)条带的灰度。
2.2.5qRT-PCR法检测PI3K、Akt、caspase-3基因表达 细胞造模结束后,使用TRIzol法提取细胞总RNA,按照逆转录试剂盒说明书,使RNA反转录成cDNA。荧光实时定量PCR为20 μL反应体系:power SYBR Green PCR Master Mix 10 μL,上、下游引物各1 μL,cDNA 5 μL,双蒸水3 μL。反应条件为:95℃ 15 s,60℃ 60 s,共40个循环。根据比较法计算基因表达相对量。采用公式2-ΔΔCt计算基因表达的相对倍数变化。引物序列见Tab 1。
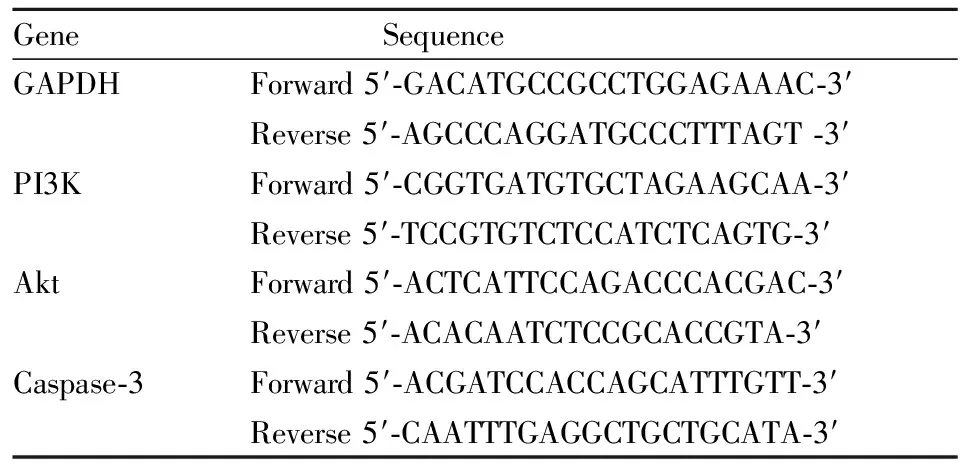
Tab 1 Primers of detected genes
3 结果
3.1EGCG对H9c2心肌细胞H/R损伤后存活率的影响如Fig 1所示,H/R组细胞存活率明显降低(P<0.05);EGCG预处理可以增加H/R损伤细胞的存活率,且EGCG浓度为18 mg·L-1时效果最好(P<0.05)。
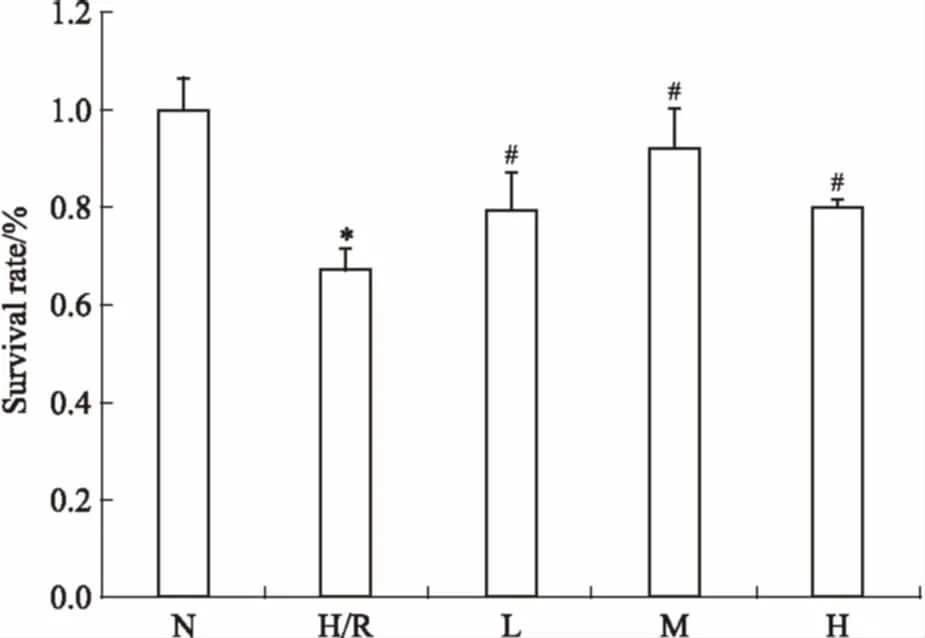
Fig 1 Effect of EGCG on survival rate of H9c2cardiac myocytes exposed to hypoxia/reoxygenation
*P<0.05vsN group;#P<0.05vsH/R group
3.2EGCG对H9c2心肌细胞H/R损伤后细胞凋亡的影响Fig 2结果显示,正常组心肌细胞凋亡不明显(凋亡率<5%),H/R后心肌细胞凋亡率明显升高(P<0.05);3个剂量的EGCG均能减少心肌细胞的凋亡率(P<0.05),且中剂量组效果最明显。
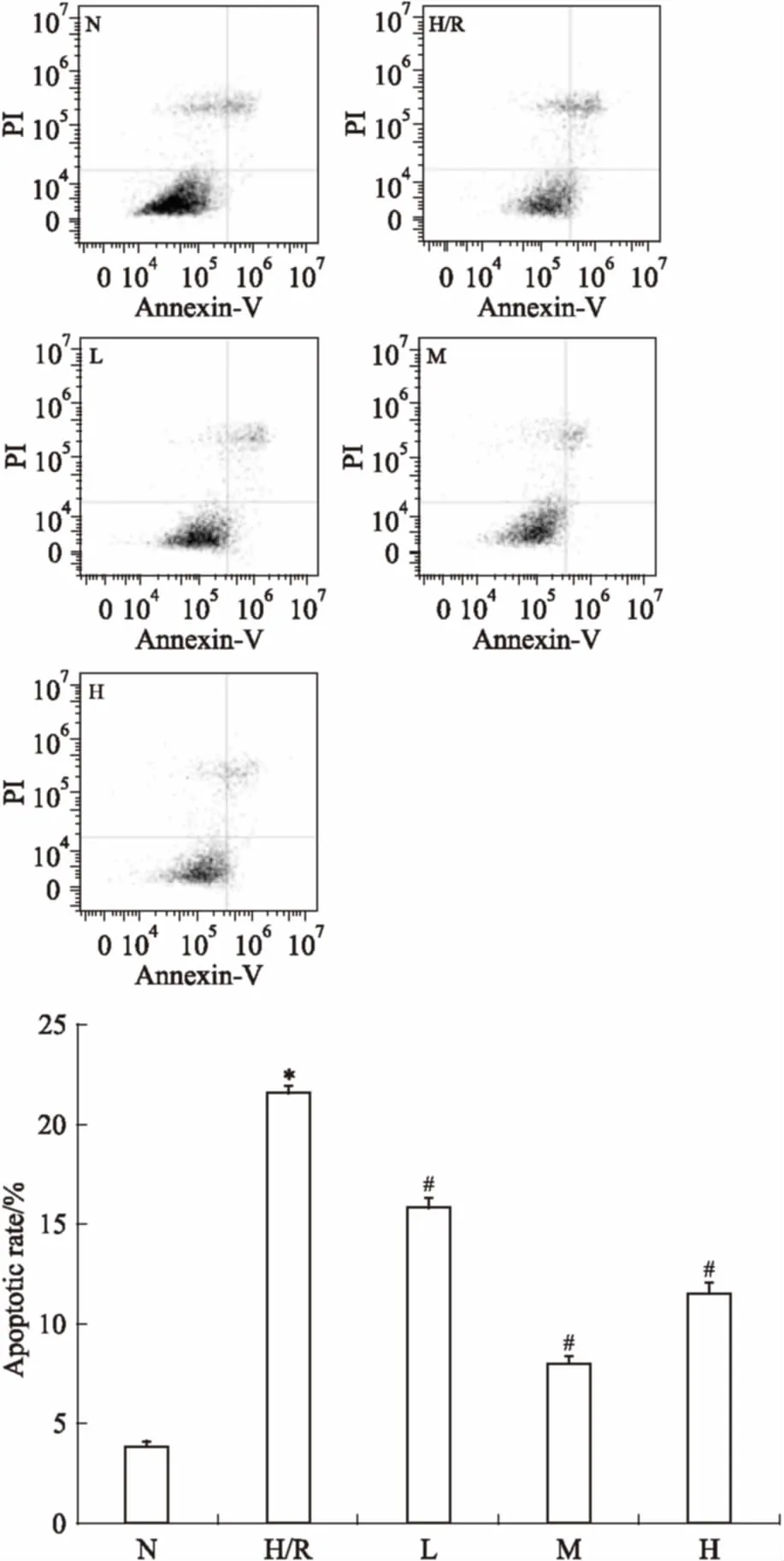
Fig 2 Effect of EGCG on apoptotic rate of H9c2cardiac myocytes exposed to hypoxia/reoxygenation
*P<0.05vsN group;#P<0.05vsH/R group
3.3EGCG对H9c2心肌细胞H/R损伤后细胞培养上清液T-AOC及TNF-α含量的影响由Tab 2可见,H/R组心肌细胞上清液T-AOC明显降低,且TNF-α含量明显增高(P<0.05);给药组3个剂量均能增加T-AOC,减少TNF-α(P<0.05),其中中剂量组效果最明显。
3.4EGCG对H9c2心肌细胞H/R损伤后Akt、p-Akt蛋白表达的影响如Fig 3所示,与正常组相比,H/R组p-Akt/Akt的水平明显降低(P<0.01);与H/R组相比,给药组3个剂量均能增加p-Akt/Akt 的水平(P<0.05),中剂量组p-Akt/Akt水平增加最明显。
Tab 2 Effects of EGCG on contents ofT-AOC and TNF-α of H9c2 cardiac myocytes exposed tohypoxia/reoxygenation(±s,n=8)
*P<0.05vsN group;#P<0.05vsH/R group
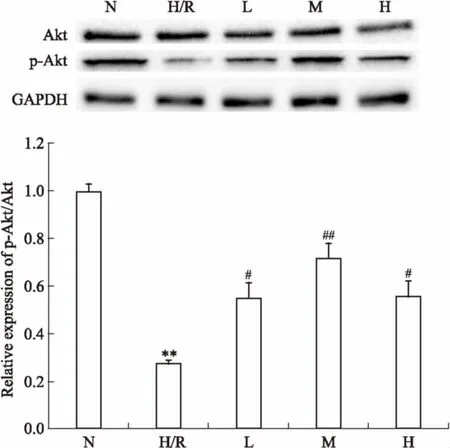
Fig 3 Effect of EGCG on expression of p-Akt/Akt of H9c2cardiac myocytes exposed to hypoxia/reoxygenation
**P<0.01vsN group;#P<0.05,##P<0.01vsH/R group
3.5EGCG对H9c2心肌细胞H/R损伤后PI3K、Akt、caspase-3基因表达的影响如Fig 4所示,与正常组相比,H/R组PI3K、Akt的mRNA表达水平明显降低(P<0.05);给药组均能增加PI3K、Akt 的mRNA表达水平(P<0.05),其中中剂量EGCG组增加最明显。H/R时,caspase-3的mRNA表达水平明显升高(P<0.05);给药组均能降低caspase-3的mRNA表达水平(P<0.05),其中中剂量减少最明显。
4 讨论
心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)指在短时间内中断心肌血供,且在短时间内恢复血供。较血供恢复前,原缺血心肌在代谢、结构、功能等方面发生更严重甚至不可逆损伤,其发病机制复杂,涉及多种生物活性分子和细胞内信号转导通路,例如活性氧、钙超载、细胞凋亡、炎症反应、线粒体渗透性转换孔道的开放等[4]。
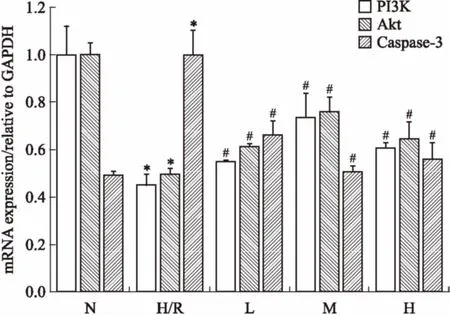
Fig 4 Effect of EGCG on mRNA levelsof PI3K, Akt and caspase-3 of H9c2 cardiac myocytesexposed to hypoxia/reoxygenation
*P<0.05vsN group;#P<0.05vsH/R group
在MIRI发生时,细胞内氧自由基增多以及心肌抗氧化能力降低[5]。抗氧化能力对机体防御反应至关重要,总抗氧化能力的强弱直接影响心肌细胞的生存状态。因此,总抗氧化力的强弱可反映心肌细胞受损伤的程度。本实验中模型组心肌细胞T-AOC明显降低,而EGCG预处理则可增强T-AOC,提高心肌细胞的存活率。文献报道[6],EGCG在低浓度时对细胞没有损伤,但在高浓度时会抑制细胞的增殖。本研究结果表明,中剂量(18 mg·L-1)EGCG预处理效果最好,EGCG抑制心肌细胞损伤的最佳浓度还有待进一步研究。
细胞凋亡是导致MIRI的一个重要因素,主要包括死亡受体、线粒体、内质网应激3种凋亡途径[7]。死亡受体途径又称外源性凋亡途径,由细胞外信号导致。死亡受体是肿瘤坏死因子受体(TNFR)家族中的一个亚家族[8],TNFR-Ⅰ和TNFR-Ⅱ为肿瘤坏死因子受体家族中的两个受体亚型,可以介导细胞凋亡[8-9]。TNFR-Ⅰ三聚体化后,同死亡区的肿瘤坏死因子受体1相关蛋白抗原衔接,进一步与Fas相关死亡域蛋白结合,激活caspase途径,诱导细胞凋亡的产生;TNFR-Ⅱ被激活,随后激活NF-κB,NF-κB的抑制能够减少炎症因子TNF-α的释放,减少细胞凋亡[10]。本实验结果显示,正常组细胞培养上清液TNF-α的含量很低,而模型组的TNF-α含量明显上升,H/R损伤后有大量的细胞凋亡,EGCG预处理组可明显降低TNF-α含量,降低心肌细胞凋亡率。提示EGCG减少H/R损伤心肌细胞凋亡可能是通过外源性凋亡途径,减少TNF-α的释放而发挥作用。
线粒体凋亡是细胞凋亡的另一条重要途径,又称为内源性凋亡途径。细胞色素C(cytC)在ATP/dATP存在的情况下,与凋亡蛋白酶活化因子(Apaf-1)形成多聚复合体,活化caspase-9,进一步活化caspase-3[11]。Caspase-3是caspases 家族中重要的凋亡执行者之一,是激活各种凋亡刺激因子的关键蛋白酶,在细胞凋亡过程中起关键作用[12]。本研究结果显示,EGCG减少caspase-3基因表达,提示EGCG可能通过内源性凋亡途径抗细胞凋亡。
PI3K/Akt信号通路是一条重要的抗凋亡/促增殖信号途径。心肌缺血/再灌注时,激活PI3K/Akt通路,Akt 在Ser473位点磷酸化变成p-Akt,作用于多个下游靶点,通过调控凋亡蛋白如caspase 家族、控制代谢等多种方式促进抗凋亡机制的活化,增加细胞存活,降低MIRI的发病率及死亡率。大量文献表明,激活PI3K/Akt信号通路在抗凋亡过程中起关键作用[13]。课题组前期研究亦发现,EGCG通过影响PI3K/Akt信号通路,抑制细胞凋亡,减少再灌注期过度自噬,对MIRI大鼠起保护作用[14]。本实验结果亦显示,H/R组中PI3K mRNA表达以及p-Akt蛋白表达明显减少,给药组增加PI3K及p-Akt的表达。EGCG干预可通过影响PI3K/Akt信号通路、外源性及内源性细胞凋亡途径,减少心肌细胞凋亡,对心肌细胞H/R损伤产生抑制作用,具体的分子机制还需进一步的实验验证。
综上所述,EGCG预处理可提高心肌细胞总抗氧化力,减少TNF-α释放和caspase-3蛋白的表达,影响PI3K/Akt信号通路,减少心肌细胞凋亡,提高心肌细胞H/R损伤的存活率,保护心肌细胞。
(致谢:本实验在桂林医学院科学实验中心及药理实验室完成,感谢各位老师和同学的帮助。)
[1] Pae M, Wu D. Immunomodulating effects of epigallocatechin-3-gallate from green tea: mechanisms and applications[J].FoodFunct, 2013,4(9): 1287-303.
[2] 雷荣荣, 吴春珍. 天然产物逆转肿瘤多药耐药性研究进展[J]. 世界临床药物, 2014,35(8): 495-500.
[2] Lei R R, Wu C Z. Research progress of natural products in reversing multidrug resistance of tumor[J].WorldClinDrugs, 2014,35(8): 495-500.
[3] Lv J, Min F, Zhang L L, et al. Protective effect of epigallocatechin gallate, a major constituent of green tea, against renal ischemia-reperfusion injury in rats[J].IntUrolNephrol, 2015,47(8): 1429.
[4] 张骏艳,姚 华,李 晟,等. Urantide 对大鼠心肌缺血/再灌注后心肌细胞凋亡的作用及机制研究[J]. 中国药理学通报, 2013,29(5):648-54.
[4] Zhang J Y, Yao H, Li S, et al. Effects and mechanisms of urantide on cardiomyocyte apoptosis after myocardial ischemia/reperfusion in rats[J].ChinPharmacolBull,2013,29(5): 648-54.
[5] 高 杰,付丽香,李冬兰,等. 九龙藤黄酮对大鼠心肌缺血/再灌注损伤的保护作用[J]. 中国医院药学杂志, 2014,34(3):175-8.
[5] Gao J, Fu L X, Li D L, et al. Protective effect of Jiulongteng flavonoids on myocardial ischemia reperfusion injury in rats[J].ChinJHospPharm, 2014,34(3):175-8.
[6] 孙 欣,武红梅,陈尔凝,等. 4种天然产物提取物的细胞毒性和抑菌性比较[J]. 生命科学仪器, 2012,10(3): 29-32.
[6] Sun X, Wu H M,Chen E N, et al. Comparison of cytotoxicity and inhibition of 4 natural product extracts[J].LifeSciInstrum,2012,10(3): 29-32.
[7] 林溢煌, 方莲花, 杜冠华. 心肌缺血/再灌注中RhoA的调控作用研究进展[J]. 中国药理学通报, 2015,31(10): 1336-9.
[7] Lin Y H, Fang L H, Du G H, et al. Progress in regulation of RhoA in myocardial ischemia/reperfusion[J].ChinPharmacolBull, 2015,31(10): 1336-9.
[8] Bhardwaj A, Aggarwal B B. Receptor-mediated choreography of life and death[J].JClinImmunol, 2003,23(5): 317-32.
[9] Barfolomeev E, Goncharov T, Fedorova A V, et al. c-IAP1 and c-IAP2 are critical mediators of tumor necrosis factor α (TNF α)-induced NF-κB activation[J].ProcNatlAcadSciUSA, 2008,105(34): 12429-34.
[10] Rauert H, Wicovsky A, Müller N, et al. Membrane tumor necrosis factor (TNF) induces p100 processing via TNF receptor-2(TNFR2)[J].JBiolChem, 2010,285(10): 7394-404.
[11] Chen H, Tang X, Zhou B, et al. A ROS-mediated mitochondrial pathway and Nrf2 pathway activation are involved in BDE-47 induced apoptosis in Neuro-2a cells[J].Chemosphere,2017,84: 679-86.
[12] Yan X, Wang L, Yang X, et al. Fluoride induces apoptosis in H9c2 cardiomyocytes via the mitochondrial pathway[J].Chemosphere,2017,182:159-65.
[13] Liao P, Sun G, Zhang C, et al. Bauhinia championii flavone attenuates hypoxia-reoxygenation induced apoptosis in H9c2 cardio myocytes by improving mitochondrial dysfunction[J].Molecules, 2016,21(11): 1469.
[14] Xuan F, Jian J. Epigallocatechin gallate exerts protective effects against myocardial ischemia/reperfusion injury through the PI3K/Akt pathway-mediated inhibition of apoptosis and the restoration of the autophagic flux[J].IntJMolMed, 2016,38(1): 328-36.
Protectiveeffectofepigallocatechin-3-gallateonhypoxia/reoxygenationinjuryincardiacmyocytesanditsmechanism
ZHENG Xiao-jia1,YU Ting1,ZHANG Hua1,LI Chun-feng2, CHEN Ye-xia1,YANG Yong-zhen1,LI Chen-xin1, JIAN Jie1
(1.CollegeofPharmacy,GuilinMedicalUniversity;2.DeptofInfectionControl,AffiliatedHospitalofGuilinMedicalUniversity,GuilinGuangxi541004)
AimTo observe the protective effect of epigallocatechin-3-gallate(EGCG)on hypoxia/reoxygenation (H/R) injury of cardiac myocytes and its mechanisms.MethodsH9c2 cardiac myocytes were culturedinvitroand randomly divided into five groups: normal group(N group), H/R group, EGCG low dose group (L group), EGCG medium dose group (M group), and EGCG high dose group(H group). The cardiomyocyte H/R injury model was established and EGCG was pretreated. Cell survival rate was tested by CCK-8 method. The cell apoptotic rate was detected using Annexin V-FITC/PI double staining. The contents of total antioxidant capacity(T-AOC) and tumor necrosis factor α(TNF-α) in cell culture medium were tested according to the kit instructions. The protein expression of Akt and p-Akt was observed using Western blot, while the gene expressions of PI3K, Akt, caspase-3 were detected by using fluorescence quantitative PCR method.ResultsCompared with model group, EGCG increased cell survival rate and reduced the apoptosis after H/R injury. Meanwhile, pretreatment EGCG improved the activity of T-AOC, reduced the level of TNF-α, up-regulated the expression of PI3K, Akt and p-Akt, and down-regulated the expression of caspase-3.ConclusionEGCG reduces apoptosis and protects cardiac myocytes by influencing PI3K/Akt signal pathway.
EGCG; H9c2 cardiac myocytes; hypoxia/reoxygenation injury; cell apoptosis;PI3K/Akt; caspase-3
A
1001-1978(2017)11-1584-05
R-332;R282.71;R329.25;R329.411;R845.22;R977.6
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.042.html
10.3969/j.issn.1001-1978.2017.11.021
2017-06-22,
2017-07-24
广西高校大学生创新创业计划项目(No 201510601007);广西高等学校优秀人才资助计划项目
郑晓佳(1992-),女,硕士生,研究方向:心肌缺血损伤修复,E-mail:237452044@qq.com; 余 婷(1995-),女,研究方向:心肌缺血损伤修复,共同第一作者,E-mail:1010492130@qq.com; 简 洁(1972-),女,博士,教授,博士生导师,研究方向:心肌缺血损伤修复,通讯作者,E-mail:jianjielucky@aliyun.com