欧盟、美国和中国生物类似药法规探析
北京市药品审评中心(100061)刘鹤 冯欣 徐春娥 田晓娟 焦立公
随着早期生物制品专利和数据保护的到期,国际上掀起了生物类似药(biosimilars)开发的浪潮。而传统的化学仿制药的监管政策并不适用于生物类似药的监管,因此亟需出台相应的政策法规对生物类似药的发展进行规范,以促进这些重要的新型药物的开发上市。
1 欧盟、美国和中国生物类似药法规发展现状
欧盟在全球最早构建了生物类似药研制、审批、生产和监管的法规框架,自2005年开始,欧盟逐步建立了一套比较完善的生物类似药的审批法规,美国FDA在2012年出台了关于生物类似药的审批途径,中国CFDA在2015年也出台了关于生物类似药的研发与评价技术指导原则。欧盟、美国和中国相关法规汇总情况见附表。
2 EMA、美国FDA、中国生物类似药法规的异同点分析
EMA、美国FDA、中国生物类似药指导原则的核心大体一致,主要体现以下三点:①均重点关注研究生物类似药的详细结果和功能特性,以便与参照药进行比较;②均采取了渐进式方法;③通过比较药学数据、非临床研究和临床研究以评价其相似性。此外,我国的指导原则也结合自身的实际情况制定了不同于国外法规的条款,主要有:①生物类似药与创新生物制药采取同样的审批途径,并未被给予一个简化的独立审批通道;②不接受国外监管机构批准的创新生物制药作为参照药。在生物类似药研发的早期,参照药可为未被CFDA批准的产品;但当进行临床试验比对时,参照药必须已获得CFDA批准;③首个上市的生物类似药不享有排他保护权[1]。
3 EMA、美国FDA、中国生物类似药批准情况
在EMA的生物类似药政策法规框架下,欧盟的生物类似药研发取得了良好的进展,据EMA官方网站公开评估报告显示,从2006年4月首个生物类似药获批,截止至2017年5月1日,EMA 共授权了28个生物类似药(以通用名计为12种)在欧洲上市。美国FDA官方网站公开信息显示,从2015年3月首个生物类似药获批,截止至2017年5月1日,FDA共授权了5个生物类似药(以通用名计为4种)在美国上市。中国目前还无生物类似药上市。
综上所述,我国药品监督部门已经充分意识到生物类似药与化学仿制药的差别,并已出台专门的生物类似药的指导原则。这一指导原则既符合中国国情,也确保了生物类似药的相似性及安全性。生物类似药的研发上市一定程度上能缓解治疗费用高昂,但是严格的监管以保证生物类似药的疗效和安全性,最大程度保证患者获得最安全有效的治疗显然更为重要。
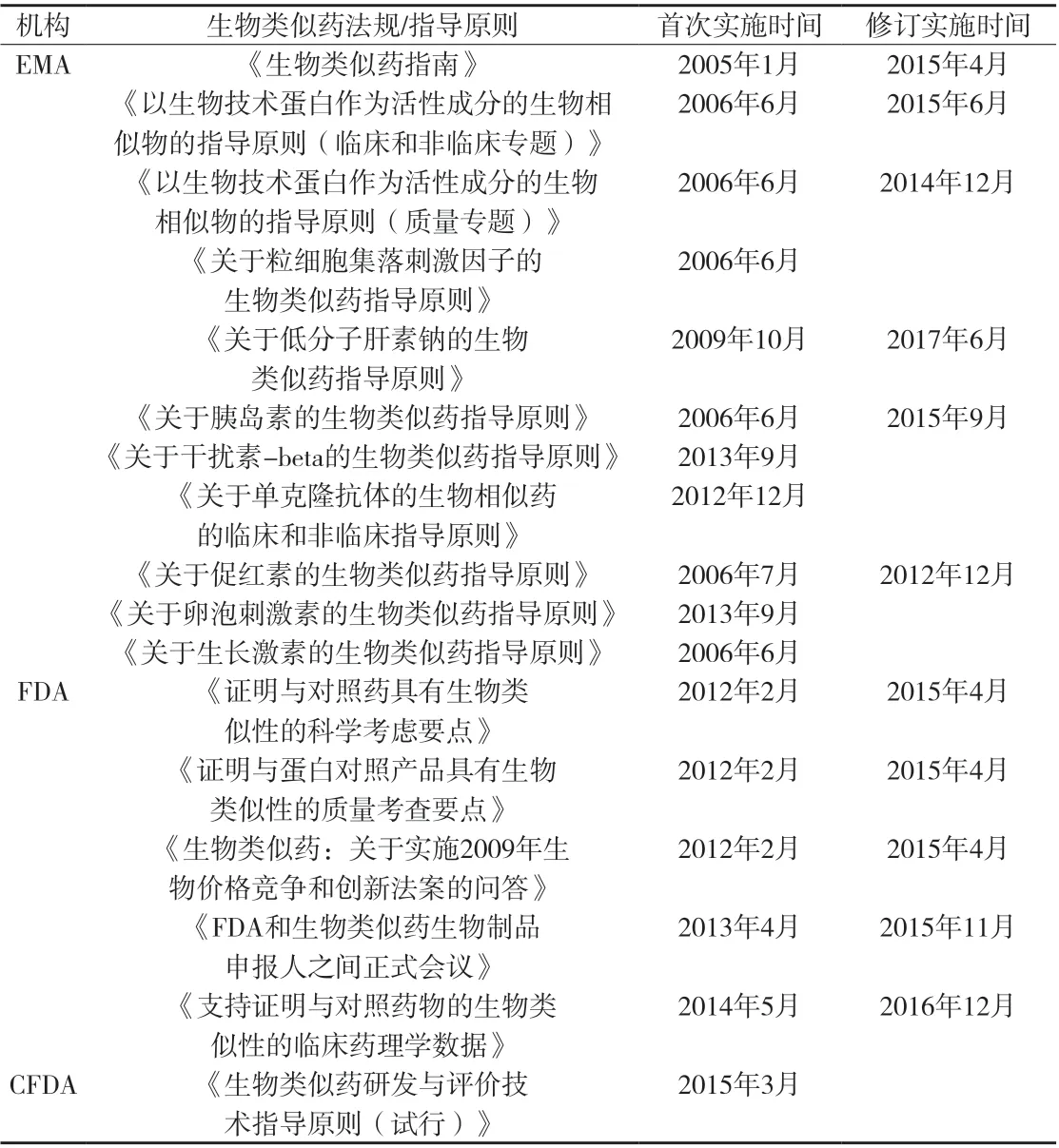
附表 欧盟、美国和中国发布的生物类似药法规汇总

