妊娠期高血压疾病与铅的相关性研究
王咏梅 尹洁 贾新转 范立佳
doi:10.3969/j.issn.1002-7386.2017.21.029
妊娠期高血压疾病与铅的相关性研究
王咏梅 尹洁 贾新转 范立佳
目的探讨铅与妊娠期高血压疾病的发生、发展的关系及正常孕产妇中铅在母血清、脐血清中的含量。方法选取产科住院分娩患者,采集妊娠期高血压疾病患者母血清、脐血清各100份(其中又分组为A、B、C 3组,即妊娠期高血压组30例,轻度子痫前期组30例,重度子痫前期组40例)同期正常孕产妇母血清、脐血清各100例,用电感耦合等离子发射光谱仪法测定母血清、脐血清中铅的含量,进行对照及分析。结果妊娠期高血压疾病患者母血清、脐血清铅含量与对照组相比明显升高,差异有统计学意义(P<0.01)。重度子痫前期患者母血清铅含量与轻度子痫前期相比明显升高,差异有统计学意义(P<0.05)。重度子痫前期患者脐血清铅含量与轻度子痫前期相比差异无统计学意义(P>0.05)。轻度子痫前期患者母血清铅含量与妊娠期高血压相比明显升高,差异有统计学意义(P<0.05)。轻度子痫前期患者脐血清铅含量与妊娠期高血压相比差异无统计学意义(P>0.05)。妊娠期高血压患者母血清铅含量与对照组相比明显升高,差异有统计学意义(P<0.05)。妊娠期高血压患者脐血清铅含量与对照组相比差异无统计学意义(P>0.05)。母血清铅与脐血清铅含量显著相关,差异有统计学意义(P<0.01)。结论有害重金属铅在妊娠期高血压疾病患者血清、脐血清中均明显增高,说明铅在体内的蓄积与妊娠期高血压疾病的发生有一定关系;妊娠期高血压疾病患者体内存在高铅现象,由此推断铅含量的增加是妊娠期高血压疾病的病因之一,其机制可能与铅影响钙离子转运系统及导致机体的氧化损伤有关。
妊娠期高血压疾病;铅;血清
妊娠期高血压疾病是妊娠期特有的一种全身性疾病,是导致孕产妇各种并发症甚至死亡的主要原因之一。妊娠期高血压疾病病因机制不明,导致该病至今不能有效预防及治疗,影响了对其防治水平的进一步提高。随着工业的发展,生活中接触铅、镉等有毒重金属的机会愈来愈多,故对有毒重金属与本病的关系的研究逐渐深入。有文献表明,铅、镉、砷、钡、汞、铊等有毒重金属元素对血压变化有重要的影响[1];母体的血铅、血镉水平与妊娠期高血压疾病发生有一定的关系。目前,笔者所见国内外对妊娠期高血压疾病与铅、镉关系的研究较少。因此,本试验通过测定妊娠期高血压疾病及正常孕产妇母血清、脐血清中铅含量,以了解本地区孕产妇体内铅蓄积情况,探讨其与妊娠期高血压疾病的发生、发展及严重程度的关系。
1 资料与方法
1.1 一般资料 选取2014年5月至2016年5月在河北医科大学第四医院产科住院分娩患者,所有患者均为石家庄地区常住人口。妊娠期高血压疾病组100例,平均年龄(28.9±5.2)岁;平均孕周(37.3±2.0)周;又分为A、B、C 3组,即妊娠期高血压组(A组)30例,轻度子痫前期组(B组)30例,重度子痫前期组(C组)40例。对照组100例,平均年龄(27.6±4.1)岁;平均孕周(38.1±2.5)周。2组患者均为单胎、初产。2组患者均无铅、镉等有害重金属接触史。无高血压、心脏病、肾病、糖尿病及肝病病史,无输血及免疫治疗史。2组患者年龄、孕周、孕次和校验比较差异无统计学意义(P>0.05)。见表1。
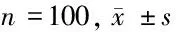

组别年龄(岁)孕周(周)孕次(次)校验(次)对照组 27.6±4.138.1±2.51.53±0.860.22±0.51妊高病组28.9±5.237.3±2.01.82±0.880.29±0.47
1.2 主要试剂及配制 铅标准储备液由石家庄市卫生检测中心配制,浓度均为1 000 μg/ml。标准系列的配制:用10 ml移液管准确移取10 ml铅标准储备液至100 ml容量瓶中,以0.15%硝酸溶液定容至刻度,其浓度值100 μg/ml。依次吸取以上混标溶液0 μg、10 μg、50 μg、100 μg、500 μg、1 000 μg分别置于100 ml容量瓶中,以0.15%硝酸溶液定容至刻度,浓度依次为0 mg/L、0.01 mg/L、0.05 mg/L、0.1 mg/L、0.5 mg/L、1.0 mg/L。
1.3 主要仪器 Optima 2000DV(SB/GP0219)型等离子体发射光谱仪(美国PE公司),-30℃冰箱SANYO日本三洋公司。
1.4 标本采集 母血采集:住院患者在产前严格消毒下,采肘静脉血5 ml,在室温放置30 min,用台式高速离心机以3 500 r/min离心5 min,用吸管将上层血清吸出放入容积为1.5 ml的离心管中,置入-30℃冰箱中冷冻保存。脐血采集:胎儿出生后立即拭净并消毒脐带,采集脐静脉血5 ml,室温放置30 min,用台式高速离心机以3 500 r/min离心5 min,用吸管将上层血清吸出放入容积为1.5 ml的离心管中,置入-30℃冰箱中冷冻保存。
1.5 样本处理 分析使用的全部容器、量具洗洁精清洗干净后,用自来水冲洗6~8遍,再经蒸馏水冲洗后,置于10%的硝酸溶液中浸泡24 h,取出后用蒸馏水和去离子水各冲洗3~4遍,烘干,放入干燥箱内保存备用。准确量取母血清、脐血清各2 ml放入石英坩埚内,加混合酸(0.5 ml高氯酸+5 ml硝酸),加盖玻璃片,静置24 h,再置于可调温的电炉上,控制温度105~110℃,缓慢加温至溶液近于白烟逸尽为止。冷却后,用去离子重蒸水定容为5 ml,上机测定。

2 结果
2.1 对照组与妊娠期高血压疾病组母血清脐血清铅含量比较 妊娠期高血压疾病患者母血清、脐血清铅含量均显著高于对照组(P<0.01)。见表2。
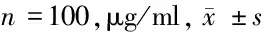
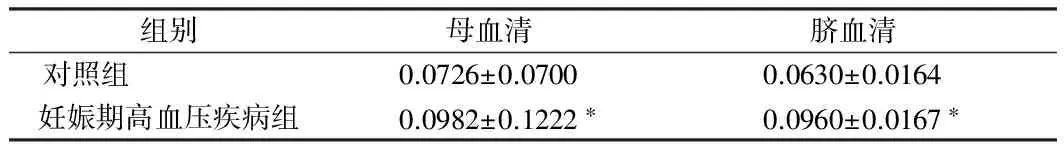
组别母血清脐血清对照组 0.0726±0.07000.0630±0.0164妊娠期高血压疾病组0.0982±0.1222∗0.0960±0.0167∗
注:与对照组比较,*P<0.01
2.2 对照组与A组母血清脐血清铅含量比较 A组患者母血清、脐血清铅含量均显著高于对照组(P<0.01)。见表3。
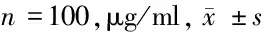

组别母血清脐血清对照组(n=100)0.0762±0.07000.0630±0.0164A组(n=30) 0.0878±0.0945∗0.0947±0.0181∗
注:与对照组比较,*P<0.01
2.3 A组与B组母血清脐血清含量比较 B组患者母血清、脐血清铅含量均显著高于A组(P<0.05)。见表4。
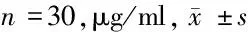
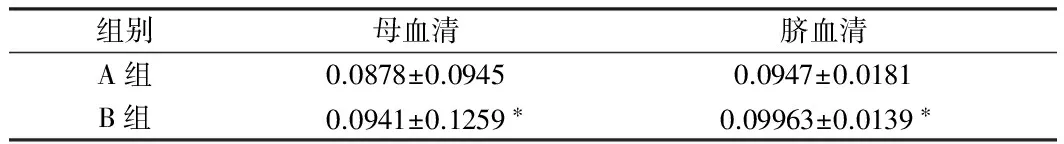
组别母血清脐血清A组0.0878±0.09450.0947±0.0181B组0.0941±0.1259∗0.09963±0.0139∗
注:与A组比较,*P<0.05
2.4 B组与C组母血清脐血清含量比较 子痫前期重度组患者母血清、脐血清铅含量均显著高于子痫前期轻度组(P<0.05)。见表5。
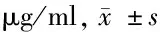
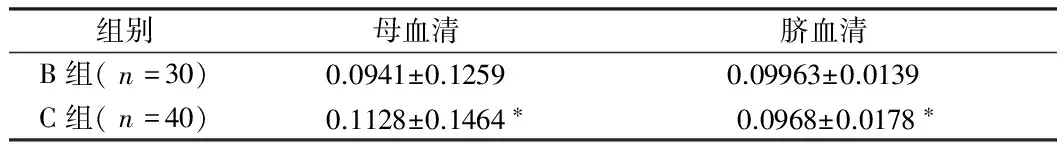
组别母血清脐血清B组(n=30)0.0941±0.12590.09963±0.0139C组(n=40)0.1128±0.1464∗0.0968±0.0178∗
注:与B组比较,*P<0.05
3 讨论
近年来,大量重金属被开采利用于日常用品,伴随而来的是人们接触有毒重金属的机会也日益增多,血铅水平与高血压病发生、发展关系密切,而妊娠期高血压疾病与铅的研究,笔者所见国内外报道甚少。本研究通过测定妊娠期高血压疾病患者和正常妊娠的孕产妇血清、脐血清内铅的含量,探讨妊娠期高血压疾病患者体内铅含量变化的意义。
人体内90%~95%的铅贮存在骨内,比较稳定。当体内的酸碱平衡发生改变时,骨骼的磷酸铅转变为溶解度大100倍的磷酸氢铅进重金属入血液,而引起铅中毒症状的发生[2]。铅是多系统毒物,对全身各器官均有不同程度的损害。铅对女性生殖系统的影响涉及到性腺发育、月经、受精、着床、胚胎发育、分娩、哺乳和婴儿的生长发育等一系列过程。高血铅孕妇发生流产、早产、死胎、出生低能儿及残疾儿的风险比低铅孕妇高27倍[3]。
有研究发现,低水平铅暴露能引起高血压病。已有文献将铅列为原发性高血压发病的诱因之一[4]。美国一项研究表明:血铅水平与血压直接相关,且在血铅水平低于1.4 μmol/L时,这种关系很明显[5]。目前比较公认的铅升压机制为血管反应异常,即人体高铅状态下血管对各种刺激表现为收缩增强或者自发收缩。血管平滑肌的收缩本质上属于张力型,血管可以长期处于收缩状态。钙的作用机制是可以引起平滑肌收缩,而铅的作用机制是导致细胞内钙过量积聚,并且还阻止其释放,细胞内钙储存逐渐增多,从而也使平滑肌收缩逐渐加强。妊娠期铅接触,血压相应会受到铅的影响。妊娠期高血压疾病发病机制是全身小血管痉挛,其中可能部分有铅的作用存在。
早孕期由于生理性血液稀释,孕妇体内各种微量元素、矿物质含量均相对减少,因此,早孕期铅含量也可能会低于正常女性。有研究表明,随着孕龄增加,孕妇血铅水平逐渐增高,尤其妊娠晚期最为明显[6]。随着钙的释放,骨中的铅便也随着骨钙的入血而入血,造成血铅水平的上升[7]。本结果显示,妊娠期高血压疾病患者母血清、脐血清铅含量均显著高于对照组(P<0.01)。表明妊娠期高血压患者体内存在高铅现象,体内铅水平的增高与妊娠期高血压疾病有关。美国密歇根州大学调查了705例孕妇,平均血铅仅(12±0.3)μg/L,经过统计学分析证实,母亲低水平血铅与妊娠合并高血压或妊娠高血压综合征有关[8]。
有研究表明血清钙离子浓度的降低可引起妊娠期高血压疾病[9]。随着胎儿逐渐长大,对钙的需要量越来越多,母体随之会释放自体钙以满足胎儿的需求,同时孕期母体血容量、肾血流量及肾小球滤过率明显增加,故而孕妇排尿增多,尿流失钙量加大,而孕期母体处在较高的雌激素水平,较高的雌激素水平会严重影响母体对骨钙的重吸收,因此整个孕期钙需要量大,流失多,血清钙的浓度必然是减少的。人体内的铅、钙关系密切,铅能导致细胞内钙离子的过量积聚,阻止钙离子从细胞内的释放。细胞内钙离子的大量增多,引起血管平滑肌的紧张性和张力增加,导致高血压[10]。而且铅、钙之间存在竞争性抑制作用,铅通过与钙竞争肠道结合蛋白上的共同结合位点而抑制钙的吸收[11]。铅对蛋白的亲和力是钙的2倍,因而血铅浓度的增加可使钙代谢平衡失调,造成血清钙浓度降低而细胞内钙水平呈现一种“超载状态”,使患妊娠期高血压疾病风险上升[12]。本结果显示,妊娠期高血压疾病患者母血清铅显著高于对照组(P<0.01)。与Rothenberg等[13]报道一致。Bogden等[14]用小白鼠做实验,发现低钙饮食组动物在孕期发生铅暴露,会导致妊娠高血压疾病发生率增加,且铅的作用会受到钙的影响,高铅会导致低钙。血钙、血铅对血压均有明显的作用,且两者之间可以相互作用引起血压的改变,即铅的蓄积可导致细胞中钙的减少,而钙的减少又使铅的浓度增加,妊娠期生理使得这种作用更加明显,因而使患妊娠期高血压疾病的几率增高。
本结果显示,妊娠期高血压疾病患者血清铅含量明显高于正常妊娠的孕妇,差异有显著性(P<0.01),且随着病情的加重,血清中铅浓度逐渐增高。在正常组、妊娠期高血压组、子痫前期轻度组、子痫前期重度组的比较中,差异均有显著性(P<0.05),表明血清铅浓度增高的程度与妊娠期高血压疾病病情发展有关,提示随着血清铅水平增加,病情逐渐加重,血清铅水平和妊娠期高血压疾病病情间呈现明显的剂量-效应关系。铅在本病中可以作用于肾血管,引起肾血管痉挛性收缩,肾血流量减少,肾局部缺血缺氧,刺激肾小球旁装置的细胞分泌肾素,肾素入血,使血管紧张素原转变为血管紧张素Ⅰ,后者在血管紧张素活化酶的作用下形成血管紧张素致Ⅱ,可直接引起细小动脉强烈收缩,使血压升高,血管紧张素Ⅱ还能刺激肾上腺皮质分泌醛固酮,使血压升高;肾素-血管紧张素-醛固酮分泌系统可以引起肾脏的水钠潴留,肾小管滤过减少,出现水肿;并且肾缺血缺氧可引起肾小球肾小管管壁的损伤,通透性增加,血浆蛋白滤出,出现蛋白尿。随着体内铅水平增高,此种作用更加明显,因此病情会越来越重。
妊娠期高血压疾病组显著高于对照组,差异有显著性(P<0.01)。且2组中脐血清铅水平均低于母血清铅,说明随着母血清铅含量的增加,脐血清铅含量逐渐上升,本试验结果显示两者之间呈正相关(P<0.01)。此结论与报道[15]一致。胎儿的器官、组织与成人相比有很大差异,细胞无论是在数量上还是在质量上都有较大的不同,因此,胎儿对铅的敏感度、吸收量与成人相比是有差异的,铅怎样通过胎盘及在胎儿体内如何分布尚不可知,因此,胎儿铅脐血浓度低于母血浓度就不可以简单地理解为胎盘的有效阻隔,而得出一种错误的结论,认为胎盘对铅有很好的屏障作用,因此母血清铅含量及脐血清铅含量的浓度差显然不能判断是由胎盘屏障作用所致。2组中脐血清铅水平均随母清血铅水平增高而增高。只能表明铅能通过胎盘屏障,从母体进入胎儿体内,并在胎儿体内蓄积。若降低孕妇体内铅含量,可减少宫内铅暴露,从而降低铅对胎儿及婴儿的危害。
在正常组、妊娠期高血压组、子痫前期轻度组、子痫前期重度组脐血清铅含量的比较中,结果显示均无显著差异(P>0.05)。其原因是否为含量较小,国内外文献中笔者未见报道,有待进一步研究。
综上所述,妊娠期高血压疾病血清、脐血清中均存在高铅现象,且随着体内铅水平的上升,妊娠期高血压疾病病情逐渐加重,说明妊娠期铅暴露与此病发生、发展有一定关系。
1 Pfeifer M,Begerow B,Minne HW,et al.Effects of a shortterm vitamin D(3)and calcium supplementation on blood pressure and parathyroid hormone levels in elderly wemen.J Clin Endocrinol Metab,2015,86:17-19.
2 顾学萁主编.劳动卫生学.第2版.北京:人民卫生出版社,2010.44.
3 Hertz-Picciotto I.The evidence that lead increases the risk for spontaneous abortion.Am J Ind Med,2013,38:300-309.
4 刘莉,叶鹏.环境铅暴露与血压的关系:2003-2010美国健康和营养调查.中华高血压杂志,2014,22:999.
5 于占洋,侯哲主编.微量元素与优生优育.第1版.北京:人民军医出版社,2010.228.
6 Schell LM,Czerw inski S,Stark AD,et al.Variation in blood lead and hematocrit levels during pregnancy in a socioeconomically disadvantaged population.Arch Environ Health,2010,55:134-140.
7 Gulson BL,Jameson CW,Mahaffey KR,et al.Mobilization of lead from the skeleton during the postnatal period is larger than during pregnancy.J Lab Clin Med,2008,131:324-329.
8 Adonaylo VN,Oteiza PI.Pb promotes lipid oxidation and alterstions inmembrane physical properties.Toxicology,2002,132:19-32.
9 姚泰主编.生理学.第6版.北京:人民卫生出版社,2014.1478-1482.
10 王世俊主编.临床职业病学.第1版.北京:北京医科大学及中国协和医科大学联合出版社,2011.26-132.
11 夏军强,刘庆山,冯昶.南昌市城区新生儿全血铅含量及其与锌、钙的关系.江西医学院学报,2008,44:511.
12 Vivoli G,Bergomi M,Roverti S,et al.Zinc,copper and zinc-or-copper-dependent enzymes in human hypertension.Biol Trace Elem Res,2013,133:1260.
13 Rothenberg SJ,Mamalo M,Jiang J,et al.Blood lead level and blood ressure during pregnance in south cental los angeles.Arch Env Heal,2010,54:382-389.
14 Bogden JD,Kemp FW,Han S,et al.Dietary calcium and lead Interact to modify maternal blood growth in rats during pregnance and fetal and neonatal growth in rats during pregnance and lactation.J Nutr,2015,125:990-1002.
15 Goldman LR.Linking research and policy to ensure childrens environmental health.Environ Health Perspect,2013,106:857-862.
R 714.246
A
1002-7386(2017)21-3309-04
2017-05-11)
050011 石家庄市,河北医科大学第四医院妇产科(王咏梅、尹洁),生殖医学科(贾新转);河北省石家庄市长安区阜康社区卫生服务中心(范立佳)

