高压氧对进展性脑卒中患者临床作用及机制分析
万玉艳 黎云
doi:10.3969/j.issn.1002-7386.2017.21.012
高压氧对进展性脑卒中患者临床作用及机制分析
万玉艳 黎云
目的分析高压氧对进行性脑卒中患者血管内皮细胞功能及血清炎性反应因子水平影响及临床治疗效果。方法选择诊断为进展性脑卒中患者120例,以信封法随机分为高压氧组与对照组,每组60例。对照组按照中国急性缺血性脑卒中诊治指南2010年版给予规范治疗,高压氧组在对照组治疗基础上给予高压氧治疗10 d。分别于治疗前及治疗后,检测血清中白介素-6(IL-6)、血清C-反应蛋白(CRP)、血清降钙素基因相关肽(CGRP)、内皮素(ET)、抵抗素及一氧化氮(NO)水平,血流变参数(纤维蛋白原含量、血浆比黏度、全血比黏度、血细胞比容、血小板聚集率)采用美国国立卫生研究院卒中量表(NIHSS)及日常生活能力指数(Barthelindex,BI)比较2组患者治疗前后临床效果。结果与治疗前比较,2组患者治疗后反应血管内皮细胞功能指标:NO、CGRP、ET和抵抗素水平及血清炎性反应因子水平均有改善,NO、CGRP水平升高,ET和抵抗素及血清CRP、IL-6水平下降,且以高压氧组改善较为显著;与对照组比较,治疗后组间差异有统计学意义(P<0.05)。 2组患者治疗后血液流变学各项指均明显改善(P<0.05)。与对照组比较,治疗后组间差异有统计学意义(P<0.05)。2组患者治疗前、后NIHSS评分下降、BI评分升高,治疗后,高压氧组改善优于对照组,2组患者组内治疗前后及治疗后组间比较差异有统计学意义(P<0.05)。结论高压氧可以改善进展性脑卒中患者临床神经功能缺损评分,提高日常生活能力,提高临床疗效。分析其机制可能与高压氧治疗改善进展性脑卒中患者血清中NO、CGRP、ET和抵抗素的代谢失衡,降低血清炎性反应水平,稳定血管内皮细胞功能及下调血清炎性反应水平机制有关。
进展性脑卒中;高压氧;内皮细胞;炎性反应
进展性脑卒中是缺血性脑卒中的特殊类型,是指缺血性脑卒中发病后6~72 h内神经功能缺损症状、体征逐渐进展或呈阶梯式加重,而不像普通卒中经过短期发展后趋于稳定发病率高,一般预后较差,往往可造成患者严重而持久的神经功能受损,使脑卒中病死率增加4倍以上,其发病机制尚未完全明了。既往研究显示脑缺血炎性爆发反应“瀑布”学说、缺血半暗带脑组组缺血再灌注损伤以及血管内皮细胞功能失衡等机制参与进展性脑卒中发生[1,2]。围绕进展性脑卒中的发生机制,其治疗手段也在不断更新,目前主要为药物溶栓、抗凝,调控血糖、血压,积极控制感染等危险因素及神经保护剂治疗等,但没有哪一种明确药物可阻止其发展。研究显示,高压氧可以减轻脑组织自由基损伤,抑制神经细胞凋亡,减轻脑水肿,改善脑供血,同时,对于血管内皮细胞具有调节功能稳定作用[3,4]。既往主要应用于脑外伤后神经损伤的修复治疗,但是否有助于进展性脑卒中患者病情的改善,尚缺乏相关研究。本研究试分析高压氧对进行性脑卒中患者血管内皮细胞功能、血清炎性反应因子水平影响及临床治疗效果。
1 资料与方法
1.1 一般资料 选择2013年8月至2015年10月诊断为进展性脑卒中患者120例,男62例,女58例;平均年龄(68.58±5.79)岁。患者以信封法随机分为高压氧组与对照组,每组60例。 高压氧组:男32例,女28例;年龄48~72岁,平均年龄(69.04±6.28)岁。对照组:男30例,女30例;年龄45~73岁,平均(69.16±5.87)岁。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院科研伦理委员会批准,签署知情同意书。
1.2 诊断与排除标准
1.2.1 诊断标准:①具有急性缺血性脑卒中典型临床症状与体征,入院24 h经颅脑CT/MRI诊断证实,并排除脑出血;②发病后48 h内神经功能缺损症状逐渐阶梯状递进加重;③缺血性脑卒中病因分型(TOAST分型)为大动脉粥样硬化型;④神志清楚者。
1.2.2 排除标准:①缺血性脑卒中病因TOAST分型为心源性脑栓塞、小动脉闭塞、其他原因以及未能确定病因者;②脑出血、短暂性脑缺血发作者;③合并既往脑血管后遗症、冠心病、心房颤动、心肌梗死、严重创伤、恶性肿瘤者;④伴有严重意识障碍者;⑤具有高压氧禁忌证明者。
1.3 治疗方法
1.3.1 对照组:按照《中国急性缺血性脑卒中诊治指南2010年版》[5]给予规范治疗,包括抗凝、溶栓、降纤等改善脑循环,依达拉奉保护神经。
1.3.2 高压氧组:在对照组治疗基础上,采用江西九江船用机械厂生产的GYS-10型多人医用高压氧舱行高压氧治疗。治疗参数:压力0.2 MPa,稳压状态下面罩吸氧60 min,加压减压各20 min,每天1次,连续治疗10 d。
1.4 观察指标
1.4.1 患者在治疗前、后当日晨采集空腹静脉血5 ml,3 000 r/min离心,置-70℃冰箱备用。采用酶联免疫吸附法检测血清中白介素-6(IL-6),免疫比浊法检测血清C-反应蛋白(CRP);放射免疫法检测血清降钙素基因相关肽(CGRP)、内皮素(ET),ELLSA方法检测抵抗素及Greiss 法检测一氧化氮(NO)的水平;抵抗素试剂盒为美国Market公司产品,CGRT、ET采用放射免疫法测定(试剂盒购自南京建成生物科技有限公司),严格按照说明书操作进行。2组患者进行治疗前后检测血流变学指标,包括纤维蛋白原含量、血浆比黏度、全血比黏度、血细胞比容、血小板聚集率。
1.4.2 采用美国国立卫生研究院卒中量表(NIHSS)[6]及日常生活能力指数(Barthel index,BI)[7]。比较2组患者治疗前、后临床效果。NIHSS评分与BI评分由2位副主任医师职称神经科医师检查判定,二者一致性性检验(kappa值=0.874)。

2 结果
2.1 2组患者血管内皮细胞功能比较 与治疗前比较,2组患者治疗后反应血管内皮细胞功能指标:NO、CGRP、ET和抵抗素水平均有改善,NO、CGRP水平升高,ET和抵抗素下降,且以高压氧组改善较为显著(P<0.05)。见表1。

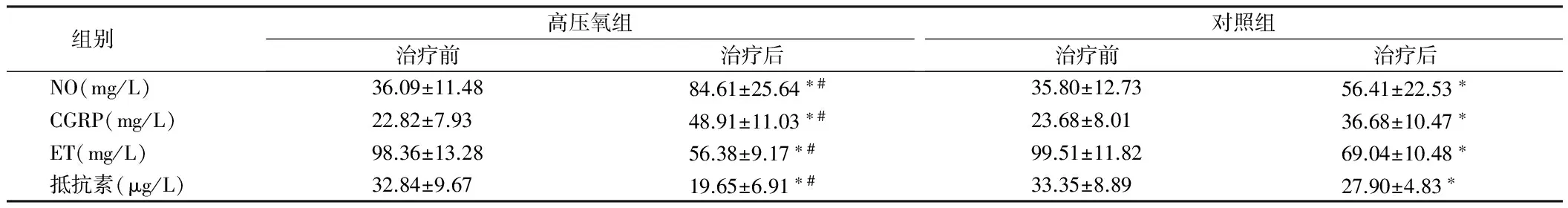
组别高压氧组治疗前治疗后对照组治疗前治疗后NO(mg/L)36.09±11.4884.61±25.64∗#35.80±12.7356.41±22.53∗CGRP(mg/L)22.82±7.9348.91±11.03∗#23.68±8.0136.68±10.47∗ET(mg/L)98.36±13.2856.38±9.17∗#99.51±11.8269.04±10.48∗抵抗素(μg/L)32.84±9.6719.65±6.91∗#33.35±8.8927.90±4.83∗
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.2 2组患者治疗前后血液流变学指标比较 与治疗前比较,2组患者治疗后血液流变学各项指均明显改善(P<0.05)。与对照组比较,治疗后组间差异有统计学意义(P<0.05)。见表2。


组别高压氧组治疗前治疗后对照组治疗前治疗后全血黏度高切(mPa·s)7.19±0.575.45±0.74∗#7.74±0.816.36±0.33∗全血黏度低切(mPa·s)12.62±1.318.98±1.15∗#12.40±1.7110.68±0.68∗血浆黏度(mPa·s)1.86±0.181.08±0.22∗#1.95±0.191.45±0.04∗纤维蛋白原(g/L)4.52±0.643.05±0.51∗#3.96±0.443.66±0.37∗血细胞比容(%)45.71±8.4640.74±6.87∗#46.74±9.6943.84±7.25∗血小板聚集率(%)52.67±7.7843.87±5.65∗#53.62±8.4748.72±6.62∗
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.3 2组患者血清炎性反应因子水平比较 与治疗前比较,2组患者治疗后血清CRP、IL-6水平下降,且以高压氧组下降最为明显。高压氧组与对照组比较,治疗后组间差异有统计学意义(P<0.05)。见表3。

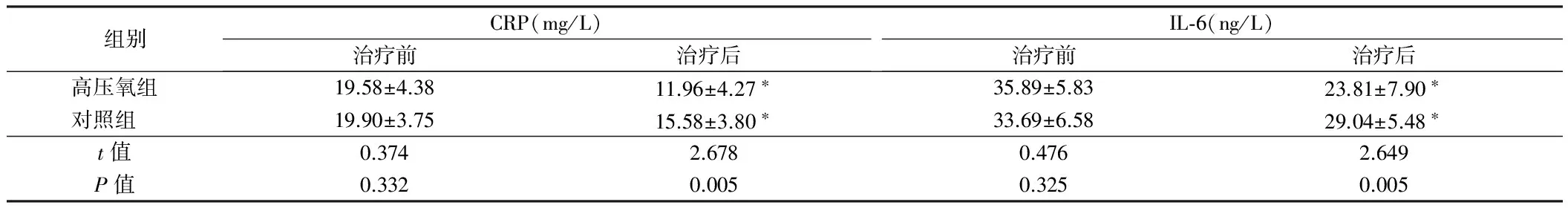
组别CRP(mg/L)治疗前治疗后IL⁃6(ng/L)治疗前治疗后高压氧组19.58±4.3811.96±4.27∗35.89±5.8323.81±7.90∗对照组 19.90±3.7515.58±3.80∗33.69±6.5829.04±5.48∗t值0.3742.6780.4762.649P值0.3320.0050.3250.005
注:与治疗前比较,*P<0.05
2.4 2组患者治疗前后NIHSS评分及Barthel指数比较 2组患者治疗前NIHSS评分及Barthel指数差异无统计学意义(P>0.05)。2组患者治疗后NIHSS评分下降、Barthel指数评分上升;治疗后,高压氧组改善幅度优于对照组,2组患者组内治疗前、后及治疗后组间比较差异有统计学意义(P<0.05)。见表4。

表4 2组治疗前后NIHSS评分及Barthel指数比较 n=60,分,
注:与治疗前比较,*P<0.05
3 讨论
心脑血管疾病是目前影响我国中老年健康的重要疾病之一,成为了我国超越癌症的第一致死疾病。进展性脑卒中是脑血管疾病的类型,占急性缺血性脑卒中的20%~30%,症状发病后72 h内早期因组织坏死加重或者脑缺血进展而导致神经功能恶化,导致较高的死亡率和致残率,给家庭和社会带来沉重负担。关于其发病机制,主要为血流动力学机制和生化机制,感染、发热、高血糖以及低血压等都是导致脑卒中进展的危险因素,动脉粥样硬化起关键作用[8]。大动脉粥样硬化性脑梗死是TOAST分型中最常见的类型,主要指患者有颅内外大动脉粥样硬化的临床证据,存在易损斑块或者狭窄程度≥50%[6]。研究表明,缺血性脑卒中患者血液处于高黏滞状态,血流速度减慢,脂质和复合糖类积聚,形成斑块及局部血栓,动脉逐渐狭窄,血管阻塞,或栓子继续脱落造成新的血管闭塞,导致局部供血不足,脑灌注血流量减少,脑组织缺血缺氧性坏死,使缺血性半暗带转化为不可逆损伤;或若斑块或血栓脱落并散落至脑部血管,增加脑缺血区域[8]。报道显示,大动脉粥样硬化性脑卒中患者临床血液流变学表现为高黏滞、高聚集状态,纤维蛋白原含量及血细胞比容均明显高于正常人,使血浆黏度及全血低切、高切增高,红细胞聚集性增加,血流缓慢,进一步增加脑梗死发生的风险及促进进展[9,10]。
动脉粥样硬化是进展性卒中的关键,而动脉粥样硬化的发生始于血管内皮细胞功能紊乱。传统观点认为血管内皮是血管壁内层单层扁平上皮细胞构成,主要起生理屏障作用。随着研究的深入,人们逐渐认识到血管内皮不仅是解剖生理结构屏障,还有细胞通透性、调节血管活性物质代谢、血管运动张力及液体平衡,维持正常的血管功能等作用;还是机体重要的内分泌组织,可以分泌多种生物活性物质,如抗凝、抗血小板物质和纤溶蛋白,同时具有抗炎作用。目前临床研究较多的内皮源血管活性因子主要为收缩因子ET、抵抗素,内皮源性舒张因子CGRP与NO[11,12],其中起主导作用的是ET及NO。在正常的内皮细胞中,血管舒张因子的生物学效应强于收缩因子,血管处于一定的舒张状态;而在动脉粥样硬化病变中,血管内皮依赖性舒张反应减弱甚至消失,并发生于动脉粥样硬化病变早期,甚至在形态学上无任何可见血管内膜增厚之前,这种结果的出现可能与内皮细胞NO合成分泌减少或(和)ET分泌增加有关。ET是目前发现的体内活性最强的缩血管物质,也是一种强烈的长效促生长因子,可以促进血管平滑肌细胞的增殖,与动脉粥样硬化的程度和范围呈正相关[13]。NO是在NOS 催化下形成的血管内皮源舒张因子,能够扩张血管,调节局部器官血流,抑制血小板在血管内皮黏附和聚集,抗血栓形成,对内皮素起着拮抗作用。当ET和NO之间的平衡被破坏时,ET含量增高,引起动脉痉挛,加重血管内皮损伤,破坏内皮的完整性和内皮的自我修复,促进动脉粥样硬化的形成,同时作用于血管平滑肌细胞使其增生增厚,进一步加重动脉粥样硬化的发展;NO水平下降或以非活性形式释放出来作用于损伤的血管内皮上,信息传递功能出现障碍,不能发挥舒张血管、抑制血小板黏附、抗形成血栓等生物学效应从促进动脉粥样硬化的发生发展[14]。张志琳等[15]对进展性脑卒中患者ET及NO含量变化的研究显示,进展性脑梗死患者进展性脑梗死患者在入院7 d内血清NO水平明显高于稳定组(P<0.05),入院14 d时2组患者血清NO含量均降低,明显低于正常对照组(P<0.05);在血浆ET水平方面,发病初期血浆ET水平较正常健康人群明显升高,并随病情的发展持续升高,7 d时达高峰;且各时间点均明显高于稳定组(P<0.05)。提示进展性脑梗死患者的病情恶化的病理生理过程与血浆ET水平的增高、血清NO水平先增高后降低密切相关。研究证实,NO有神经保护和神经毒性的双重作用,一方面能够为急性缺血性脑卒中患者提供脑组织保护作用,但其保护时间不足2 h,而过量的NO能够使细胞内钙超载,抑制线粒体呼吸,使细胞能量代谢受到较大干扰,能量迅速衰竭,造成神经元死亡,促使脑损伤加重;大量的NO 又会损害内皮细胞造成,导致其释放ET增多,从而使血管收缩,血黏度增加,血小板聚集,微血栓形成,加重脑组织损伤[14]。当NO含量降低时,血小板将不断聚集并释放血管收缩因子引起血管痉挛,导致局部脑血流量下降,加重脑水肿和使缺血范围扩大,这也是促使病情加重的重要因素。有研究证实,NO由缺血中心区向正常区域递减,促使半暗带神经元发生进行性损伤,致半暗带不断加入梗死区,使梗死面积扩大[15]。CGRP是一个由37个氨基酸构成的生物活性多肽,是体内最强是舒血管活性肽,具有很强的扩张血管、正性心肌、抑制脂质过氧化作用,且不论是内源性或外源性,都能对损伤的内皮细胞起到一定保护作用。有研究证实,CGRP舒张脑血管的作用并不完全依赖血管皮的完整性,去除内皮细胞其舒张作用依然存在,对粥样硬化的动脉仍有扩张作用;CGRP对 ET具有生物学拮抗作用,从而抑制缩血管和血管平滑肌细胞增殖,发挥抗动脉粥样硬化作用;血浆CGRP水平升高能刺激NO释放,起到抗动脉粥样硬化作用[13]。此外,细胞内钙离子超载也是动脉粥样硬化发生的机制,而CGRP能通过细胞膜超级介导的部分激活钙-钠通道而抑制钙离子内流。可见CGRP通过刺激一氧化氮释放,抑制血管平滑肌细胞增殖,防止细胞内钙超负荷等干预动脉粥样硬化形成,与动脉粥样硬化呈负相关。抵抗素(resistin)是近年来发现的一种脂肪因子,能抑制脂肪细胞形成,调节机体的糖代谢与脂代谢,具有促胰岛素抵抗的作用,并具有致炎因子的特征。资料显示,抵抗素与动脉粥样硬化具有相关性:(1)引起内皮细胞功能失调:抵抗素能够提高ET编码基因启动子的活性,使ET释放增多;还能够增加内皮细胞纤溶酶原激活物抑制物-1(PAI-1)mRNA的表达及其分泌,诱导内皮的炎症反应;剂量依赖性地诱发内皮细胞的增殖和迁移,导致内皮功能失调。(2)促血管平滑肌增殖迁移及巨噬细胞的脂质沉积,最终促进其成为泡沫细胞,促进动脉粥样硬化的发生与发展。(3)促进炎症的发生:动脉粥样硬化是一种慢性亚临床性炎症,抵抗素与炎症关系密切,不仅可以促进炎症的发生,而且一些炎性因子如TNF-α和IL-6还可以参与抵抗素表达的。抵抗素可以通过促炎作用参与动脉粥样硬化的病理生理过程。Logistle回归分析显示,抵抗素为缺血性脑血管疾病的独立因索,缺血性脑血管病患者血浆抵抗素水平明显上升。以上结果证明抵抗素在,动脉粥样硬化→进展性脑卒中的发病机制中有重要作用。由此可见,在动脉粥样硬化病变中内皮细胞功能紊乱,血管内皮功能受损,而血管内皮细胞损伤后发生的一系列缩血管与舒血管物质调节失衡,引起血小板黏附、聚集,炎性细胞、单核细胞浸润,进一步促进动脉粥样硬化的发生发展。如何稳定血管内皮细胞功能是临床治疗重要目标。
炎性因子如CPR、TNF-α、转换生长因子-β及白细胞介素-6水平增高与缺血性卒中的发生和发展密切。缺血性脑卒中发生既可能是血清炎性反应因子水平增高的损害结果,也有可能是脑梗死后机体继发性炎性、反映病情的进展。宋正良[16]研究认为表明,血管内微炎症反应是动脉粥样硬化持续进展的关键因素,随着损伤-炎性反应的加重,血清炎性因子水平升高可能是进展性脑卒中发生的重要因素。炎症因素可以促使已存在的动脉粥样斑块不稳定,促发斑块破裂,引发血栓形成。CRP与IL-6是炎性反应的重要介质,二者参与缺血性脑卒中发生后继发脑细胞损伤的病理过程。白介素主要介导和调节炎性反应及免疫应答,脑梗死急性期反应以炎性介质IL-6的激活为标志。正常情况下,血清中IL-6含量极微,而脑梗死发病数小时后发生炎性反应和细胞凋亡可刺激胶质细胞释放IL-6,从而损伤血管内皮、增加血管通透性,破坏血脑屏障,并产生大量自由基,使脑水肿加剧。Vila等[17]研究发现,指出IL-6是脑梗死的独立损害因子,血清IL-6水平越高,脑梗死体积越大,而与脑梗死发生部位无关。方建等[18]报道,进展性卒中发生后,脑组织中IL-6 表达明显增高,并在第7天达到高峰,测定IL-6水平对于监测进展性卒中的情况及严重程度具有重要意义。CRP主要由IL-6刺激肝脏产生,既是炎症标志物,同时也是缺血脑卒中的诱发因素,在缺血性卒中,尤其是进展性卒中发生发展过程中起着重要的作用[19]。CRP可激活补体通路,诱导炎性细胞因子产生,结合氧化修饰低密度脂蛋白而诱导泡沫细胞形成,促进血栓、引起动脉粥样硬化斑块破裂和缺血性病损恶化;CRP能促进细胞间黏附因子和血管内皮黏附因子的释放,导致白细胞黏附并穿过内皮层,损害内皮功能,加速动脉硬化。CRP水平的升高借助多种组织因子的表达影响凝血机制,促使斑块破裂、血栓进一步变大,促使脑卒中的发展。报道显示,CRP水平与缺血性卒中的严重程度密切相关, CRP水平与NIHSS评分呈正相关,与BI指呈显著负相关[20,21]。上官稳[22]报道显示,进展性脑卒中,其发病后第1、3、7、14天外周血IL-6、CRP水平明显高于无进展者(P<0.05),第14天与正常对照组比较差异无统计学意义(P>0.05),与王平[23]报道一致。由此可见,急性脑梗死患者血清IL-6、CRP增高与进展性脑卒中密切相关,,监测血清IL-6、CRP水平对于监测疾病活动情况及严重程度等具有重要意义,同时有效抑制患者体内炎性反应水平以及保护血管内皮细胞功能有助于阻止进展性脑卒中病情进展。
高压氧治疗是指在高压(超过常压)的环境下,让患者吸入纯氧或高浓度氧以治疗缺氧性相关疾患的方法。治疗机制:(1)在高压环境下通过提高患者肺泡氧分压,加大血氧含量,提高组织含氧量,增加组织毛细血管内氧弥散能力,改善缺血区组织灌注,增加脑后循环及缺血区的血流量,减少脑梗死坏死区周围缺血半暗带继发性脑细胞损伤增加;(2)降低血黏度,促进血栓吸收,抗炎抗应激反应,抗自由基作用等,最终减轻脑组织的损伤,迅速改善脑部缺血缺氧的供血,恢复该区的神经功能。但既往研究主要集中在缺血性脑卒中稳定期后的神经康复治疗,认为高压氧能够提供足够的氧气到缺血缺氧脑组织,减少缺血区,加快微循环血流速度,促进侧枝循环建立,有利于改善组损伤脑组织缺氧状况,对凋亡的大脑神经细胞有明显的修复作用,对脑卒中后认知功能障碍、运动功能障碍及吞咽功能障碍均有促进作用[24],但对于缺血性脑卒中急性进展期治疗尚缺乏研究。本研究结果显示,高压氧治疗可显著降低缺血性脑卒中急性进展期患者脑组织损伤缺血程度,减少神经功能缺损程度评分,增加日常生活能力评分,研究证明高压氧治疗对于进展性脑卒中具有显著临床疗效。本研究发现与治疗前比较,2组患者治疗后血液流变学指标、血管内皮细胞功能指标:NO、CGRP、ET和抵抗素水平及血清炎性反应因子水平均有改善,表现NO、CGRP水平升高,ET和抵抗素及血清CRP、IL-6水平下降,且以高压氧组改善较为显著。与对照组比较,治疗后2组组间差异有统计学意义(P<0.05)。血液粘度增高,血管内皮细胞功能失衡以及血清炎性反应增加是缺血性脑卒中病情进展的机制之一。高压氧治疗可以通过降低血黏度,促进血栓吸收,调节血管内皮细胞功能平衡以及下调体内炎性反应来起到治疗作用。近年来,也有基础实验表明高压氧治疗对于兔颈内动脉和基底动脉内皮细胞凋亡相关基因的表达具有一定影响[13],进展性脑卒中发生是否存在该因素影响,有待进一步研究深入。
综上所述,高压氧可以改善进展性脑卒中患者临床神经功能缺损评分,提高日常生活能力,提高临床疗效。分析其机制可能与高压氧治疗改善进展性脑卒中患者血清中NO、CGRP、ET和抵抗素的代谢失衡,降低血清炎性反应水平,稳定血管内皮细胞功能及下调血清炎性反应水平机制有关,是治疗进展性脑卒中一种有效的物理疗法。
1 杨磊,胡文立.应该规范进展性卒中的定义.中华神经科杂志,2011,44:292-295.
2 周秀华,马冬岩.高压氧对慢性充血性心力衰竭患者血循环内皮细胞及脑钠素的影响.北华大学学报,2006,7:243-244.
3 张彬,胡浩.进展性卒中研究现状分析.中国中西医结合急救杂志,2012,19:255-257.
4 吴杨,王水平,程晋成,等.高压氧治疗对急性脑梗死患者血清C发应蛋白和白细胞介素-6含量的影响及疗效观察.中华航海与高气压医学杂志,2013,20:12-14.
5 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010.中国全科医学,2011,14:4013-4017.
6 中华神经科学会.脑卒中患者临床神经功能缺损程度评分标准.中华神经科杂志,1996,29:381-383.
7 周维金,孙启良主编.瘫痪康复评定手册.第1版.北京:人民卫生出版社,2006.45-51.
8 高卓,朱峰,田国萍.进展性脑卒中相关因素临床分析.中国医药导报,2011,8:159-160.
9 LiR Y,Cao ZG,Li Y,et al.Increased whole blood viscosity is associated with silent cerebral infarction.Clin Hemorheol Microcirc,2015:59:301-307.
10 Murphy SA,Cannon CP,Wiviott SD,et al.Reduction in recurrent cardiovascular events with intensive lipid-lowering statin therapy compared with moderate lipid-lowering statin therapy after acute coronary syndromes from the PROVE IT-TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Th.J Am Coll Cardiol,2009,54:2358-2362.
11 郑金锋.内皮素与动脉粥样硬化关系的研究进展.实用医药杂志,2001,18:477-478.
12 吴翊馨,张海平,苏胜林.不同强度有氧运动对动脉粥样硬化大鼠血浆ET-1、NO浓度的影响.中国老年学,2014,34:1568-1569.
13 Dávalos A,Toni D,Weim F,et al.Neurological deterioration in acute ischemic stroke:potential predictors and associated factors in the European cooperative acute stroke study (ECASS) I.(ECASS)I.Stroke,1999,30:2631-2636.
14 潘登.NO与缺血性脑卒中患者颈动脉粥样硬化斑块的相关性探讨.中国现代药物应用,2014,8:25-26.
15 张志琳,霍红梅,王运良,等.进展性脑卒中患者内皮素、一氧化氮含量的变化.中国实用神经疾病杂志,2004,7:8-9.
16 宋正良.进展性脑卒中危险因素及发病机制研究概况.现代中西医结合杂志,2014,23:3528-3529.
17 Vila N,Castillo J,Dávalos A,et al.Proinflammatory cytokines and early neurological worsening in ischemic stroke.Stroke,2003,31:2325-2329.
18 方建,陈文武.进展性缺血性脑卒中患者血清TNF-α和IL-6水平变化及依达拉奉对其的影响.中国医师进修杂志,2009,32:13-14.
19 Di Napoli M,Schwaninger M,Cappelli R,et al.Evaluation of C-reactive protein measurement for assessing the risk and prognosis in ischemic stroke:a statement for health care professionals from the CRP Pooling Project members.Stroke,2005,36:1316-1329.
20 曹红,孙长凯,赵杰,等.血清c-反应蛋白水平与脑梗死病情及预后的关系.临床神经病学杂志,2005,18:422.
21 田英,张梅,刘翠萍,等.缺血性脑卒中患者CRP变化和临床意义研究.河北医药,2012,34:337-338.
22 上官稳.进展性缺血性脑卒中患者血清IL-6和C-反应蛋白水平的变化及临床意义.中国临床新医学,2012,5:427-430.
23 王平.血清CRP、IL-6、MMP-9与进展性卒中发病机制相关关系研究.世界最新医学信息文摘:电子版,2013,13:182-183.
24 王红艳,戚肪,胥向红,等.高压氧联合盐酸法舒地尔治疗急性进展性脑梗死临床疗效观察.中国医科大学学报,2011,40:938-940.
R 742.82
A
1002-7386(2017)21-3248-05
2017-05-18)
项目来源:河北省科学技术研究与发展支撑计划项目(编号:20160463)
063000 河北省唐山市丰南区医院内五科(万玉艳);河北省唐山工人医院神经内科(黎云)

