超声心动图联合HbA1c和MOP检测对脓毒症心肌损伤风险的评估价值
韩斌 郑文香 曹新河 孙江涛 王丹 唐济飞 周文花 刘东海
doi:10.3969/j.issn.1002-7386.2017.21.010
超声心动图联合HbA1c和MOP检测对脓毒症心肌损伤风险的评估价值
韩斌 郑文香 曹新河 孙江涛 王丹 唐济飞 周文花 刘东海
目的观察超声心动图联合糖化血红蛋白(HbA1c)及髓过氧化物酶(MOP)检测对脓毒症心肌损伤风险的评估价值。方法84例脓毒症患者按诊断分为3组,分别为脓毒症组30例、严重脓毒症组28例和脓毒性休克组26例,另选体检正常者30例为对照(正常组)。4组患者均于入院后24 h内行超声心动图检查,测量左心房内径(LAD)、左心室舒张末内径(LVEDD)、左心室射血分数(LVEF)、短轴缩短率(FS)。检测清BNP和cTnI水平、血浆髓过氧化物酶(MOP)及糖化血红蛋白(HbA1c),评估患者急性生理和慢性健康状况评分Ⅱ(APACHEⅡ)分值。结果脓毒症组、严重脓毒症组、脓毒性休克组患者LAD、LVEDD均较正常组增加,HbA1c、MOP、BNP、cTnI水平升高,APACHEⅡ评分增加,LVEF及FS降低,差异均有统计学意义(P<0.05),且3组组间两两比较差异有统计学意义(P<0.05)。提示随着脓毒症病情的加重,心脏功能受损也越严重。相关性分析统计结果显示, HbA1c、 MOP水平与APACHEⅡ评分、BNP及cTnI水平均有相关性(P<0.05),其中LVEF、FS与APACHEⅡ评分、BNP及cTnI水平呈负相关,LVEDD、LAD、HbA1c、MOP呈正相关性。结论超声心动图联合MPO、HbA1C检测可以更好的预测脓毒症心肌损伤发生的风险,评估心肌损伤的程度。
超值心动图;糖化血红蛋白;过氧化物酶;脓毒症;心肌
脓毒症是由感染引起的全身炎性反应综合征,具有较高的发病率和病死率。尽管近年来脓毒症束集化治疗在临床上的推广和和应用在一定程度上改善了脓毒症患者的预后,但其病死率仍居高不下[1]。心肌损伤是脓毒症常见的并发症,其发生率可高达40%以上,是加速脓毒症病情进展、导致多器官功能障碍综合征 (MODS)及预后不良的重要因素[2,3]。Vieillard等[4]报道,50%以上的脓毒症患者早期即可出现心功能障碍。Esper等[5]研究统计显示,约60%的ICU脓毒症患者有心功能障碍的临床表现,其中出现心力衰竭者占7%。Parrillo等[6]研究表明,无心肌损伤的脓毒症患者病死率为20%,而合并心肌损伤的脓毒症患者病死率显著增加到70%~90%。因此,对脓毒症患者进行监测,及早发现心肌损伤的风险,早期诊治,对改善患者预后具有积极意义。故寻求早期预测心肌损伤的检测方法成为临床需要重视的问题。本研究采用病例对照研究方法,初步分析超声联合糖化血红蛋白(HbA1c)及髓过氧化物酶(MOP)检测脓毒症心肌损伤风险的评估及对预后意义。
1 资料与方法
1.1 一般资料 选择2014年8月至2016年8月廊坊市人民医院急诊重症医学科收治的符合纳入标准的84例脓毒症患者,按诊断结果将患者分为3组,分别为脓毒症组、严重脓毒症组和脓毒性休克组。其中脓毒症组30例,男14例,女16例;年龄25~67岁,平均年龄(44.63±6.12)岁;疾病类型:原发性肺炎7例,弥漫性腹膜炎7例,急性重症胰腺炎4例,泌尿系统感染3例,严重外伤3例,肠道术后肠瘘软组织感染3例,烧伤2例,其他1例。严重脓毒症组28例,男13例,女15例;年龄24~65岁,平均年龄(46.47±7.38)岁;疾病类型:原发性肺炎8例,弥漫性腹膜炎6例,急性重症胰腺炎6例,泌尿系统感染5 例,严重外伤2例,肠道术后肠瘘软组织感染1例。脓毒性休克组26例,男12例,女14例;年龄26~69岁,平均年龄(41.22±5.53)岁;疾病类型:原发性肺炎7例,弥漫性腹膜炎6例,急性重症胰腺炎4例,泌尿系统感染4例,严重外伤3例,肠道术后肠瘘软组织感染2例。3组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。另选同期廊坊市人民医院体检正常者30名作为对照(正常组),男13例,女17例;年龄42~62岁,平均年龄(46.72±5.91)岁;均无高血压、糖尿病、感染及心脏病史。
1.2 病例选择标准
1.2.1 诊断标准:选择符合《2012国际严重脓毒症及脓毒性休克诊疗指南》[7]中脓毒症、严重脓毒症及脓毒性休克诊断标准的病例。
1.2.2 排除标准:①既往有心脏病史者,如扩张型心肌病、肥厚型心肌病、心肌炎、风湿性心脏瓣膜病及其他器质性心脏病、慢性心力衰竭;②入组2周内进行过胸外心脏按压心脏复苏、除颤、直流电复律,发生过心肌梗死、冠脉支架植入术或冠脉搭桥术者;③有慢性心、肝、肺、肾、血液系统疾病及肌肉性疾病、糖尿病患者;④急性病毒性心肌炎、急性冠脉综合征;⑤治疗72 h 内死亡或出院者;⑥合并有消化道大出血、肠梗阻等严重消化道疾病;⑦合并恶性肿瘤及自身免疫性疾病者;⑧胸部创伤、开胸手术、肺栓塞及急性脑出血者;⑨年龄>70岁。所有纳入病例签署知情同意书,并经过所在医院伦理委员会批准。
1.3 研究方法 3组患者均按照《2012国际严重脓毒症及脓毒性休克诊疗指南》接受液体复苏、抗感染、抗休克及营养支持等常规支持治疗及对症治疗。于入院后24 h内行超声心动图检查,采用分别测量量左心房内径(LAD)、左心室舒张末内径(LVEDD)、左心室射血分数(LVEF)、短轴缩短率(FS)。检测血清BNP和cTnI水平、血浆髓过氧化物酶(MOP)及糖化血红蛋白(HbA1c),评估患者急性生理和慢性健康状况评分Ⅱ(APACHEⅡ)分值。其中超声心动图检查采用飞利浦彩色多普勒超声诊断仪HD5检测;BNP及cTnI测定采用化学发光免疫分析法,所有分析步骤均由仪器自动完成,分析仪器为美国贝克曼库尔特全自动化学发光免疫分析仪ACCESS2,试剂盒分别为深圳市新产业生物医学工程有限公司、北京泰格科信生物科技有限公司生产。HbA1c检测采用高效液相色谱法,检测仪器为美国Bio-Rad公司生产的D糖化血红蛋白,采用配套试剂。血浆MPO的检测采用酶联免疫吸附测定法,试剂盒为武汉优尔生(Uscn life)科技股份有限公司公司生产,严格按照说明书操作。

2 结果
2.1 4组超声心动图检查结果比较 超声心动图检测结果显示,脓毒症组、严重脓毒症组、脓毒性休克组患者LAD、LVEDD均较正常组增加,LVEF及FS降低,差异均有统计学意义(P<0.05)且3组组间两两比较差异有统计学意义(P<0.05)。提示随着脓毒症病情的加重,心脏功能受损也越严重。见表1。


指标正常组(n=30)脓毒症组(n=30)严重脓毒症组(n=28)脓毒性休克组(n=26)LAD(mm)27.23±3.3536.96±4.26∗42.14±5.38∗#53.91±3.76∗#△LVEDD(mm)42.17±3.8850.07±5.75∗55.65±4.12∗#63.24±5.33∗#△LVEF(%)68.82±4.1652.36±4.82∗43.34±4.85∗#32.37±3.91∗#△FS(%)38.74±3.2927.67±2.43∗20.47±2.76∗#15.46±2.85∗#△
注:与正常组比较,*P<0.05;与脓毒症组比较,#P<0.05;与严重脓毒症组比较,△P<0.05
2.2 4组HbA1c、MOP、BNP和cTnI检测结果比较 脓毒症组、严重脓毒症组、脓毒性休克组患者HbA1c、MOP、BNP和cTnI水平均较正常组增加,差异均有统计学意义(P<0.05),且3组组间两两比较差异有统计学意义(P<0.05)。见表2。


指标正常组(n=30)脓毒症组(n=30)严重脓毒症组(n=28)脓毒性休克组(n=26)HbA1c(%)5.72±0.557.91±1.02∗8.49±1.81∗#10.27±2.73∗#△MOP(μg/L)32.58±0.83105.43±11.37∗163.85±16.44∗#252.09±22.68∗#△BNP(ng/L)36.33±6.26313.02±24.81∗854.73±48.38∗#1135.63±126.41∗#△cTnI(ng/ml)0.048±0.0020.252±0.066∗0.684±0.125∗#1.167±0.447∗#△
注:与正常组比较,*P<0.05;与脓毒症组比较,#P<0.05;与严重脓毒症组比较,△P<0.05
2.3 4组APACHEⅡ评分比较 正常组、脓毒症组、严重脓毒症组、脓毒性休克组组间APACHEⅡ分值两两比较差异有统计学意义(P<0.05),脓毒症组低于正常组,严重脓毒症组低于脓毒症组,脓毒性休克组低于严重脓毒症组。见表3。
2.4 相关性分析 脓毒症患者超声心动图检测结果及HbA1c、MOP水平与APACHEⅡ分值、BNP及cTnI水平均有相关性(P<0.05),其中LVEF、FS与APACHE Ⅱ分值、BNP及cTnI水平呈负相关,LVEDD、LAD、HbA1c、MOP呈正相关性。见表4。
表3 4组APACHEⅡ分值比较 分
注:与正常组比较,*P<0.05;与脓毒症组比较,#P<0.05;与严重脓毒症组比较,△P<0.05
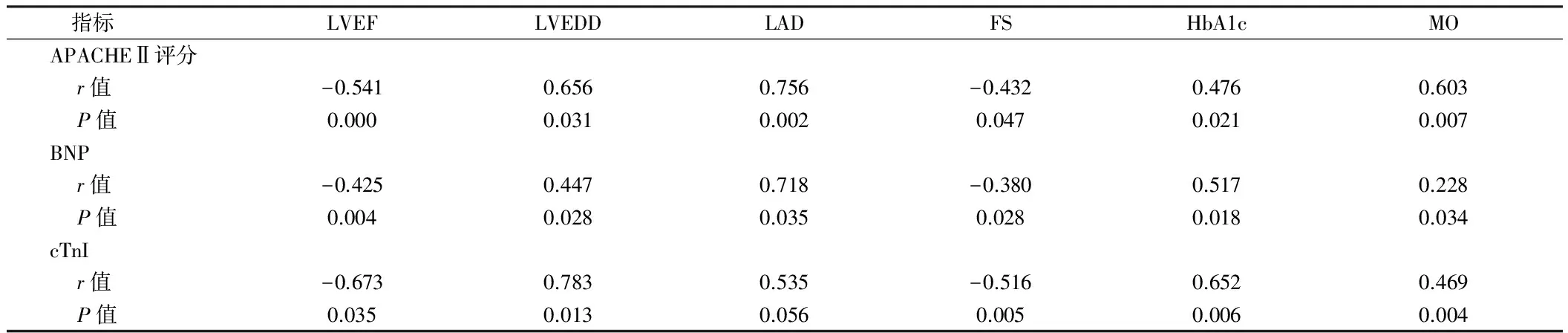
表4 相关性分析
3 讨论
脓毒症是感染引起的全身炎性反应综合征,病情进一步恶化成为严重脓毒症、脓毒性休克及MODS,具有高患病率和病死率。心脏作为循环系统的中心,是最易受脓毒症打击的靶器官,主要表现为全心收缩和舒张功能衰竭。这种损害随着感染和全身炎性反应的发生而出现,当脓毒症病情好转后心肌病变和心力衰竭可得到好转、恢复。目前,脓毒症心肌功能障碍的发病机制尚不明确[8]。因此,早期预测和发现脓毒症心肌损害,及时采取有效措施阻断和逆转心肌功能障碍的发生发展,是促进脓毒症患者康复、改善患者预后的重要环节,具有重要的社会和经济意义。
目前,有关脓毒症心肌损害的检测研究主要集中于心脏超声的表现,脓毒症心肌损害的早期识别主要基于LVEF降低[9]。LVEF是评价左心室收缩功能、预测收缩性心功能不全预后的最常用的指标。Jardin等[10]报道,脓毒症休克患者食道超声心动图显示,LVEF明显降低。APACHE Ⅱ是国际上应用最广泛的评估危重患者预后的评分方法,其预测病死率的正确率高达86%,该方法简单、准确、可靠[11]。王晓燕等[12]研究显示,脓毒症患者LVEF与APACHE Ⅱ呈负相关,从临床实践操作来看,超声心动图检查无创伤,操作性强,患者接受程度高,且较APACHE Ⅱ更客观,因此在APACHE Ⅱ基础上加用心脏超声心动监测,有助于脓毒症患者心肌损害的评价。但单纯从以LVEF的变化来判断脓毒症心肌损害存在较大争议。Pulido等[13]认为,将LVEF降低作为诊断脓毒症心肌功能障碍的唯一标准是错误的,具有误导性;其研究指出,在超声心动图上提示心肌损害与非心肌损害脓毒症患者的30 d、1年病死率无明显差异(P>0.05),考虑可能为样本量太小或纳入标准不同。且近年随着来舒张性心功能障碍概念的提出,脓毒症患者存在舒张性心功能障碍也得到相关研究证实。刘晨燕[14]依据超声心动图检查结果分析指出,脓毒症患者心肌损害可分为3种类型表现:(1)左心室径正常,而舒张功能减低;(2)左心室扩大及舒张功能减低;(3)左心室扩大,收缩功能及舒张功能减低。提示脓毒症患者普遍存在左心室舒张功能障碍。本研究结果显示,相对于正常人,脓毒症患者心脏超声LVEF降低(P<0.05),LVEDD增大(P<0.05),且随着脓毒症的发展,在脓毒症早期、严重脓毒症、脓毒性休克各个阶段也都存在差异(P<0.05),并且与APACHE Ⅱ分值具有相关性(P<0.05),提示脓毒症患者可能同时存在心室舒张功能与收缩功能不全,从而加速心肌功能受损,使病情进一步恶化。故我们认为,可以将超声心动图检测作为脓毒症患者临床病情评估和预后判断的可靠手段,同时联合灵敏度高的生物标志物能更准确的判断心肌损害的程度,以便及时进行干预和治疗,改善患者预后。
目前,磷酸肌酸激酶同工酶(CK-MB)是心肌损伤的常规检查项目,但其敏感性和特异度均较差,无法检测出心肌损伤较小的反应。而cTnI是具有高度灵敏性和特异性的心肌损伤标志物。所以,cTnI的早期阳性率较高,并能检出微小心肌损伤,具有检测快速、诊断窗口期宽等优点,已取代CK-MB成为判断心肌损伤,特别是急性心肌梗死的“金标准”,对可疑急性心肌梗死的诊断率可达94.3%,诊断特异性为100%[15],同时也是诊断脓毒症心肌损伤的重要指标。脓毒症患者cTnI水平明显高于正常人,且cTnI水平越高,心肌功能就越差,并与APACHEⅡ分值呈正相关,预示着病情加重、病死率增高,若分时段检测cTnI的动态变化,有可能更及时的发现心肌损害,与本研究结果一致。中华医学会检验分会建议把肌钙蛋白作为诊断心肌损伤的金标准,还建议如已开展了肌钙蛋白的测定就不必进行心肌酶谱的检测。但郭健等[16]研究指出,cTnI能够诊断脓毒症心肌损伤,但与LVEF无相关性,不能反映左心室收缩功能不全。本研究结果显示,脓毒症患者cTnI水平与LVEF、FS呈负相关,与LVEDD、LAD呈正相关性(P<0.05),与上述研究结果不一致,有待进一步研究。
BNP是一种多肽类神经内分泌激素,是临床心力衰竭诊断、治疗及判断预后的定量标志物。郭健等[16]研究显示,脓毒症LVEF≤40%组患者BNP水平比LVEF>40%组明显升高,死亡组BNP水平明显高于存活组,BNP与APACHEⅡ分值和LVEF均呈正相关。提示BNP可反映脓毒症心功能障碍,尤其是左室收缩功能不全,并且与患者病情严重程度及预后密切相关。Post等[17]发现,BNP在脓毒症LVEF降低的患者中显著升高。黎利娟[18]研究也证实,感染是使脓毒症患者血浆BNP水平升高的主要因素之一,将BNP值作为脓毒症患者心功能不全及液体超负荷的诊断依据时须谨慎,目前尚不能完全排除脓毒症时BNP升高与心肌损害有关。因此,临床上大多以cTnI和BNP联合检测作为诊断脓毒症心肌损伤和心肌功能障碍、判断脓毒症患者病情严重程度和预后的指标。其中cTnI升高反映了心肌细胞膜的损伤,BNP升高反映了心室壁张力的改变,二者分别反映了心脏结构和功能改变,当cTnI与BNP水平显著升高时,患者病死率将增加12倍左右[19]。本研究结果显示,与正常人群相比,脓毒症患者cTnI及BNP水平均显著升高(P<0.05),联合超声心动图检测结果提示,脓毒症患者存在心肌功能受损,且重度脓毒症、脓毒症休克患者心肌受损情况更为严重。
MPO又称过氧化物酶,是一种由中性粒细胞、单核细胞、巨噬细胞分泌的含血红素辅基的血红素蛋白酶,存在于嗜中性多核细胞的嗜天青颗粒和巨嗜细胞中,参与体内许多病理生理过程,是近年来最被看好的新的心脏标志物[20]。Brennan等[21]报道,血浆MPO测定值能独立地预测早期心肌梗死的危险,以及以后30 d和6个月期间发生重大不良心脏事件的危险,且MPO可以在心肌无坏死的情况下预测心脏事件的危险。此外,MPO还参与了心肌再灌注损伤,心肌缺血再灌注时,心肌有中性粒细胞浸润,其胞浆的嗜天青颗粒中含有大量的溶酶体酶MPO。MPO既能间接反映心肌浸润中性粒细胞的数量又能反映其激活程度,是心肌损伤过程中中性粒细胞浸润的标志物[22]。但其对脓毒症心肌损伤的诊断及预后判断中的作用目前报道较少。姬晓伟等[23]报道显示,脓毒症、脓毒性休克患者存在心肌损伤,MPO早期诊断阳性率为81.8%,具有较高的敏感性。安静霞[24]实验研究显示,脓毒症大鼠心肌组织较对照组MPO活性升高,且心肌组织间隙炎症细胞浸润增加。脓毒症一种全身性过度炎性反应综合征,机体免疫系统受损,大量炎性介质、促炎性介质、及不同来源的细胞因子释放,以“细胞因子风暴”的效应方式,直接损伤心肌细胞,引起心肌灌注不足、心肌能量代谢障碍以及心肌细胞凋亡。脓毒症早期炎症因子的升高与心肌损伤具有正相关性。中性粒细胞是体内粒细胞最大的亚群,在炎症的发生、发展和转归中起着至关重要的作用。中性粒细胞聚集参与脓毒症时SIRS和多脏器功能损伤,如急性肺损伤、肝损伤、肠屏障功能衰竭、肾衰竭等,是心肌损伤的初始条件。脓毒症时,活化的中性粒细胞聚集在心肌微血管内并浸润到心肌组织中,随后其他炎症介质、氧自由基、和急性期反应蛋白被释放,引起心肌损伤。MPO是中性粒细胞的特异性酶,能催化产生多种活性氧化物质,导致氧化应激和氧化性组织损伤,使内皮细胞功能受损,造成NO生成障碍,影响血管平滑肌舒张功能,从而引起局部心肌组织血流供应减少,导致心肌细胞坏死和凋亡;其激活程度与中性粒细胞的浸润程度密切相关,是反映中性粒细胞浸润的特异性指标[25]。因此,MPO在血浆中的水平升高先于心肌损伤。陈蕊等[26]研究显示,脓毒症心肌损伤时,心肌组织MPO水平明显增高,心肌组织存在中性粒细胞浸润,与血清 cTnI 水平呈正相关。本研究结果显示,脓毒症患者MPO水平显著高于正常人(P<0.05),且随着病情的加重,其水平显著升高(P<0.05),与血清cTnI 水平呈正相关(P<0.05),提示MPO对脓毒症心肌损害的判断具有重要意义,MPO水平越高,心肌损害越严重。从长远而看,临床上联合MPO检测可以对脓毒症心肌损害作出更加准确的评估结果,对于制定治疗策略大有裨益。
脓毒症患者无论原先是否合并糖尿病,在多种疾病因素的强烈刺激下,内分泌及代谢紊乱,加之营养支持治疗等,易于出现以高血糖为特征的糖代紊乱。高血糖可损害多个器官系统,对血管内皮功能、血流动力学、免疫系统等均有不良影响,是脓毒症患者死亡的独立危险因素之一。脓毒症时应激性高血糖可诱导炎性介质分泌增加,如NF-α、IL-6,产生自由基,激活蛋白酶K等,从而加重机体的炎性反应,导致血管内皮功能紊乱,引起内皮依赖性血管舒张功能减退及内皮细胞凋亡,造成更严重的心肌损伤[27];高血糖时,相关胰岛素分泌不足,可致糖分解底物减少,脂肪酸增多,后者可降低心肌收缩力,促进心衰和心律失常;血糖升高使糖化血红蛋白升高,血小板聚增加,抗凝活性降低,导致血液粘稠度增高,血液阻力加大,进而影响微循环,使组织血液灌注量显著减少,而使心肌细胞对缺血、缺氧更加敏感,心脏功能减退。动物实验研究证实,高血糖可以增加大鼠心肌缺血再灌注损伤的易感性,这可能与高糖诱发的氧化应激效应加重MIRI大鼠活性氧的产生、高凝状态、内皮功能不全,以及加重炎症反应,致心肌氧化还原失衡等,进而影响冠脉舒张,加重再灌注期微循环障碍,使凋亡加重[28]。因此,在对脓毒症患者的治疗积极检测血糖具有重要的意义,能够及早发现心肌损伤。HbA1c是血红蛋白与葡萄糖通过非酶促作用形成的化合物,其含量可以反映测定前4~12周体内平均血糖水平。高HbA1c水平是导致心肌损伤的一个独立危险因素,与hs-cTnT呈正相关,对早期心肌损伤患者定期检测HbA1c有助于评估微小心肌损伤程度,以早期干预[29]。吴彩军等[30]报道显示,HbA1c较随机血糖评价脓毒症患者预后更准确,不论患者既往是否有糖尿病病史,HbA1c升高组APACHE Ⅱ分值及28 d病死率均明显高于HbA1c正常组(P<0.01),提示HbA1c升高脓毒症患者预后差。本研究结果显示,脓毒症患者糖化血红蛋白水平明显高于正常人,且随着病情的加重,其水平显著升高(P<0.05),预后越差,与血清cTnI、BNP水平呈正相关(P<0.05)。
综上所述,我们认为可以将超声心动图检测是脓毒症患者临床病情评估和预后判断的可靠手段,同时联合灵敏度高的生物标志物cTnI及BNP检测能早期确定脓毒症心肌损害的程度,提高确诊率。但是cTnI及BNP水平升高到一定水平时才能确诊心肌损伤,提示高水平的cTnI及BNP出现时,脓毒症患者已经出现心肌损害,不能提前预测心肌损伤的发生。而MPO水平升高先于心肌损害的发生,高HbA1c水平是导致心肌损伤的一个独立危险因素,因此超声联合MPO、HbA1c检测可以更好的评估脓毒症心肌损伤发生的风险,及时采取规范化的预防措施。同时本研究还显示,MPO、HbA1c与cTnI、BNP、APACHE Ⅱ还具有明显的相关性,提示超声联合MPO、HbA1c检测还能够对心肌损伤程度及预后进行评估。
1 王海彦,廖品琥.脓毒症集束化治疗的临床研究进展.天津医药,2013,41:392-395.
2 Zaky A,Deem S,Bendjelid K,et al.Characterization of cardiac dysfunction in sepsis:an ongoing challenge.Shock,2014,41:12-24.
3 Hunter JD,Doddi M.Sepsis and the heart.Br J Anaesth,2010,104:3-11.
4 Vieillard-Baron A,Caille V,Charron C,et al.Actualincidence ofglobal left ventricular hypokinesia in adult septic shock.Crit Care Med,2008,36:1701-1706.
5 Esper AM,Martin GS.Extending international sepsis epidemiology:the impact of organ dysfunction.Crit Care,2009,13:148-150.
6 Parrillo JE,Parker MM,Natanson C,et al.Septic shock in humans.Advances in the understanding of pathogenesis,cardiovascular dysfunction,and therapy.Ann Intern Med,1990,113:227-242.
7 Dellinger RP,Levy MM,Rhodes A,et al.Surviving sepsis campaign:international guidelines for man agement of severe sepsis and septic shock:2012.Crit Care Med,2013,41:580-637.
8 马云涛,商波,房伟,等.脓毒症心肌抑制机制的研究进展.中华临床医师杂志(电子版),2016,10:100-104.
9 刘晨燕,柴艳芬.脓毒症患者左心室功能改变及其临床意义探讨.中外医疗,2010,29:19-21.
10 Jardin F,Fourme T,Page B,et al.Persistent preload defect in severe sepsis despite fluid loading:a longitudinal echocardiographic study in patients with septic shock.Chest,1999,116:1354-1359.
11 郑兴珍,朱简,于强.APACHE Ⅱ评分在临床应用的现状及进展.医学综述,2011,17:3297-3299.
12 王晓燕,张流忠,周莉,等.脓毒症患者左室射血分数的研究.湖南中医药大学学报,2016,36:983-983.
13 Pulido JN,Afessa B,Masaki M,et al.Clinical spectrum,frequency,and significance of myocardial dysfunction in severe sepsis and septic shock.Mayo Clin Proc,2012,87:620-628.
14 刘晨燕.脓毒症患者左心室结构和功能变化特点及其临床意义探讨.天津医科大学,2010.
15 Braunwald E,Antman EM,Beasley JW,et al.ACC/AHA 2002 guideline update for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction-summary article:a report of the American College of Cardiology/American Heart Association task force on practice guidelines (Committee on the Management of Patients With Unstable Angina).J Am Coll Cardiol,2002,40:1366-1374.
16 郭健,汤瑾,夏一春,等.BNP和cTnI在脓毒症心肌功能障碍中的诊断意义.中国医药导刊,2014,16:726-727.
17 Post F,Weilemann LS,Messow CM,et al.B-type natriuretic peptide as a marker for sepsis-induced myocardial depression in intensive care patients.Crit Care Med,2008,36:3030-3037.
18 黎利娟.脓毒症患者B型利钠肽的影响因素分析.暨南大学,2013.
19 马光,洪广亮,赵光举,等.脓毒症患者血浆B型尿钠肽和肌钙蛋白I的变化及意义.中国中西医结合急救杂志,2014,21:99-103.
20 Nahrendorf M,Sosnovik D,Chen JW,et al.Activatable magnetic resonance imaging agent reports myeloperoxidase activity in healing infarcts and noninvasively detects the antiinflammatory effects of atorvastatin on ischemia-reperfusion injury.Circulation,2008,117:1153-1160.
21 Brennan ML,Penn MS,Van Lente F,et al.Prognostic value of myeloperoxidase in patients with chest pain.N Engl J Med,2003,349:1595-1604.
22 匡秀青,范金茹,姜益宏,等.心痛方对心肌缺血模型大鼠MPO活性及PS表达的干预作用.湖南中医药大学学报,2012,32:31-33.
23 姬晓伟,谢波.NT-proBNP、FABP、GPBB、MPO对脓毒症心肌病早期诊断价值的研究//中华医学会西湖重症医学论坛、2015年浙江省重症医学学术年会.2015.
24 安静霞.过氧亚硝基阴离子在脓毒症心肌细胞促炎症转变中的作用. 江苏大学,2016.
25 Sinning C, Schnabel R, Peacock WF, et al. Up-and-coming markers:myeloperoxidase, a novel biomarker test for heart failure and acute coronary syndrome application?Congest Heart Fail,2008,14:46-48.
26 陈蕊,姜巧,熊日成,等.脓毒症小鼠心肌损伤与中性粒细胞浸润的关系.现代生物医学进展,2012,12:1817-1819.
27 杨乐,邹晓静,李树生,等. 脓毒症心肌抑制研究进展.内科急危重症杂志,2010,16:46-48.
28 白莉,贾永平,忽海洋. 应激性高血糖对大鼠心肌缺血再灌注损伤的观察. 中西医结合心脑血管病杂志,2014,12:994-996.
29 李礼,于正清,胡娟玉,等. 糖化血红蛋白检测在早期心肌损伤诊断中的价值. 江苏大学学报医学版,2012,22:491-493.
30 吴彩军,李丽华,李春盛. 脓毒症患者糖化血红蛋白与预后的研究. 中国急救医学,2011,31:680-682.
R 631.2
A
1002-7386(2017)21-3239-05
2017-05-18)
项目来源:廊坊市科学技术研究与发展支撑计划项目(编号:2016013017)
065000 河北省廊坊市人民医院急诊重症医学科(韩斌、周文花),B超室(曹新河、王丹),检验科(孙江涛),皮肤科(刘东海);廊坊卫生职业学院微生物检验教研室(郑文香);河北省廊坊市中心血站血液保障部(唐济飞)

