羊栖菜蛋白质提取及功能性研究
庞庭才,胡上英,范和良,黄 海,林丽丹
(1.钦州学院 广西北部湾海洋生物多样性养护重点实验室,广西 钦州 535000;2.钦州学院广西高校北部湾特色海产品资源开发与高值化利用重点实验室,广西 钦州 535000;3.钦州学院 机械与船舶海洋工程学院,广西 钦州 535000)
羊栖菜蛋白质提取及功能性研究
庞庭才1,2,胡上英3,范和良2,黄 海2,林丽丹2
(1.钦州学院 广西北部湾海洋生物多样性养护重点实验室,广西 钦州 535000;2.钦州学院广西高校北部湾特色海产品资源开发与高值化利用重点实验室,广西 钦州 535000;3.钦州学院 机械与船舶海洋工程学院,广西 钦州 535000)
以羊栖菜为原料,考察提取工艺对其蛋白质得率的影响,并研究羊栖菜蛋白质的功能特性。通过单因素试验考察了液料比、碱质量分数、浸提温度和浸提时间等4个因素,根据Box-Benhnken试验设计和响应面分析法确定羊栖菜蛋白提取的最佳工艺条件。结果表明,羊栖菜蛋白的最佳提取条件为液料比21∶1(mL∶g),碱质量分数2.5%,浸提温度57℃,浸提时间5 h。在此最佳工艺条件下,蛋白质得率为28.95%。羊栖菜蛋白的起泡性高达76.7%,优于大豆分离蛋白,而吸水性、吸油性、乳化能力、乳化稳定性、泡沫稳定性均不如大豆分离蛋白。
羊栖菜;蛋白质;提取;功能特性;响应面分析法
羊栖菜(Hizikia fusiformis)属于褐藻门、马尾藻科的一种海洋孢子植物,主要附生在基质上,是一种底栖附生生活型藻类。主要分布在我国浙江、福建、广东等沿海地区[1]。羊栖菜营养丰富,富含有多糖、蛋白、食物纤维素、维生素以及微量元素等营养物质,在医药、食品以及化妆品等领域均具有较高的开发和利用价值[2]。蛋白质作为食物中的重要组成部分,被认为是人类所必需的第一营养素或生命素,占人体组成成分的45%[3]。无论动物或者人类都离不开蛋白质,但目前世界上约有1/5的人口缺乏蛋白质,蛋白质资源短缺及来源匮乏已是当今世界,特别是发展中国家亟需解决的问题[3-4]。长期以来,我国利用最广泛的植物蛋白是大豆蛋白,其他蛋白质资源亟待开发,因此探索新的蛋白质资源具有重要的现实意义[4]。已有研究表明,郑温翔等[5]采用木瓜蛋白酶酶解的方法提取紫菜蛋白多肽,蛋白提取率为82%。刘立闯等[6]采用不同的方法提取螺旋藻蛋白行破碎,结果表明:超声波法得到蛋白溶出率为71.51%,高压均质法蛋白溶出率为73.87%,反复冻融法蛋白溶出率为72.03%。BERMEJO R等[7]采用阴离子交换树脂层析柱纯化螺旋藻藻蓝蛋白,最终得率为9.6%。本研究采用碱溶酸沉法提取羊栖菜中的蛋白质[8],通过单因素试验考察液料比、碱质量分数、浸取时间和浸提温度4个因素对蛋白得率的影响,并采用响应面法优化羊栖菜蛋白质的提取工艺,并研究羊栖菜蛋白质的功能性质,旨在为提高羊栖菜的综合利用价值提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
羊栖菜:广东雷州市市售;盐酸、氢氧化钠、四氯化碳、硫酸铜(均为分析纯):成都科龙化工试剂厂;大豆分离蛋白(soybean protein isolate,SPI):河南省柘城县耕道贸易有限公司。
1.2 仪器与设备
HH-4型恒温水浴锅:金坛市城西峥嵘实验仪器厂;BSA124S型电子天平:赛多利斯科学仪器(北京)有限公司;DHG-9030A型鼓风干燥箱:上海一恒科学仪器有限公司;UV-1800型紫外可见分光光度计:岛津(中国)有限公司;TDL-5000-CR型离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 羊栖菜蛋白质提取工艺流程

1.3.2 羊栖菜蛋白质等电点的确定
称取4.0 g羊栖菜样品粉末,按照液料比10∶1(mL∶g),加入0.1 mol/L NaOH溶液,在60℃恒温条件下浸提1 h,4 500 r/min离心10 min,过滤取上清液,用0.1 mol/L HCl溶液将提取液pH分别调节为4.4、4.6、4.8、5.0、5.2、5.4、5.6、5.8、6.0、6.2,静置20 min,3 000 r/min下离心15 min,取沉淀烘干至恒质量,沉淀最大时的pH即为羊栖菜蛋白质的等电点。
1.3.3 提取工艺优化单因素试验
考察不同液料比(10∶1、15∶1、20∶1、25∶1、30∶1(mL∶g)),不同碱质量分数(0.5%、1.5%、2.5%、3.5%、4.5%、5.5%),不同浸提温度(50℃、60℃、70℃、80℃、90℃),不同浸提时间(1 h、3 h、5 h、7 h、9 h)对蛋白提取效果的影响。
1.3.4 提取工艺优化响应面试验
在单因素试验的基础上,考察液料比(X1)、浸提时间(X2)、碱质量分数(X3)、浸提温度(X4)对羊栖菜蛋白质提取效果的影响,根据Box-Benhnken中心组合试验设计原理进行响应面设计[9-10],以蛋白得率为评价指标,对羊栖菜蛋白提取条件进行优化,响应面试验因素与水平如表1所示。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiments
1.3.5 蛋白含量测定及得率计算
采用微量凯氏定氮法测定样品中蛋白含量[11];蛋白质得率计算公式如下:

1.3.6 羊栖菜蛋白功能特性评价方法
(1)吸水性的测定[12]
称量0.5 g蛋白样品m,加入5 mL蒸馏水V1置于离心管中,混匀1 min后,静置30 min,在4 000 r/min离心30 min,测上清液的体积V2,则吸水性(WA)=(V1-V2)/m。
(2)吸油性的测定[12]
称量0.5 g蛋白样品m,加入5 mL花生油V1置于离心管中,混匀1 min后,静置3 min,在4 000 r/min离心30 min,测上清液的体积V2,则吸油性(FA)=(V1-V2)/m。
(3)乳化性及乳化稳定性[13]
蛋白质乳化性的测定:称取2.5g蛋白产品分散于50mL水中,加入50 mL大豆油,在2 000 r/min条件下匀浆1 min,1 200 r/min离心5 min,按下式计算其乳化能力:

蛋白质乳化稳定性的测定:将上述产品于80℃水浴加热30 min后,冷水冷却15 min,1 200 r/min离心5 min,按下式计算其乳化稳定性:
(4)起泡性及其泡沫稳定性[14]
称量3 g蛋白产品和50 mL去离子水置于锥形瓶中,用0.1 moL/L NaOH或HCl调pH至中性,同时搅拌10 min,再加入100 mL去离子水作为测试液,以1 000 r/min快速搅拌3 min,记录所产生的泡沫体积V0(mL),计算起泡性,然后静置30 min,记录所剩余的泡沫体积V30(mL),以此代表其泡沫稳定性。按下式计算起泡性和泡沫稳定性:

2 结果与分析
2.1 羊栖菜蛋白质等电点的确定

图1 蛋白等电点的确定Fig.1 Determination of protein isoelectric point
由图1可知,当羊栖菜蛋白提取液pH=5.0时,蛋白质沉淀量达到最大值,为1.21 g,由此可确定羊栖菜蛋白质的等电点(isoelectric point,pI)为5.0。
2.2 提取工艺优化单因素试验结果
2.2.1 液料比对蛋白质得率的影响

图2 不同液料比对蛋白得率的影响Fig.2 Effects of different liquid solid ratio on protein yield
由图2可知,随着液料比在10∶1~20∶1(mL∶g)范围内增大,羊栖菜蛋白得率逐渐增大;液料比为20∶1(mL∶g)时,羊栖菜蛋白得率最大,为14.63%;当液料比>20∶1(mL∶g)时,蛋白得率则呈下降趋势。当液料比较低时,样品中蛋白质不能充分溶解,随着液料比增大,适合的物料浓度有助于物质的扩散。同时,液料比过大不仅造成成本增加,还会产生过多的废液。因此,选取最佳液料比为20∶1(mL∶g)。
2.2.2 碱质量分数对蛋白质得率的影响

图3 不同碱质量分数对蛋白得率的影响Fig.3 Effects of different alkali concentration on protein yield
由图3可知,随着碱质量分数在0.5%~2.5%范围内增加,羊栖菜蛋白得率呈上升增加的趋势;当碱质量分数达到2.5%时,蛋白得率达到最大值,为18.41%;之后即使碱质量分数继续增大,蛋白得率反而缓慢下降。较低的碱质量分数,蛋白质-水相互作用增强,有利于羊栖菜蛋白溶解,过高的碱质量分数容易引起蛋白质脱氨、脱羧、肽键断裂,引起胱赖反应,使蛋白变性[15]。因此,选取最佳碱质量分数为2.5%。
2.2.3 浸提温度对蛋白质得率的影响
由图4可知,浸提温度在30~60℃范围内增加,羊栖菜蛋白得率随之增大;浸提温度为60℃时,羊栖菜蛋白得率最大,为17.37%;浸提温度>60℃时,羊栖菜蛋白得率随之下降。可能的原因是随着温度升高,会增加蛋白质在提取溶液中的溶解度,而且高温能使之前不完全破壁的细胞破裂,这样能使蛋白质的溶解度增加;但当温度过高时,蛋白质会发生变性,其内部结构发生改变[16],使得蛋白溶解度下降,从而导致得率降低。因此,选取最佳浸提温度为60℃。

图4 不同浸提温度对蛋白得率的影响Fig.4 Effects of different extraction temperature on protein yield
2.2.4 浸提时间对蛋白质得率的影响
由图5可知,浸提时间在1~5 h范围内增加,羊栖菜蛋白得率随之增大;浸提时间达到5 h时,羊栖菜蛋白得率达到最大值,为14.67%;浸提时间>5 h时,羊栖菜蛋白得率有所下降。浸提时间过短,蛋白质溶出不充分,反之浸提时间过长,样品中其他物质可能与蛋白结合,亦不利于蛋白质的溶解。因此,选取最佳提取时间为5 h。
2.3 响应面试验结果
以液料比(X1)、浸提时间(X2)、碱质量分数(X3)、浸提温度(X4)为变量,蛋白质得率(Y)为响应值,设计响应面分析试验,试验方案及结果见表2,方差分析结果见表3。
利用Design Expert统计分析软件对表3数据进行回归拟合,得到二次回归方程:

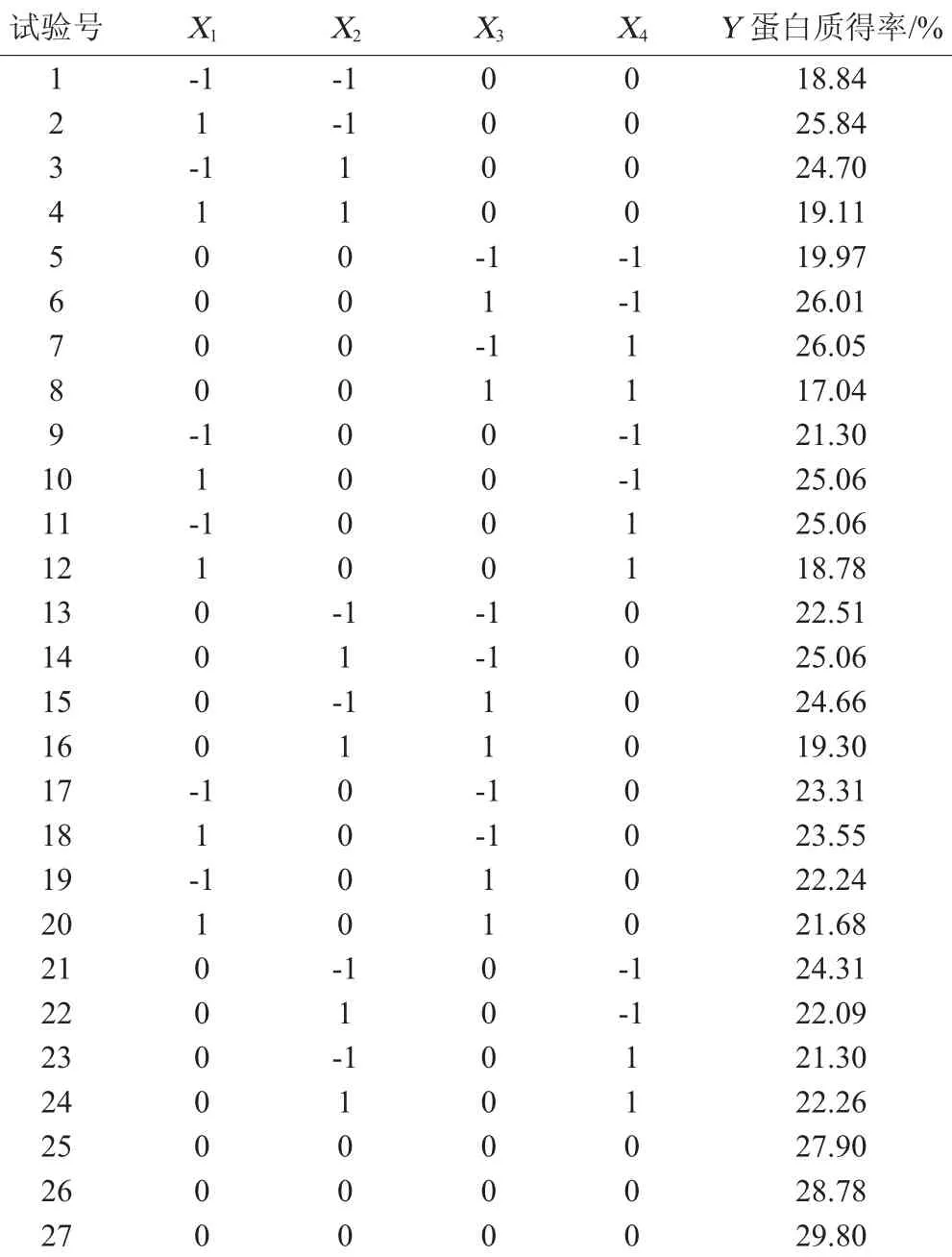
表2 响应面试验设计与结果Table 2 Design and results of response surface experiments

表3 回归模型方差分析Table 3 Variance analysis of regression model
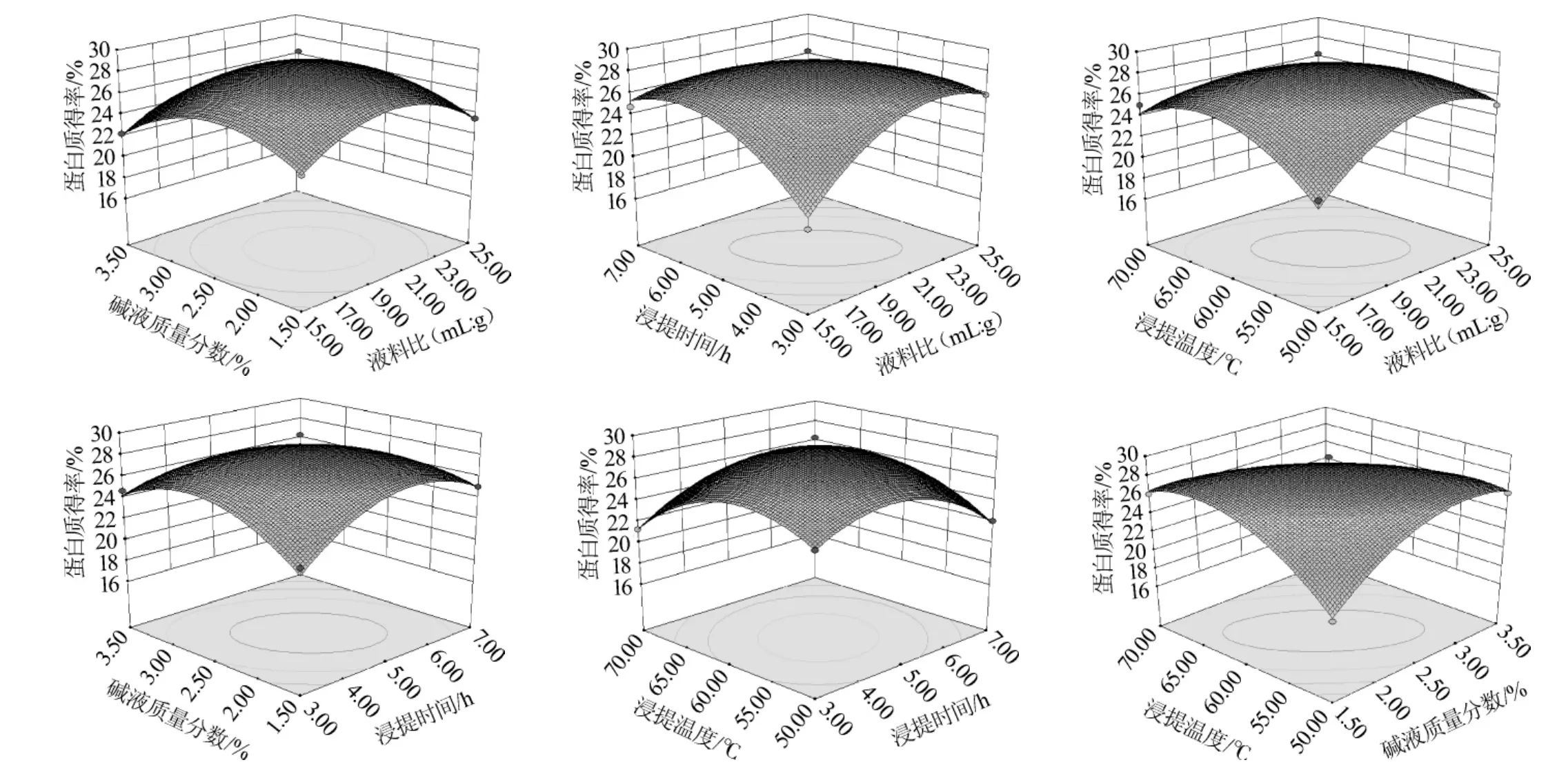
图6 各因素交互作用对羊栖菜蛋白得率影响的响应曲面及等高线Fig.6 Response surface plots and contour line of effects of interaction between various factors onH.fusiformisprotein yield
由表3可知,试验所选的二次多项模型具有极高的显著性(P<0.000 1),决定系数R2=97.9%,说明响应值的变化有97.9%来源于所选变量,即料液比、碱质量分数、浸提温度、浸提时间。因此,回归方程拟合度良好,可利用该方程代替真实试验点进行分析。由P值可知,方程的X3、X4、X2X3、X3X4、X12、X22、X32、X42对Y值影响极显著(P<0.01),X1X4对Y值影响显著(P<0.05),而X1、X2、X1X2、X1X3、X2X4对Y值无显著影响(P>0.05),表明交互作用对响应值影响较小,方程二次项对响应值影响较大。失拟项P=0.860 5,无显著性影响,表明数据没有异常点,不需要分析更高次数的项,模型适当。
由表3的P值可知,各试验因素对羊栖菜蛋白得率的影响排序为:碱质量分数>浸提温度>浸提时间>液料比。
响应曲面越陡峭,表明响应值对操作条件的变化越敏感,反之曲面越平缓,响应值对操作条件的变化影响就越小。由图6可知,碱质量分数与浸提时间/浸提温度变化时,响应值变化比较明显,碱质量分数2.0%~3.0%与浸提时间5~6 h/浸提温度55~65℃时,蛋白质得率相对较高。
2.4 最佳工艺条件的确定及验证
利用Design Expert统计软件分析,羊栖菜蛋白最佳提取工艺条件为液料比20.96∶1(mL∶g)、浸提时间4.55 h、碱质量分数2.6%、浸提温度57.34℃,在此条件下得到羊栖菜蛋白的理论得率为28.91%。考虑到实际操作中的便利性及可行性,将提取工艺参数调整正为液料比21∶1(mL∶g)、浸提时间5 h、碱质量分数2.5%、浸提温度57℃,进行平行验证试验,蛋白平均得率为28.95%,与理论预测值相差不大,表明通过响应面设计建立的数学模型对优化羊栖菜蛋白提取工艺具有实际指导意义。
2.5 羊栖菜蛋白功能特性评价
通过对羊栖菜蛋白样品的几个功能性质评价,并与市售的大豆分离蛋白产品功能进行性质比较,结果见表4。由表4可知,羊栖菜蛋白的起泡性优于大豆分离蛋白,而其他性质则均略差于大豆分离蛋白。所以,羊栖菜蛋白产品能在一定程度上替代大豆分离蛋白产品,但整体功能性质不如大豆分离蛋白。
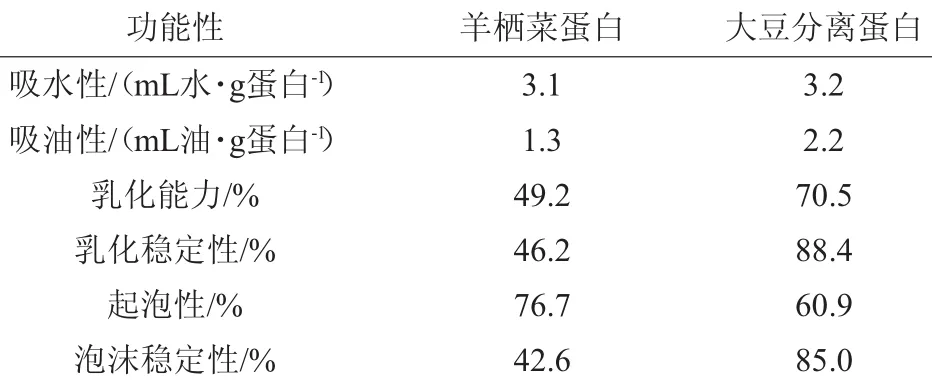
表4 羊栖菜蛋白和大豆分离蛋白的功能特性比较Table 4 Comparison of functional properties ofH.fusiformis protein and soybean protein isolate
3 结论
通过单因素试验和Box-Behnken中心组合设计以及响应面分析对羊栖菜蛋白质提取工艺进行优化。结果表明:各因素对羊栖菜蛋白质得率的影响次序为:碱质量分数>浸提温度>浸提时间>液料比。最佳提取工艺参数为液料比21∶1(mL∶g),浸提时间5 h,碱质量分数2.5%,浸提温度57℃。在此最佳工艺条件下,蛋白得率为28.95%,说明此最佳提取工艺切实可行,可广泛应用于羊栖菜蛋白的制备。羊栖菜蛋白的起泡性优于大豆分离蛋白,而吸水性、吸油性、乳化能力、乳化稳定性、泡沫稳定性均不如大豆分离蛋白。羊栖菜蛋白质含量丰富,可开发成一种新型的功能性高蛋白食品,或作为食品添加剂广泛应用于各类食品加工。
[1]吴 越.羊栖菜生物活性成分研究[D].哈尔滨:东北林业大学,2014.
[2]李杰女,汲晨锋,季宇彬.羊栖菜多糖药用活性的研究进展[J].亚太传统医药,2009,5(7):148-150.
[3]刘高强,周 虎.复合胰蛋白酶提取松毛虫蛹中总蛋白质的工艺[J].食品科技,2008,33(12):140-143.
[4]陈复生,郭兴风.蛋白质化学与工艺[M].郑州:郑州大学出版社,2012:1-5.
[5]郑温翔,郑惠彬,王宝周,等.发酵酶解法提取紫菜蛋白多肽及其特性研究[J].食品与发酵工业,2013,39(4):130-134.
[6]刘立闯,胡志和,刘 彤,等.螺旋藻蛋白提取方法比较研究[J].食品科学,2008,24(11):228-233.
[7]BERMEJO R,FELIPE M,TALAVERA E,et al.Expanded bed adsorption chromatography for recovery of phycocyanins from the microalga Spirulina platensis[J].Chromatographia,2006,63(1):59-66.
[8]张 乐,周林燕,宋洪波,等.响应面法优化金针菇废弃菌根的蛋白提取工艺研究[J].食品工业科技,2014,35(6):221-225.
[9]DURMUS E F,EVRSNUX O.Response surface methodology for protein extraction optimization of red pepper seed(Capsicum frutescens)[J].LWT-Food Sci Technol,2010,43(2):226-231.
[10]MA T Z,WANG Q,WU H W.Optimization of extraction conditions for improving solubility of peanut protein concentrates by response surface methodology[J].LWT-Food Sci Technol,2010,43(9):1450-1455.
[11]中华人民共和国卫生部.GB 5009.5—2010食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2010.
[12]熊 拯,陈敏娥,张炳亮.油茶籽粕蛋白质提取工艺及功能特性研究[J].粮油食品科技,2013,21(1):27-30.
[13]凌孟硕,崔 淼,赵晨伟,等.沙棘籽粕蛋白的碱酶两步法提取工艺及功能性研究[J].食品工业科技,2012,33(17):240-244.
[14]刘 贺,李清华,刘剑侠,等.扁杏仁分离蛋白与水解蛋白功能性质的比较研究[J].食品工业科技,2013,35(4):92-95.
[15]邵佩兰,徐 明.提取大豆分离蛋白的工艺研究[J].粮油加工与食品机械,2005(9):47-51.
[16]阚建全.食品化学(第二版)[M].北京:中国农业大学出版社,2008:44-102.
Extraction and functional properties ofHizikia fusiformisprotein
PANG Tingcai1,2,HU Shangying3,FAN Heliang2,HUANG Hai2,LIN Lidan2
(1.Guangxi Key Laboratory of Beibu Gulf Marine Biodiversity Conservation,Qinzhou University,Qinzhou 535000,China;2.Guangxi Colleges and Universities Key Laboratory of Development and High-value Utilization of Beibu Gulf Seafood Resources,Qinzhou University,Qinzhou 535000,China;3.School of Mechanical and Marine Engineering,Qinzhou University,Qinzhou 535000,China)
WithHizikia fusiformisas raw material,the effect of extraction process on protein yield was investigated,and the functional properties of H.fusiformisprotein were researched.Four factors(including liquid solid ratio,alkali concentration,extraction temperature and time)were researched bysingle factor experiments.The optimum extraction process conditions ofH.fusiformisprotein were determined byBox-Behnken experiments design and response surface methodology.The results showed that the optimum extraction conditions were liquid solid ratio 21∶1(ml∶g),alkali concentration 2.5%,extraction temperature 57℃and time 5 h.Under the optimum conditions,the protein yield was 28.95%.The foaming ability ofH.fusiformis protein was up to 76.7%,which was higher than that of the soybean protein isolate,while the water absorption,oil absorption,emulsifying ability,emulsifying stability and foaming stability were not as good as that of soybean protein isolate.
Hizikia fusiformis;protein;extraction;functional property;response surface methodology
R282.71
0254-5071(2017)09-0148-05
10.11882/j.issn.0254-5071.2017.09.032
2017-02-25
广西自然科学基金(2016GXNSFAA380067);广西北部湾海洋生物多样性养护重点实验室(钦州学院)基金资助(2015ZC02);广西高校北部湾特色海产品资源开发与高值化利用重点实验室(钦州学院)基金资助(2016ZB08)
庞庭才(1985-),男,实验师,硕士,研究方向为动植物活性成分开发与利用。

