林可霉素工业生产发酵工艺优化
谢 婷,武 培*,韩德全,马朝安,张增辉,李胜利,赵晓强
(天方药业有限公司,河南 驻马店 463000)
林可霉素工业生产发酵工艺优化
谢 婷,武 培*,韩德全,马朝安,张增辉,李胜利,赵晓强
(天方药业有限公司,河南 驻马店 463000)
为了提高林可霉素工业生产发酵效价,该研究对林可霉素发酵工艺进行了优化。结果表明,林可霉素最佳发酵条件为二级种子罐发酵培养基中淀粉和黄豆饼粉添加量分别为0.97%和1.43%、延长二级种子移种菌龄至48 h及四级发酵罐基础料计料体积为8 m3。在此优化发酵工艺条件下,林可霉素发酵四级放罐效价高达7 505 U/mL,比原始工艺四级放罐效价提高了16%。初步优化了林可霉素工业生产发酵工艺,提高了林可霉素发酵效能和产量。
林肯链霉菌;林可霉素;工业生产;发酵工艺优化
林可霉素又称林肯霉素、洁霉素,是由林肯链霉菌(Streptomyces lincolnensis)通过好氧发酵产生的一种广谱抗生素,属于林可酰胺类素[1-4]。林可霉素及其衍生物是一类通过抑制菌体中蛋白质的合成而起作用的药物,是一种较有前途的抗生素。临床上适用于治疗革兰氏阳性菌引起的感染,对革兰氏阴性菌也有效[5-7]。林可霉素用药途径较多,副反应较少,适用于青霉素过敏的病人,己成为临床应用上主要的抗生素之一[8-10]。
目前对林可霉素的研究主要集中在培养基优化、无机盐或前体等物质添加、物料研究以及发酵过程控制等方面[11-16]。研究发现,林可霉素发酵生产培养基中主要碳源为淀粉和葡萄糖,葡萄糖浓度过低时会明显影响菌体的生长,浓度过高时又会产生葡萄糖效应,从而会降低林可霉素的产量,葡萄糖效应并不是葡萄糖本身所产生的作用,而是其分解产物所致,所以在发酵过程中,选择缓慢利用的碳源,保持低浓度的葡萄糖,是避开葡萄糖效应的一种有效的方法;氮源中的黄豆饼粉降解为氨基酸或氨的速率很慢,而不至于会阻遏抗生素的合成,因此,在林可霉素的发酵生产中常用其作为氮源;pH影响林可霉素的合成,在弱碱性的环境中,有利于林可霉素的生物合成;林肯链霉菌为好氧菌,转速控制在150~190 r/min时,不但能提高发酵体系溶解氧浓度,而且不会使菌丝体过分断裂[17-21]。
国内外对林可霉素摇瓶培养阶段和发酵罐发酵阶段研究较多。国内发酵小试或中试一般以二级发酵为主,工业生产多采用三级发酵[22-23]。林可霉素的发酵过程可分为初期(0~24 h)、前期(24~48 h)、中期(48~140 h)和发酵后期(140 h至发酵终点)[24-25]。国内林可霉素生产工艺普遍采用分批补料,分批补料培养基中通常含葡萄糖、玉米浆、黄豆饼粉及一些金属离子。这些成分在发酵过程中可防止菌丝生长过盛或延缓菌体衰老,延长菌体产生林可霉素的时间,大幅提高林可霉素的效价[22]。
本研究通过考察二级种子罐发酵培养基中碳源和氮源、二级种子移种菌龄及四级发酵罐基础料计料体积对林肯链霉菌四级发酵产林可霉素的影响,优化林可霉素工业生产发酵工艺条件,以期能通过基础研究解决林可霉素工业生产实际问题,提高发酵效能和产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
林肯链霉菌(Streptomyces lincolnensis):由天方药业有限公司提供。
1.1.2 培养基
斜面培养基:淀粉2.11%,黄豆粉饼0.50%,FeSO4·7H2O 0.001%,KNO30.09%,K2HPO40.04%,MgSO4·7H2O 0.40%,NaCl 0.07%,琼脂2.00%,pH值为7.00。
摇瓶培养基:淀粉2.11%,黄豆粉饼1.58%,葡萄糖1.60%,玉米浆3.00%,(NH4)2SO40.15%,CaCO30.40%,pH值为7.00。
一级种子罐培养基:淀粉0.45%,黄豆粉饼1.00%,葡萄糖3.00%,玉米浆1.45%,(NH4)2SO40.06%,NaNO30.43%,KH2PO40.03%,CaCO30.95%,NaCl 0.65%,片碱0.10%,NH4NO30.30%,泡敌0.08%,消泡剂0.09%,pH值为7.00。
二级种子罐培养基:淀粉0.87%,黄豆粉饼1.33%,葡萄糖3.80%,玉米浆1.33%,(NH4)2SO40.40%,NaNO30.63%,KH2PO40.03%,CaCO30.75%,NaCl 0.71%,片碱0.10%,NH4NO30.40%,泡敌0.04%,消泡剂0.06%,pH值为7.00。
三级种子罐培养基:淀粉0.50%,黄豆粉饼1.35%,葡萄糖6.30%,玉米浆1.50%,(NH4)2SO40.45%,NaNO30.50%,KH2PO40.03%,CaCO30.80%,NaCl 0.88%,片碱0.10%,NH4NO30.45%,泡敌0.04%,消泡剂0.03%,pH值为7.00。
四级发酵罐培养基:淀粉0.44%,黄豆粉饼1.32%,葡萄糖6.50%,玉米浆1.32%,(NH4)2SO40.44%,NaNO30.44%,KH2PO40.03%,CaCO30.74%,NaCl 0.81%,片碱0.10%,NH4NO30.44%,泡敌0.04%,消泡剂0.03%,pH值为7.00。
大稀料培养基:黄豆粉饼10.00%,玉米浆13.00%,CaCO30.40%,泡敌0.08%,消泡剂0.08%,pH值为5.00。
以上培养基灭菌条件:121℃,30 min。
液化糖:淀粉30.00%,淀粉酶0.60%,液化酶0.60%,硫酸铵1.80%,115℃灭菌15 min。
1.2 仪器与设备
HI2211pH计:北京哈纳仪器厂;TDL-80-2B台式低速离心机:上海安亭科学仪器厂;GZF-GF101-BS干燥箱:上海跃进医疗器械厂;XWW25/450旋转摇瓶机:乐山三九长征药业股份有限公司;XG1.X(Y)中型压力灭菌器:山东新华医疗器械厂;一级(2 m3)、二级(20 m3)、三级(70 m3)和四级(100m3)发酵罐:武汉同创工程设备有限公司;CX31-12L02显微镜:南京庚辰科学仪器有限公司。
1.3 方法
1.3.1 林可霉素四级发酵工艺流程
林可霉素的发酵工艺为四级发酵,其发酵工艺流程如下:

操作要点:
种子摇瓶培养:挖取斜面培养基上1 cm2左右的菌块,接种于装有100mL种子培养基的1000mL三角瓶中,30℃、220 r/min培养40~50 h,接种pH为7.00~7.40。
一级种子罐:0.10%的接种量,30℃,培养40~50 h,移种pH值为7.00~7.40。
二级种子罐:10~15%的接种量,30℃,培养20~50 h,移种pH值为7.00~7.40。
三级种子罐:15~30%的接种量,30℃,培养45~70 h,移种pH值为7.00~7.40。
四级发酵罐:30~40%的接种量,30℃,培养150~180h;稀料:30 h后每8 h补一次,每次1~3 m3;补糖:接种后至放罐整个发酵体系中还原糖控制在0.20~1.80%;调节pH值为6.40~7.00。1.3.2培养方法
(1)二级种子罐发酵培养基中碳源的优化
在原二级种子罐发酵培养基碳源基础上优化淀粉的浓度,比较二级种子罐发酵培养基中淀粉含量分别为0.77%、0.87%、0.97%和1.07%时后续四级放罐效价,以原二级种子罐发酵培养基淀粉含量0.87%为对照,确定林肯链霉菌产林可霉素的二级种子罐发酵培养基中淀粉的最优浓度。
(2)二级种子罐发酵培养基中氮源的优化
在已优化淀粉浓度以及原二级种子罐发酵培养基中氮源的基础上优化黄豆饼粉的浓度,比较二级种子罐发酵培养基中黄豆饼粉含量分别为1.23%、1.33%、1.43%和1.53%时后续四级放罐效价,以原二级种子罐发酵培养基黄豆饼粉浓度1.33%为对照,确定林肯链霉菌产林可霉素的二级种子罐发酵培养基中黄豆饼粉的最优浓度。
(3)二级种子移种菌龄的确定
采用管道压差法对二级种子罐接种后,考虑到工业生产四级发酵各阶段时间衔接以及生产成本,将二级种子移种菌龄由26 h延长至48 h。通过比较二级种子移种时发酵液菌浓和四级放罐效价,确定林肯链霉菌产林可霉素的二级种子移种菌龄。
(4)发酵罐基础料计料体积的优化
在已优化工艺的基础上,比较发酵罐基础料计料体积分别为6 m3、8 m3和10 m3时四级发酵罐发酵过程中发酵液的效价,确定较优的四级发酵罐基础料计料体积。
1.3.3 测定方法
(1)菌体生长量—菌浓的测定
取10 mL发酵液倒入10 mL离心试管中,2 500 r/min离心5 min,取上清液的体积,记作A,计算菌体的湿菌浓(简称菌浓),菌浓计算公式如下:
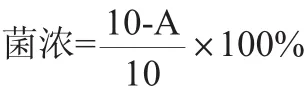
(2)发酵液效价的测定
发酵液效价的测定:采用管碟法[6]。
2 结果与分析
2.1 二级种子罐发酵培养基中碳源的优化
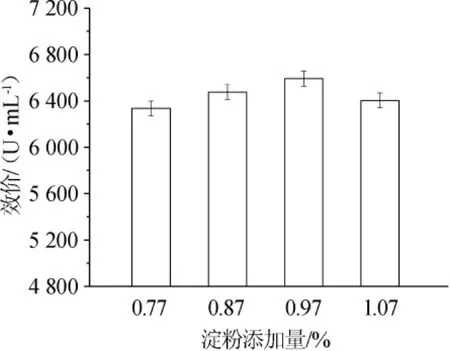
图1 不同的淀粉添加量对林肯链霉菌产林可霉素的影响Fig.1 Effects of different starch addition on lincomycin production byS.lincolnensis
由图1可知,四级放罐效价随着二级种子罐发酵培养基中淀粉添加量的增加而增加,当培养基中淀粉添加量为0.97%时,林可霉素四级放罐效价达到最大值6 593 U/mL,比原二级种子罐发酵培养基中淀粉添加量为0.87%(对照)时的四级放罐效价(6477U/mL)提高了116 U/mL;当培养基中淀粉浓度为1.07%时,林可霉素四级放罐效价反而降低,仅为6 405 U/mL,比对照组效价低了72 U/mL。可见,当二级种子罐发酵培养基中淀粉浓度较低时,不能给菌体提供足够的碳源,影响菌体生长;当培养基中淀粉浓度高时,淀粉将大量转化成葡萄糖后产生了葡萄糖效应,限制了菌体生长,二者皆会导致后续发酵四级放罐效价降低。因此,二级种子罐发酵培养基中淀粉添加量为0.97%时较优。
2.2 二级种子罐发酵培养基中氮源的优化
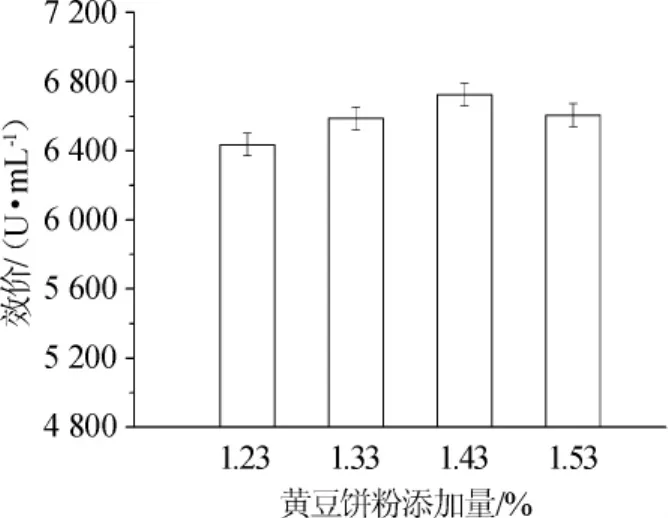
图2 不同的黄豆饼粉添加量对林肯链霉菌产林可霉素的影响Fig.2 Effects of different soybean cake powder addition on lincomycin production byS.lincolnensis
由图2可知,四级放罐效价随着二级种子罐发酵培养基中黄豆饼粉添加量的增加而增加,当培养基中黄豆饼粉添加量为1.43%时,林可霉素四级放罐效价达到最大值6725U/mL,比原二级种子罐发酵培养基中黄豆饼粉添加量为1.33%(对照)时的四级放罐效价(6 587 U/mL)提高了132 U/mL;当培养基中黄豆饼粉添加量为1.53%时,林可霉素四级放罐效价反而降低,仅为6 605 U/mL。可见,当二级种子罐发酵培养基中黄豆饼粉添加量较低时,不能提供给菌体足够的氮源,影响了菌体生长;当培养基中黄豆饼粉添加量高时,黄豆饼粉大量降解成为氨基酸或氨,使得营养过剩,高渗透压限制了菌体的生长,二者皆会导致后续发酵四级放罐效价降低。因此,二级种子罐发酵培养基中黄豆饼粉添加量为1.43%时较优。
2.3 二级种子移种菌龄对林肯链霉菌产林可霉素的影响

图3 移种菌龄对林肯链霉菌产林可霉素的影响Fig.3 Effect of transplanting cell age on lincomycin production by S.lincolnensis
由图3A可知,二级种子移种菌龄由26 h延长至48 h,移种时发酵液菌浓由38%提高至46%,提高了21%。由图3B可知,四级放罐效价也明显提高,从6 720 U/mL提高至7 117 U/mL,提高了397 U/mL。可见,二级种子移种菌龄由26 h延长至48 h,提高了二级种子移种时发酵液菌浓,同时无菌检验批次增加,降低了种子液带菌的风险;较高的种子菌体浓度,缩短了种子在发酵罐中的适应期,促进了后续发酵效价的提高。因此,二级种子移种菌龄48 h时较优。
2.4 发酵罐基础料计料体积对林肯链霉菌产林可霉素的影响
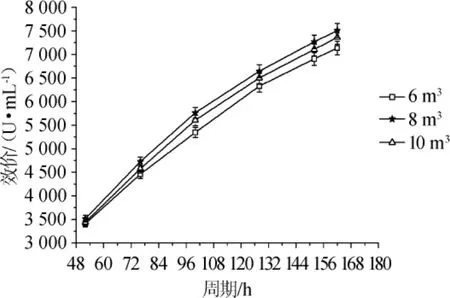
图4 计料体积对林肯链霉菌产林可霉素的影响Fig.4 Effect of material volume on lincomycin production by S.lincolnensis
由图4可知,四级发酵罐发酵过程中发酵液效价的整体趋势是随着发酵周期的延长而升高,发酵液效价随着基础料计料体积的增加先升高后降低。四级发酵罐基础料计料体积为8 m3时,发酵效价整体较高,且162 h(放罐)效价为7 505 U/mL,比计料体积为6 m3和10 m3时的放罐效价(7 236 U/mL和7 361 U/mL)分别提高了269 U/mL和144 U/mL,同时比原始工艺四级放罐效价(6 477 U/mL)提高了16%。由此可见,菌体生长需要一定的营养和能量,若计料体积低,则提供给林肯链霉菌的能量和营养会相对较少,在一定程度上会限制菌体生长,菌丝质量差,效价则会受到影响;若计料体积高,则过剩的碳源分解成大量葡萄糖会造成葡萄糖效应,同时过剩的氮源大量降解为氨基酸或氨又会阻遏抗生素的合成。因此,在现有工艺条件下,四级发酵罐基础料计料体积为8 m3时较理想。
3 结论
林可霉素是一类具有重要临床意义的高效广谱抗生素,为了提高林可霉素工业生产效价,本研究通过采取优化林可霉素发酵工艺条件。结果表明,最佳发酵工艺条件为二级种子罐发酵培养基中淀粉和黄豆饼粉的添加量分别为0.97%和1.43%、延长二级种子移种菌龄至48 h及优化四级发酵罐基础料计料体积为8 m3。优化林可霉素工艺生产发酵工艺后,林可霉素发酵四级放罐效价高达7 505 U/mL,比原始工艺四级放罐效价提高了16%。在林可霉素现有工业发酵工艺的基础上进行工艺优化,不但使二级种子无菌检验批次增加,降低了种子液带菌的风险,而且较高的种子菌体浓度,缩短了种子在发酵罐中的适应期,促进了后续发酵效价的提高,给工厂带来了一定的经济效益。
[1]SPIZEK J,REZANKA T.Lincomycin,clindamycin and their applications[J].Appl Microbiol Biot,2004,64:455-464.
[2]LI X,ZHANG J,TAN Y L.Effects of flow field on the metabolic characteristics ofStreptomyces lincolnensisin the industrial fermentation of lincomycin[J].J Biosci Bioeng,2013,115:27-31.
[3]李 华,张 立,王 鑫.林可霉素发酵工艺优化降低B组分[J].科技信息,2016,45(8):63-64.
[4]吕和平,庞学玮,刘俭国.稀土元素对林可霉素生物合成的影响[J].山东化工,2016,45(18):19-22.
[5]RAJESWARAN M.,SRIKRISHNAN T.Crystal and molecular structure and absolute configuration of lincomycin hydrochloride monohydrate[J].Carbohyd Res,2004,339:2111-2115.
[6]张海丹.林可霉素的生物合成及发酵工艺的调控[D].上海:华东理工大学,2014.
[7]张 锐,刘 虹,刘俭国,等.林可霉素发酵中后期代谢的调控[J].广东化工,2016,43(5):67-68.
[8]薛正莲,朱 艳,张相美,等.响应面优化林可霉素发酵培养基[J].中国抗生素杂志,2009,34(5):277-280.
[9]YE R F,WANG Q,ZHOU X F.Lincomycin,rational selection of high producing strain and improved fermentation by amino acids supplementation[J].Bioproc Biosyst Eng,2009,32:521-529.
[10]QIAN G,WU Y Y,YANG X Y,et al.Exploiting polymorphism in the purity enhancement of lincomycin hydrochloride[J].Chem Eng Sci,2012,77:42-46.
[11]董维平,杨淑慎,李维平,等.林可霉素菌种选育及摇瓶培养基的优化[J].河南科学,2016,34(3):327-331.
[12]DU L,LIU R H,LI Y.An efficient intergeneric conjugation of DNA fromEscherichia colito mycelia of the lincomycin-producerStreptomyces lincolnensis[J].Int J Mol Sci,2012,13:4797-4806.
[13]邓加聪,施潇蕊,曾德样,等.高产林可霉素链霉菌的筛选及发酵条件的优化[J].中国酿造,2015,34(11):99-102.
[14]CHOI D,CHO K.Effect of carbon source consumption rate on lincomycin production fromStreptomyces lincolnensis[J].J Microbiol Biotechn,2004,14(3):532-539
[15]LI X B,ZHAO G R,ZHENG H.Improved industrial fermentation of lincomycin by phosphorus feeding[J].Process Biochem,2007,42(4):662-668.
[16]LEE Y R,LEE M J.CHOI Y E.Optimization of cultivation medium and fermentation parameters for lincomycin production byStreptomyces lincolnensis[J].Biotechnol Bioproc Eng,2014,19:1014-1021.
[17]乔现婷.林可霉素髙产菌株及代谢过程的调控[D].上海:华东理工大学,2011.
[18]储 矩,李友荣.现代工业发酵调控学[M].北京:化学工业出版社,2006:59-62.
[19]胡彪群.林可霉素发酵工艺及膜分离技术的研[J].南昌:江西师范大学,2015.
[20]SPIZEK J,REZANKA T.Lincomycin,cultivation of producing strains and biosynthesis[J].Appl Microbiol Biot,2004,63(5):510-519.
[21]HAQ I,ALI S,QUADEER M A.Influence of dissolved oxygen concentration on intracellular pH for regulation ofAspergillus nigergrowth rate during citric acid fermentation in a stirred tank bioreactor[J].Int J Biol Sci,2005,1(1):34-41.
[22]钟益清.林可霉素中试发酵工艺的优化[D].南昌:江西师范大学,2013.[23]李继安,林惠敏,牛金刚,等.流加补料技术在林可霉素发酵中的应用[J].中国医药工业杂志,2012,43(9):739-742.
[24]毛全贵,赖 坤,邢继红.林可霉素发酵后期的工艺改进[J].国外医药抗生素分册,2014,35(6):265-267.
[25]李 啸,杭海峰,储 炬,等.林可霉素生物合成过程中后期的调控研究[J].工业微生物杂志,2008,38(4):7-13.
Optimization of fermentation process of lincomycin industrial production
XIE Ting,WU Pei*,HAN Dequan,MA Chaoan,ZHANG Zenghui,LI Shengli,ZHAO Xiaoqiang
(Topfond Pharmaceutical Co.,Ltd.,Zhumadian 463000,China)
In order to increase the fermentation potency of lincomycin industrial production,the fermentation process of lincomycin was optimized.The results showed that the optimum fermentation conditions of lincomycin were as follow:the concentrations of starch and soybean cake powder in the fermentation medium of two-stage seeds fermenter were 0.97%and 1.43%,respectively,the transplanting cell age of two-stage seeds was extended to 48 h and the volume of the base material of four-stage fermentation tank was 8 m3.Under the optimum fermentation conditions,the fermentation potency of lincomycin after four-stage fermentation was up to 7 505 U/ml,which was 16%higher than that of the original fermentation process.The fermentation process of lincomycin industrial production was optimized preliminarily,and the fermentation efficiency and yield of lincomycin were improved.
Streptomyces lincolnensis;lincomycin;industrial production;fermentation process optimization
S216.4
0254-5071(2017)09-0060-04
10.11882/j.issn.0254-5071.2017.09.013
2017-01-05
谢 婷(1987-),女,助理工程师,硕士,研究方向为微生物发酵工程。*
武 培(1984-),男,工程师,硕士,研究方向为微生物发酵工程。

