高锰酸钾法测定铁含量的半微量实验的改进
胡庆兰
(湖北第二师范学院 化生院, 武汉 430205)
高锰酸钾法测定铁含量的半微量实验的改进
胡庆兰
(湖北第二师范学院 化生院, 武汉 430205)
SnCl2-TiCl3-KMnO4滴定分析法测定铁矿石中铁,用常量分析仪器进行半微量试验,考察了不加入指示剂以及分步加入指示剂对终点颜色判断的影响以及对测定铁含量的结果的影响。结果表明,用量为常量的1/2,1/4时,在接近终点时加入指示剂,终点颜色变化明显,结果无显著性差异;不加入指示剂和滴定前加入指示剂,终点颜色变化不易把握,测定结果偏高,实际用量为常量的1/2无显著性差异,1/4有显著性差异。改进后的试验敏化了终点观察,在化学实验教学中具有很大推广价值。
高锰酸钾法; 铁矿石; 半微量; 改进
我国现在既是一个铁矿石生产大国, 又是一个铁矿石进口大国[1]。铁矿石中铁含量的分析研究技术也得到了进一步提高[2-3]。进口铁矿石的增长也推动了口岸铁矿石检验设施及在生产过程中对化验铁矿石中铁品位的技术的提高, 利用矿物分析技术监控铁矿石的品质或进一步提高元素检测的准确性已日显重要地位。目前, 铁矿石中铁含量的无污染测定主要方法有: 重铬酸钾滴定法[4-5]、无汞法[6-8]、光谱法[9-12]等。
测定铁矿石中全铁的经典方法是浓盐酸溶解试样,氯化亚锡还Fe3+为Fe2+,过量的氯化亚锡用二氯化汞氧化,重铬酸钾标准溶液滴定。由于该法具有快速、简便、准确度高等优点,一直被广泛采用,但使用该法每一份试液需加入饱和二氯化汞溶液5mL ,二氯化汞是一种剧毒化学试剂,会造成严重的环境污染,长期接触会在体内蓄积,引起慢性中毒[13],使得重铬酸钾应用受到限制,并且重铬酸钾滴定法中化学参数对其影响报道很少, 重铬酸钾滴定法测定铁含量时其温度、指示剂和空白溶液等化学参数对其影响, 标准中也仅对空白溶液进行了校正, 而未涉及对温度和指示剂的校正[1]。氧化还原指示剂在滴定过程中能发生氧化还原反应,即指示剂由氧化态变成还原态或由还原态变成氧化态,且氧化态和还原态的颜色明显不同,利用这种性质可以指示终点是否已经到达[14]。所以,在氧化还原过程中, 指示剂也参与了反应, 到终点时并不能恢复到原来状态, 实际上起了部分还原剂的作用[15]。因此在常量的基础上我们用微量法测定指示剂对氧化还原反应终点颜色判断的影响进行讨论。
高锰酸钾无污染,成本低,所以采用SnCl2-TiCl3-KMnO4滴定分析法测定铁矿石中铁。
1 实验部分
1.1 实验原理
矿样用HCl溶解后,首先在热浓的HCl溶液中用SnCl2将大部分Fe(Ⅲ)还原为Fe(Ⅱ),再用TiCl3还原剩余的Fe(Ⅲ),反应方程式为:
Fe3++Ti3++H2O=Fe2++TiO2++2H+
当全部Fe(Ⅲ)定量还原为Fe(Ⅱ)之后,稍过量的 TiCl3即可使溶液中作为指示剂的NaWO4由无色还原为蓝色的W(Ⅴ),然后用少量稀的KMnO4溶液将过量的钨蓝氧化,使蓝色恰好消失,从而指示预还原的终点。
预处理后,在硫磷混合酸介质中,以二苯胺磺酸钠为指示剂,用KMnO4标准溶液滴定至溶液呈紫色,即达终点[16]。
铁含量的计算:
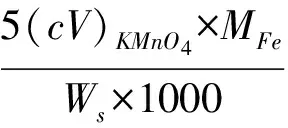
c: KMnO4的浓度;
V:KMnO4的体积;
MFe:铁的摩尔质量(55.845g/mol)
Ws:试样的质量
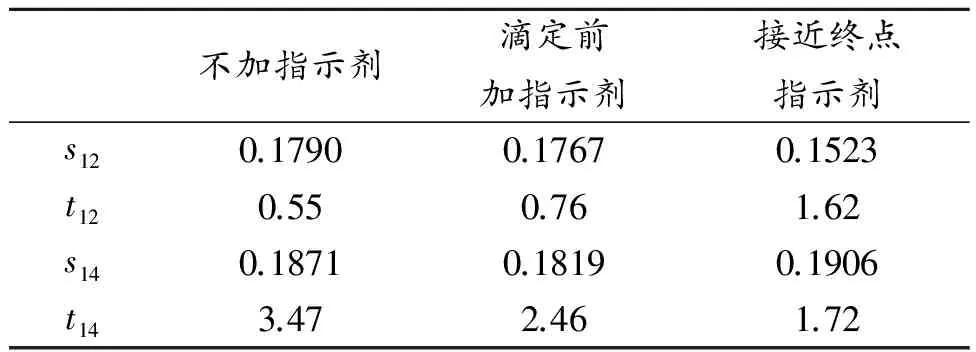
常量法和微量法各步骤试剂用量的结果对照列表示出:
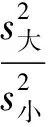
查F值表[17],f大=9,f小=9,F表=3.18,F 查t值表[17],当P=0.95,f=n1+n2-2=18时,t0.95,18=1.73。t 电子万用炉(DL-1,北京市永光医疗仪器有限公司);电子天平(FA2004,上海舜宇恒平科学仪器有限公司);电热鼓风干燥箱(3697,南通泸男科学仪器有限公司) 1.3.1 实验试剂名称 表1 试剂表 1.3.2 实验试剂的配制 (1)KMnO4溶液配制:称量3.2g高锰酸钾,放入1000mL烧杯中,加入1000mL水,加热至完全溶解,冷却后,定量转移到500mL棕色细口瓶中。 (2)1∶1 HCl:按水和盐酸体积1∶1的比例配制。 (3)2g/L 二苯胺磺酸钠溶液:称取1g二苯胺磺酸钠溶于500mL水中。 (4)50g/L SnCl2溶液:称取5g SnCl2·2H2O溶于100mL(1:1)HCl中,冷却后转移到100ml白色细口瓶中。 (5)1∶9 TiCl3溶液:取50mLTiCl3原装溶液50mL,加入100mL(1:1)HCl,350mL水中。 (6)250g/L NaWO4溶液:称取25g NaWO4溶于适量水中,加入5mL浓磷酸,加水稀释至100mL。 (7)1∶1硫磷混合酸:取150mL浓硫酸缓慢加入700mL水中,冷却后加入150mL浓磷酸,混匀。 高锰酸钾溶液的标定:准确称取0.13~0.16g基准物质NaC2O4置250 mL锥形瓶中,加40mL水,10mL 3mol/L H2SO4,加热至70~80℃。趁热用KMnO4溶液进行滴定。滴定溶液至微红色,半分钟不褪色即为终点[16]。 1.4.1 滴定前加入指示剂 (1)常量法: ①矿样的溶解: 准确称取0.2g铁矿石试样一份,置于250mL锥形瓶中,用少量蒸馏水润湿,加入10 mL浓HCl,盖上表面皿,在通风橱中用电炉小火加热20~30 min,至残渣为白色时,表明试样溶解完全,停止加热。此时溶液呈橙黄色,用少量水吹洗表面皿和锥形瓶内壁。趁热用滴管盖上表面皿,小火加热至溶解[16]。 ②预处理: 趁热滴加50g/L SnCl2溶液以还原Fe3+,边滴边摇,直到溶液由棕黄色变为浅黄色,表明大部分加Fe(Ⅲ)已被还原。加入4滴Na2WO4溶液和60mL水,在摇动下逐滴加入TiCl3至溶液出现稳定的蓝色(即30秒内不褪色) ,再过量2 滴。用自来水冲洗锥形瓶外壁使溶液冷却至室温。小心滴加稀释10倍的KMnO4溶液至蓝色刚刚消失(此时不记数)[16]。 加入15 mL硫磷混合酸,再加入6滴二苯磺酸钠指示剂,立即用KMnO4标准溶液滴定至溶液呈稳定的粉红色为终点,平行测定10次。 (2)1/2半微量法: 取500mL高锰酸钾标准液于1000mL烧杯中,加煮沸的水500mL,混匀后转移到棕色瓶中,此时溶液浓度为原浓度的1/2。 ①矿样的溶解: 准确称取0.1g铁矿石试样一份,置于50mL锥形瓶中,用少量蒸馏水润湿,加入10mL浓HCl,盖上表面皿,在通风橱中用电炉小火加热10~15min,至残渣为白色时,表明试样溶解完全,停止加热。此时溶液呈橙黄色,用少量水吹洗表面皿和锥形瓶内壁。趁热用滴管盖上表面皿,小火加热至溶解[16]。 ②预处理: 趁热滴加50g/L SnCl2溶液以还原Fe3+,边滴边摇,直到溶液由棕黄色变为浅黄色,表明大部分加Fe(Ⅲ)已被还原。加入2滴Na2WO4溶液和30 mL水,在摇动下逐滴加入TiCl3至溶液出现稳定的蓝色(即30秒内不褪色) ,再过量1 滴。用自来水冲洗锥形瓶外壁使溶液冷却至室温。小心滴加稀释10倍的KMnO4溶液至蓝色刚刚消失(此时不记数)[16]。 加入7.5mL硫磷混合酸,再加入3滴二苯磺酸钠指示剂,立即用KMnO4标准溶液滴定至溶液呈稳定的粉红色为终点,平行测定10次。 (3)1/4半微量法: 取250mL高锰酸钾标准液于1000mL烧杯中,加煮沸的水750mL,混匀后转移到棕色瓶中,此时溶液浓度为原浓度的1/4。 称量0.05g铁矿石试样,按操作进行试验,平行测定10次。 1.4.2 接近终点时加入指示剂 (1)常量法: ①矿样的溶解: 准确称取0.2 g铁矿石试样一份,置于250mL锥形瓶中,用少量蒸馏水润湿,加入10mL浓HCl,盖上表面皿,在通风橱中用电炉小火加热20~30 min,至残渣为白色时,表明试样溶解完全,停止加热。此时溶液呈橙黄色,用少量水吹洗表面皿和锥形瓶内壁。趁热用滴管盖上表面皿,小火加热至溶解[16]。 ②预处理: 趁热滴加50g/L SnCl2溶液以还原Fe3+,边滴边摇,直到溶液由棕黄色变为浅黄色,表明大部分加Fe(Ⅲ)已被还原。加入4滴Na2WO4溶液和60mL水,在摇动下逐滴加入TiCl3至溶液出现稳定的蓝色(即30秒内不褪色) ,再过量2滴。用自来水冲洗锥形瓶外壁使溶液冷却至室温。小心滴加稀释10倍的KMnO4溶液至蓝色刚刚消失(此时不记数)[16]。 加入15mL硫磷混合酸,用KMnO4标准溶液滴定,在摇动的情况下观察KMnO4自身的红色褪色的快慢;当KMnO4的红色褪色的明显变慢时(意味着接近滴定终点) ,加入6滴二苯胺磺酸钠指示剂,继续滴定至稳定的粉红色即为终点,平行测定10次。 (2)半微量法: 按实验操作进行,平行测定10次。 1.4.3 不加指示剂 (1)常量法: ①矿样的溶解: 准确称取0.2g铁矿石试样一份,置于250mL锥形瓶中,用少量蒸馏水润湿,加入10mL浓HCl,盖上表面皿,在通风橱中用电炉小火加热20~30min,至残渣为白色时,表明试样溶解完全,停止加热。此时溶液呈橙黄色,用少量水吹洗表面皿和锥形瓶内壁。趁热用滴管盖上表面皿,小火加热至溶解[16]。 ②预处理: 趁热滴加50g/LSnCl2溶液以还原Fe3+,边滴边摇,直到溶液由棕黄色变为浅黄色,表明大部分加Fe(III)已被还原。加入4滴Na2WO4溶液和60ml水,在摇动下逐滴加入TiCl3至溶液出现稳定的蓝色(即30秒内不褪色) ,再过量2滴。用自来水冲洗锥形瓶外壁使溶液冷却至室温。小心滴加稀释10倍的KMnO4溶液至蓝色刚刚消失(此时不记数)[16]。 加入15mL硫磷混合酸,立即用KMnO4标准溶液滴定至溶液呈稳定的粉红色为终点,平行测定10次。 (二)半微量法: 按实验操作进行,平行测定10次。 数据表示说明: 常量法与1/2半微量法的合并标准偏差:s12; F值:F12;t值:t12; 常量法与1/4半微量法的合并标准偏差: s14; F值:F14;t值:t14; MFe=55.845g/mol; MNaC2O4=134.00g/mol; MKMnO4=158.03g/mol. 表2 高锰酸钾溶液的标定 表3 常量法和半微量法测铁结果对照表不加指示剂 1/2半微量法测定次数cKMnO410-3/mol·L-1VKMnO4/mLWFe2O3/%计算结果①10.4826.3777.17②10.4826.3377.05③10.4826.4577.40④10.4826.4677.43⑤10.4826.4477.38⑥10.4826.3877.20⑦10.4826.3777.17⑧10.4826.4777.46⑨10.4826.2876.91⑩10.4826.4177.29WFe2O3=77.25%s=0.18% 1/4半微量法测定次数cKMnO410-3/mol·L-1VKMnO4/mLWFe2O3/%计算结果①5.132527.0477.49②5.132526.9377.20③5.132527.1177.69④5.132527.0677.55⑤5.132527.0877.63⑥5.132526.9477.23⑦5.132526.9277.16⑧5.132526.9777.29⑨5.132527.0977.65⑩5.132526.9177.14WFe2O3=77.40%s=0.21% 滴定前加入指示剂 1/2半微量法测定次数cKMnO410-3/mol·L-1VKMnO4/mLWFe2O3/%计算结果①10.4826.7878.37②10.4826.6177.89③10.4826.6377.93④10.4826.7077.13⑤10.4826.7278.04⑥10.4826.7578.28⑦10.4826.7278.19⑧10.4826.7978.39⑨10.4826.7478.25⑩10.4826.6277.90WFe2O3=78.14%s=0.19% 1/4半微量法测定次数cKMnO410-3/mol·L-1VKMnO4/mLWFe2O3/%计算结果①5.132527.3378.34②5.132527.3578.39③5.132527.3578.40④5.132527.2278.03⑤5.132527.2678.13⑥5.132527.2578.10⑦5.132527.3878.50⑧5.132527.3978.52⑨5.132527.3878.47⑩5.132527.2278.02WFe2O3=78.28%s=0.20% 接近终点时加入指示剂 1/2半微量法测定次数cKMnO410-3/mol·L-1VKMnO4/mLWFe2O3/%计算结果①10.4826.2976.93②10.4826.3377.04③10.4826.2276.74④10.4826.1976.63⑤10.4826.3176.98⑥10.4826.2776.87⑦10.4826.1976.65⑧10.4826.3477.08⑨10.4826.2276.74⑩10.4826.2376.76WFe2O3=76.84%s=0.16% 1/4半微量法测定次数cKMnO410-3/mol·L-1VKMnO4/mLWFe2O3/%计算结果①5.132526.7576.66②5.132526.8676.99③5.132526.7576.66④5.132526.8777.02⑤5.132526.7776.74⑥5.132526.7476.64⑦5.132526.9077.10⑧5.132526.8977.08⑨5.132526.8576.96⑩5.132526.7676.70WFe2O3=76.86%s=0.19% 由公式 可以得出s1,s1/2,s1/4的值。 表4 计算试样标准偏差不加指示剂 滴定前加指示剂 接近终点指示剂 表5 测得的F值表测得的F值表 表6 F值表(双边,P=95%) F12,F14 表7 合并标准偏差 表8 tp,f值表 注:P(2)是双侧的概率,P(1)是单侧的概率,n是自由度 实验结果: 原因: (2)KMnO4的氧化性非常强,能够氧化溶液中的Cl- 离子,在有铁离子存在的情况下,此副反应加剧,从而影响滴定结果的准确性;在滴定前加入大量的二苯胺磺酸钠作指示剂,然而KMnO4会破坏二苯胺磺酸钠指示剂,滴定前加入的指示剂在终点不起指示作用[19]。 (3)试验用的是常量仪器,滴定管的最小刻度是0.1mL,而不是微型滴定装置,可操作性弱一些。当试剂用量降低到原用量的1/4时,试样量少,读数误差,滴定误差,无法满足定量分析误差要求。 (1)不加入指示剂与加入二苯胺磺酸钠指示剂,测定结果有很大不同,不加入指示剂时,终点颜色不敏感,测定结果偏高。 (2)在滴定前加入指示剂与接近终点时加入指示剂,测定结果也有很大不同,在滴定前加入指示剂,对终点无指示作用,与不加入指示剂时颜色变化相同(黄绿色→粉红色),铁的测定结果明显偏高。 (3)接近终点时(即在摇动锥形瓶,红色褪去很慢的时候)加入一定量指示剂,继续滴定有明显的颜色变化黄绿色到紫色)。 (4)SnCl2-TiCl3-KMnO4滴定分析法测定铁矿石中铁的含量,在滴定前加入指示剂,不加入指示剂时,1/4半微量法不可行,临近终点加入指示剂运用常量仪器进行半微量分析可行,变色范围小且稳定。 [1]张洪波,田鹏,秦雨,等.滴定分析法测定铁矿石中铁含量[J].沈阳师范大学学报(自然科学版),2011,29(4):546-548. [2]葛焕炳, 江成选. 无污染法测定铁矿石中的铁[ J] . 甘肃冶金, 1995,(3) : 43- 46. [3]应海松, 廖海平, 任春生. 铁矿石检测技术及其新进展[ J] . 金属矿山, 2007, 373( 7) : 10- 12. [4]付慧莉. 三氯化钛- 重铬酸钾容量法快速测定铁矿石中全铁量[ J] . 山东冶金, 2000, 22( 3) : 59- 60. [5]谢立群, 翟淑英. 重铬酸钾法测定铁含量的改进方法[ J] . 黑龙江农垦师专学报, 2001, 55( 1) : 97- 99. [6]叶 青, 欧阳晓庆. 氯化亚锡- 三氯化钛- 高锰酸钾无汞无铬滴定法测定铁[ J] . 冶金分析, 2005, 25( 5) : 94- 95. [7]王瑞斌. 盐酸羟胺- 重铬酸钾无汞滴定法测定铁矿石中铁[ J] . 冶金分析, 2005, 25( 6) : 89- 90. [8]王瑞斌, 刘步明, 王高祥. EDTA 无汞无铬滴定法快速测定废水中铁含量研究[ J] . 化学试剂, 2007, 29( 9) : 551-552. [9]杨大蔚, 沈春玉. 萘相分光光度法测定原油中微量铁[ J] . 冶金分析, 2009, 29( 9) : 78- 80. [10]康艳红, 田 鹏, 朱永春, 等. 灰渣的湿法消化法及其利用[ J] . 沈阳师范大学学报: 自然科学版, 2007, 25( 3) : 357-360. [11]林 舒, 鲁琛琛, 李绍卿. 化学发光法测定铁的进展[ J] . 冶金分析, 2008, 28( 5) : 27- 32. [12]张建波, 朱丽辉, 林 力. X- 射线荧光光谱法测定钛白粉中磷铁锆铌[ J] . 冶金分析, 2009, 29( 1) : 40- 43. [13]乔蓉.铁矿石中全铁分析方法的改进. 重庆科技学院学报(自然科学版),2013,(2):44-46. [14]陶秀峻.浅析氧化还原滴定的可行性. 泰山学院学报,2014,(1): 1672-2590 [15]吴政宙, 张军华. 影响铁矿石中铁含量测定的因素分析和校正[ J] . 冶金分析, 2003, 23( 1) : 69- 70. [16]华中师范大学,东北师范大学,陕西师范大学,北京师范大学编.分析化学实验(第三版).北京:高等教育出版社,2001:75-82. [17]华中师范大学主编.分析化学(第四版)北京:高等教育出版社,2011:77-95. [18]黄桂荣.标定低浓度高锰酸钾溶液的方法比较[J].环境科学导刊,2007,26(6):83-84 [19]洪建和,安黛宗,田曙玲,等.高锰酸钾滴定法测定常量铁实验的改进[J].实验室研究与探索,2008,27(8):47-48. On Improvement of Semimicro Experiment of Measuring Iron Content by Potassium Permanganate Method HU Qing-lan With the measurement of the iron content in iron ore by SnCl2- TiCl3- KMnO4titrimetric analysis, and semimicro experiment carried out by constant quantity instrument, the effect of no indicator or fractional indicator on the judge of end point color and the measurement results of iron content are observed. According to the experiments, results show little difference with distinct change of end point color when adding the half or quarter dosage of constant near the end. The measurement is on the high side and the change of end point color is difficult to observe when adding no indicator, or adding indicator before titrimetric operation. There is no distinct difference when reducing the dosage by half, while the difference is distinct when reducing the dosage to a quarter. The improved experiment sensitizes end point observation which is worthy of promotion. potassium permanganate method; iron ore; micro-scale titrate; improvement G642.423 A 1674-344X(2017)8-0001-07 2017-07-10 胡庆兰(1965-),女 ,高级工程师,研究方向为分析化学。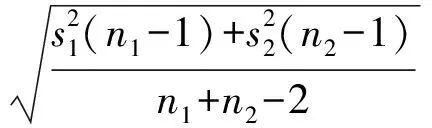

1.2 实验仪器
1.3 实验试剂

1.4 实验步骤
2 结果与讨论
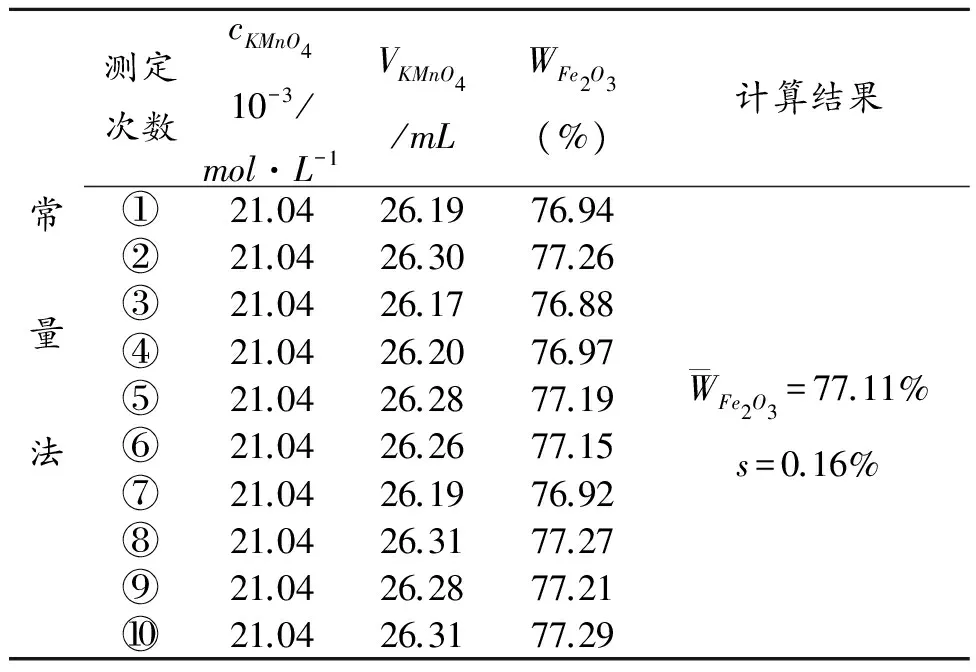
2.1 实验数据记录

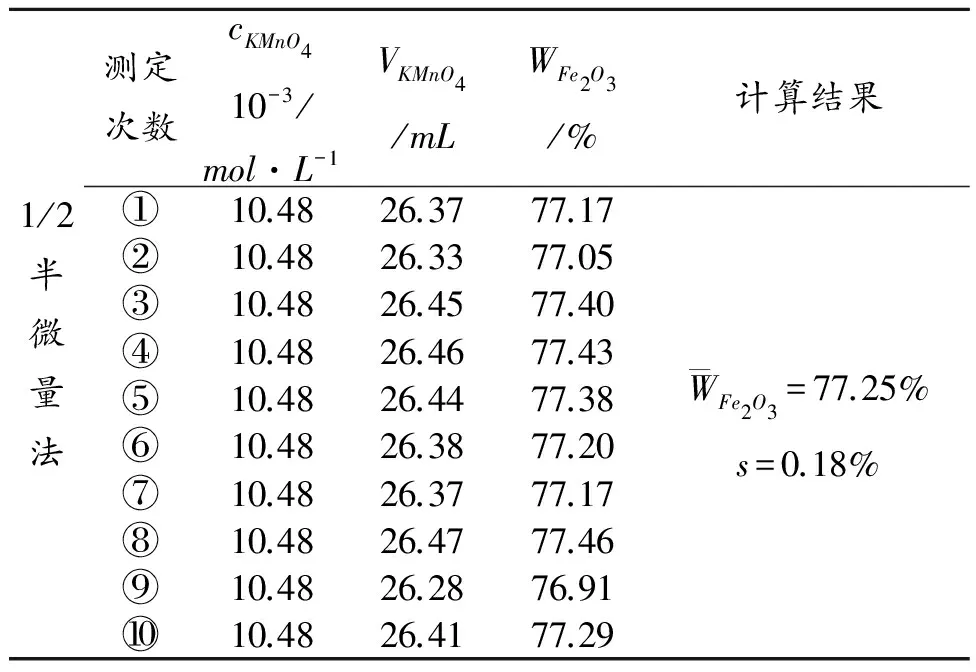

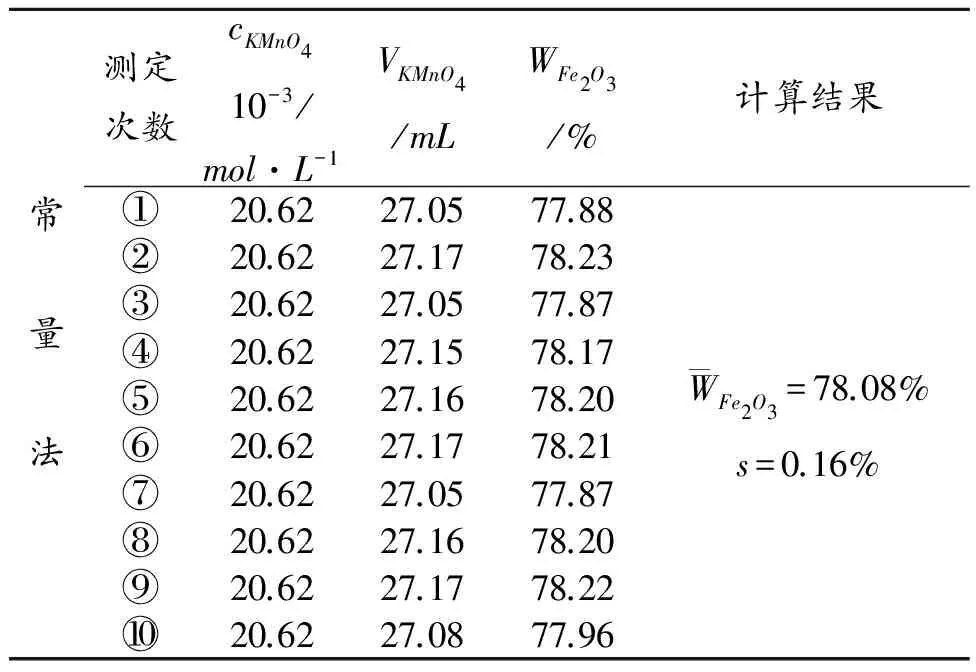





2.2 实验数据处理
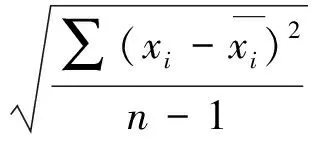



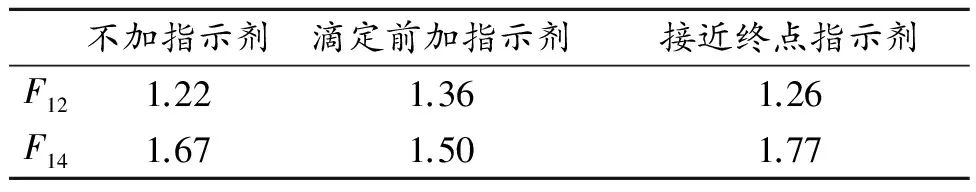






3 结论
(School of Chemistry and Life Sciences, Hubei University of Education, Wuhan 430205, China)
——卡文迪什测定万有引力常量

