53份脐带血干细胞制备的初探
钟昌瑞,李玉闽,邱小兰,阙庆和
(福建医科大学附属龙岩市第一医院输血科,福建 龙岩364000)
53份脐带血干细胞制备的初探
钟昌瑞,李玉闽,邱小兰,阙庆和
(福建医科大学附属龙岩市第一医院输血科,福建 龙岩364000)
目的 制备符合临床治疗需求的干细胞制剂,观察脐带血量与提取的细胞数之间的关系。方法 本院产科足月妊娠剖腹产分娩的53例婴儿胎儿娩出并断脐后,在清洁状态下迅速采集脐带血于采血袋中,用负收集法分离提取脐带血干细胞。用Sysmex-2100全血细胞分析仪计数提取干细胞悬液的单个核细胞总数。结果 采集的净脐带血量为88.9±15.4(70~180)m l,提取干细胞后的单个核细胞计数为3.8±1.73×109[(2.0~6.7)×109],运用散点图相关分析,两者相关系数r为0.82。结论 提取的单个核细胞含量随脐带血量增加而升高,二者之间呈正相关(r=0.82)。在日常操作中如果能获得较多的脐带血应该就能收集到更多的用于移植的细胞,应用这新的造血干细胞来源,用于任何一个需要移植的病人。
脐血;干细胞;分离;正相关
脐带血(umbilical cord blood,UCB)是产后留存在胎盘和脐带中的血液,以往被作为医学废物而丢弃[1]。近十几年的研究发现,人脐带中存在大量间充质干细胞,间充质干细胞(mesenchymal stern cells,MSCs)是成体干细胞的一种,具有自我更新、高度增殖和多向分化潜能,可以重建人体造血和免疫系统的造血干/祖细胞,可用于造血干细胞移植,治疗多种疾病[2]。我们采用负收集混合法,制备了53份脐带血干细胞制剂供临床移植使用,现报告如下。
1 材料与方法
1.1 试剂与仪器人类骨髓、脐带血干细胞/祖细胞体外分离纯化试剂盒 (宁夏中联达生物技术有限公司)。采血袋(四川南格尔生物医学股份有限公司),D5KR低温离心机。全自动细菌培养仪和配套标准的血培养瓶,Sysmex-2100全血细胞分析仪。分离、纯化所用的离心管、移液管一次性无菌产品及0.4%台盼蓝染液由宁夏中联达生物有限公司提供。苏净安泰VS-1300L-U100级的洁净工作台、显微镜、电动移液器、微量移液器、中科美菱贮血/试剂冰箱。
1.2 供血产妇的选择供血产妇为本院2011年1月至2016年5月期间产科足月妊娠剖腹产分娩的产妇,排除乙型肝炎、丙型肝炎、艾滋病、梅毒以及其他传染性疾病,无家族遗传性疾病和各种急、慢性疾病,妊娠期内无严重合并症。
1.3 脐带血的采集在产妇及家属知情并同意捐赠的情况下,用采血袋(CPDA抗凝)封闭式收集第3产程剖宫产的新生儿脐带血,每袋采脐血 (60~180)ml/例,采集好的脐血迅速送至百级层流细胞分离实验室备用。
1.4 脐血干细胞制备采用负收集混合法分离提取脐带血干细胞。严格按照体外分离纯化试剂盒的操作步骤进行分离提取,用生理盐水重复洗涤3次后,即得干细胞。每例提取的脐带血干细胞以生理盐水稀释到100ml制备成干细胞悬液制剂[3],立即通过静脉进行干细胞移植。
1.5 病原微生物的检测术前常规进行母体血标本的乙型肝炎病毒表面抗原(HBsAg)、丙型肝炎抗体(抗-HCV)、人类免疫缺陷病毒抗体(抗-HIV)、梅毒螺旋体(TP)等病原微生物检测;细菌学检查:取干细胞制备的上清液10ml(末次离心),用全自动细菌培养仪和配套标准的血培养瓶进行真菌和细菌检测,排除干细胞悬液受污染的可能。上清液在干细胞悬液的上方,因此,上清液如不受细菌污染,可以排除干细胞悬液污染的可能。
1.6 脐血干细胞含量检测用Sysmex-2100全血细胞分析仪的HPC模式,计数提取干细胞后单个核细胞数[4]。
1.7 细胞存活率检测使用0.4%台盼蓝染色法计数活细胞数目。干细胞悬液与0.4%台盼蓝染色液以9:1混合混匀后滴入血球计数盘内,在3min内按白细胞计数法,分别计数活细胞数和死细胞数。统计细胞存活率=活细胞数/(活细胞数+死细胞数)×100%。
1.8 统计方法运用散点图相关分析探讨脐带血量与提取干细胞后单个核细胞数的相互关系,|r|>0.95 为显著相关,|r|≥0.8 为高度相关,0.5≤|r|<0.8为中度相关,0.3≤|r|0.5为低度相关,|r|<0.3为不相关,r=0为无线性相关。
2 结果
2.1 干细胞制剂安全性检测53份脐血母体标本的病源微生物指标检测全部合格。干细胞制剂制备的上清液经5d的细菌、真菌培养,均未发现细菌、真菌的污染。移植的患者均未发现严重不良反应及并发症,移植后大多数患者的临床症状明显改善。
2.2 细胞数检测脐血在手术当天以剖宫产方式取得,采集的净脐带血量为88.9±15.4(70~180)ml,提取干细胞后的单个核细胞计数为3.8±1.73×109[(2.0~6.7)×109], 提取的单个核细胞含量随脐带血量增加而升高,二者之间呈正相关(r=0.82),具体如图1所示。
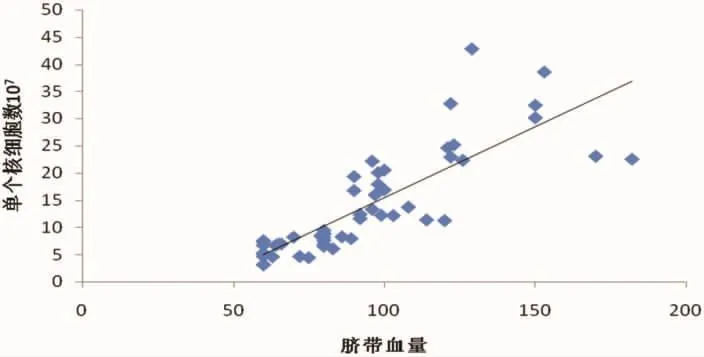
图1 脐带血量与单个核细胞数的相关性,且成正相关,r=0.82。
2.3 干细胞活力检测细胞经台酚蓝染色后,在显微镜下可见活细胞(不着色并保持正常形态,有光泽),而死细胞(着浅蓝色并膨大,无光泽)。在镜下分别计数活细胞数和死细胞数,根据公式计算分离的干细胞活率为(98.2±0.63%)。
2.4 干细胞临床应用53例干细胞主要用于血液性疾病,风湿性疾病,股骨头坏死等,详见图2。
3 讨论

图2 53例干细胞临床应用分布
干细胞是人体及其各种组织细胞的最初来源,具有高度自我复制、增殖和多向分化的潜能。干细胞按其来源分类可以分为外周血干细胞、骨髓干细胞和脐带血干细胞[5]。与骨髓和外周血相比,脐带血具有以下优点:⑴脐带血来源广泛,目前有许多国内外的研究表明可以从脐带的不同部位(脐带静脉内皮,内皮下层,Wharton's jelly,血管及其周围组织)分离得到MSCs[6]。⑵脐带血中的干/祖细胞较成人骨髓中的干/祖细胞更原始,有更强的增殖分化能力。⑶脐带血中淋巴细胞的免疫功能不够成熟,未接受外界抗原刺激,其免疫原性较弱,移植物抗宿病发生率低[7]。⑷脐带血中不会有肿瘤细胞[8]。⑸脐带血中间充质干细胞易于分离[9]。有资料显示,脐带血干细胞制剂中主要以MSCs为主,其含量浓度很高[3]。脐带血间充质干细胞有多向分化潜能,它在体内可以分化为骨、软骨细胞、骨骼肌细胞、肝细胞、心肌细胞以及神经元细胞等[10],因而脐带血干细胞具有极大的临床应用价值。
脐带血干细胞治疗在我院作为新技术新项目引入,主要通过多个科室间的合作完成,我科负责脐带血干细胞的分离、纯化工作。脐带血干细胞分离要求在万级洁净实验室里进行,脐带血和试剂移取要求在局部百级洁净台内操作。脐带血分离技术是脐血干细胞移植的关键环节,关于脐血干细胞提取分离方法还没有统一的标准。因密度梯度离心法分离脐血单个核细胞有细胞得率高、方法简单等优点[11],现作为常用的分离方法。本文采用负收集混合法分离提取脐带血干细胞,提取干细胞后的单个核细胞计数为 3.8±1.73×109[(2.0~6.7)×109],提取的单个核细胞含量随脐带血量增加而升高,二者之间呈正相关(r=0.82);分离的干细胞活率为 (98.2±0.63%);53份干细胞制剂制备的上清液经5d的细菌、真菌培养,均未发现细菌、真菌的污染,移植患者均未发现严重不良反应及并发症,移植后大多数患者的临床症状明显改善。因脐带血干细胞分离需经数次离心并且多次移液,离心力、离心时间、离心次数及离心温度等是影响制备效果的因素。离心力过大,离心时间过长或离心次数过多会增加干细胞死亡(细胞膜破裂)。此外,制备干细胞悬液勿剧烈震荡,以免造成细胞破坏。脐血干细胞移植成功与否受到诸多因素的影响,如病种、年龄、宿主微环境、药物干预等,供者因素中重要的是输入细胞量[5]。为了保证脐带血干细胞在临床中更广泛的应用,更好的疗效,在日常操作中如果能获得较多的脐带血应该就能收集到更多的用于移植的细胞。因此,对操作人员要有规范系统的教育培训,以具备操作的专业知识和能力,才能收集到更多质量更好的干细胞。
[1]唐晓鹏,王文龙,张旻,等.脐血有核细胞输注治疗慢性肝衰竭的初步临床观察[J].中国输血杂志,2008,21(6):420-423.
[2]宋希拿,何祎,韩俊领.人脐带间充质干细胞的生物学特性及其在血液系统疾病中的应用[J].医学综述,2009,15(2):166-169.
[3]范娅涵,蒋天伦,黎儒青,等.治疗用脐血干细胞的制备及初步临床应用[J].中国输血杂志,2010,23(3):179-182.
[4]王大光,杨晓枫.Sysmex XE-2100血液分析仪外周血造血干细胞检测与CD34+流式细胞仪检测的相关性[J].实验与检验医学,2009,27(2):199-200.
[5]任娜,朱荔青,赵威,等.脐血干细胞制备的检测分析[J].检验医学与临床,2012,9(5):528-530.
[6]李洁,傅勇辉,吴琼,等.冻存前后脐带间充质干细胞生物学特性的比较[J].实验与检验医学,2014,32(1):8-10.
[7]梁燕丹,王培福,杜继臣.脐血干细胞的实验与临床应用[J].中国组织工程研究与临床康复,2009,13(27):5349-5352.
[8]吴祖泽,贺福初,裴雪涛.造血调控[M].上海:上海医科大学出版社,2000:245.
[9]张巧玲,覃莉珍,解继胜,等.脐带血间充质干细胞研究进展及应用前景[J].右江民族医学院学报,2005,27(1):101-103.
[10]Neuhof S,Moers J,Ricks M.Proliferation,diferentiation,and cytokine secretion of human umbilical cord blood-derivedmononuclear ceil in vitro[J].Exp Hematol,2007,35(7):1119-1131.
[11]郭继强,刘爱斌,王东平,王黎明.密度梯度离心法分离脐血干细胞:分离介质的筛选 [J].中国组织工程研究,2013,17(23):4189-4195.
R457.1+2,R446.11+1
A
1674-1129(2017)05-0810-03
10.3969/j.issn.1674-1129.2017.05.063
李玉闽。
2017-03-09;
2017-06-05)

