我国3种疯草的内生真菌培养特性研究
汪治刚,曹师,徐娜,徐杉,李彦忠
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
我国3种疯草的内生真菌培养特性研究
汪治刚,曹师,徐娜,徐杉,李彦忠*
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
家畜取食疯草出现中毒或死亡的原因为疯草体内含可产生苦马豆素的内生真菌。我国的多种疯草中的内生真菌为同一种,同种疯草中的内生真菌因随种子传播而孤立于单一寄主,可能出现与其他疯草内生真菌不同的生物学特性。为此在通过形态学和分子生物学鉴定菌种的基础上研究了我国最主要3种疯草小花棘豆、黄花棘豆和甘肃棘豆中内生真菌菌株(LYZ0091、LYZ0093和LYZ0109)在不同温度、pH值和培养基上的菌落生长速率和形态特性。结果表明,1)3个菌株的菌落停止生长的最高温度不同,LYZ0109无法在30 ℃下生长,但LYZ0091和LYZ0093仍可生长,最适宜生长温度分别为20、25和25 ℃,在5、10和15 ℃下4周时LYZ0091的生长速率显著(P<0.05)高于LYZ0109,在20和25 ℃下则显著(P<0.05)低于LYZ0109;2)在pH 4~11下3个菌株均可生长,菌株之间无显著(P>0.05)差异;在培养基NA、PCA、PDA、PSA和WHDA上LYZ0109多显著(P<0.05)大于LYZ0091;3)在温度、pH值和培养基处理中3个菌株均未产生分生孢子,LYZ0091和LYZ0109的菌丝扭曲状,厚垣孢子少,而LYZ093无扭曲状菌丝,大量成串的厚垣孢子由基质底部向上呈树状生长。
疯草;内生真菌;共生体;菌株;培养特性
疯草(locoweed)是能引起草食动物出现典型神经学症状和病理学变化的有毒植物的统称,主要为棘豆属(Oxytropis)和黄芪属(Astragalus)植物中的部分种[1-2],全球已知25种棘豆和31种黄芪,共计有56种[3],其中我国有23种棘豆和22种黄芪,共计45种[4]。全世界每年因疯草导致的家畜中毒,损失十几亿美元[5],其中美国和我国是主要的受害国,美国西部是受害最严重的地区,据统计,西部17个州每年因有毒植物导致家畜中毒所造成的经济损失高达1亿美元;我国疯草主要分布在陕西、四川、内蒙古、宁夏、甘肃、青海、新疆和西藏等省(区)的草原、山地和荒漠地带,优势疯草为黄花棘豆和甘肃棘豆,疯草灾害已经成为世界范围内的“生态经济病”之一[6]。
已查明疯草中的毒性物质主要为苦马豆素(Swainsonine,SW),而苦马豆素的含量与其体内的内生真菌有关[7-8]。美国已在绢毛棘豆(O.sericea) 、密柔毛黄芪(A.mollissimus)和兰伯氏棘豆(O.lambertii)等2种棘豆和6种黄芪中发现了内生真菌[8-10]。我国已在甘肃棘豆(O.kansuensis)[11]、小花棘豆(O.glabra)[12]、黄花棘豆(O.ochrocephala)[13]、毛瓣棘豆(O.sericopetala)、冰川棘豆(O.glacialis)[14]、变异黄芪(A.variabilis)[13]和茎直黄芪(A.strictus)[14]5种棘豆和2种黄芪中发现了内生真菌。
疯草内生真菌自1999年首次发现至今,其分类地位先后发生了多次变化,起初鉴定为链格孢(Alternaria)[8],2006年描述为埃里砖格孢(Embellisia)[15],2009年为此类真菌建立了新属(Undifilum),并将长蠕孢(Helminthosporiumbornmuellerii)描述为一个组合新种Alternariabornmuellerii作为此新属的模式种[16],2014年又重新归入链格孢属,为此类真菌建立了Undifilum组[17]。疯草内生真菌目前已描述了3个种,分别为绢毛棘豆、兰伯氏棘豆、甘肃棘豆和小花棘豆中的棘豆链格孢(Alternariaoxytropis)[18]和美国的密柔毛黄芪中的Alternariacinereum和斑荚黄芪中的Alternariafulvum[19]。Yu[20]、卢萍等[21-22]、崔振[23]研究发现我国的所有疯草内生真菌无论黄芪还是棘豆均为棘豆链格孢,而美国的疯草内生真菌的种类更多。
疯草内生真菌在常用培养基上和通常温湿条件下生长极其缓慢、产孢量较少,给深入研究该菌带来了很大困难。以往研究发现,菌落生长极其缓慢,在25 ℃、马铃薯葡萄糖琼胶培养基(PDA)下生长速率为0.03~0.34 mm/d,菌落形状与颜色因不同疯草种类及菌株变化较大,白色絮状至深棕色或黑色,菌落表面致密,培养基内部常产生黑色、褐色的厚垣孢子[24]。大多菌落很难产孢,某些疯草上的内生真菌从不产孢,如U.Cinereum[19]。该菌产生的分生孢子为棒状,有隔膜。分隔处缢缩,分生孢子萌发出的芽管呈波浪状,故称之为波浪芽管孢[24]。不同疯草上的内生真菌产生的分生孢子的形态并无明显差异[19,24]。
已有研究发现疯草内生真菌的菌丝分布于包括种子在内的植株体内的任何组织中[25-26],其仅可通过种子带菌传到下一代疯草植株中[10,27-28],但不能在同种的不同植株之间传播,更不能在不同种的植株之间传播,然而,在美国绢毛棘豆、兰伯氏棘豆和我国的小花棘豆、黄花棘豆和甘肃棘豆中的内生真菌却为同一个真菌种。如果疯草内生真菌只能通过种子垂直传播而不能通过孢子水平传播的论断正确,则说明这种菌在其寄主进化的某个阶段就已分别进入到不同疯草之中了,经过长期与寄主的共同进化,不同疯草中的菌株之间可能存在某些差异。
本试验的研究目的为比较我国的甘肃棘豆、小花棘豆和黄花棘豆体内的内生真菌在不同温度、不同培养基、不同酸碱度的培养基上的菌落特征确定菌株之间的异同。
1 材料与方法
1.1供试材料
1.1.1植物材料 小花棘豆于2013年8月采集于内蒙古自治区阿拉善左旗,黄花棘豆于2014年7月采集于宁夏海原县南华山,甘肃棘豆于2014年9月采集于甘肃省天祝县抓喜秀龙乡。将采集的标本制作为蜡叶标本,供分离其内生真菌。
1.1.2供试菌株 从1.1.1中采集的植株中分离真菌,获得不同疯草中的内生真菌,在每种疯草中各选一个菌株用于比较菌落生长特性。
1.1.3供试培养基 本研究使用的8种培养基分别为:马铃薯葡萄糖琼胶培养基(Potato dextrose agar, PDA。马铃薯200 g,葡萄糖20 g,琼胶17 g,蒸馏水1000 mL)[29]、马铃薯胡萝卜煎液培养基(Potato carrot agar, PCA。胡萝卜和马铃薯各20 g,琼胶17 g,蒸馏水1000 mL)[30]、马铃薯蔗糖琼胶培养基(Potato sucrose agar, PSA。马铃薯200 g,蔗糖20 g,琼胶17 g,蒸馏水1000 mL)、营养琼脂培养基(Nutrient agar, NA。牛肉浸膏3 g,蛋白胨5 g,葡萄糖2.5 g,琼胶17 g,蒸馏水1000 mL)、水琼脂培养基(Water agar, WA。琼胶17 g,蒸馏水1000 mL)[29]、V-8培养基(Vegetables-8。番茄滤液200 mL,CaCO33 g,琼胶17 g,蒸馏水1000 mL)[30]、麦秆煎液琼脂培养基 (Wheat-straw decoction agar, WHDA。小麦秸秆20 g,琼胶17 g,蒸馏水1000 mL)[31]、疯草煎液琼胶培养基(Locoweed decoction agar, LDA。疯草植株20 g,琼胶17 g,蒸馏水1000 mL)。
1.2方法
1.2.1内生真菌分离 按如下步骤从植株的茎秆中分离内生真菌:在每种疯草的植株中挑选无病无虫生长健壮的2个枝条,摘除叶片、叶柄和侧枝,选取5 cm的一段茎秆;用75%的酒精消毒30 s,再用1%的次氯酸钠溶液消毒3 min,用无菌水冲洗2次后用滤纸吸干表面的水滴;切成3 mm的大块,转移到马铃薯琼脂培养基(PDA)上22 ℃下培养。待组织块周围长出菌落时挑取菌落边缘的菌丝体纯化获得纯培养。
1.2.2内生真菌的确定 采用菌落形态和分子生物学2种方法确认分离纯化的菌株为内生真菌。将纯化的菌株在PDA上培养,根据菌落生长速度极其缓慢、菌落凸起而不易在培养基表面扩展的特性初步确定为疯草内生真菌。并提取菌株的DNA,用ITS1和ITS4引物PCR扩增后测序,采用MEGA 5.1软件中的邻接法(neighbour-joining method, NJ)将测序获得的序列与国内外已报道的疯草内生真菌菌种的ITS序列混总构建系统发育树进一步确认为疯草内生真菌。
1.2.3菌落特性比较 本研究设有不同培养基、 不同温度和pH值共3个试验, 其中供试培养基同1.1.3,22 ℃黑暗培养; PDA培养基在5、10、15、20、25、30和35 ℃共7个温度梯度, 黑暗培养; 用1 mol/L的HCl和1 mol/L的NaOH溶液将PDA培养基的pH值分别调制为4、5、6、7、8、9、10和11, 共8个梯度, 22 ℃黑暗培养。
在上述培养基制备后用内径4.5 mm的打孔器在PDA上22 ℃下培养5周的菌落边缘取出菌饼,转至装有供试培养基的90 mm培养皿中,每个处理设3个重复并用封口膜封口,置于满足上述条件的培养箱中培养。在培养过程中每周检查封口膜是否完好,如发现封口膜有裂口则及时更换。
培养后每周按十字交叉法测量1次菌落直径,共测4次,按如下公式计算菌落净生长直径和菌落生长速度。
菌落净生长直径(D)=菌落直径(D2)-菌饼直径(D1)
菌落生长速率(R)=菌落净生长直径(D)/培养天数(T)
每次测量时观察菌落形状、颜色和质地,并拍照。
1.2.4菌丝生长与产孢显微观察 测量观察4周后继续培养至菌落大小占培养皿一半以上,选择具有代表性的NA培养基和pH 7的PDA培养基的菌落,用于观察菌丝特征和产孢特征。具体方法为:剪下盖玻片一半大小的透明胶带放在菌落表面,轻轻按下使菌丝粘在胶带上,再把胶带放在载玻片上,加1滴无菌水,加1滴苯胺蓝液,盖上盖玻片制作水装片后观察气生菌丝和厚垣孢子的形状和颜色,并测量直径。在培养皿中向下切取一块菌落,深度至培养皿底部,再切去培养基的表面,留无气生菌丝的培养基,取小块压碎在载玻片上,加水和苯胺蓝,置于普通光学显微镜下观察基质内菌丝的形状和颜色,测量菌丝直径和厚垣孢子的大小。
1.3统计分析
同组的菌落生长速率采用SPSS 17.0软件Duncan法统计分析,计算结果采用Excel 2007制图。采用Photeshop制作菌落特性、菌丝特征和厚垣孢子特征的图片。
2 结果与分析
2.1菌株分类与分类地位确认
从小花棘豆、黄花棘豆和甘肃棘豆的茎秆中分离的真菌菌落均生长缓慢,菌落初期白色,后变灰褐色,与此前研究获得的菌株特性相同。从中选择出的菌株编号分别为LYZ0091、LYZ0093和LYZ0109。此3个菌株在构建系统发育树均与已报道的疯草内生真菌Alternariaoxytropis、Alternariafulvum和Alternariacinereu归于同一分支,自展值为95,均属于链格孢undifilum组,在该组中供试的3种疯草中的内生真菌与Alternariaoxytropis无差异,而Alternariafulvum和Alternariacinereu自成下一级分支中,可确定供试的3种疯草的内生真菌为Alternariaoxytropis(图1)。
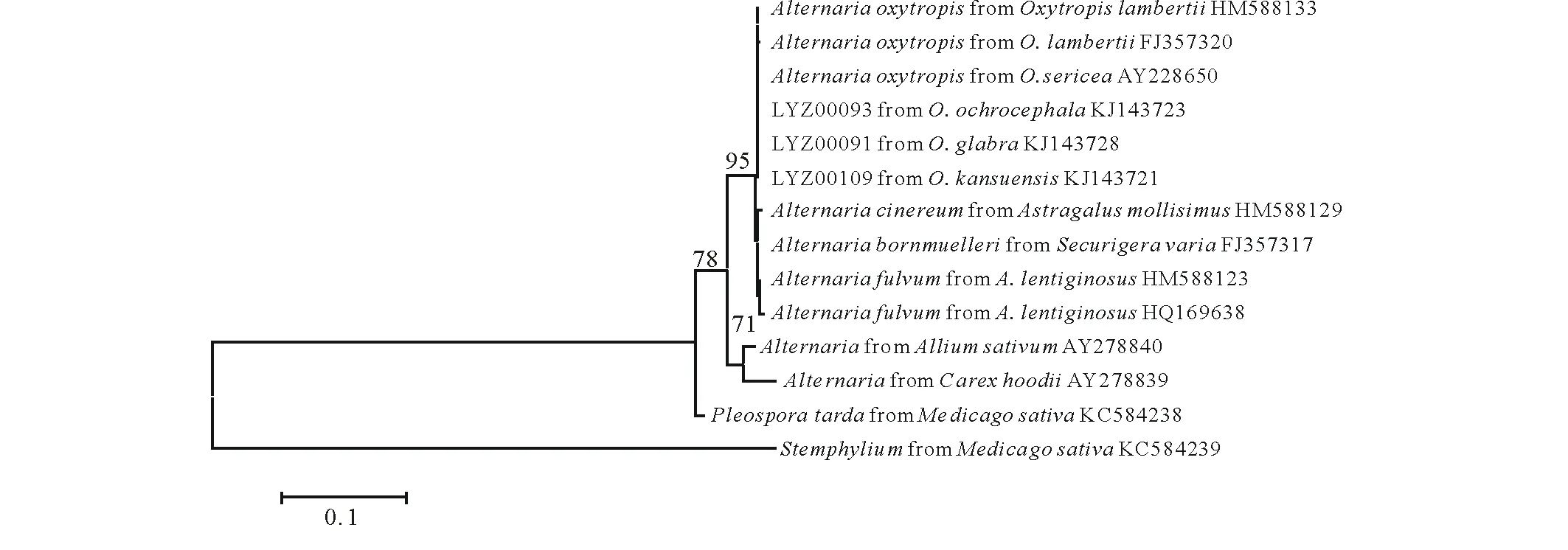
图1 基于ITS-rDNA的疯草内生真菌的系统发育树Fig.1 Phylogenetic tree of locoweed endophyte based on ITS-rDNA 图中数字表示自展支持率,越高代表亲缘关系越近。 The digital of the Figure represents the bootstrap value, of which higher on behalf of closer genetic relationship.
2.2在不同温度下的菌落特征
3个菌株在5~25 ℃范围内均可生长,LYZ0091和LYZ0093在30 ℃下也可缓慢生长,但LYZ0109在30 ℃下不能生长,3个菌株在35 ℃下均停止生长(图2)。
除在10 ℃下第一周时之外,在5、10和15 ℃下的第1周至第四周时LYZ0091的生长速率均显著(P<0.05)高于其他2个菌株,LYZ0093的生长速率在5 ℃下的第4周、10 ℃下的第4周和15 ℃下的第3周和第4周均显著(P<0.05)高于LYZ0109 (图2-A, B, C)。
在20和25 ℃下LYZ0109 的生长速度超过其他2个菌株,在20 ℃时仅在第2周时显著(P<0.05)高于其他2个菌株,而在25 ℃下除在第1周差异不显著之外,其他3周均显著(P<0.05)高于其他2个菌株(图2-D, E)。在30 ℃下LYZ0109 已停止生长,而其他2个菌株生长缓慢,其中LYZ0091的生长速率显著高于LYZ0093(图2-F)。
LYZ0091的最高生长速率为0.80 mm/d(20 ℃下3周时)(图2-D),LYZ0093的最高生长速率为0.96 mm/d(25 ℃下4周时)(图2-E),LYZ0109 的最高生长速率为1.09 mm/d(25 ℃下4周时)(图2-E)。
由上可见,3个菌株最适温度为20~25 ℃,LYZ0091与LYZ0093对温度的反应相似,在5~20 ℃下比LYZ0109 生长快。与其他2个菌株相比,LYZ0109 不耐高温。
在5、10和15 ℃下3个菌株的菌落均为白色,菌落边缘圆,而20和25 ℃下菌落表面出现黑褐色,菌落边缘锯齿状;在30 ℃下LYZ0091和 LYZ0093有少量生长,前者白色,后者仅有少量菌丝,菌落颜色未明显变化,LYZ0109未生长,仍保留接入时的黑色。
Taking a0 = 84 μm, xd = 37.5 μm, γc = 0.9545 and γd = 1 into Eqs. (9) and (10):

图2 疯草内生真菌3个菌株在PDA上不同温度下黑暗培养4周的生长速率 Fig.2 Grow rate of locoweed endophyte cultured on PDA under different temperature at dark for 4 weeks A:5 ℃,B:10 ℃,C:15 ℃,D:20 ℃,E:25 ℃,F:30 ℃;LYZ0091为小花棘豆内生真菌,LYZ0093为黄花棘豆内生真菌,LYZ0109 为甘肃棘豆内生真菌;3个菌株比较在同一时间的数据上标有不同字母者差异显著(P<0.05)。下同。A: 5 ℃, B: 10 ℃, C: 15 ℃, D: 20 ℃, E: 25 ℃, F: 30 ℃; LYZ0091: endophyte from Oxytropis glabra, LYZ0093: endophyte from O. ochrocephala, LYZ0109: endophyte from O. kansuensis; Data with different letters mean difference significantly (P<0.05) compared within 3 strains.The same below.
在20和25 ℃下3菌落差异最明显,LYZ0091的菌落凸起,表面的菌丝体隆起,呈同心轮纹状,LYZ0109则在培养基表面扩展,菌落平坦,LYZ0093介于二者之间。
2.3在不同酸碱度下的菌落特征
3个菌株在供试的所有酸碱度下均能正常生长,LYZ0093的生长速率在大部分处理中均高于其他2个菌株,LYZ0109在碱性条件下低于其他2个菌株,但差异不显著(P>0.05)(图3-A、C、D、E、F、G、H)。
3个菌株在pH 10下菌落生长较快,其次为pH 8和pH 9下。LYZ0091生长速率最大为1.11 mm/d(在pH 10下4周)(图3-G),LYZ0093生长速率最大为1.30 mm/d(在pH 10下4周)(图3-G),LYZ0109最大为0.80 mm/d(在pH 7下4周)(图3-D)。
LYZ0091除在pH 10上菌落边缘有放射状菌丝外, 在其他酸碱条件下(pH 4~9)均呈白色至灰色, 中心凸起,边缘隆起一圈,呈煎蛋状。LYZ0093和LYZ0109在pH 4~9下的菌落黑褐色,菌落平坦,边缘有白色的圈。LYZ0109在pH 10~11下的菌落为白色泛蓝。总体上,LYZ0091不同于LYZ0093和LYZ0109, 而后两者相似。
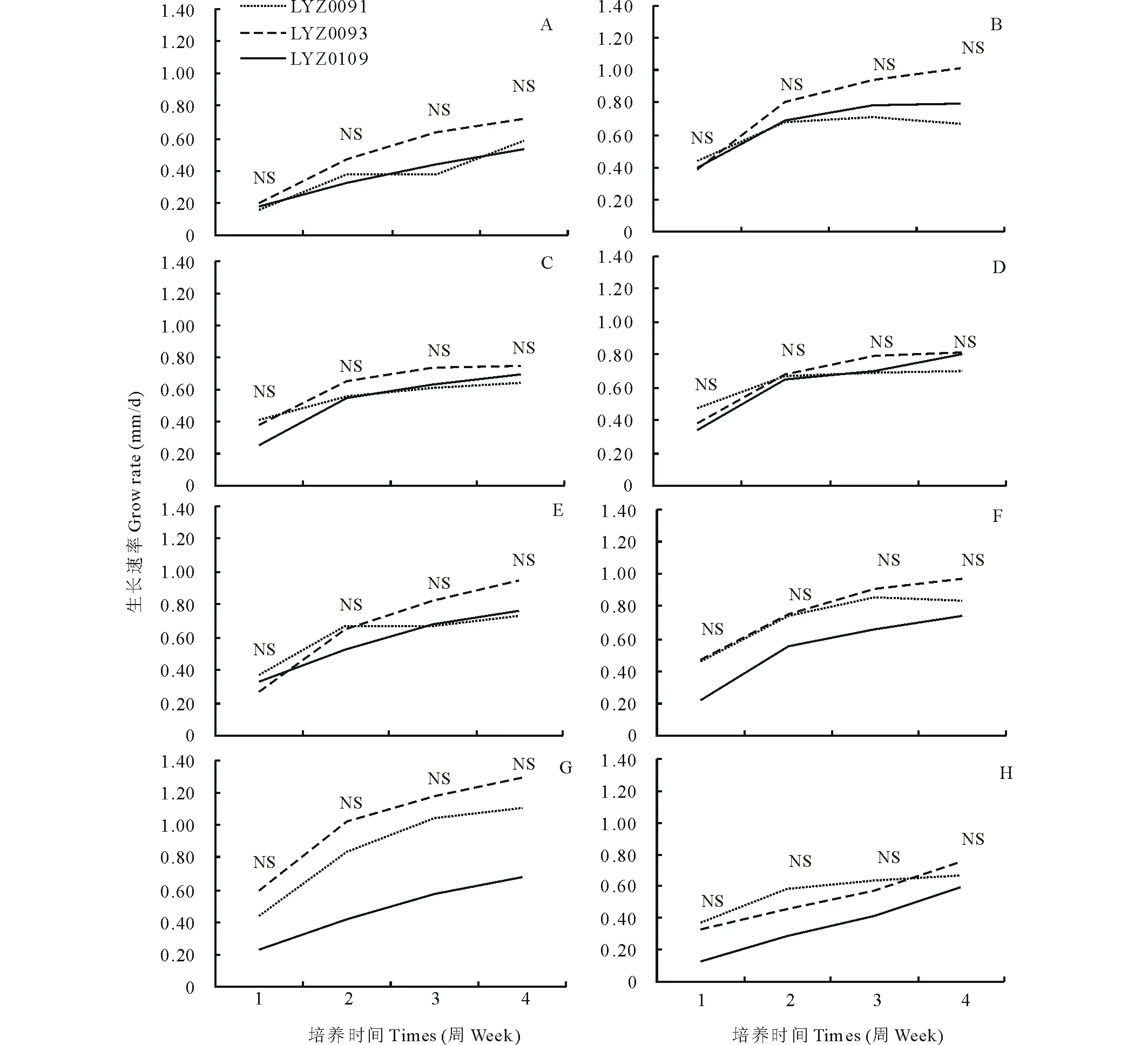
图3 疯草内生真菌3个菌株在PDA上不同酸碱度下黑暗培养4周的生长速率Fig.3 Grow rate of locoweed endophyte cultured on PDA under different pH at dark for 4 weeks A:pH 4,B:pH 5,C:pH 6,D:pH 7,E:pH 8,F:pH 9,G:pH 10;H:pH 11.
2.4在不同培养基上的菌落特征
LYZ0109在大部分培养基上的生长速率高于其他2个菌株(图4-B、C、D、E),且从第1周至第4周先增加后降低(图4-A、B、D、E、F)。除在WHDA上第2周时生长速率明显增加和在WA上2周时明显下降之外,LYZ0091在其他培养基上的生长曲线与横坐标几乎平行,或轻微向上,故此菌株的生长速度最稳定(图4-A、B、C、D、E、F)。
LYZ0091的生长速率最大为1.25 mm/d(在V-8上4周时),LYZ0093的生长速率最大为1.28 mm/d(在V-8上3周时),LYZ0109的生长速率最大为1.30 mm/d(在PSA上3周时)(图4)。
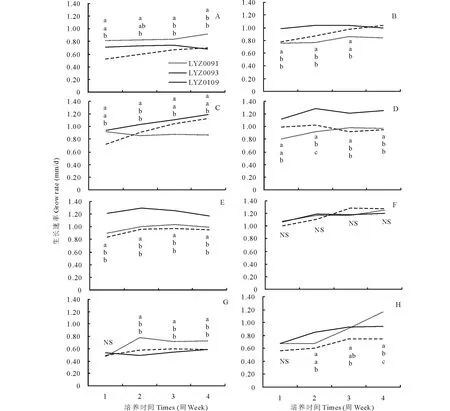
图4 疯草内生真菌3个菌株在不同培养基上黑暗培养4周的生长速率Fig.4 Grow rate of locoweed endophyte cultured on different media at dark for 4 weeks A:疯草煎液琼胶培养基 Locoweed decoction agar (LDA); B:营养琼脂培养基 Nutrient agar (NA); C:马铃薯胡萝卜煎液培养基 Potato carrot agar (PCA); D:马铃薯葡萄糖琼胶培养基 Potato dextrose agar (PDA); E:马铃薯蔗糖琼胶培养基 Potato sucrose agar (PSA); F:V-8培养基 Vegetables-8 (V-8); G:水琼脂培养基 Water agar (WA); H:麦秆煎液琼脂培养基 Wheat-straw decoction agar (WHDA).
供试菌株在PDA和PSA上的菌落形状和颜色基本相同。LYZ0091的菌落中心凸起,灰色,边缘隆起,白色,中心至边缘下陷,菌落呈煎蛋状,LYZ0093的菌落平展,黑褐色,边缘放射状白色菌丝体,LYZ0109的菌落平展,白色,边缘整齐,但在PSA上的菌落边缘灰色。
同一菌株在V-8、WHDA、LDA上的菌落也相似,灰色泛蓝,但在LDA上有黑色晕圈。
在PCA上的菌落与其他培养基上均不同,除顶部有白色之外,菌落其他部位均呈黑褐色。在NA上的菌落均呈白色。
综合3种菌株在8种培养基上的特征,最明显的差异为:LYZ093的菌落边缘放射状的菌丝,不整齐,而其他菌株的边缘无放射状菌丝,整齐。
2.5菌丝生长与产孢显微观察
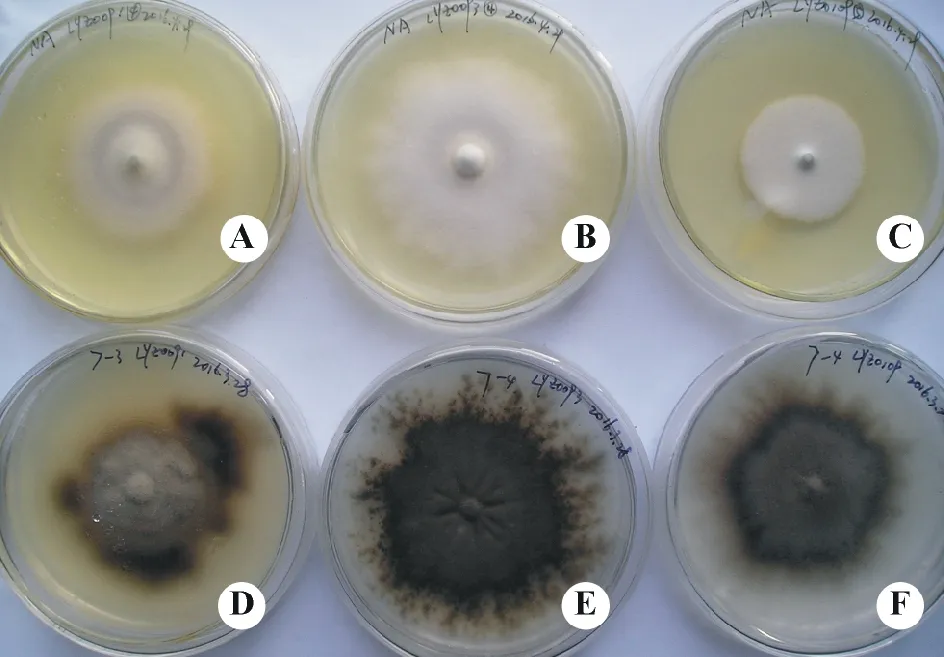
图5 疯草内生真菌3个菌株培养30周时的菌落特征Fig.5 Colony characteristics of locoweed endophyte cultured for 30 weeks A:小花棘豆内生真菌LYZ0091在NA上;B:黄花棘豆内生真菌LYZ0093在NA上;C:甘肃棘豆内生真菌LYZ0109在NA上;D:LYZ0091在pH 7上;E:LYZ0093在pH 7上;F:LYZ0109在pH 7上。A: Endophyte from Oxytropis glabra LYZ0091 on NA; B: Endophyte from O. ochrocephala LYZ0093 on NA; C: Endophyte from O. kansuensis LYZ0109 on NA; D: LYZ0091 on pH 7; E: LYZ0093 on pH 7; F: LYZ0109 on pH 7.
3个菌株在NA培养基和pH 7下培养30周后菌落均存在明显差异,其中在NA上的菌落白色,但LYZ0091的菌落上有灰色,LYZ0093的菌落表面粗糙,边缘锯齿状,LYZ0109的菌落平坦,质地细密(图5);在pH 7下的菌落均呈黑色,其中LYZ0093最黑,且边缘有树状大量分枝,LYZ0109的菌落边缘有纤细的放射状分枝,LYZ0091的菌落边缘出现不对称的聚集状变黑(图5)。
LYZ0091和LYZ0109的菌丝特征相同:气生菌丝的生长方向杂乱,多纤细,宽5 μm,高度扭曲状,菌丝圈状(图6-a),纤细的菌丝中有少量笔直,比螺旋状菌丝宽2倍,10 μm,气生菌丝中出现圆球状的膨大体,即生于菌丝中的厚垣孢子,无色至褐色,培养基中的菌丝与气生菌丝相似(图6-b);而LYZ0093的气生菌丝从菌落中心向外扩展,笔直、无扭曲状菌丝,菌丝中出现成串的黑褐色的厚垣孢子(图6-c),培养基中菌丝少,而有大量成串的厚垣孢子,形成树状多级分枝,“树”的主秆在培养基的底部,树状分枝向上伸展(图6-d)。3个菌株在所有培养条件下均未产生分生孢子。
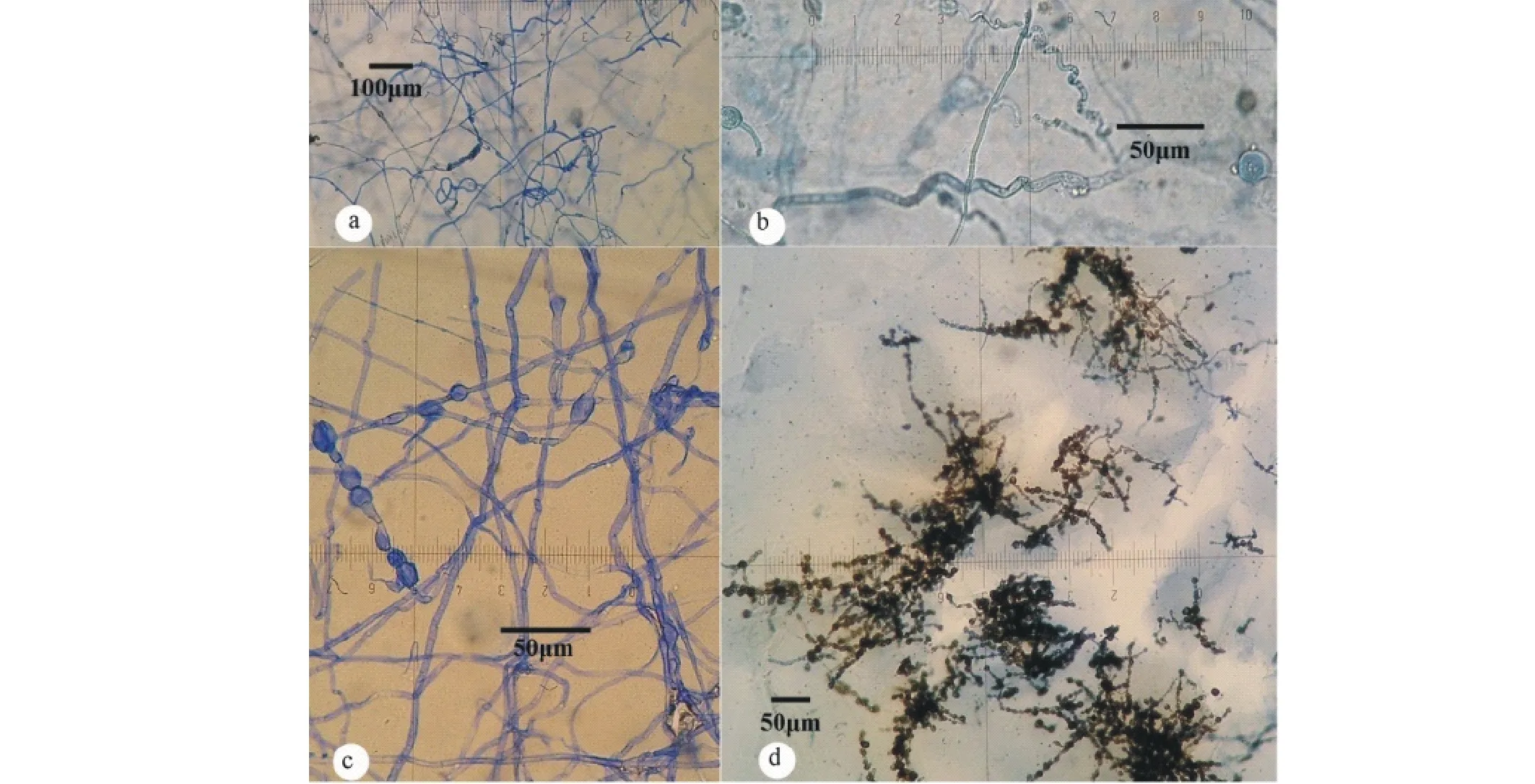
图6 疯草内生真菌3个菌株的菌丝和产孢观察(在NA和pH 7上黑暗培养30周)Fig.6 Hyphae and sporulation of locoweed endophyte cultured for 30 weeks a:LYZ0109卷曲的气生菌丝;b:LYZ0091的波浪形的菌丝;c:LYZ0093气生菌丝上产生的厚垣孢子;d:LYZ0093基质中的厚垣孢子。a: Curved aerial hypha of LYZ0109; b: Waved aerial hyphae of LYZ0091; c: Chlamydospore of LYZ0093 from aerial hyphae; d: Chlamydospore of LYZ0093 from submerged hyphae.
3 结论与讨论
小花棘豆、黄花棘豆和甘肃棘豆作为我国主要的3种疯草,造成家畜中毒死亡的事件频发,动物毒理学测定其对反刍动物的毒性较高[32-36]。这些疯草的内生真菌可产生苦马豆素,其含量与美国疯草中的苦马豆素含量接近[20,22,37-40]。本研究用分离自小花棘豆、黄花棘豆和甘肃棘豆的3个内生真菌菌株LYZ0091、LYZ0093和LYZ0109,经形态学和分子生物学鉴定后确定为同一种即棘豆链格孢(Alternariaoxytropis),研究其菌落培养特性如生长速率、形态学特征等,与Pryor等[24]、Baucom等[19]、崔振[23]的研究基本一致。我国的小花棘豆和甘肃棘豆的内生真菌已在此类真菌分类地位确立时被鉴定为Alternariaoxytropis(异名为Embellisiaoxytropis,Undifilumoxytropis)[16-17],2015年崔振[23]测定了黄花棘豆内生真菌的7个基因位点,构建的系统发育树均证明该疯草中的内生真菌与小花棘豆和甘肃棘豆中的内生真菌属于同个物种。
每种生物在进化过程中都形成了稳定的生物学特性,其中对温度适应能力是主要的生物学指标,可生存的最高、最低和最适温度称为生物的三基点温度。本研究发现3个菌株之间最大差异为菌落可生长的最高温不同,即甘肃棘豆内生真菌在30 ℃下无法生长,在25 ℃下可良好生长,故甘肃棘豆内生真菌菌落最高生长温度在25~30 ℃之间。此特性同其近似种甘肃链格孢(Alternariagansuense),异名为沙打旺埃里砖格孢(Embellisiaastragali)[41-42]。小花棘豆和黄花棘豆内生真菌在35 ℃下也无法生长,在30 ℃下生长,但后者的生长速率极小,近于停止,因此,二者最高生长温度在30~35 ℃之间,且完全抑制黄花棘豆菌落生长的最高温应低于小花棘豆内生真菌。因菌株不同,适宜于菌落生长的最适温度不同,菌株LYZ0091适宜温度为20 ℃,LYZ0093,LYZ0109适宜温度为25 ℃。其中小花棘豆内生真菌对温度的反应较为迟钝,在30 ℃下的生长速率与在5 ℃下相近,在15 ℃下的也与在20 ℃下和在25 ℃下的差异不大。
甘肃棘豆内生真菌不耐高温可能与其寄主生长环境有关,甘肃棘豆多生长在祁连山脉的高山草原,土壤以黑钙土为主,海拔在2500 m以上,气候寒冷阴湿,主要见于宁夏、甘肃、青海、四川和云南的西北以及西藏的一些高寒牧区[43],本研究的LYZ0109菌株的寄主采集自天祝县抓喜秀龙草原,该地位于青藏高原的东北缘,海拔在2878~3425 m,年均气温仅1.2 ℃[44-46]。与此相比,小花棘豆生长在草原、荒漠草原以及荒漠区的低湿地,是轻度耐盐植物[47-48],如本研究中小花棘豆采集于阿拉善左旗,年均气温为6.0~8.5 ℃[49],采集黄花棘豆的海原县的年均气温为7 ℃[50]。然而,本研究观察到不同菌株在一定高温下停止生长,也并不意味着菌丝死亡,故后续有必要确定其菌丝死亡的温度,即致死高温。
3个菌株在供试的各级酸性和碱性培养基上均可生长,LYZ0091和LYZ0093在pH 10下的生长速率最高,但LYZ0109在pH 7下的生长速率最大,差异不明显。疯草内生真菌的菌丝完全生活在寄主体内,其寄主体内的pH条件应较为稳定,甘肃棘豆生长土壤以黑钙土为主,pH偏中性,而小花棘豆生长的草原、荒漠草原以及荒漠区的低湿地,pH偏碱性,是轻度耐盐植物,故在pH 10时生长最快,为何其对酸碱条件的反应不明显,有待后续研究。同类的情况亦出现在菌丝完全寄生体内的一种其近似种甘肃链格孢(Alternariagansuense)上[31]。
V-8是培养和鉴定此类真菌常用的培养基[10],3个菌株在此培养基上菌落生长最快,在WA上生长速率最低,是因为其仅可提供菌物水分,而不提供营养成分。用疯草茎秆煎熬配制的LDA对菌落生长速率未产生明显影响。甘肃链格孢在WHDA上的生长速率显著高于V-8[41],疯草内生真菌与此菌不同。然而,在不同培养基条件下,菌落形状和颜色比菌落生长速率提供的信息更丰富,可用来区分菌株。如根据3个菌株在PDA或PSA上的形状和颜色可区分开来。疯草内生真菌是一类生长缓慢的真菌,气生菌丝较少,而大部分菌丝生长在培养基内,故其菌落的生长速率可能与培养基的营养状况有关,观察发现营养丰富时菌落更易向培养基底部和顶部生长,而不会沿培养基表面和内部扩散,如在PDA培养基上。V-8、PCA、WHDA、LDA等培养基为营养贫乏培养基,疯草内生真菌的菌落生长速率高于PDA等。
在所有培养条件下3个菌株均未产生分生孢子,但在一些条件下产生了大量成串的厚垣孢子。疯草内生真菌在人工培养条件下较难产孢,有的菌种未见产孢,如密柔毛黄芪中的内生真菌Alternariacinereum就不能产孢,而是根据其分子生物学特性鉴定为新种[19]。显微观察发现菌落颜色决定于是否产生厚垣孢子,如果没产生厚垣孢子,则菌落为白色,如果产生了少量厚垣孢子,则菌落颜色浅;换言之,菌落颜色加深意味着已产生了厚垣孢子。在气生菌丝和基质中的菌丝上均可产生厚垣孢子,但以基质中的菌丝为主。无论是气生菌丝还是基质中的菌丝,新生的菌丝呈波浪状或高度扭曲状,气生菌丝在培养基表面则出现圈状菌丝团。疯草内生真菌曾命名为Undifilum属,其义为分生孢子产生的芽管呈波浪状[16],但近年发现这种特性并不一定出现在所有同类真菌中[40]。崔振[23]研究发现疯草内生真菌在培养过程中划伤菌落有利于产孢,本研究培养的3个菌株在多种培养条件下均未产孢可能与密封培养皿导致皿内的湿度过大,有利于营养生长而不利于生殖产孢有关。通过优化培养基组分和培养条件获得分生孢子有利于最终查明其完整的生活史,可减轻疯草及其内生真菌对畜牧业造成的负面影响。
内生真菌对寄主有明显的趋化性,在进化过程中已经形成对寄主的适应机制[38]。内生真菌侵染组织后,为了行使特定的生物学功能,双方在形态、生理和分子水平均发生着深刻的变化,从而建立稳定有效的共生体[43]。小花棘豆采自内蒙古腾格里境内,黄花棘豆采自宁夏海原,均属温带大陆性气候,甘肃棘豆采自甘肃天祝高寒草原,气候寒冷阴湿,3种菌株虽属同种真菌,但因对寄主不同生境的适应性进化,彼此产生了一定的差异。虽然小花棘豆、黄花棘豆和甘肃棘豆中的内生真菌在培养温度等方法存在一些差异,但趋同性多于差异性,这与分子生物学研究结果相符。我国已发现的2种黄芪和6种棘豆中的内生真菌均为同一个真菌种[23,39],意味着可能存在不同疯草中的内生真菌可以相互侵染其寄主的情况,是否存在这种可能尚有待通过交换寄主接种来验证。
References:
[1] Molyneux R J, James L F. Loco intoxication: indolizidine alkaloids of spotted locoweed (Astragaluslentiginosus). Science, 1982, 216: 190-191.
[2] Gardner D R, Molyneux R J, Ralphs M H. Analysis of swainsonine: extraction methods, detection, and measurement in populations of locoweeds (Oxytropisspp.). Journal of Agricultural and Food Chemistry, 2001, 49(10): 4573-4580.
[3] Lu H, Ma Y, Zhao B Y,etal. Isolation and identification of endophytic fungus fromOxytropisdeflexa. Acta Veterinariaet Zootechnica Sinica, 2010, 41(7): 902-908.
路浩, 马尧, 赵宝玉, 等. 急弯棘豆内生真菌的分离与鉴定. 畜牧兽医学报, 2010, 41(7): 902-908
[4] Zhao B Y, Tong D W, Ge P B,etal. Locoweed harm investigation in the west grassland of China. Grassland of China, 2003, 25(4): 65-68.
赵宝玉, 童德文, 葛鹏斌, 等. 我国西部草原疯草危害调查. 中国草地, 2003, 25(4): 65-68.
[5] Shi Z C, Wang Y Z. The advances of study on the poisonous plants in the western grassland in China. Chinese Journal of Biological Control, 2004, 20: 22-25.
史志诚, 王亚洲. 中国西部草地重要毒草研究的新进展. 中国生物防治, 2004, 20: 22-25.
[6] Hu Y C, Liu L, Liu P,etal. An overview of ecological research on locoweed. Progress in Veterinary Medicine, 2011, (3): 108-112.
胡延春, 刘玲, 刘鹏, 等. 疯草的生态学研究概况. 动物医学进展, 2011, (3): 108-112.
[7] McLain-Romero J, Creamer R, Zepeda H,etal. The toxicosis of fungi from locoweed (Oxytropislambertii) is similar to locoweed toxicosis in rats. Journal of Animal Science, 2004, 82(7): 2169-2174.
[8] Braun K. Fungal Endophyte Infection and Swainsonine Toxicity in Locoweed[D]. Las Cruces: New Mexico State University, 1999.
[9] Lu H, Wang Z X, Zhao B Y,etal. The research progress on diagnosis and treatment of animal locoism in American. Pratacultural Science, 2010, 27(1): 136-143.
路浩, 王占新, 赵宝玉, 等. 美国动物疯草中毒诊断与防治技术研究进展. 草业科学, 2010, 27(1): 136-143.
[10] Braun K, Romero J, Liddell C,etal. Production of swainsonine by fungal endophytes of locoweed. Mycological Research, 2003, 107(8): 980-988.
[11] Qi W, Nagao H, Yu L,etal.Embellisiaoxytropis, a new species isolated fromOxytropiskansuensisin China. Mycotaxon, 2006, 95: 255-260.
[12] Lu P, Zhao M L, Lv G F,etal. Culture and identification of endophytic fugi fromOxytropisglabraDC. Acta Ecologica Sinica, 2009, 29(1): 53-58.
卢萍, 赵萌莉, 吕桂芬, 等. 小花棘豆(OxytropisglabraDC.)内生真菌的培养与鉴定. 生态学报, 2009, 29(1): 53-58.
[13] Yu Y T. Isolation, Identification and genetic polymorphism of swainsonine-producing fungal endophytes from locoweeds in China[C]//China animal husbandry and veterinary association animal toxicology branch 2009 conference proceedings. Zhanjiang, Guangdong, 2009.
余永涛. 产苦马豆素疯草内生真菌的分离鉴定及其遗传多态性研究[C]//中国畜牧兽医学会动物毒物学分会 2009 年学术研讨会论文集. 湛江, 2009.
[14] Yu Y T, Wang J H, Wang Y,etal. Identification of swainsonine-producing fungal endophytes from three species of locoweeds in Tibet. Scientia Agricultura Sinica, 2009, (10): 3662-3671.
余永涛, 王建华, 王妍, 等. 西藏3种疯草中合成苦马豆素内生真菌的鉴定. 中国农业科学, 2009, (10): 3662-3671.
[15] Wang Q, Nagao H, Li Y.Embellisiaoxytropis, a new species isolated fromOxytropiskansuensisin China. Mycotaxon, 2006, 95: 255-260.
[16] Pryor B, Creamer R, Shoemaker R,etal.Undifilum, a new genus for endophyticEmbellisiaoxytropisand parasiticHelminthosporiumbornmuellerion legumes. Botany, 2009, 87: 178-194.
[17] Woudenberg J H C, Groenewald J Z, Binder M,etal. Alternaria redefined. Studies in Mycology, 2013, 75: 171-212.
[18] Li Y Z, Creamer R, Baucom D,etal. PathogenicEmbellisiaastragalionAstragalusadsurgensis very closely related to locoweed endophyte. Phytopathology, 2011, 101(6): S102-S103.
[19] Baucom D L, Romero M, Belfon R,etal. Two new species ofUndifilum, fungal endophytes ofAstragalus(locoweeds) in the United States. Botany, 2012, 90(9): 866-875.
[20] Yu Y T. Isolation, Identification and Genetic Polymorphism of Swainsonine-Producing Fungal Endophytes from Locoweeds in China[D]. Yangling: North West Agriculture and Forestry University, 2009.
余永涛. 产苦马豆素疯草内生真菌的分离鉴定及其遗传多态性研究[D]. 杨陵: 西北农林科技大学, 2009.
[21] Lu P, Zhao M L, Han G D,etal. The locoweed in Inner Mongolia and research progress. Chinese Journal of Grassland, 2006, 28(1): 63-68.
卢萍, 赵萌莉, 韩国栋, 等. 内蒙古疯草及其研究进展. 中国草地学报, 2006, 28(1): 63-68.
[22] Lu P. Studies on Correlated Factors to Swainsonine in ThreeOxytropisSpecies in Inner Mongolia[D]. Hohhot: Inner Mongolia Agricultural University, 2007.
卢萍. 内蒙古三种棘豆属植物中苦马豆素相关因子的研究[D]. 呼和浩特: 内蒙古农业大学, 2007.
[23] Cui Z. Study on the Corresponding Relationship of Locoweed and Locoweed Endophyte Population[D]. Lanzhou: Lanzhou University, 2015.
崔振. 疯草与疯草内生真菌类群对应关系研究[D]. 兰州: 兰州大学, 2015.
[24] Pryor B M, Creamer R, Shoemaker R A,etal. Undifilum, a new genus for endophyticEmbellisiaoxytropisand parasiticHelminthosporiumbornmuellerion legumes. Botany, 2009, 87(2): 178-194.
[25] Ralphs M H, Creamer R, Baucom D,etal. Relationship between the endophyteEmbellisiaspp. and the toxic alkaloid swainsonine in major locoweed species (AstragalusandOxytropis). Journal of Chemical Ecology, 2008, 34(1): 32-39.
[26] Ralphs M H, Cook D, Gardner D R,etal. Transmission of the locoweed endophyte to the next generation of plants. Fungal Ecology, 2011, 4: 251-255.
[27] McLain-Romero J, Creamer R, Ralphs M,etal. Association of a fungal endophyte with seed tissue and locoweed toxicity. Phytopathology, 2002, 92: S70.
[28] Creamer R, McLain-Romero J. Fungal endophyte of locoweed: an overview. Poisonous Plants, 2007, 3(7): 338-344.
[29] Fang Z D. Method Plant Pathology[M]. Beijing: China Agriculture Press, 1998.
方中达. 植病研究方法[M]. 北京: 农业出版社, 1998.
[30] Simmons E G.Helminthosporiumalliias type of a new genus. Mycologia, 1971, 63(2): 380-386.
[31] Li Y Z. Studies of Yellow Stunt and Root rot of Standing Milk-vetch(AstragalusadsurgensPall.)[D]. Lanzhou: Lanzhou University, 2007.
李彦忠. 沙打旺黄矮根腐病(Embellisiaastragalinov. sp. Li and Nan)研究[D]. 兰州: 兰州大学, 2007.
[32] Zhao B Y, Fan Y Y, Fan Z F,etal. The damage of locoweed in western China and control the locoisim. Grass-Feeding Livestock, 2006, (S1): 12-15.
赵宝玉, 樊月圆, 樊泽峰, 等. 我国西部草原疯草危害及其动物中毒病的控制. 食草家畜, 2006, (S1): 12-15.
[33] Zhang C, Zou J R. The investigation for locoism in western China. Shaanxi Journal of Agricultural Sciences, 2002, (10): 34-35.
张聪, 邹军荣. 西部草原疯草问题的调查报告. 陕西农业科学, 2002, (10): 34-35.
[34] Wu D, Si H L, Wang J H. Study on locoweed. Pratacultural Science, 2003, 20(2): 43-47.
吴达, 司红丽, 王建华. 疯草研究现状. 草业科学, 2003, 20(2): 43-47.
[35] Gao X L, Han B, Zhao M L,etal. Locoweed and advances in research on toxic components. Acta Prataculturae Sinica, 2011, 20(3): 279-286.
高新磊, 韩冰, 赵萌莉, 等. 疯草及毒性成分研究进展. 草业学报, 2011, 20(3): 279-286.
[36] Chen J P, Ma Y, Lu H,etal. The research progress in locoweed-fungal endophyte. Progress in Veterinary Medicine, 2011, 32(2): 77-81.
陈基萍, 马尧, 路浩, 等. 疯草内生真菌研究进展. 动物医学进展, 2011, 32(2): 77-81.
[37] Yu Y T, Zhao Q M, Wang J H. Swainsonine-producing fungal endophytes from major locoweed species in China. Toxicon, 2010, 56: 330-338.
[38] Peters S, Schulz B. Interactions in dual cultures of endophytic fungi with host and nonhost plant calli. Mycologia, 1998, 90(3): 360-367.
[39] Yu Y, Wang J, Zhao Q M,etal. Isolation and identification of swainsonine-producing fungal endophyte fromOxytropiskansuensis. Journal of Northwest A & F University: Nat. Sci. Ed., 2009, 3(72): 40-47.
[40] Liu J L, Li Y Z, Creamer R. A Re-examination of the taxonomic status ofEmbellisiaastragali. Current Microbiology, 2016, 72: 404-409.
[41] Li Y Z, Nan Z B. Nutritional study onEmbellisiaastragali, a fungal pathogen of milk vetch (Astragalusadsurgens). Antonie Van Leeuwenhoek, 2009, 95(3): 275-284.
[42] Liu J L, Li Y Z, Nan Z B. Design of species-specific PCR method for detection of pathogenEmbellisiaastragaliin standing milk-vetch seeds. Letters in Applied Microbiology, 2015, 60(4): 372-378.
[43] Yuan Z L, Zhang C L, Lin F C. Recent advances on physiological and molecular basis of fungal endophyte-plant interactions. Acta Ecologica Sinica, 2008, 28(9): 4430-4439.
袁志林, 章初龙, 林福呈. 植物与内生真菌互作的生理与分子机制研究进展. 生态学报, 2008, 28(9): 4430-4439.
[44] Qi G X, Qian L, Wang Z C. Analysis of climate change in recent 60 years in Tianzhu County. Journal of Anhui Agricultural Sciences, 2014, 42(16): 5255-5257.
齐高先, 钱莉, 汪作成. 天祝县近60年气候变化分析. 安徽农业科学, 2014, (16): 5255-5257.
[45] Zhang X L. Preliminary investigation of grassland pests in Tianzhu. Gansu Normal University: Natural Science Edition, 1964, (1): 1-18.
张兴礼. 天祝草原虫害的初步调查. 甘肃师范大学学报(自然科学版), 1964, (1): 1-18.
[46] Xu J H, Liu X N, Zhang D G. Integrated orderly classification of grassland in Tianzhu County and evaluation of ecosystem service value. Chinese Journal of Grassland, 2009, 31(5): 23-29.
徐吉宏, 柳小妮, 张德罡. 天祝县草地综合顺序分类及生态系统服务价值评价. 中国草地学报, 2009, 31(5): 23-29.
[47] Ma Y Q. Inner Mongolia Flora[M]. Hohhot: Inner Mongolia People Publishing House, 1989.
马毓泉. 内蒙古植物志[M]. 呼和浩特: 内蒙古人民出版社, 1989.
[48] Zhao Y Z, Liu L. Ecological geographic distributions specificity of flora ofOxytropisin Inner Mongolia. Journal of Inner Mongolia University: Natural Science Edition, 1997, 28(2): 200-212.
赵一之, 刘丽. 内蒙古棘豆属 Oxytropis 植物区系生态地理分布特征. 内蒙古大学学报: 自然科学版, 1997, 28(2): 200-212.
[49] Chen C, Zhou G S. Characteristics of air temperature and ground temperature in Alxa Left Banner from 1961 to 2010. Journal of Natural Resources, 2014, 29(1): 91-103.
陈超, 周广胜. 1961-2010年阿拉善左旗气温和地温的变化特征分析. 自然资源学报, 2014, 29(1): 91-103.
[50] Hu W J, Mei S G, Yang W Y,etal. The opinion to establishment local nature reserve in Huanshan of Haiyuan County. Ningxia Journal of Science and Technology, 2003, (3): 44-45.
虎卫军, 梅曙光, 杨文云, 等. 成立海原南华山区级自然保护区项目刍议. 宁夏科技, 2003, (3): 44-45.
Culturalcharacteristicsoffungalendophytefrom3locoweedspeciesinChina
WANG Zhi-Gang, CAO Shi, XU Na, XU Shan, LI Yan-Zhong*
StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
Locoweeds contain swainsonine-producing fungal endophytes. Endophytes in several locoweed species in China are known to belong to the same taxonomic species of fungus. However, since these endophytes are isolated within their respective hosts and vertically transmitted to seed of the next plant generation, it is likely that the fungal endophytes of the various locoweed species have developed distinctive biological traits. Colony growth rate and morphological characteristics of endophytes fromOxytropisglabra,O.ochrocephalaandO.kansuensis(strains LYZ0091, LYZ0093 and LYZ0109, respectively) were studied under different temperature and pH regimes and grown on various media to test this hypothesis. It was found that: 1) The maximum temperature for growth differed between strains (LYZ0109 ceased growth at 30 ℃, while LYZ0091 and LYZ0093 continued to grow at 30 ℃); 2) The optimum temperatures for colony growth were 20, 25 and 25 ℃, respectively, for LYZ0091, LYZ0093, and LYZ0109; 3) The growth rate of LYZ0091 at 5, 10 and 15 ℃ was significantly (P<0.05) higher than LYZ0109, while significantly (P<0.05) lower than LYZ0109 at 20 and 25 ℃. 4) No significant growth difference between fungal strains was found over the pH range pH 4 to pH 11; 5) The colony growth rate of strain LYZ0109 was significantly (P<0.05) higher than that of LYZ0091 on NA, PCA, PDA, PSA and WHDA media for most growth measures; 6) No conidia were produced by any fungal strain in any of temperature, pH and media combinations tested; 7) Hyphae of LYZ0091 and LYZ0109 were waved, and seldom produced chlamydospores; hyphae of LYZ093 were straight with plentiful chlamydospores arranged as tree-like structures from the media bottom to the surface.
locoweed; endophyte; symbiont; strain; cultural characteristics
10.11686/cyxb2017009http//cyxb.lzu.edu.cn
汪治刚, 曹师, 徐娜, 徐杉, 李彦忠. 我国3种疯草的内生真菌培养特性研究. 草业学报, 2017, 26(10): 158-169.
WANG Zhi-Gang, CAO Shi, XU Na, XU Shan, LI Yan-Zhong. Cultural characteristics of fungal endophyte from 3 locoweed species in China. Acta Prataculturae Sinica, 2017, 26(10): 158-169.
2017-01-09;改回日期:2017-03-15
国家自然基金面上项目(31272496),公益性行业(农业)科研经费专项项目(201303057)和云南省高端科技人才引进项目(2012HA012)资助。
汪治刚(1993-),男,甘肃天水人,在读硕士。E-mail: wangzhg14@lzu.edu.cn
*通信作者Corresponding author. E-mail: liyzh@lzu.edu.cn

