人参皂苷Re对阿尔茨海默病模型小鼠脑组织生物标记物调控作用的研究
人参皂苷Re对阿尔茨海默病模型小鼠脑组织生物标记物调控作用的研究
李菁媛王喆刘颖李伟李乃静
目的通过超高速液相色谱-质谱联用(UPLC-MS)技术研究人参皂苷Re(G-Re)对阿尔茨海默病(AD)模型小鼠生物标记物的调控作用以及机制,为AD的中药治疗提供新思路。方法将小鼠随机分为对照组、AD模型组和G-Re治疗组,通过免疫组化实验观察小鼠脑部海马区细胞的病理学改变,运用以UPLC-MS为基础的代谢组学技术研究G-Re对AD模型小鼠脑组织生物标记物的调控作用。结果免疫组化实验发现,对照组小鼠海马区无Aβ沉积,AD模型组小鼠海马区可见大量Aβ沉积,经G-Re治疗后小鼠海马区Aβ沉积明显减少。代谢组学分析发现,AD模型组小鼠脑组织中存在次黄嘌呤、次黄嘌呤核苷、苯丙氨酸、16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰胆碱C16:0、溶血磷脂酰胆碱C18:1、溶血磷脂酰胆碱C18:0等9种生物标记物。与对照组比较,AD组次黄嘌呤、次黄嘌呤核苷和苯丙氨酸的含量明显升高(P<0.05),16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰胆碱(C16:0、C18:1、C18:0)的含量明显降低(P<0.05)。经G-Re干预后,AD组小鼠脑组织中次黄嘌呤、次黄嘌呤核苷和苯丙氨酸的含量明显降低(P<0.05),16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰胆碱(C16:0、C18:1、C18:0)的含量明显升高(P<0.05)。结论G-Re可以干预AD小鼠体内氨基酸、核酸及脂质等代谢途径,减少小鼠海马区的Aβ沉积,从而对AD起到治疗作用。
人参皂苷Re; 阿尔茨海默病; 生物标记物; 超高速液相色谱-质谱联用
阿尔茨海默病(Alzheimer’s disease,AD)是一种致死性的神经系统退行性疾病,其临床特点包括渐进性的记忆减退、情绪改变、沟通及推理方面障碍,最终病人将失去独立生活的能力[1]。AD不仅严重影响老年人的社交、工作与生活,其医疗和护理也给病人家庭和社会带来沉重的经济负担[2]。因此,研究AD的发生机制,探索有效的预防和治疗策略,具有重要的临床意义。人参皂苷Re(ginsenoside Re,G-Re)作为人参的生物活性成分之一,具有改善脑缺血缺氧,提高学习和记忆能力等作用[3]。关于G-Re治疗AD的代谢组学研究,国内外均未见报道。本研究首次将超高速液相色谱-质谱联用(ultra performance liquid chromatography-mass spectrometry,UPLC-MS)为基础的代谢组学技术,用于研究G-Re对AD生物标记物的调控作用及其机制,以期为AD的防治指明新方向。
1 材料与方法
1.1 试剂与仪器 G-Re(上海源叶生物科技有限公司);β淀粉样肽25-35(amyloid β-protein 25-35,Aβ25-35)、兔抗鼠Aβ42(美国Sigma 公司);山羊抗兔/鼠免疫组化试剂盒(北京中杉金桥生物技术有限公司);色谱乙腈,色谱甲醇(美国Fisher公司)。TGL-16台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);液相系统 AcquityTMUltra Performance Liquid Chromatography system,质谱仪 Quattro microTMAPI Mass Spectrometers(美国Waters公司)。
1.2 实验动物及分组 健康12周龄雄性昆明小鼠24只,体质量为18~22 g,由沈阳药科大学实验动物中心提供,动物使用许可证号[SYXK(辽)2014-004]。将24只小鼠随机分为对照组、AD模型组和G-Re治疗组,每组各8只。小鼠置于室温23 ℃~25 ℃,光照12 h/12 h昼夜循环的条件下饲养,自由饮水和进食。
1.3 实验方法
1.3.1 AD模型制备:AD组和G-Re组小鼠经5%水合氯醛麻醉后,选取右侧侧脑室为注射位点,缓慢注射凝聚态的Aβ25-35溶液5 μl。对照组小鼠侧脑室内注射等体积生理盐水。
1.3.2 给药方法:造模成功后3 d开始灌胃给药,G-Re治疗组小鼠给予G-Re 4 mg/(kg·d),对照组和AD组均给予生理盐水10 ml/(kg·d)。1次/d,连续给药30 d。
1.3.3 免疫组化实验:实验小鼠经乙醚麻醉后,采用断头取脑的方法获取脑组织。取脑后置于4%多聚甲醛液中,固定3 d,将脑组织常规包埋并制成石蜡切片,切片厚度为2.5 μm。切片置于60 ℃恒温箱内过夜。切片脱蜡处理后,用PBS洗去酒精。将切片放在抗原修复液中,37 ℃温箱中修复30 min以暴露抗原。漂洗后3%过氧化氢溶液室温孵育40 min,以阻断内源性过氧化物酶活性。漂洗后滴加山羊血清封闭抗原,室温孵育40 min。漂洗后滴加兔抗鼠Aβ1-42(1∶100),4 ℃孵育过夜。漂洗后滴加聚合物辅助剂,室温孵育20 min。滴加辣根酶标记的抗鼠/兔IgG聚合物,室温孵育20 min。应用DAB显色、苏木素复染后,自来水充分冲洗返蓝,酒精梯度脱水,二甲苯透明,封片后光镜下观察。
1.4 样品的采集与预处理 样品采集:各组小鼠经乙醚麻醉后,断头取脑置于EP管中,分别称重并记录,放入-80 ℃冰箱待用。预处理:每0.1 g脑组织加入1 ml水,冰浴中匀浆。取150 μl匀浆液,加入600 μl甲醇沉淀蛋白,涡旋5 min,在4 ℃条件下15 000 r/min离心10 min,取上清液于氮气下吹干。临测时用100 μl初始流动相(乙腈-水,v∶v 2∶98)复溶,取10 μl注入UPLC系统。
1.5 色谱和质谱条件 色谱分析条件:色谱柱为ACQUITY UPLC® BEH C18 Column(1.7 μm,2.1×50 mm,Waters),流动相A为0.1%甲酸水,流动相B为0.1%甲酸乙腈,流速为0.25 ml/min。梯度洗脱条件如下:0 min,98% A;0~3 min,98%~80% A;3~4 min,80%~45% A;4~13 min,45%~0% A;13~14 min,0%~98% A。进样量为10.0 μl,柱温为30 ℃。质谱分析条件:采用电喷雾离子源(ESI),离子源温度为120 ℃,正离子模式检测,扫描方式为全扫描,扫描范围为100~1000 m/z;毛细管电压为3.2 kV,锥孔电压为30 V;脱溶剂气为氮气,流速为600 L/h,温度为350 ℃。在运用MS/MS的方式进行二级扫描时,碰撞气为氩气。
1.6 代谢组学数据处理 将原始图谱导入Markerlynx V 4.1软件分析,收集每个色谱图的总离子强度数据,进行主成分分析(principal component analysis,PCA)。经PCA分析输出得分图和载荷图,对数据进行分组,找出对分组贡献较大的物质,进行二级扫描以获得更多质谱碎片信息,根据HMDB(http://www.hmdb.ca/)、KEGG(http://www.kegg.jp/)和LIPID MAPS(http://www.lipidmaps.org/)等数据库,确定AD的生物标记物。3组间各生物标记物的峰强度比较采
用t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 免疫组织化学实验 对照组小鼠大脑海马区神经元细胞排列紧密,细胞核大而规则,可观察到明显的核仁,细胞间无Aβ沉积。AD组小鼠大脑海马部位神经元细胞稀疏,排列紊乱,细胞核深染,细胞间有明显深褐色的大块Aβ沉积。G-Re组小鼠与AD组比较,小鼠海马部位神经元细胞排列较为整齐,细胞核染色变淡,Aβ沉积明显减少。见图1。
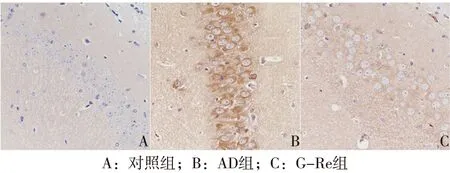
图1 小鼠脑组织海马区免疫组化染色结果(PV法,×400)
2.2 小鼠脑组织代谢组学分析
2.2.1 UPLC-MS代谢产物图谱:对照组、AD组和G-Re组小鼠脑组织正离子模式下的基峰色谱图见图2。
图2 小鼠脑组织正离子模式下的基峰色谱图
2.2.2 UPLC-MS数据分析:将对照组、AD组和G-Re组小鼠脑组织的代谢物谱数据进行PCA分析,得到得分图(图3A,横纵坐标分别代表PCA模型中的两个主成分的打分向量)和载荷图(图3B,横纵坐标分别代表的是两个主成分的载荷向量)。得分图可见对照组与AD组界限明显,无任何交集,而G-Re组处于对照组和AD组之间,证明G-Re干预后AD小鼠脑组织代谢物发生明显变化。载荷图中分散于外围的变量为对分组贡献较大的变量,即AD的生物标志物。

图3 3组脑组织代谢物普的得分图(A)和载荷图(B)
2.2.3 生物标记物的确认:经PCA分析及相关代谢组学数据库,确定了9种AD的生物标志物,分别是次黄嘌呤、次黄嘌呤核苷、苯丙氨酸片段、苯丙氨酸、16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰胆碱(Lysophosphatidylcholine,LPC)C16:0、LPC C18:1、LPC C18:0,这9种生物标记物在各组小鼠脑组织中的峰强度变化见图4。与对照组比较,AD组次黄嘌呤、次黄嘌呤核苷和苯丙氨酸的含量明显升高(P<0.05),16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明显降低(P<0.05)。经G-Re干预后,小鼠脑组织中次黄嘌呤、次黄嘌呤核苷和苯丙氨酸的含量明显降低(P<0.05),16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明显升高(P<0.05)。
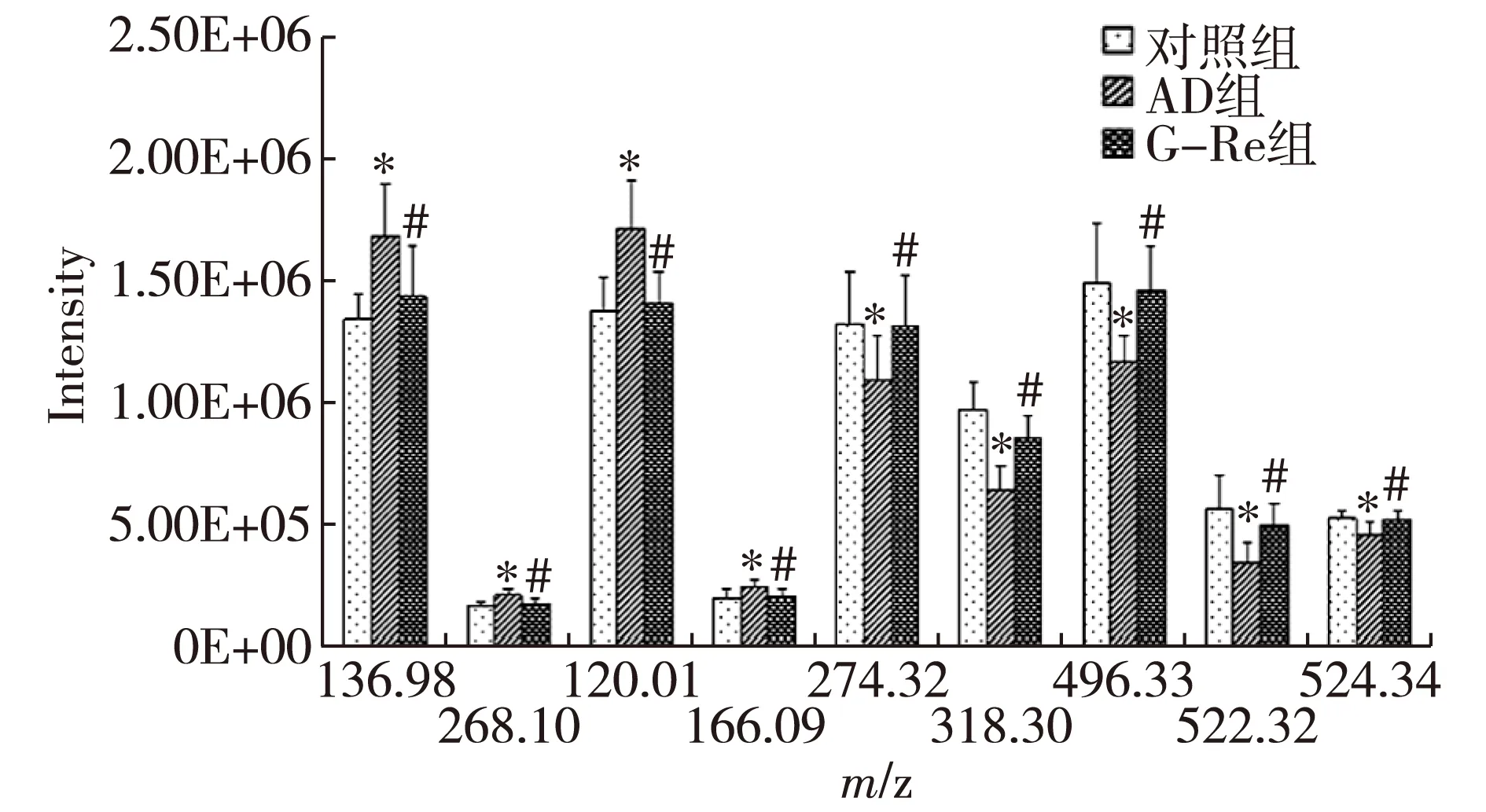
注:与对照组比较,*P<0.05;与AD组比较,#P<0.05。m/z 136.98:次黄嘌呤;m/z 268.10:次黄嘌呤核苷;m/z 120.01:苯丙氨酸片段;m/z 166.09:苯丙氨酸;m/z 274.32:16碳鞘氨醇;m/z 318.30:植物鞘氨醇;m/z 496.32:LPC C16:0;m/z 522.32:LPC C18:1;m/z 524.34:LPC C18:0。图4 对照组、AD组和G-Re组生物标记物的峰强度
3 讨论
研究表明,G-Re能通过减少AD细胞模型中活性氧的生成、抑制AD小鼠脑组织糖原合成酶激酶-3β的活性等途径,对神经元起到保护作用,缓解AD的病理过程[4-5]。而代谢组学以相对分子质量<1000的小分子代谢物质为研究对象,着重研究机体受内外因素扰动后(如基因改变或环境变化等),代谢物的种类、数量变化及其规律[6]。换言之,代谢组学可以从宏观层面来理解疾病的发展过程,与中医的整体观思维方式不谋而合。因此,代谢组学可用来研究G-Re对AD模型小鼠体内内源性代谢物及异常代谢通路的调控作用,进一步阐明G-Re治疗AD的作用机理。
AD的特征性病理改变包括Aβ沉积形成的老年斑(senile plaques,SPs))和tau蛋白过度磷酸化形成的神经元纤维缠结(neurofibrillary tangles,NFTs),常伴有神经元丢失。本研究通过免疫组化的方法,在AD小鼠大脑海马区观察到神经细胞减少、排列紊乱,细胞核呈现凋亡的特征性改变(核质固缩、边集及碎裂),并有明显的SPs,提示AD模型小鼠具备与AD病人脑部类似的病理学改变。G-Re组与对照组比较,虽然神经元细胞似乎仍有减少,但相对于AD组,小鼠海马区Aβ沉积明显减少,仅能观察到少量SPs。以上结果说明了G-Re可以减弱Aβ蛋白对海马区神经元的毒害作用,对神经元具有保护作用。
本研究通过UPLC-MS技术来研究AD小鼠脑组织中代谢物谱的变化,确定了9种AD生物标记物。与对照组比较,AD小鼠脑组织中次黄嘌呤、次黄嘌呤核苷和苯丙氨酸的含量明显增加,而16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明显降低。经G-Re干预后,与AD组比较,次黄嘌呤、次黄嘌呤核苷和苯丙氨酸的含量明显降低,16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明显升高。说明G-Re可以干预AD小鼠体内氨基酸、核酸及脂质等代谢途径,对AD起到治疗作用。
次黄嘌呤核苷又称肌苷,是核酸代谢的中间产物,由腺苷脱氨后产生,在核苷磷酸化酶的作用下生成次黄嘌呤。有研究表明,AD病人脑中磷酸腺苷脱氨酶活性升高,加速磷酸腺苷降解生成腺苷[7],因而肌苷和次黄嘌呤的浓度随之升高。嘌呤能信号在AD的发展过程中发挥重要的作用[8]。次黄嘌呤可以通过抑制Na+,K+-ATP酶的活性来诱导大鼠纹状体氧化应激[9]。氧化应激在AD中起重要作用,多种可能的发病机制或病理生理改变都与氧化应激反应有关[10]。Kaddurah-Daouk等[11]研究表明,嘌呤代谢紊乱可能与tau蛋白及Aβ蛋白的病理发展过程相关。因此,次黄嘌呤和肌苷可以作为AD的生物标记物。本研究表明,AD小鼠脑组织内次黄嘌呤、肌苷的含量均高于对照组小鼠。G-Re给药后,与AD组比较,次黄嘌呤和肌苷水平均明显下调,证明G-Re可通过介导核酸代谢发挥作用。
苯丙氨酸是人体必需氨基酸之一,主要存在于血浆和脑组织内。Wissmann等[12]的研究表明,AD病人的血清中苯丙氨酸浓度升高,且苯丙氨酸/色氨酸的比值也升高,这与慢性免疫激活紧密相关,免疫应答激活有关的苯丙氨酸的代谢障碍可能与AD的炎症机制相关。本研究中,与对照组相比,AD组小鼠脑组织中苯丙氨酸浓度显著升高,这和之前的报道相一致。因此,苯丙氨酸可以作为AD一个的生物标记物。G-Re组与AD组比较,小鼠脑组织内苯丙氨酸的含量明显降低,提示G-Re可以干预苯丙氨酸代谢发挥治疗作用。
鞘氨醇又称神经鞘氨醇,属于鞘脂类。鞘脂类是体内重要的信号分子,参与多种生理功能调节,例如细胞的生长与老化、细胞识别、信号转导等,在细胞功能的维持中起着一系列至关重要作用[13]。神经酰胺是鞘脂类的中间代谢产物,由神经鞘氨醇长链碱基与脂肪酸组成。鞘氨醇作为鞘脂的分解产物,它通过再酰化被回收利用,生成神经酰胺及其衍生物[14]。有报道称,在以AD为代表的神经退行性疾病中,膜相关的氧化应激异常活跃,导致神经酰胺的的大量蓄积,而作为合成原料的鞘氨醇含量明显降低[15]。本研究中,AD小鼠脑组织中16碳鞘氨醇和植物鞘氨醇的含量均显著下降。经G-Re干预后,与AD组比较,二者的含量均明显升高,说明G-Re可以改变异常的鞘氨醇代谢通路。
LPC是磷脂代谢的的中间产物,是体内重要的生物活性物质,可作为第二信使来参与多种细胞功能的调节,包括信号转导、基因表达和细胞增殖等[16]。神经细胞膜上的磷脂代谢异常是AD的特征性病理改变,它会导致细胞膜崩解[17],这可能与AD发病过程中的神经元丢失有关。磷脂酶A2(phospholipaseA2,PLA2)是磷脂代谢的关键酶。PLA2的过度活化会刺激磷脂酰胆碱(PC)变性生成LPC,LPC迅速水解产生甘油磷酸胆碱(GPCh),磷酸胆碱(PCh),最后变为胆碱(Ch),并释放游离脂肪酸[18]。有研究表明,LPC在 AD 病人的脑脊液[19]、脑组织[20]和血浆[21]中均显著降低。 本实验结果表明,AD小鼠脑组织中LPC C16:0、LPC C18:1、LPC C18:0的含量较对照组显著降低。经G-Re干预后,与AD组比较,LPC(16:0、 C18:1、C18:0)的含量明显升高,说明G-Re能通过调控磷脂代谢起到抗AD的效果。
本研究运用UPLC-MS技术,对G-Re干预的Aβ25-35所致AD模型小鼠的脑组织代谢物谱进行分析,确定了9种AD的生物标志物,并发现G-Re通过干预AD小鼠体内氨基酸、核酸及脂质等代谢途径,发挥对AD的治疗作用。
[1] Pan X, Nasaruddin MB, Elliott CT, et al. Alzheimer’s disease-like pathology has transient effects on the brain and blood metabolome[J]. Neurobiol Aging, 2016,38:151-163.
[2] Graham SF, Chevallier OP, Roberts D, et al. Investigation of the human brain metabolome to identify potential markers for early diagnosis and therapeutic targets of Alzheimer’s disease[J]. Anal Chem, 2013, 85(3):1803-1811.
[3] 姜红柳, 杨振, 孟勤, 等. 人参皂苷Re对小鼠学习记忆障碍的作用[J]. 中国药理学通报, 2008, 24(10):1399-1400.
[4] Huang GD, Zhong XF, Deng ZY, et al. Proteomic analysis of ginsenoside Re attenuates hydrogen peroxide-induced oxidative stress in human umbilical vein endothelial cells[J]. Food Funct, 2016,7(5):2451-2461.
[5] 贾立云, 潘晓华, 刘晶, 等. 人参皂苷Rb1、Re对Aβ25-35诱导SK-N-SH细胞损伤的保护作用[J]. 山东大学学报:医学版, 2011,49(4):33-37.
[6] Alnouti Y. Metabolomics[M]. Springer New York, 2014:10.
[8] Kaddurah-Daouk R. Metabolomic changes in autopsy-confirmed Alzheimer’s disease[J]. Alzheimers Dement, 2011,7(3):309-317.
[9] Wyse AT, Bavaresco CS, Reis EA, et al. Training in inhibitory avoidance causes a reduction of Na+, K+-ATPase activity in rat hippocampus[J]. Physiol Behav, 2004, 80(4):475-479.
[10] 林玉坤, 曾园山, 曲泽强, 等. 氧化应激与阿尔茨海默病[J]. 解剖学研究, 2009,31(1):67-70.
[11] Kaddurah-Daouk R, Zhu H, Sharma S, et al. Alterations in metabolic pathways and networks in Alzheimer’s disease[J]. Transl Psychiatry, 2013, 3:e244.
[12] Wissmann P, Geisler S, Leblhuber F, et al. Immune activation in patients with Alzheimer’s disease is associated with high serum phenylalanine concentrations[J]. J Neurol Sci, 2013, 329(1/2):29-33.
[13] Alesenko AV. The potential role for sphingolipids in neuropathogenesis of Alzheimer’s disease[J]. Biomed Khim, 2013, 59(1):25-50.
[14] Kitatani K, Idkowiak-Baldys J, Hannun Y. The sphingolipid salvage pathway in ceramide metabolism and signaling[J]. Cell Signal, 2008,20(6):1010-1018.
[15] Haughey NJ, Bandaru VV, Bae M, et al. Roles for dysfunctional sphingolipid metabolism in Alzheimer’s disease neuropathogenesis[J]. Biochim Biophys Acta, 2010, 1801(8):878-886.
[16] Farooqui AA, Horrocks LA. Phospholipase A2-generated lipid mediators in the brain: the good, the bad, and the ugly[J]. Neuroscientist, 2006, 12(3):245-260.
[19] Mulder C, Wahlund LO, Teerlink T, et al. Decreased lysophosphatidylcholine/phosphatidylcholine ratio in cerebrospinal fluid in Alzheimer’s disease[J]. J Neural Transm(Vienna), 2003,110(8):949-955.
[20] Grimm MO, Grösgen S, Riemenschneider M, et al. From brain to food: Analysis of phosphatidylcholins, lyso-phosphatidylcholins and phosphatidylcholin-plasmalogens derivates in Alzheimer’s disease human post mortem brains and mice model via mass spectrometry[J]. J Chromatogr A, 2011,1218(42):7713-7722.
[21] Liu Y, Li N, Zhou L, et al. Plasma metabolic profiling of mild cognitive impairment and Alzheimer’s disease using liquid chromatography/mass spectrometry[J]. Cent Nerv Syst Agents Med Chem, 2014,14(2):113-120.
ProtectiveeffectofginsenosideReonbiomarkersinmicewithAlzheimer’sdisease
LIJing-yuan,WANGZhe,LINai-jing.
DepartmentofGerontology,ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China;LIUYing.DepartmentofEmergencyMedicine,LaboratoryofPLAWoundandTraumaCenter,theGeneralHospitalofShenyangMilitary,Shenyang110016,China;LIWei.CollegeofPharmacy,ShenyangPharmaceuticalUniversity,Shenyang110016,China
ObjectiveTo investigate the effect of ginsenoside Re(G-Re) on biomarkers in an Alzheimer’s disease (AD) mouse model based on UPLC-MS, and to provide new ideas for traditional Chinese medicine treatment of AD.MethodsTwenty-four mice were randomly divided into control group, AD model group and G-Re treatment group with eight mice in each group. Pathological changes in the hippocampus were assessed by immunohistochemistry. UPLC/MS-based metabolomics was used to identify biomarkers which were differentially expressed in the brains of AD mice.ResultsThe hippocampal amyloid deposition increased in AD mice, and it was ameliorated by the treatment of G-Re. A total of 9 potential biomarkers were identified, which were associated with the metabolism of purine, amino acids, sphingolipids and lysophosphatidylcholines in AD mice. Compared to control group, the peak intensities of 9 biomarkers give a pronounced change in AD(P<0.05). G-Re treatment affected all these metabolic pathways.ConclusionsThese results indicate that G-Re can reduce the hippocampal amyloid deposition in AD mice by regulation of related brain metabolic pathways. In a word, G-Re plays a positive role in the treatment of AD.
ginsenoside Re; Alzheimer’s disease; biomarkers;ultra performance liquid chromatography-mass spectrometry
R 749.16
A
10.3969/j.issn.1003-9198.2017.10.007
2016-12-12)
国家自然科学基金(81203002)
110004 辽宁省沈阳市,中国医科大学附属盛京医院干诊科(李菁媛,王喆,李乃静);110016 辽宁省沈阳市,沈阳军区总医院急诊医学部全军重症战创伤救治中心实验室(刘颖);110016 辽宁省沈阳市,沈阳药科大学药学院药物分析教研室(李伟)
李乃静,Email:lnjlw2003@163.com

