乳酸菌胞外多糖在食品工业中的应用
彭家伟,黄桂东,黄伟志,曾 荣,郭颖媚,黄雯丽
(佛山科学技术学院,佛山市酿造工程技术研究中心,广东佛山 528000)
乳酸菌胞外多糖在食品工业中的应用
彭家伟,*黄桂东,黄伟志,曾 荣,郭颖媚,黄雯丽
(佛山科学技术学院,佛山市酿造工程技术研究中心,广东佛山 528000)
乳酸菌在生长代谢过程中可产生具有较强生理活性的胞外多糖,能在外部环境中维持肠道菌群微生态平衡、增强机体免疫功能、预防和抑制肿瘤发生、改善制品风味,目前常被作为增稠剂、稳定剂、凝胶剂和乳化剂等应用于乳制品制作中。研究发现,乳酸菌胞外多糖可以明显改善食品的品质与风味,这些功能特性取决于单糖的连接方式、空间构象及其与发酵底物成分的相互作用,从胞外多糖在发酵制品方面的应用及其基本原理进行综述。
乳酸菌;胞外多糖;食品工业
Abstract:Lactic acid bacteria can produce exopolysaccharides with strong physiological activity during its growth and metabolism.Exopolysaccharides can maintain the microbial balance of intestinal microflora in the external environment,enhance the immune function,prevent and inhibit tumor occurrence,improve food product flavor.It is often used as thickeners,stabilizers,gelling agents and emulsifiers in the manufacture of dairy products.The research shows that exopolysaccharides produced by lactic acid bacteria can significantly improve the quality and flavor of food,which depend on the connection of monosaccharides,the spatial conformation and its interaction with the fermentation substrate.The application of exopolysaccharides in fermented products and its basic principles are investegated in this review.
Key words:lactic acid bacteria;exopolysaccharides;food industry
研究发现,嗜热链球菌(Streptococcus thermophilus)[4]、嗜酸乳杆菌 (Lactobacillus acidophilus)[5]、肠膜明串球菌(Leuconostoc mesenteroides)[6]、植物乳杆菌(Lactobacillusplantarum)[2]、魏斯氏乳酸菌(Weissella)[7]、鼠李糖乳杆菌(Lactobacillus rhamnosus)[8]、开菲尔基粒乳杆菌(Lactobacillus kefiranofaciens)[9]、乳酸链球菌(Lactobacillus stretococcus)[10]等乳酸菌在生长代谢过程中可产生胞外多糖(Exopolysaccharides,EPS),产量一般在0.01~2.00 g/L[11],是一种长链、高分子质量的多糖,由重复单元和分支组成[12]。这些胞外多糖有的与细胞壁结合,称为荚膜多糖(Capsular polysaccharide,CPS);有的释放到外部环境,称为胞外多糖[13]。许多研究发现,胞外多糖具有多种生理功能,如抗氧化、抗肿瘤、降胆固醇、促肠道菌群平衡等[14],目前常被作为增稠剂、稳定剂、凝胶剂和乳化剂等应用于乳制品(如发酵乳和酸奶)的制作中,然而它们在制备低脂奶酪、无麸质面包和某些饮料方面尚处于初步阶段[15]。以EPS在发酵乳、饮料、低脂干酪、无麸质面包等方面的应用,以及EPS改善上述产品的品质、风味等方面的基本原理进行探究。
1 乳酸菌胞外多糖的分类与结构
乳酸菌产生的多糖结构呈多样性,并且可以根据不同的标准分类。Sutherland I W[16]定义EPS为细菌及微藻类在其生长代谢过程中分泌到细胞外(黏液多糖,SPS) 或黏附在细胞壁上(荚膜多糖,CPS)的多糖。从单糖的组成成分看,又可以分为同多糖(Homopolysaccharide,HoPS) 和杂多糖(Hetropolysaccharide,HePS)。其中,同多糖是由一种单糖组成的,而杂多糖则是由2种或2种以上不同单糖的重复单元组成[17]。
乳酸菌胞外多糖的分类见表1。

表1 乳酸菌胞外多糖的分类
1.1 同多糖
同多糖的基本糖单元主要有3种,即葡萄糖(葡聚糖)、果糖(果聚糖)和半乳糖(聚半乳糖);按其连接方式可以分为4种类型:α-D-葡聚糖、β-D-葡聚糖、果聚糖和半乳聚糖[18]。一般来说,同多糖的分子量为4.0×104~6.0×106Da。相比于杂多糖的合成,同多糖的生物合成相对简单,主要是以葡萄糖或果糖为原料,在糖基转移酶的催化作用下,在细胞外合成的多糖,属于单链合成机制[19]。乳酸菌同多糖中较为著名的有右旋糖酐,其主链由α-DGlcp(1→6),α-D-Glcp(1→3)连接而成,正是由于其独特的化学结构,右旋糖酐拥有独特的物理性质,能明显增加产品的黏性和稳定性,在改善产品流变学方面的特性尤其突出,并且在食品、医药等领域中有着重要的作用[20]。
1.2 杂多糖
通常情况下,HePS的主链是由D-葡萄糖、D-半乳糖、L-鼠李糖等单糖单元,经过重复连接而组成[3]。研究表明,从乳酸菌杂多糖的组成结构来看,半乳糖的含量最高,其次是葡萄糖,而鼠李糖的含量最低[21];而且少数杂多糖重复单位的主链与其支链含有N-乙酰化单糖(N-乙酰基-葡糖胺和N-乙酰基-半乳糖胺)、其他单糖(岩藻糖、核糖) 及有机和无机取代基(葡萄糖醛酸、乙酰基、甘油、磷酸等)[22-23]。在形态上,HePS是黏稠或黏液状的,分子量为1.0×104~6.0×106Da。杂多糖的生物合成机制比同多糖较为复杂,首先葡萄糖和乳糖等底物通过主动运输进入细胞内,葡萄糖和乳糖酶的催化作用下转化为葡萄糖-1-磷酸和半乳糖-1-磷酸,然后葡萄糖-1-磷酸在酶的催化下合成糖核苷酸,最后在糖基转移酶的催化作用下将糖核苷酸转移到脂载体上,在酶的催化下不断转移并连接,聚合成杂多糖,然后经过细胞膜分泌到细胞外或黏附在细胞壁上[21,24]。因此,杂多糖的生物合成可以总结为4个步骤:①糖转运进入细胞质;②糖-1-磷酸的合成;③糖核苷酸的合成和EPS重复单元的聚合;④形成杂多糖[25]。
国内巨大的市场也吸引了大量的外资企业,同时外资企业带来的国际化技术标准、管理模式和经营理念也为民营电梯企业在技术、质量、管理、服务上步入国际化行列提供了便利。根据中国电梯协会统计,2015年外资品牌约占国内54%的市场份额,国内本土电梯品牌约占有46%的市场份额,我国电梯行业呈现外资品牌与本土品牌二元竞争的市场格局。
杂多糖的生物合成见图1。
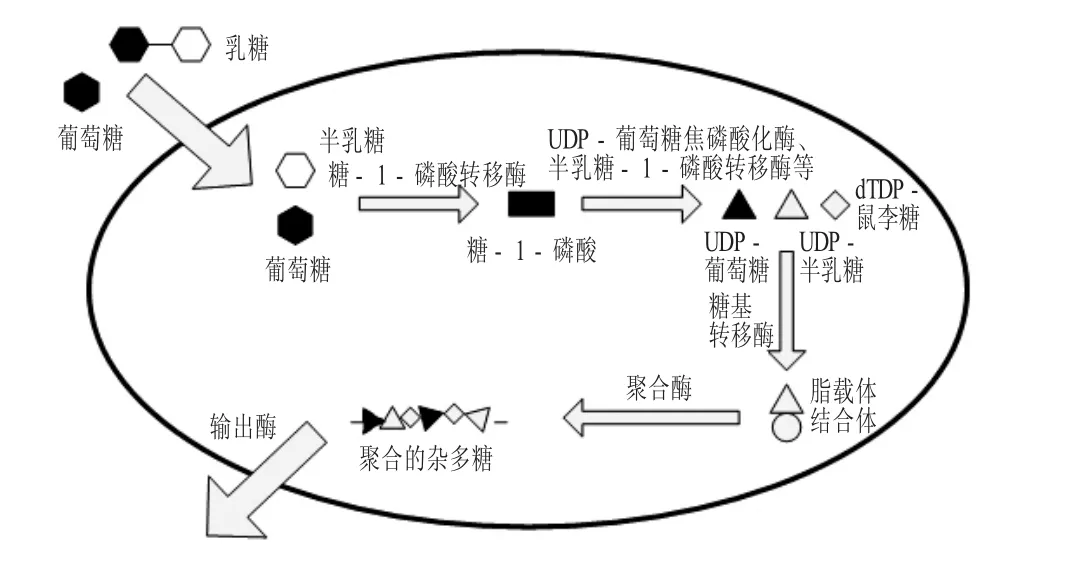
图1 杂多糖的生物合成
2 乳酸菌EPS在食品工业中的应用及其基本原理
目前,EPS被广泛应用在乳制品、发酵饮料、奶酪、发酵面包当中,其主要作用是作为凝胶剂,用于改善食品的物理化学性质(黏着性、稳定性、水结合作用)和口感风味[15]。
2.1 EPS在发酵乳和饮料中的应用
EPS常被作为天然的食品添加剂(增稠剂、发酵剂或稳定剂)直接添加到乳制品的加工过程,以提高产品的风味和感官评定;同时,它也可以在乳制品的发酵过程中添加产EPS的乳酸菌株与发酵剂,使其产生EPS。在食品发酵过程中,EPS能提高酸乳产品的黏度和组织状态,使酸乳更加细腻光滑,适用于开发像低脂发酵乳类新产品[26]。
袁世龙[6]研究发现,添加产EPS的肠膜明串球菌发酵乳的凝乳时间、酸度、黏度、持水力、胶体收缩敏感作用等都比未添加的有了较大提升。Medrano M等人[9]发现,在开菲尔酸乳(Kefir)发酵过程中会产生水溶性多糖,这些多糖主要是由有分支的葡萄糖半乳糖体组成,因此开菲尔酸乳比市面上的普通酸乳更黏稠[27]。
另外,EPS在其他饮料也有应用。Zannini E等人[7]发现Weissella MG1菌能够在添加有蔗糖的大麦麦芽汁发酵过程中产生胞外多糖和寡糖,在最优的环境下可产生多达36.4 g/L的右旋糖酐,从而改善了所得发酵物的流变特性。墨西哥国酒——龙舌兰酒(Pulque),因其独特的口感而备受人们喜爱。Torres-Rodriguez I和Escalante A等人[28-29]发现,从龙舌兰酒中提取到的 Leuconostoc kimchii和 L.mesenteroides菌种都产有胞外多糖(主要是右旋糖酐和果聚糖)。
EPS能改善发酵乳流变学特性的主要原理:EPS的结构独特、内部分子的连接方式(如右旋糖酐的主链是由 α-D-Glcp(1→6),α-D-Glcp(1→3)连接而成)决定了它黏稠的特性,添加到乳品中,EPS分散到整个环境当中,EPS分子与乳蛋白之间有一定的相互作用,一定程度打破了原有的凝胶网络结构,从而降低硬度。
2.2 EPS在奶酪中的应用
低脂干酪由于脂肪含量的降低,使其物理特性受到影响,尤其是水分的降低会导致质感、弹性等变差。EPS在一定程度上能改善和提高低脂干酪的黏度、稳定性及水合作用。
许多国外学者发现,乳酸菌EPS对于干酪的产量、增稠效果和风味等方面有明显的效果。在提高低脂干酪水分和产量方面,Costa N E等人[30-31]发现具有优良的水合性能及保水能力的胞外多糖,可以提高低脂莫兹瑞拉干酪(Mozzarella cheese)的融化性。Wang W等人[32]用产EPS的S.thermophilus TM11制作干酪过程中发现,与直接酸化的干酪相比,该菌稍微增加了水分含量,导致干酪有了更高的产量。Costa N E等人[30]发现,用乳球菌胞外多糖生产的切德干酪(Cheddar cheese) 比普通生产的高出8.2%产量(每100 kg的牛奶),高出9.5%水分含量,同时也增加了水分活度和水分吸附率。Trabcoso-Reyes N等人[33]发现,单独添加EPS可以通过增加水和脂肪含量来提高墨西哥奇瓦瓦干酪(Chihuahua cheese) 的产量。而在改善风味方面,Di Cagno R等人[34]用S.thermophilus生产低脂的Caciotta意大利奶酪,结果这种奶酪具有较好的风味和咀嚼性。Agrawal P等人[35]发现,含有EPS制作出来的切德干酪比普通不含EPS的干酪更有弹性。Hassan A N等人[36]在含有EPS的传统埃及Karish干酪中发现,EPS可以作为一种外源多糖来替代像果胶、藻酸酯、明胶等的稳定剂,同时延长乳制品在口中的停留时间,并带来更好的口感。
国内的学者也获得了同样的结果。耿建暖等人[37]用在泡菜中筛选出的4种乳酸菌进行中式干酪的生产,其中2株菌发酵酸乳产生的EPS含量高很多,相对应干酪成品的黏度更大。李丽等人[38]的双蛋白干酪制作的试验中,发现L.Lactis subsp.Cremoris QH27-1和L.Lactis subsp.Lactis XZ3303较其余4种菌株能产更多的EPS,相应的发酵牛乳在外观、气味和风味等方面的感官评价都比其他菌株的得分高。
EPS能改善奶酪的品质主要取决于HoPS中一些侧链结构,如N-乙酰化单糖(N-乙酰基-葡糖胺和N-乙酰基-半乳糖胺),能加强与乳蛋白结合的能力;EPS通过与环境中的结合水、蛋白质和胶粒等的相互作用,有效地限制乳品的脱水收缩作用,减少乳清的析出,从而能提高干酪的延伸性和保水性。
2.3 EPS在发酵面包中的应用
EPS在发酵面包的应用,主要集中在无麸质面包(Gluten-free bread) 方面。部分人群对麸质(小麦面筋蛋白)患有先天过敏症,摄入含小麦麸质的食品会破坏他们肠道的表皮细胞,诱发乳糜泻疾病[39]。但是,由于配方中缺少麸质,造成无麸质面包的持气性和起发性较差,色泽暗淡,感官品质不良。研究表明,添加水溶性胶体、乳化剂和牛乳蛋白可以改善面粉无麸质面包的焙烤特性,提高面包的品质[40]。而EPS有一定的增稠效果,可以用作水溶性胶体替代物。
许多国外学者研究发现,EPS对于无麸质面包的保质期、黏弹性、品质等方面有明显的效果。Maina N H等人[41]通过试验发现,高分子质量的右旋糖酐可以被用于酵母烘焙来生产高品质的面包。Tieking M等人[42]发现,旧金山乳杆菌(L.sanfranciscensis)合成的β-(2,6)果聚糖可以通过促进水分的吸收,减低面团的面筋含量来改善面包的纹理特性,同时延缓面包的陈化和延长货架期。Wolter A和Galle S等人[43-44]发现,Weisella菌株可以产生右旋糖酐和合成益生元而被应用于小麦和无麸质面包的生产,并且有效改善面包的质地和品质。Sandra G和Torrieri E等人[45-46]发现,乳酸菌在发酵过程中产生的胞外多糖能提高面团的黏弹性,增大面包体积,降低面包芯硬度。Ketabi A等人[47]发现,乳酸菌胞外多糖的存在能够有效地提高面包产品的比容。Corsetti A等人[48]发现,乳酸菌胞外多糖通过影响贮藏过程中体系的淀粉和蛋白质组分分布,抑制淀粉回生和延缓老化的过程。
国内也有相关研究,张思佳[49]通过对5株不同乳酸菌胞外多糖对荞麦面包品质的研究中发现,乳酸菌发酵产生的EPS能够改善酸化对面包面团带来的不利影响;同时,EPS的产生降低了面团的硬度,改善了面团流变学方面的特性,其中LFS(发酵乳杆菌Lactobacillus fermentum) 中胞外多糖高于其他乳酸菌荞麦面团,相应的其流变发酵特性较好,更接近未发酵组。
乳酸菌EPS在食品工业中的应用及功能见表2。

表2 乳酸菌EPS在食品工业中的应用及功能
3 总结
上述的大量试验与研究表明,EPS作为天然的、安全的食品添加剂和功能性食品材料投入到食品工业生产,能一定程度改善产品的理化性质和口感风味。例如,在发酵乳中添加产EPS的乳酸菌对乳制品流变学特性和风味有了很大的提升作用;在奶酪方面的应用则对其产量、增稠效果和风味等方面有明显的效果;在发酵面包方面的应用则能改善面包的焙烤特性,提高面包的品质和延长货架期。
首先,在结构上,同多糖和异多糖由于其单位(葡萄糖、果糖、半乳糖等)的连接方式,决定了独特的物理特性,能增加产品的黏度和稳定性。其次,EPS可以通过与结合水以及与其他成分(如蛋白质和胶粒)相互作用,增加酪蛋白网络的刚性结构。另外,EPS是一种物理稳定剂,能够结合水并限制脱水收缩作用[50]。此外,EPS的这些功能特性还取决于其自身的组成、结构,以及其与发酵底物成分(蛋白质和离子)的相互作用[51]。
4 展望
利用EPS提高发酵食品的品质、风味越来越引起国内外重视,EPS作为天然的食品添加剂添加到食品生产中,为取代或减少外部凝胶剂的使用提供了可能性。另外,EPS还具有降胆固醇、抗氧化、抗肿瘤、调节消化道等生理功能[15],在开发糖尿病、肠胃不良人群等的保健食品方面有较广阔的前景。但是,目前乳酸菌EPS的产量很低,一般为0.01~2.00 g/L,因此选取或诱变出高产EPS的乳酸菌,通过基因工程手段改造得出高产EPS的乳酸菌,优化培养条件、培养方法是首要解决的问题;在性能方面与其他细菌EPS,如黄原胶、结冷胶、褐藻胶等[52],比较是否有优势等也值得进一步研究。
[1]倪晓宇,王建红.乳酸菌饮料在不同贮存温度下乳酸菌和酸度的变化分析 [J].中国乳业,2014(6):51-53.
[2]Vera Pingitore E,Pessione A,Fontana C,et al.Comparative proteomic analyses for elucidating metabolic changes during EPS production under different fermentation temperatures by Lactobacillus plantarum Q823[J].International Journal of Food Microbiology,2016 (7):96-102.
[3]Zannini E,Waters D M,Coffey A,et al.Production,properties,and industrial food application of lactic acid bacteria-derived exopolysaccharides[J].Applied Microbiology and Biotechnology,2016(3):1 121-1 135.
[4]Pachekrepapol U,Lucey J A,Gong Y,et al.Characterization of the chemical structures and physical properties of exopolysaccharides produced by various Streptococcus thermophilus strains[J].Journal of Dairy Science,2017 (5):3 424-3 435.
[5]Gerard W B,Ricardo G G,Han H,et al.Structural characterization of the exopolysaccharide produced by Lactobacillus acidophilus LMG9433[J].Carbohydrate Research,1996 (19):203-218.
[6]袁世龙.豆豉中高产胞外多糖乳酸菌及其在发酵乳中发酵特性的研究 [D].南宁:广西大学,2015.
[7]Zannini E,Mauch A,Galle S,et al.Barley malt wort fermentation by exopolysaccharide-forming Weissella cibaria MG1 for the production of a novel beverage[J].J Appl Microbiol,2013 (6):1 379-1 387.
[8]Shao L,Wu Z J,Zhang H,et al.Partial characterization and immunostimulatory activity of exopolysaccharides from Lactobacillus rhamnosus KF5[J].Carbohydrate Polymers,2014 (10):51-56.
[9]Medrano M,Hamet M F,Abraham A G,et al.Kefiran protects Caco-2 cells from cytopathic effects induced by Bacillus cereus infection[J].Antonie Van Leeuwenhoek,2009 (9):505-513.
[10]Jutta C.Exocellular polysaccharides produced by lactic acid bacteria[J].FEMS Microbiology Letters,1990 (1/2):113-130.
[11]Badel S,Bernardi T,Michaud P.New perspectives for Lactobacilli exopolysaccharides[J].Biotechnology Advances,2011 (9):45-66.
[12]童良琴,曲亚军,陈敏.乳酸菌胞外多糖的研究进展 [J].中国生物工程杂志,2015,35(11):85-91.
[13]Chapot-Chartier M P,Kulakauskas S.Cell wall structure and function in lactic acid bacteria[J].Microb Cell Fact,2014 (13):1-9.
[14]Ryan P M,Ross R P,Fitzgerald G F,et al.Sugar-coated:exopolysaccharide producing lactic acid bacteria for food and human health applications[J].Food Funct, 2015 (6):679-693.
[15]Torino M I,Font De Valdez G,Mozzi F.Biopolymers from lactic acid bacteria.Novel applications in foods and beverages[J].Frontiers in Microbiology,2015 (6):253-259.
[16]Sutherland I W.Bacterial exopolysaccharides Adv[J].Microbiol,1972 (8):142-143.
[17]Hassan A N.ADSA foundation scholar award:possi-bilities and challenges of exopolysaccharide-producing lactic cultures in dairy foods[J].Journal of Dairy Science,2008 (4):1 282-1 298.
[18]Malik A,Radji M,Kralj S,et al.Screening of lactic acid bacteria from Indonesia reveals glucansucrase and fructansucrase genes in two different Weissella confusa strains from soya[J].FEMS Microbiol Lett,2009 (10):131-138.
[19]Gaizba G I,Duenas M T,Irastorza A,et al.Naturally occurring 2-substituted(1,3)-β-D-glucan producing Lactobacillus suebicus and Pediococcus parvulus strains with potential utility in the production of functional foods[J].Bioresour Technol,2010 (11):9 254-9 263.
[20]De Vuyst L,Degeest B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiol Rev,1999(3):153-177.
[21]胡盼盼,宋微,杜明,等.乳酸菌胞外多糖的研究进展 [J].粮油食品科技,2014,22(5):87-92.
[22]De Vuyst L,De Vin F,Vaningelgem F,et al.Recent development in the biodsynthesis and applications of heteropolysaccharides from lactic acid bacteria[J].Int.Dairy,2011(11):687-707.
[23]MozziF,VaningelgemF,HébertEM,etal.Diversityof heteropolysaccharide producing lactic acid bacterium strains and their biopolymers[J].Appl.Environ.Microbiol,2006 (7):4 431-4 435.
[24]Schmid J,Sieber V.Enzymatic transformations involved in the biosynthesis of microbial exopolysaccharides based on the assembly of repeat units[J].Chembiochem,2015(8):1 141-1 147.
[25]Laws A,Gu Y,Marshall V.Biosynthesis,characterisation,and design of bacterial exopolysaccharides from lactic acid bacteria[J].Biotechnology Advances,2001 (8):597-625.
[26]Prasanna P H P,Grandison A S, Charalampopoulos D.Screening human intestinal Bifidobacterium strains for growth,acidification,EPS production and viscosity potential in low-fat milk[J].International Dairy Journal,2012 (1):36-44.
[27]Hamrt,Piermaria,Abraham.Selection of EPS-producing Lactobacillus strains isolated from kefir grains and rheological characterization of the fermented milks[J].LWT-Food Science and Technology,2015(1):129-135.
[28]Torres-Rodriguez I, Rodriguez-Alegria M E, Miranda-Molina A,et al.Screening and characterization of extracellular polysaccharides produced by Leuconostoc kimchii isolated from traditional fermented pulque beverage[J].Springerplus,2014 (3):583-590.
[29]Escalante A,López Soto D R,Velázquez Gutiérrez J E,et al.Pulque,a traditional mexican alcoholic fermented beverage: historical, microbiological, and technical aspects[J].Frontiers in Microbiology,2016 (7):523-526.
[30]Costa N E,Hannon J A,Guinee T P,et al.Effect of exopolysaccharide produced by isogenic strains of Lactococcus lactis on half-fat Cheddar cheese[J].Journal of Dairy Science,2010 (8):3 469-3 486.
[31]Costa N E,O'Callaghan D J,Mateo M J,et al.Influence of an exopolysaccharide produced by a starter on milk coagulation and curd syneresis[J].International Dairy Journal,2012 (1):48-57.
[32]Wang W,Zhang L,Li Y.Production of volatile compounds in reconstituted milk reduced-fat cheese and the physicochemical properties as affected by exopolysaccharide-producing strain[J].Molecules,2012 (17):14 393-14 408.
[33]Trancoso-Reyes N,Gutiérrez-Méndez N,Sepulveda D R,et al.Assessing the yield,microstructure,and texture properties of miniature Chihuahua-type cheese manufactured with a phospholipase A1 and exopolysaccharide-producing bacteria[J].Dairy Sci,2014 (9):598-608.
[34]Di Cagno R,De Pasquale I,De Angelis M,et al.Use of microparticulated whey protein concentrate,exopolysaccharide-producing Streptococcus thermophilus,and adjunct cul-tures for making low-fat Italian Caciotta-type cheese[J].Dairy Sci,2014 (9):72-84.
[35]Agrawal P,Hassan A N.Characteristics of reduced fat Cheddar cheese made from ultrafiltered milk with an exopolysaccharide-producing culture[J].Dairy Res,2008 (5):182-188.
[36]Hassan A N,Corredig M,Frank J F,et al.Microstructure and rheology of an acid-coagulated cheese (Karish) made with an exopolysaccharide-producing Streptococcus thermophilus strain and its exopolysaccharide non-producing genetic variant[J].Dairy Res,2004 (1):116-120.
[37]耿建暖,于建军,谢爱英.中式干酪生产用菌种的筛选研究 [J].食品工业,2012,33(9):51-53.
[38]李丽,宗绪岩,张莉,等.双蛋白干酪发酵剂的筛选及发酵特性研究 [J].食品科技,2012(9):20-24.
[39]Niewinski M M.Advances in celiac disease and gluten-free diet[J].Journal of the American Dietetic Association,2008 (4):661-672.
[40]张中义,孟令艳,晁文,等.牛乳蛋白对无麸质面包焙烤特性的改善作用 [J].食品工业科技,2012(8):176-178.
[41]Maina N H,Virkki L,Pynnönen H,et al.Structural analysis of enzyme-resistant isomaltooligosaccharides reveals the elongation of α-(1→3)-linked branches in Weissella confusa dextran[J].Biomacromolecules,2011 (12):409-418.
[42]Tieking M,Gänzle M G.Exopolysaccharides from cerealassociated Lctobacilli[J].Trebds Food Sci.Technol,2005 (16):79-84.
[43]Wolter A,Hager A S,Zannini E,et al.Evaluation of exopolysaccharide producing Weissella cibaria MG1 strain for the production of sourdough from various[J].Food Microbiol,2014 (7):44-50.
[44]Galle S,Schwab C,Arendt E,et al.Exopolysaccharideforming Weissella strains as starter cultures for sorghum and wheat sourdoughs[J].Agric.Food Chem,2010(8):5 834-5 841.
[45]Sandra G,Arendt E K.Exopolysaccharides from sourdough lactic acid bacteria[J].Critical Reviews in Food Science and Nutrition,2014(7):891-901.
[46]Torrieri E,Pepe O,Ventorino V,et al.Effect of sourdough at different concentrations on quality and shelf life of bread[J].LWT-FOOD Science and Technogy,2014 (2):508-516.
[47]Ketabi A,Soleimanian-Zad S,K·M,et al.Production of microbial exopolysaccharides in the sourdough and its effects on the rheological properties of dough[J].Food Research International,2008 (10):948-951.
[48]Corsetti A,Gobbetti M,Balestrierif,et al.Sour-dough lactic acid bacteria effects on bread firmness and staling[J].Journal of Food Science,1998 (2):347-351.
[49]张思佳.酸面团乳酸菌发酵荞麦面包品质的研究 [D].无锡:江南大学,2015.
[50]杨贞耐,张雪.乳酸菌胞外多糖的流变学特性和分子结构修饰 [J].食品科学,2007(12):535-538.
[51]Duboc P,Mollet B.Applications of exopolysaccharides in the dairy industry[J].International Dairy Journal,2001 (11):759-768.
[52]徐佳,吴正钧,翁新楚,等.细菌胞外多糖及其在乳制品中的应用 [J].乳业科学与技术,2017(1):33-37.◇
Applications in Food IndustryofExopolysaccharides Produced by Lactic Acid Bacteria
PENG Jiawei,*HUANG Guidong,HUANG Weizhi,ZENG Rong,GUO Yingmei,HUANG Wenli
(Foshan Engineering Research Center for Brewing Technology,Foshan University,Foshan,Guangdong 528000,China)
Q53
A
10.16693/j.cnki.1671-9646(X).2017.09.041
1671-9646(2017) 09b-0047-06
2017-06-26
国家自然科学基金(31501476,31660459);江苏省自然科学基金(BK20150139);佛山市科技局项目(2016AB000011,2015AG10011)
彭家伟(1994— ),男,在读硕士,研究方向为微生物应用及发酵工程。
*通讯作者:黄桂东(1978— ),女,博士,特聘教授,硕士生导师,研究方向为微生物应用及发酵工程。

