荧光光谱法测定蔬菜中毒死蜱残留量
盖 轲,齐慧丽,魏晓霞,何春晓,屈双艳
(陇东学院 化学化工学院,甘肃 庆阳 745000)
荧光光谱法测定蔬菜中毒死蜱残留量
盖 轲,齐慧丽,魏晓霞,何春晓,屈双艳
(陇东学院 化学化工学院,甘肃 庆阳 745000)
在HAc-NaAc缓冲溶液中,十二烷基苯磺酸钠可使中性红荧光显著增强,当在体系中加入毒死蜱后,其荧光强度有所降低,且荧光强度降低值与毒死蜱的浓度呈良好的线性关系。据此建立了荧光光谱法测定毒死蜱的新方法,该方法操作简便、测定快速,可用于测定蔬菜中毒死蜱的残留量。
中性红;十二烷基苯磺酸钠;毒死蜱
Abstract: In HAc-NaAc buffer solution,the fluorescence intensity of neutral red may be increased by sodium dodecyl benzene sulfonate.The fluorescence intensity is decreased after adding chlorpyrifos into the system.The concentration of chlorpyrifos has good linear relationship with the decrease of fluorescence intensity.A new method is established for determining the content of chlorpyrifos by fluorescence spectrometry.This method is simple,rapid and accurate.The method could be used for determining residues of chlorpyrifos in vegetables.
Keywords: Neutral red;Dodecyl benzene sulfonic acid sodium;Chlorpyrifos
毒死蜱是乙酰胆碱酯酶抑制剂,是一种高效、广谱有机磷杀虫剂[1],毒死蜱混用相容性好,与常规农药相比毒性低,对地下害虫有特效,残毒期短[2]。随着现代农业的快速发展,农药大量使用带来了污染环境、损害人们健康等一系列问题,因此,农产品中有机磷农药残留量的快速精准分析就成了一个迫切的问题[3]。当前检测农产品中毒死蜱残留量的方法主要有气相色谱法、液相色谱法、免疫法、生物传感器法[4]等。色谱法需要对样品进行复杂的预处理,免疫法具有特异性,应用受到限制[5,6]。荧光分析法因具有选择性好、方法简单、灵敏度高,测定快速准确等诸多的优点而被广泛应用。
实验研究表明[7-9],在HAc-NaAc缓冲溶液中,阴离子型表面活性剂十二烷基苯磺酸钠(SDBS)可显著增强中性红(NR)荧光强度,加入毒死蜱后,体系荧光强度降低值与毒死蜱的浓度呈线性关系。基于此,可此建立测定毒死蜱的新方法。
1 实验部分
1.1实验仪器与试剂
F-7000型荧光光谱仪(日本日立公司),石英荧光比色皿;KH-250E型超声机(昆山禾创超声仪器有限公司),BS224S型分析天平(北京赛多利斯仪器有限公司)。
毒死蜱标准品(北京上立方联合化工技术研究院);十二烷基苯磺酸钠(天津博迪化工股份有限公司);十六烷基三甲基溴化铵(天津市福展化学试剂厂)、十二烷基磺酸钠(上海英鹏添加剂化工有限公司),β-环糊精(汕头市光华化学厂),中性红(上海抚生实业有限公司)。所用试剂均为分析纯,实验用水均为二次蒸馏水。
实验材料:菠菜、生菜、油菜(市售)。
1.2实验方法
在25mL比色管依次加入5.0×10-5mol·L-1NR溶液2.50mL、适量表面活性剂溶液、HAc-NaAc缓冲溶液(pH=4.7)和一定量的毒死蜱溶液,用蒸馏水稀释至25mL,摇匀,待充分反应后,在500V电压下,用533nm波长光激发,在波长622.2nm处测定体系荧光强度IF,并在相同条件下测其空白溶液的荧光强度IF0,计算溶液的荧光强度降低值ΔIF(ΔIF=IF0-IF)。
2 实验结果与讨论
表面活性剂的种类及用量、溶液酸度、中性红浓度等因素对体系荧光强度有显著影响。实验分别研究了表面活性剂、溶液酸度、中性红浓度对体系荧光强度的影响。
2.1荧光光谱
在HAc-NaAc缓冲溶液中(pH=4.7),当λex=533nm时,中性红溶液被激发而产生荧光,其激发光谱与荧光光谱如图1所示。在中性红溶液中加入十二烷基苯磺酸钠(SDBS)后,溶液荧光显著增强;在中性红与SDBS混合溶液中加入毒死蜱后,体系荧光强度降低,即毒死蜱对中性红-SDBS体系具有荧光猝灭作用,且体系荧光强度降低值与加入的毒死蜱的浓度呈线性关系。

(a)激发光谱 (b)荧光光谱图1 NR-SDBS-Chlorpyrifos体系荧光光谱图
2.2溶液酸度对体系ΔIF的影响
分别用1mol·L-1H2SO4、1mol·L-1NaOH、HAc-NaAc缓冲溶液(pH=4.7)调节溶液酸度后,测定其荧光强度(见表1)。由实验结果可知,中性红在碱性条件下很不稳定,极易水解,因此选择在酸性条件下进行测定。在pH值为4.7的HAc-NaAc缓冲溶液中,ΔIF最大且体系稳定。故选择HAc-NaAc缓冲溶液调节溶液pH值。
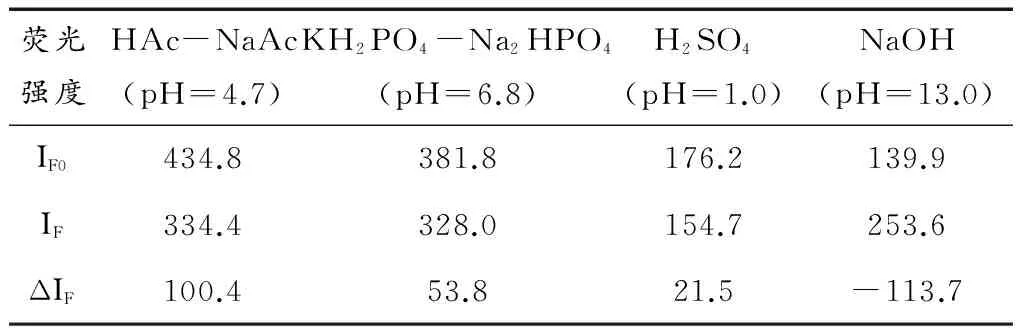
表1 缓冲溶液对ΔIF的影响
实验考察了缓冲溶液用量对体系荧光强度的影响(见图2)。当HAc-NaAc缓冲溶液用量由1.00mL增加至5.00mL时,体系ΔIF随缓冲溶液用量的增加而增大,继续增加缓冲溶液用量,ΔIF值保持不变且体系荧光强度稳定,故实验选择加入5.00mL的HAc-NaAc缓冲溶液(pH=4.7)调节溶液酸度。
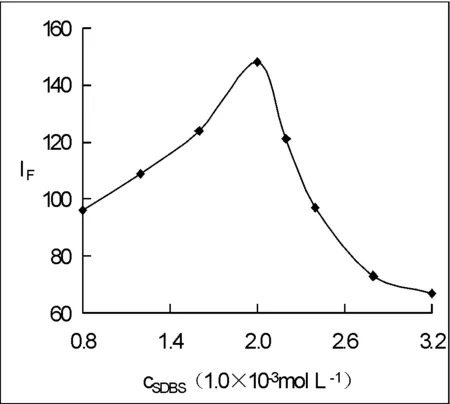
图2 HAc-NaAc缓冲溶液用量对ΔIF的影响
2.3反应体系的选择
实验以中性红为发光物质,分别加入适量十二烷基苯磺酸钠(SDBS)、十六烷基三甲基溴化铵(CTMAB)、十二烷基磺酸钠(SLS)、β-环糊精,混匀后加入等量的毒死蜱溶液,稀释至刻度,以空白溶液对照,分别测定各溶液的荧光强度差值ΔIF,实验结果见表2。实验结果表明:SDBS、CTMAB、SLS、β-环糊精对体系荧光均有增敏作用,其中SDBS增敏作用最显著,且体系荧光强度稳定,因此,后续实验选择SDBS为增敏剂。
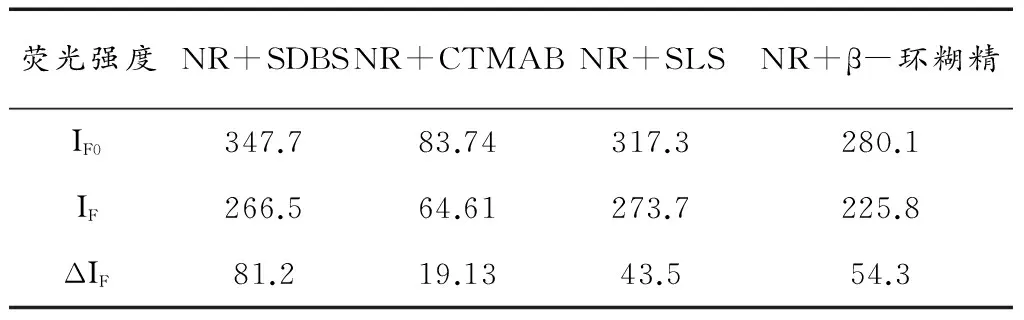
表2 表面活性剂对ΔIF的影响
2.4十二烷基苯磺酸钠浓度的选择
体系加入SDBS后ΔIF升高。实验研究了SDBS的浓度对ΔIF的影响。在比色管中依次加入5.0×10-5mol·L-1NR溶液2.50mL、一定量1.0×10-2mo·L-1SDBS溶液和480mg·L-1毒死蜱溶液7.50mL,用HAc-NaAc缓冲溶液定容至25mL,摇匀后,测定体系ΔIF,实验结果见图3。
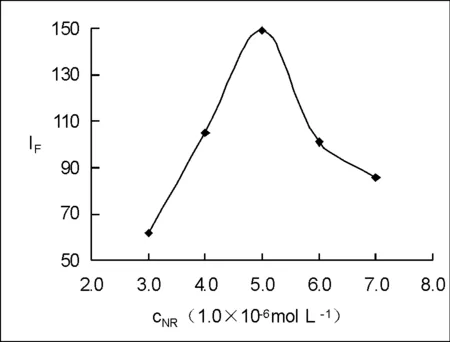
图3 SDBS浓度对ΔIF的影响
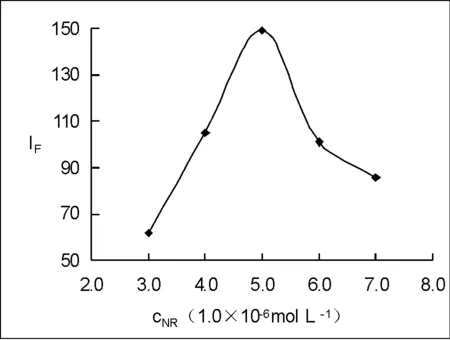
图4 中性红浓度对ΔIF的影响
图3表明,当体系中SDBS的浓度由8×10-4mol·L-1增大至2×10-3mol·L-1时,ΔIF逐渐增大,当SDBS浓度为2×10-3mol·L-1时,体系ΔIF达最大值,继续增大SDBS浓度,体系ΔIF反而减小。故实验选择SDBS的最佳浓度为2×10-3mol·L-1。
2.5中性红浓度的选择
在25mL比色管中分别加入一定体积NR溶液、1.0×10-2mol·L-1SDBS溶液5.00mL和7.50mL毒死蜱储备液(浓度为480mg·L-1),用HAc-NaAc缓冲溶液定容,摇匀,测定ΔF,实验结果如图4所示。
由实验结果可知,中性红浓度在3×10-6mol·L-1~5×10-6mol·L-1范围内,体系ΔIF随NR浓度而增大;当NR浓度为5×10-6mol·L-1时,ΔIF达最大值;继续增大NR浓度,体系ΔIF降低。故实验中选择中性红浓度为5×10-6mol·L-1。
2.6共存物质的影响
在优化的实验条件下,实验考察了共存物质对测定结果的影响。当毒死蜱标准溶液浓度为96mg·L-1,相对误差≤±5%时,1000倍的Ca2+、Mg2+、Na+、K+、SO42-、Cl-,500倍的Fe3+、Cr3+、Zn2+、Cu2+、抗坏血酸,400倍的Mn2+、Fe2+、NO3-、PO43-、柠檬酸、葡萄糖、尿素均不产生干扰;20倍的Pb2+对测定不产生干扰,高于允许量的Pb2+可加入Na2S生成沉淀而消除其干扰。
2.7标准曲线
在优化的实验条件下,以空白溶液对照,分别测定不同浓度的毒死蜱标准溶液的荧光强度,以ΔIF为纵坐标,毒死蜱浓度为横坐标,绘制标准曲线(图5)。
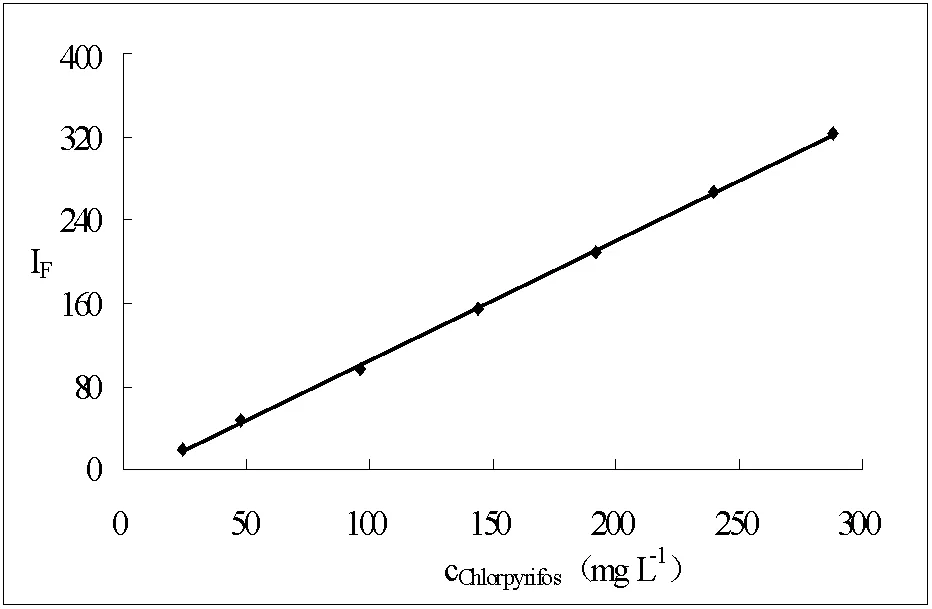
图5 荧光光谱法测定毒死蜱标准曲线
毒死蜱浓度在24~288mg·L-1范围内与ΔIF呈良好的线性关系,线性回归方程为:ΔIF=1.1533c-10.748(c单位为mg·L-1),线性相关系数为r=0.9998(n=3)。对浓度为96mg·L-1的毒死蜱标准溶液进行11次平行测定,相对标准偏差为1.6%。方法的检出限为7.8mg·L-1。
3 样品测定
准确称取蔬菜样品(菠菜、生菜、油菜)10.0g,切碎后置于100mL锥形瓶中,加入50mL蒸馏水,超声清洗5min,用上述方法测定各样品的荧光强度,空白对照,测定各样品溶液的ΔIF值,代入线性相关方程计算各样品中毒死蜱的残留量,并与标准方法[10-12]测定结果对照,实验结果见表3。
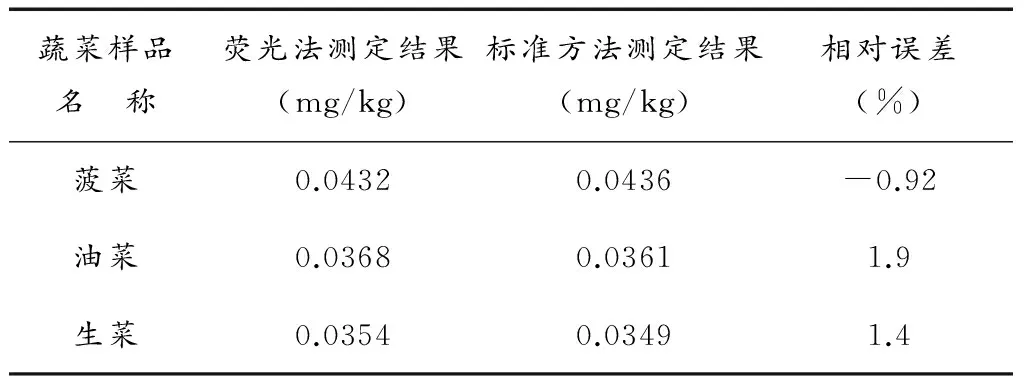
表3 样品测定结果(n=3)
4 结论
在pH=4.7的HAc-NaAc缓冲溶液中,毒死蜱可使中性红-十二烷基苯磺酸钠体系荧光猝灭,且毒死蜱的浓度在24~288mg·L-1范围内与体系荧光强度降低值呈良好的线性关系。该方法测定快速,操作简便,准确度高,可用于蔬菜中毒死蜱残留量的快速测定。
[1]李志伟,梁丹,张建夫.有机磷类农药残留分析方法的研究进展[J].华中农业大学学报,2008,27(5):691-695.
[2]罗建波,黄伟雄.用微波萃取气相色谱测定果蔬中的农药残留量研究[J].中国公共卫生,2002,18(3):336-337.
[3]郭永泽,张玉婷,刘凤米.农药残留分析技术及发展[J].天津农业科学,2002,12(8):22-25.
[4]李本昌.农药残留量实用检测方法手册[M].北京:化学工业出版社,2001:507-510.
[5]E Wilkins,M Carter,J Voss,et al.A quantitative determination of organophosphate pesticides in orginic solvents[J].Electrochemistry Communications,2000(2):768-790.
[6]史长生.农药残留危害以及检测技术的分析[J].食品研究与开发,2016,31(9):218-221.
[7]KS Lee,HJ Kim,GH Kim,I Shin,JI Hong.Fluorescent chemodosimeter for selective detection of cyanide in water[J].Organic Letters,2008,10(1):49-51.
[8]叶忠英.现代农药应用技术全书[M].北京:中国农业出版社,2002:212-221.
[9]Wang JN,Zhang C,Wang HX,et al.Development of a luminol-based chemiluminescence flow-injection method for the determination of dichlorvos pesticide.Talanta,2001,54(6):1185-1193.
[10]刘长江,门万杰,刘彦军,等.农药对土壤的污染及污染土壤的生物修复[J].农业系统科学与综合研究,2002,18(4):295-297.
[11]姚家彪,赵颖,潘伟,等.蔬菜和食用菌中有机磷类农药残留检测技术[J].应用化学,2015,27(4):488-493.
[12]国家质量监督检验检疫总局.SN/T 2158-2008进出口食品中毒死蜱残留量检测方法[S].北京:中国标准出版社,2008:2-22.
【责任编辑赵建萍】
DeterminationofChlorpyrifosResiduesinVegetablesbyFluorescenceSpectrometry
GAI Ke,QI Hui-li,WEI Xiao-xia,HE Chun-xiao,QU Shuang-yan
(CollegeofChemistryandChemicalEngineering,LongdongUniversity,Qingyang745000,Gansu)
O657.3
A
1674-1730(2017)05-0049-04
2017-06-27
2016年甘肃省中小企业创新基金项目《快速测定农产品中农药残留的生物传感器的开发研究及应用》(1604JCCM126)
盖 轲(1968—),男,甘肃庆阳人,教授,硕士,主要从事光谱分析研究。

