绿豆皮可溶性膳食纤维提取工艺优化及其物理特性研究
罗 磊 王雅琪 马丽苹 朱文学 张 宽 姬青华 马永哲
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 河南省食品原料工程技术研究中心,河南 洛阳 471023)
绿豆皮可溶性膳食纤维提取工艺优化及其物理特性研究
罗 磊1,2王雅琪1,2马丽苹1,2朱文学1,2张 宽1,2姬青华1,2马永哲1,2
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 河南省食品原料工程技术研究中心,河南 洛阳 471023)
以绿豆皮为原料,采用超微粉碎技术辅助酶法提取可溶性膳食纤维,通过二次通用旋转组合设计对提取条件进行优化,并对其性质进行研究。结果表明,超微粉碎可显著提高绿豆皮可溶性膳食纤维的得率,当物料粒径为25~38 μm时,酶法提取绿豆皮可溶性膳食纤维的最佳工艺为:液料比33∶1 (mL/g),酶解温度60 ℃,酶底比190 U/g,酶解时间2 h。该条件下可溶性膳食纤维的得率达14.02%,持水力389%,持油力142%,膨胀力2.67 mL/g,对胆酸钠的吸附率为30.29%。
绿豆皮;可溶性膳食纤维;提取;物理特性
Abstract: Superfine grinding-assisted enzymatic extraction of soluble dietary fiber fromPhaseolusRadiatushull were studied, and the extraction conditions were optimized by two general rotary combination design. Then the properties were studied. The results showed that the superfine grinding could significantly improve the extraction rate of soluble dietary fiber of Phaseolus radiatus hull, when the particle size was 25~38 μm, and the enzymatic extraction of soluble dietary fiber were: ratio of solvent-to-solid 33∶1 (mL/g), enzyme solution temperature, 60 ℃, ratio of enzyme-substrate 190 U/g, the enzymolysis time 2 h. Under this conditions, the yield of soluble dietary fiber reached 14.02%, the water holding capacity was 389%, the oil holding capacity was 142%, the expansion force was 2.67 mL/g, and the adsorption rate of sodium cholate was 30.29%.
Keywords:phaseolusRadiatushull; soluble dietary fiber; extract-ion; physical characteristics
绿豆皮是绿豆芽加工过程中的副产物,富含多种生物活性物质,但目前大多被作为废渣或饲料而未被充分利用,造成了严重的环境污染及资源浪费。有研究[1]表明,绿豆皮中膳食纤维含量高达65.85%。随着营养学的深入发展以及人们对健康饮食的追求,膳食纤维作为“第七类营养素”得到学术界和普通百姓的广泛关注。膳食纤维可分为可溶性膳食纤维(Soluble Dietary Fiber,SDF)和不可溶性膳食纤维(Insoluble Dietary Fiber,IDF)两大类。据报道[2],可溶性膳食纤维具有降低血脂与胆固醇,预防心血管疾病;降低血糖,减少糖尿病发生;预防肿瘤发生及其进展等多种生理功能。近年来,国内外制备可溶性膳食纤维的原料有:米糠、芦笋、椪柑渣、癞葡萄渣、梨渣[3-7]等。但以绿豆皮为原料制备可溶性膳食纤维鲜有报道。
绿豆皮结构致密、韧性和硬度较强,不利于其SDF的提取。超微粉碎技术能使粉体颗粒微细化,比表面积和孔隙率增加[8],可有效地促进原料中SDF的溶出。利用酶法降解细胞壁,能够减少提取时的阻力,从而提高效率并缩短时间,同时酶法具有条件温和、操作简单、产品纯度高等优点[9]。因此本研究拟利用超微粉碎技术辅助酶法提取绿豆皮中的SDF,并对SDF的性质进行研究,为绿豆皮SDF开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
绿豆皮:洛阳新农村豆芽厂;
纤维素酶(5万U/g)、α-淀粉酶(4万U/g)、木瓜蛋白酶(1万U/g):江苏瑞阳生物科技有限公司;
胆酸钠:分析纯,上海蓝季生物科技发展有限公司;
1,1-二苯基-2-三硝基苯肼(DPPH):分析纯,上海伊卡生物技术有限公司;
醋酸、醋酸钠、无水乙醇、浓硫酸、糠醛、抗坏血酸(VC)、三乙酸、氯化铁、硫酸亚铁、铁氰化钾、磷酸二氢钠、磷酸氢二钠、过氧化氢、水杨酸等:均为分析纯。
1.2 仪器与设备
高速多功能粉碎机:HC-1000Y2型,永康市天祺盛世工贸有限公司;
超微粉碎机:HMB-701型,北京环亚天元机械技术有限公司;
台式低速离心机:TDZ5-WS型,湖南湘仪实验室仪器开发有限公司;
循环水式多用真空泵:SHB-Ⅲ型,郑州长城科工贸有限公司;
旋转蒸发器:RE-52A型,上海亚荣生化仪器厂;
紫外可见分光光度计:UV2400型,上海舜宇恒平科学仪器有限公司;
双功能水浴恒温振荡器:SHA-B型,北京科伟永兴仪器有限公司;
恒温水浴锅:HH-S型,江苏金坛市亿通电子有限公司;
电子分析天平:FA1004型,上海上平仪器公司;
pH计:PHS-3C型,上海越平科学仪器有限公司;
电热恒温鼓风干燥箱:101-2-BS型,上海跃进医疗器械厂。
1.3 方法
1.3.1 绿豆皮样品的制备 绿豆皮经蒸馏水反复清洗、除杂后,在室温下干燥至恒重,后经高速粉碎机粉碎后过50目筛,得到绿豆皮粗粉。向绿豆皮粗粉中加入20 U/g的α-淀粉酶,置于65 ℃水浴恒温振荡器中振荡1 h,沸水浴灭酶10 min后,冷却,加入10 U/g的木瓜蛋白酶,置于45 ℃水浴恒温振荡器中振荡2 h[10],沸水浴灭酶10 min后,过滤、烘干至恒重,得到绿豆皮粉样品。
1.3.2 可溶性膳食纤维的提取 称取一定质量的样品置于100 mL离心管中(每组3个平行试验),将纤维素酶用醋酸—醋酸钠缓冲溶液溶解后,加入离心管中与绿豆皮样品充分混合,振荡,恒温水浴提取一段时间后,沸水浴加热10 min,灭酶,冷却后,于4 000 r/min离心15 min,过滤弃去残渣,取上清液,用旋转蒸发器将上清液浓缩至一定体积,浓缩液用4倍体积的无水乙醇沉淀2 h,然后离心(3 600 r/min,10 min),取沉淀。收集到的固体物质放在40 ℃电热鼓风干燥箱中干燥,称重,即得到绿豆皮SDF,按式(1)计算SDF的得率。

(1)
式中:
c——SDF得率,%;
m1——提取的可溶性膳食纤维质量,g;
m2——样品质量,g。
1.3.3 超微粉碎对绿豆皮可溶性膳食纤维提取率的影响
取一定量的绿豆皮样品放入超微粉碎机(1.5 kW)中粉碎,得到绿豆皮超微粉,将所得粉末分别过50,100,200,300,400,500目的筛网,得到不同粒径的超微粉,按1.3.2中方法进行可溶性膳食纤维的提取,探究超微粉粒度大小对提取率的影响,得到最佳粉末粒度,并在此试验基础上,对酶法提取绿豆皮SDF的工艺进行进一步优化。
1.3.4 单因素试验
(1) 液料比对SDF得率的影响:固定反应条件为酶底比200 U/g、酶解时间2 h、酶解温度55 ℃,考察不同的液料比[10∶1,15∶1,20∶1,25∶1,30∶1,35∶1 (mL/g)]对绿豆皮SDF得率的影响。
(2) 酶底比对SDF得率的影响:固定反应条件为液料比30∶1 (mL/g)、酶解时间2 h、酶解温度55 ℃,考察不同的酶底比(100,150,200,250,300,350 U/g)对绿豆皮SDF得率的影响。
(3) 酶解时间对SDF得率的影响:固定反应条件为液料比30∶1 (mL/g)、酶底比200 U/g、酶解温度55 ℃,考察不同的酶解时间(1.0、,1.5,2.0,2.5,3.0,3.5 h)对绿豆皮SDF得率的影响。
(4) 酶解温度对SDF得率的影响:固定反应条件为液料比30∶1 (mL/g)、酶解时间2 h、酶底比200 U/g,考察不同酶解温度(40,45,50,55,60,65 ℃)对绿豆皮SDF得率的影响。
1.3.5 响应面优化试验 根据1.3.4的结果,选取对绿豆皮得率影响相对较大的因素,以绿豆皮SDF得率为响应值,采用Design-Expert 8.0.5软件对所得数据进行处理并分析,得出提取绿豆皮SDF的最佳工艺条件。
1.3.6 绿豆皮SDF持水力的测定 参考郑慧等[11]的方法,并做一定的调整,准确称取质量为m1的绿豆皮SDF粉末放入离心管中,加入50 mL蒸馏水,在室温下搅拌24 h,在3 000 r/min的条件下离心15 min,弃去上清液,用滤纸吸干离心管内壁残留水分,称其质量为m3。按式(2)计算SDF的持水力。

(2)
式中:
c——持水力,%;
m1——绿豆皮SDF粉末质量,g;
m2——离心管质量,g;
m3——SDF粉末与离心管总质量,g。
1.3.7 绿豆皮SDF膨胀力的测定 参考谢怡斐等[12]的方法,并做一定的调整,准确称取质量为m1的绿豆皮SDF粉末置于经干燥的10 mL量筒中,记录其原始体积V1;然后向量筒中加蒸馏水至刻度,搅拌均匀,室温放置过夜后测定其吸水后体积V2,按式(3)计算SDF的膨胀力。

(3)
式中:
c——膨胀力,mL/g;
V1——原始体积,mL;
V2——吸水后体积,mL。
1.3.8 绿豆皮SDF持油力的测定 参考Wang等[13]的方法,并做一定的调整,准确称取质量为m1的绿豆皮SDF粉末放入离心管中,加入10 mL植物油,浸泡1 h,每隔10 min搅拌一次,然后在3 000 r/min的条件下离心15 min,弃去上清液,用滤纸吸干内壁多余油脂,静置5 min后,称量剩余残渣的重量记为m2,按式(4)计算SDF的持油力。

(4)
式中:
c——持油力,%;
m1——绿豆皮SDF粉末质量,g;
m2——剩余残渣的质量,g。
1.3.9 绿豆皮SDF对胆酸盐的体外吸附试验
(1) 胆酸钠含量的测定:采用糠醛比色法。精确称取胆酸钠0.100 0 g,加蒸馏水溶解到50 mL容量瓶中,并定容至刻度(2 mg/mL);准确吸取0.0,1.0,2.0,3.0,4.0,5.0,6.0 mL至10 mL容量瓶中定容。
精确移取各个不同浓度的标准溶液1 mL于具塞试管中,加入45%的硫酸6 mL,再加入0.3%的糠醛溶液1 mL,振荡混匀,置于65 ℃恒温水浴锅中反应30 min,冷却至室温后,以样1为参比,于620 nm处测定吸光值[14]。
(2) 绿豆皮SDF对胆酸盐的体外吸附:向250 mL锥形瓶中加入含0.2 g胆酸钠的0.15 mol/L NaCl溶液100 mL,调节pH至7,加入1.0 g SDF,搅拌均匀使之充分溶解,在37 ℃恒温水浴锅中保温,放入水浴锅时移取1 mL反应液用糠醛比色法在620 nm下测定其吸光度值,每隔15 min从其中移取1.0 mL溶液测定吸光度值并绘制时间—吸光度图[15]。
2 结果与分析
2.1 超微粉粒度对SDF得率的影响
由图1可知,随着筛网目数的增大,绿豆皮SDF的得率逐渐提高,在50~400目(粉末粒径270~25 μm)时,这种变化尤为明显。当筛子目数达到400目时(此时样品通过400目筛而未通过500目筛,粒径为25~38 μm),得率达到13.33%,可能是粉体颗粒微细化,比表面积增大,与溶剂的接触面积增大[16],促进了SDF的溶出;同时强作用力使得绿豆皮的细胞破碎的更彻底,绿豆皮的细胞壁得到进一步降解,其亲水性增强,SDF可直接溶于溶剂中,而不必通过细胞膜进行缓慢扩散[17]。当筛网为500目时(样品通过500目筛,粒径小于25 μm),得率为13.36%,较400目变化较小,且过细的颗粒可能会影响提取效果,因此选择通过400目而未通过500目筛(粒径为25~38 μm)的样品进行纤维素酶酶解研究。

图1 超微粉粒度对SDF得率的影响
2.2 单因素试验结果
2.2.1 液料比对SDF提取率的影响 由图2可知,在液料比小于30∶1 (mL/g)时,随着液料比升高,绿豆皮SDF得率增加。可能是液料比越大,原料与溶剂的接触更充分,有助于SDF的溶出;提取液中SDF质量浓度越低,传质推动动力越大,提取速率增大[18]。当超过30∶1 (mL/g)时,随着液料比继续增大,SDF的得率变化趋于平缓,同时过高的液料比会造成原料的浪费和醇析时乙醇的大量消耗,给后处理工序增加困难,所以,在保证高得率的前提下,尽量减少溶剂用量,降低蒸发浓缩负荷,因此选择适宜液料比为30∶1 (mL/g)。
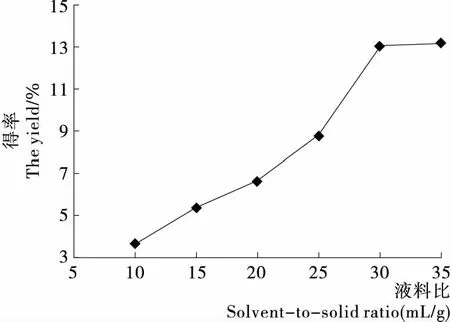
图2 液料比对SDF得率的影响
2.2.2 酶解时间对SDF得率的影响 由图3可知,酶解时间在1~2 h时,SDF的得率随时间的推移而不断增加,在2 h时达到最大(13.11%),在2 h后得率降低,可能是SDF在酶作用下充分水解使得率增大,随着反应时间的增加,酶的作用有限,提取量达到饱和,同时时间越长SDF中包含的果胶物质以及部分半纤维素越易发生降解[19],因此选择适宜的酶解时间为2 h。
2.2.3 酶底比对SDF得率的影响 由图4可知,在酶底比<200 U/g时,随着纤维素酶添加量的增加,SDF的得率逐渐增大,当酶底比>200 U/g时,得率降低。可能是在适量纤维素酶的作用下,SDF不断溶出,同时部分不溶性膳食纤维发生降解,分子链断裂,分子量降低,溶解度发生变化转变为SDF;随着纤维素酶的继续添加,不溶性膳食纤维会降解为较低分子量的多糖或低聚糖,它们因分子量小而不能被乙醇沉淀下来[20],使得率降低。因此选择酶底比为200 U/g。

图3 酶解时间对SDF得率的影响
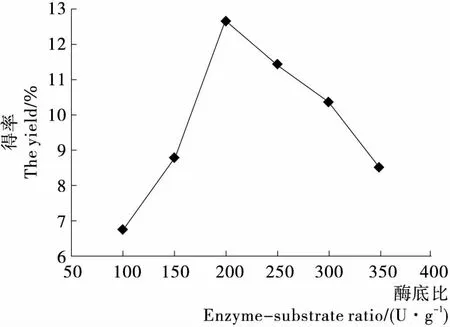
图4 酶底比对SDF得率的影响
2.2.4 酶解温度对SDF得率的影响 由图5可知,随着温度升高,SDF得率逐渐先上升后下降,在55 ℃达到最大值。可能是当温度低于55 ℃时,纤维素酶的活性被抑制不能得到充分发挥,SDF不能完全水解;而温度过高造成酶的活性降低,原料提取液随着温度升高黏度增大,从而导致绿豆皮SDF得率降低。因此纤维素酶的最适宜温度为55 ℃,选择酶解温度为55 ℃。
2.2.5 响应面优化试验结果
(1) 因素水平编码表的确定:根据单因素结果,固定酶解时间为2 h,选取对绿豆皮得率影响相对较大的因素:液料比、酶解温度、酶底比进行三因素五水平的二次通用旋转组合试验设计,见表1。

图5 酶解温度对SDF得率的影响
(2) 模型的建立:二次通用旋转组合设计试验结果见表2。
表1三元二次通用旋转组合设计试验因素水平表
Table 1 Factors and levels of three-factor second order rotation combination experimental design

编码X1液料比(mL/g)X2酶解温度/℃X3酶底比/(U·g-1)-1.68226.6446.59149.55-128.0050.00170.00030.0055.00200.00132.0060.00230.001.68233.3663.41250.45△j2530

表2 三元二次通用旋转组合设计试验结果
采用Design-Expert 8.05软件进行数据分析。对表2试验结果进行多元回归拟合,得SDF得率对液料比(X1)、酶解温度(X2)、酶底比(X3)的二次多项式回归模型:

(5)
对回归模型进行方差分析和系数显著性检验,结果见表3。由表3可知,模型显著性极高(P<0.000 1),R2=0.959 0,说明该模型与实际数据相关性较好;失拟性检验不显著(P>0.05),说明回归方程的拟合性好。因此该模型可用来对酶法提取绿豆皮SDF进行分析和预测。
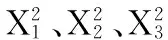

(6)
表3三元二次通用旋转组合试验结果方差分析表
Table 3 Analysis of variance for the regression model developed for extraction yield of polysaccharides

变异来源平方和自由度均方比值FP值X129.6645129.664581.06860<0.0001X210.1422110.142227.717080.0003X39.264319.264325.317860.0004X214.827014.827013.191340.0037X228.350418.350422.820420.0006X2312.6026112.602634.441010.0001X1X20.279510.27950.763710.3863X1X31.688511.68854.614380.0501X2X36.914416.914418.896100.0011回归85.664399.518326.01200<0.0001剩余3.6592100.3659失拟1.693050.33860.861000.5632误差1.966150.3932总和89.323519
(3) 模型双因素交互作用分析:将回归方程中的任意1个因素固定在零水平,对其余2个因素经Design-Expert 8.05软件分析,考察其余2个因素的交互作用,得到交互因素的响应面和等高线图,结果见图6。
由图6可知,响应面坡度都比较陡峭,说明酶解温度(X2)和酶底比对SDF得率均有较大的影响。响应曲面的等高线图呈椭圆形,表明二者交互作用非常显著,与表4的显著性分析结果一致。X2X3交互作用显著的原因可能是酶解温度的变化影响酶的活性、酶底比的变化影响SDF的溶出及IDF转变为SDF,两者相互作用改变绿豆皮SDF的得率。
(4) 验证实验:以绿豆皮SDF得率为指标,经二次通用旋转组合设计优化得到的最佳提取工艺条件:液料比33.28∶1 (mL/g),酶解温度60.35 ℃,酶底比为185.18 U/g。为验证回归模型的可靠性,响应面法优化提取工艺的可行性,在模型所得最优工艺条件下进行验证。在实际操作中,采用液料比33∶1 (mL/g),酶解温度60 ℃,酶底比190 U/g,进行3次重复验证实验,测得绿豆皮SDF得率均值为14.02%,与理论预测值14.08%偏差较小,重复性好,没有显著差异,说明得到的模型参数准确可靠。

图6 液料比(X2)与酶底比(X3)的交互作用图
Figure 6 The interplay of extraction temperature value and solvent-to-solid ratio on yield of SDF fromPhaseolusRadiatushull
2.3 持水力、持油力和膨胀力测定结果
由表4可知,绿豆皮SDF的持水力为389%,膨胀力为2.67 mL/g,持油力为142%。李梦琴等[21]通过超高压处理小麦麸皮制备SDF,测得SDF的持水力、膨胀力分别为308%和1.49 mL/g;苗敬芝等[22]以花生粕为原料提取SDF,其持水力为351%,溶胀力为2.37 mL/g;鞠健等[23]提取的山药皮可溶性膳食纤维的持油性1.30 g/g,说明本试验所得绿豆皮SDF具有很好的持水力、持油力和膨胀力。持水力、持油力和膨胀力高的SDF,能使人产生饱腹感,降低食欲,进而控制肥胖,并能够刺激肠道蠕动,使粪便中的有害物质能及时排出体外,大大减少患肠道癌、痔疮等疾病的风险。因此,绿豆皮SDF是一种优良膳食纤维源,可以作为添加剂应用于食品加工中。
2.4 胆酸盐体外吸附试验结果
由图7可知,随着时间的延长,SDF溶液中胆酸钠的浓度不断变小,尤其在前30 min内变化比较显著,然后趋于平缓最终趋向一个定值,可能是溶液中SDF的含量是有限的,其对胆酸钠的吸附量也是有限的,因此SDF的吸附量会随着时间的推移逐渐饱和,在反应120 min时测得的胆酸钠浓度为2.61 mg/mL,清除量为1.12 mg/mL,SDF对胆酸钠的吸附率达到了30.29%。徐苗均等[24]测得小麦麸皮SDF对胆酸钠的吸附率为17%;B.Drzikova等[25]以燕麦麸为原料,研究其膳食纤维各组分与胆酸盐的结合作用,结果得到的结合率最高为40%。胆酸盐是胆固醇分解后的产物,通过吸附胆酸盐并将其排出体外可有效降低胆酸盐在肝肠循环过程中的积累,从而促进胆固醇的代谢,使血清胆固醇下降,因此绿豆皮SDF具有一定的降血脂功能。

表4 SDF持水力、持油力和膨胀力测定结果
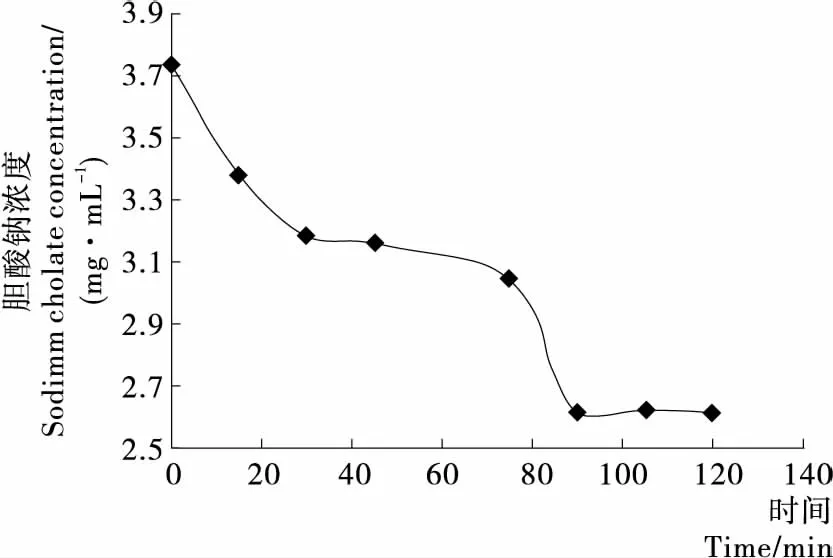
图7 胆酸钠溶液吸光度值随时间变化图
3 结论
本试验采用超微粉碎辅助纤维素酶法提取绿豆皮SDF,显著提高了绿豆皮SDF得率。所得SDF成品呈黄白色粉末状,水溶性较好,具有良好的膨胀力、持水力和持油力,能使人产生饱腹感,促进粪便中有害物质排出体外,从而降低患肠道癌、痔疮等疾病的风险;对胆酸钠有较强的吸附能力,具有一定的降血脂功能。
在后期的研究中将对制备的绿豆皮SDF进行分离纯化,并对其生理功能进行全面深入的探究,为绿豆皮资源的有效利用以及绿豆皮SDF的应用提供进一步的理论依据。
[1] 邓志汇, 王娟. 绿豆皮与绿豆仁的营养成分分析及对比[J]. 现代食品科技, 2010(6): 656-659.
[2] 刘博, 曾琳娜, 林亲录, 等. 可溶性膳食纤维生理功能研究进展[J]. 粮食与油脂, 2013(9): 42-45.
[3] 许晖. 用挤压法提高米糠中可溶性膳食纤维含量的研究[J]. 食品与机械, 1999(6): 19-20.
[4] 刘秀凤, 常学东, 蔡金星, 等. 芦笋老茎中可溶性膳食纤维提取工艺优化[J]. 食品与机械, 2009, 25(6): 96-98, 180.
[5] 王磊, 袁芳, 向俊, 等. 响应面法优化高压均质提取椪柑渣中可溶性膳食纤维及抗氧化活性研究[J]. 中国食品学报, 2015, 15(5): 82-89.
[6] 屈浩亮, 顾小红, 汤坚, 等. 癞葡萄渣可溶性膳食纤维提取工艺的研究及其单糖组分分析[J]. 食品与机械, 2008, 24(4): 73-78.
[7] 李梁, 聂成玲, 薛蓓, 等. 响应面法优化酶辅助提取苹果梨渣中可溶性膳食纤维工艺及品质分析[J]. 中国食品添加剂, 2016(12): 156-163.
[8] 王跃, 李梦琴. 超微粉碎对小麦麸皮物理性质的影响[J]. 现代食品科技, 2011, 27(3): 271-274.
[9] 陈小举, 吴学凤, 姜绍通, 等. 响应面法优化半纤维素酶提取梨渣中可溶性膳食纤维工艺[J]. 食品科学, 2015(6): 18-23.
[10] 郦金龙, 滕超, 查沛娜, 等. 酶水解制备玉米芯喷爆渣可溶性膳食纤维[J]. 中国食品学报, 2016(6): 105-111.
[11] 郑慧, 陈希平, 尤祯丹, 等. 蜂花粉可溶性膳食纤维酶法提取工艺优化及其理化分析[J]. 食品与机械, 2016, 32(12): 184-188.
[12] 谢怡斐, 田少君, 马燕, 等. 超微粉碎对豆渣功能性质的影响[J]. 食品与机械, 2014, 30(2): 7-11.
[13] WANG Lei, XU Hong-gao, YUAN Fang, et al. Preparation and physicochemical properties of soluble dietary fiber from orange peel assisted by steam explosion and dilute acid soaking[J]. Food Chemistry, 2015, 185(11): 90-98.
[14] 张建民. 车前草可溶性膳食纤维的制备及其活性研究[D]. 南昌: 南昌大学, 2007: 69-71.
[15] 周小理, 黄琳, 周一鸣. 苦荞水溶性蛋白体外吸附胆酸盐能力的研究[J]. 食品科学, 2011, 32(23): 77-81.
[16] 于滨, 和法涛, 葛邦国, 等. 超微粉碎对苦瓜渣理化性质与体外降糖活性的影响[J]. 农业机械学报, 2014(2): 233-238.
[17] 张相伦, 吴大伟, 陆鹏, 等. 普通和超微粉碎对银杏叶黄酮和萜内酯释放规律的影响研究[J]. 粮食与饲料工业, 2014(6): 45-47, 52.
[18] 齐军茹, 杨晓泉, 廖劲松, 等. 可溶性大豆多糖的提取对功能性的影响研究[J]. 中国食品添加剂, 2010(4): 165-168.
[19] 张荣, 任清, 罗宇. 小米可溶性膳食纤维提取及其理化性质分析[J]. 食品科学, 2014, 35(2): 69-74.
[20] 赵梅. 枣渣膳食纤维酶法改性工艺及相关性质研究[D]. 无锡: 江南大学, 2014: 24-25.
[21] 李梦琴, 王跃, 徐艳艳, 等. 小麦麸皮超高压处理条件优化及SEM表征[J]. 中国粮油学报, 2011, 26(9): 14-19.
[22] 苗敬芝, 赵永珍, 董玉玮, 等. 花生粕中可溶性膳食纤维功能性研究[J]. 农业机械, 2011(8): 153-155.
[23] 鞠健, 廖李, 乔宇, 等. 山药皮可溶性膳食纤维的提取及物化特性分析和应用[J]. 食品科技, 2016(9): 216-220.
[24] 徐苗均. 小麦麸皮可溶性膳食纤维的制备及其性质研究[D]. 合肥: 合肥工业大学, 2012: 49-51.
[25] DRZIKOVA B, DONGOWSKI G, GEBHARDT E. The composition of dietary fibre-rich extrudates from oat affects bile acid binding and fermentation in vitro[J]. Food Chemistry, 2005, 90(1/2): 181-192.
Study and optimization on extraction process and physical characteristics of soluble dietary fiber from Phaseolus radiatus Hull
LUO Lei1,2WANGYa-qi1,2MALi-ping1,2ZHUWen-xue1,2ZHANGKuan1,2JIQing-hua1,2MAYong-zhe1,2
(1.CollegeofFood&Bioengineering,HenanUniversityofScienceandTechnology,Luoyang,Henan471023,China; 2.FoodMaterialsEngineeringTechnologyResearchCenterofHenanProvince,Luoyang,Henan471023,China)
10.13652/j.issn.1003-5788.2017.08.032
罗磊,男,河南科技大学教授,博士。
朱文学(1967—),男,河南科技大学教授,博士。 E-mail:zwx@haust.edu.cn
2017—05—14

