刺参肠内源酶对体壁胶原蛋白的降解作用
齐 申, 吴 海 涛,2, 王 成 成, 唐 越,2, 孙 娜,2, 于 翠 平,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
刺参肠内源酶对体壁胶原蛋白的降解作用
齐 申1, 吴 海 涛1,2, 王 成 成1, 唐 越1,2, 孙 娜1,2, 于 翠 平1,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
采用明胶酶谱法检测刺参肠内源酶中胶原降解酶的活性,应用流变仪分析刺参体壁粗胶原纤维的流变特性。通过SDS-聚丙烯酰胺凝胶电泳和TCA可溶性寡肽含量测定方法,考察了刺参肠内源酶对体壁酶促溶性胶原蛋白的降解作用。结果表明,当粗胶原纤维质量分数为3%时,溶胀的粗胶原纤维显示出明显的凝胶特性,经刺参肠内源酶处理后,其凝胶性明显下降。在pH 9.0和40 ℃的条件下,刺参肠内源酶作用0.5 h后,可显著促进PSC中γ、β及α链的降解;在此过程中,体壁酶促溶性胶原蛋白降解产物中TCA可溶性寡肽含量逐渐增加。研究表明,刺参肠中具有能够降解体壁胶原蛋白的内源酶,并在刺参自溶中发挥重要作用。
刺参;体壁;自溶;内源酶;胶原蛋白
Abstract: The activity of endogenous enzyme was determined by gelatin zymography. The rheological behavior of crude collagen fiber fromS.japonicuswas analyzed by rheometer. The effects of gut endogenous enzymes on degradation of pepsin-soluble collagen (PSC) were analyzed by SDS-PAGE and TCA-soluble oligopeptide content assay. The swelling of crude collagen fibers showed obvious gel characteristic when the crude collagen fiber mass fraction was 3%, but the gel properties decreased obviously when treated with endogenous enzymes ofStichopusjaponicus. The band intensities of γ-, β- and α-chain in PSC significantly decreased by treated with gut endogenous enzymes at pH 9.0 and 40 ℃ for 0.5 h. The content of TCA-soluble oligopeptides in the PSC degradation products increased gradually. The result suggested thatS.japonicuscontain endogenous enzymes that could degrade collagen in the body wall, and plays an important role in autolysis ofS.japonicus.
Keywords:Stichopusjaponicus; body wall; autolysis; endogenous enzymes; collagen
0 引 言
刺参(Stichopusjaponicus)是重要的海洋棘皮类动物[1],其自溶主要通过自身水解酶类的作用发生消解,同时伴随胞内物质的释放[2-3]。刺参体壁是刺参主要的食用部位,主要由上皮组织以及真皮结缔组织构成,体壁中的胶原蛋白含量最多,而胶原蛋白是胶原纤维的基本组成单位,对刺参体壁起着重要的支撑作用[4-5]。目前,对海参胶原蛋白的研究主要集中在氨基酸及亚基的组成方面[6]。刺参肠中含有丰富的蛋白水解酶,如胃蛋白酶、胰蛋白酶、组织蛋白酶B、高碱性蛋白酶和肽水解酶[7-10]。Wu等[11]研究发现,体壁中的半胱氨酸蛋白酶是一类重要的蛋白酶,它直接参与了海参自溶过程中非胶原蛋白质的降解,而对于自溶过程中刺参肠内源酶与胶原蛋白的直接酶解作用还鲜有报道。
为延续上述研究工作,本实验以刺参体壁粗胶原纤维(crude collagen fiber,CCF)和酶促溶性胶原蛋白(pepsin-soluble collagen,PSC)为研究对象,利用刺参肠内源酶考察其对体壁胶原蛋白的酶解作用,为进一步丰富海参自溶机理奠定研究基础。
1 材料与方法
1.1 原料与主要试剂
刺参购自大连长兴市场;明胶、SDS、溴酚蓝、Tris、丙烯酰胺、N,N-亚甲基双丙烯酰胺、过硫酸铵、Triton、考马斯亮蓝R-250、考马斯亮蓝G-250、N,N,N,N-四甲基乙二胺、尿素、巯基乙醇,上海生工生物工程有限公司;蛋白分子质量标准品,宝生物工程(大连)有限公司;牛血清白蛋白,瑞士Fluka公司;甘油、甘氨酸、冰乙酸,天津市科密欧化学试剂开发中心;其他试剂均为化学分析纯。
1.2 主要设备
Discovery HR-1流变仪,美国TA仪器;Satorius pH计,塞多利丝科学仪器(北京)有限公司;AE-6450垂直电泳仪槽,日本ATTO株式会社;TS.B-108往复式脱色摇床,江苏海门其林贝尔仪器制造有限公司;MF-ChemiBIS 2.0凝胶成像仪,DNR Bio-imaging systems Ltd。
1.3 方 法
1.3.1 刺参肠内源酶提取及酶活检测
1.3.1.1 刺参肠内源酶的提取
根据文献[12]的方法,本实验中的刺参肠内源酶提取方法略有改变。方法如下:向干净的刺参肠中加入2倍体积pH 9.0 20 mmol/L Tris-HCl缓冲液研磨浸提;离心后的上清液即为刺参肠内源酶提取液。与前期研究方法不同之处在于,Tris-HCl缓冲液中去除了10 mmol/L的CaCl2,主要由于Ca2+对CCF凝胶溶液的形成有很大影响。
1.3.1.2 刺参肠内源酶明胶酶谱检测
根据文献[13]的方法,将酶液稀释2.5、5、10、20、30、40倍,取10 μL酶液进行明胶酶谱检测。
1.3.2 刺参体壁CCF的提取[14]
先将冷冻刺参体壁打碎,水洗离心,向所得沉淀中加入pH 8.0 0.1 mol/L含5 mmol/L EDTA、0.5 mol/L NaCl的Tris-HCl 缓冲液搅拌;再将离心所得沉淀水洗至中性后,用去离子水搅拌提取,离心后得到的上层清液中含有粗胶原纤维;向下层沉淀中加入去离子水重复提取一次,并将两次提取的上清液合并;经NaOH洗涤后再水洗至中性,经冷冻干燥得到胶原粗纤维。以上操作均在4 ℃下进行。
1.3.3 刺参体壁CCF流变特性的测定及刺参肠内源酶的影响
1.3.3.1 刺参体壁CCF流变特性的测定
采用流变仪反映刺参体壁CCF的流变特性。用超纯水溶胀CCF 12 h,制备质量分数分别为1%、2%、3%的悬浊液,离心除气泡,静置后用流变仪进行测试。
根据文献[15]的方法,测试参数设定为采用40 mm平行板作为夹具,温度15 ℃,分别进行频率1 Hz、应变0.1%~100%的应变扫描,应变2%、频率0.1~10 Hz的频率扫描和剪切速率0.1~100 s-1的剪切速率扫描3种模式测量。
1.3.3.2 刺参肠内源酶对CCF流变性的影响
制备质量分数为3%的CCF悬浊液,将悬浊液与刺参肠内源酶液以质量比10∶1的比例均匀混合,同时添加等量的pH 9.0 20 mmol/L Tris-HCl缓冲液作对照,用流变仪进行测试。
1.3.4 刺参体壁酶促溶性胶原蛋白的提取
将粗胶原纤维溶于500倍0.5 mol/L乙酸溶液中,并加入胃蛋白酶;离心,向上清液中加入NaCl静置过夜;将离心所得沉淀溶于少量0.5 mol/L 乙酸中,采用0.02 mol/L Na2HPO4-NaH2PO4和0.1 mol/L乙酸透析液透析,将离心所得沉淀经冷冻干燥得到酶促溶性胶原蛋白。以上操作均在4 ℃下进行。
1.3.5 刺参肠内源酶对PSC的影响
1.3.5.1 预处理
用pH 9.0 20 mmol/L Tris-HCl缓冲液溶解PSC,终浓度1.5 mg/mL,将稀释5倍的刺参肠内源酶液与PSC混合,终浓度1.5 mg/mL,于40 ℃下分别孵育0.5、1、2、4 h。
1.3.5.2 SDS-PAGE检测
向预处理后的各样品中加入5×上样缓冲液,离心,上清液进行SDS-PAGE电泳。
1.3.5.3 TCA可溶性寡肽含量的测定
向预处理后的各样品中加入等体积20 g/mL 预冷过的TCA溶液,并振荡混合均匀,室温静置后离心,上清液采用Folin-酚法测定[16]。
每个酶解时间作4组平行实验。以牛血清蛋白为标准品,获得标准曲线为y=0.779 87x+0.069 81 (R2=0.996 19)。其中y为吸光度,x为牛血清蛋白质量浓度。根据蛋白质标准曲线计算TCA-可溶性寡肽的含量。
1.3.6 统计分析
数据以(平均值±标准差)表示。采用在线软件进行Student’st检验,P<0.05,差异性显著。
2 结果与讨论
2.1 刺参肠内源酶的酶活检测
按照“1.3.1”的方法提取刺参肠内源酶并对其进行稀释,利用明胶酶谱法进行检测,结果如图1所示。采用pH 9.0 20 mmol/L Tris-HCl缓冲液提取获得的刺参肠内源酶经稀释2.5倍、5倍后可由明胶酶谱清晰检出,而稀释10倍以上时酶含量过低,明胶酶谱显示酶活较低。

L,低分子质量标准marker;H,高分子质量标准marker;1~6,刺参肠内源酶分别稀释40、30、20、10、5、2.5倍样品;7,未经稀释的刺参肠内源酶原液
图1 刺参肠内源酶的活力
Fig.1 Activity of endogenous enzyme from gut inStichopusjaponicus
2.2 刺参体壁CCF的流变特性
按照“1.3.2”的方法分别制备质量分数1%、2%、3%的CCF悬浊液,样品如图2所示,不同质量分数的CCF样品呈现不同的凝胶效果。当CCF质量分数为1%时,将样品倒置观察,发现部分水被分离出来,海参胶原纤维凝胶效果较差;CCF质量分数为2%时,凝胶效果增强,但仍有少量水被分离,倒置后样品有流动性;而当CCF质量分数达到3%时,无水分分离,凝胶效果较好。因此,选用质量分数为3%的刺参体壁CCF进行后续研究。

图2 不同质量分数刺参体壁CCF悬浊液的外观形态
Fig.2 CCF suspension of body wall at different concentration
按照“1.3.3.1”方法,采用流变仪对质量分数为2%和3%的刺参体壁CCF悬浊液进行流变特性的考察,以综合评定其凝胶特性,结果如图3所示。在图3(a)中,G′为储能模量,代表流变行为的弹性部分;G″为损耗模量,代表流变行为的黏性部分。在质量分数为2%时,G′和G″较小,说明凝胶性不明显。当质量分数达到3%时,G′随着应变量的增加先保持不变,后急剧减小;而G″随着应变的增加先上升后下降。G′大于G″,说明刺参体壁CCF悬浊液在质量分数为3%时,弹性特性高于黏性特性,表现为类似固体的弹性行为占主导,呈现出凝胶性。
如图3(b)所示,复数黏度(η*)体现了黏度和弹性共同的贡献。在频率扫描中,η*随频率增加而急剧下降,初始η*随刺参体壁CCF悬浊液的质量分数的增加而增大;G′和G″都随着频率的增加而略有增大。
图3(c)为剪切速率扫描,刺参体壁CCF悬浊液的黏度(η)随剪切速率的增加而急剧减小,呈现明显的剪切稀化现象。在同一剪切速率下,刺参体壁CCF的质量分数越大,初始黏度越大;同一剪切速率下,其剪切应力(σ)随质量分数的增加而增大。
2.3 刺参肠内源酶对体壁CCF流变特性的影响
按照“1.3.3.2”方法将质量分数为3%的CCF与刺参肠内源酶液混合处理,并以Tris-HCl缓冲液为对照,再按照“1.3.3.1”方法采用流变仪考察刺参肠内源酶对体壁CCF流变特性的影响,结果如图4所示。质量分数为3%的刺参体壁凝胶溶液经刺参肠内源酶处理12 h后,在应变扫描(a)、频率扫描(b)和剪切速率扫描(c)3种流变模式下,刺参肠内源酶均显示出明显降低体壁CCFG′、G″、η*、η及σ的作用,说明刺参肠内源酶可能通过降低体壁CCF的凝胶性进一步发挥降解胶原的能力。
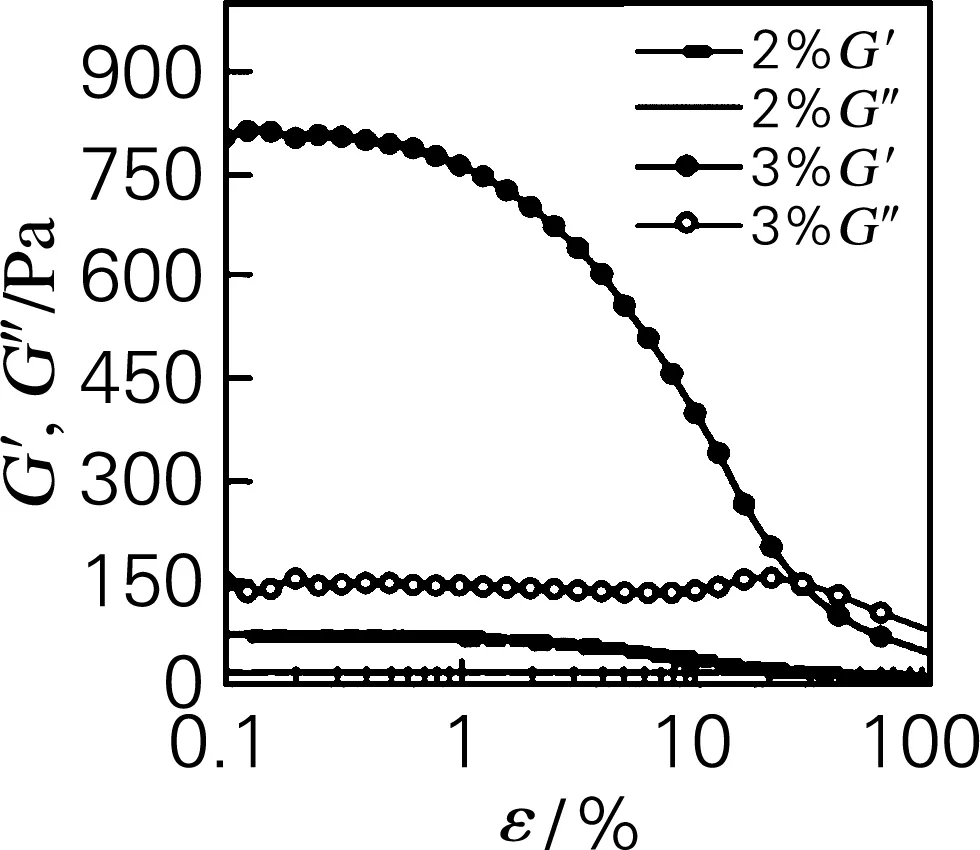
(a) 应变扫描(b) 频率扫描(c) 剪切速率扫描图3 不同质量分数刺参体壁CCF的流变特性Fig.3 The rheological properties of CCF suspension from body wall of Stichopus japonicus at different concentration

(a) 应变扫描(b) 频率扫描(c) 剪切速率扫描图4 刺参肠内源酶对体壁CCF流变特性的影响

2.4 刺参肠内源酶对体壁PSC的降解作用
根据“2.1”的结果,按照“1.3.5.1”方法选择5倍稀释的酶液对刺参体壁酶促溶性胶原蛋白进行酶解,并进行SDS-PAGE电泳分析,结果如图5所示。刺参胶原蛋白主要含β及α链,少量γ链,与文献[17]结果一致。在pH 9.0 20 mmol/L Tris-HCl缓冲体系中,刺参体壁PSC在内源酶作用0.5 h时,PSC基本降解完全,说明刺参肠内源酶对体壁PSC降解能力较强。
按照“1.3.5.3”方法,将刺参肠内源酶对体壁PSC进行酶解,检测其TCA可溶性寡肽相对释放量的变化情况,结果如图6所示。随着刺参肠内源酶作用时间的延长,体壁PSC降解产物中TCA可溶性寡肽含量逐渐增加,即大分子PSC被降解为小分子多肽。这一结果与电泳结果保持一致,说明刺参肠内源酶可明显降解体壁PSC,并产生小分子肽类物质。

L,低分子质量标准marker;H,高分子质量标准marker;1,未加酶对照组PSC;2~5,刺参肠内源酶作用时间分别为30、60、120、240 min的产物
图5 刺参肠内源酶对体壁PSC降解作用
Fig.5 Effect of endogenous enzyme from gut on degradation of PSC of body wall inStichopusjaponicus
3 结 论
刺参肠内源酶中含有胶原降解酶,刺参体壁CCF悬浊液在质量分数为3%时显示出较强的流变特性。将刺参肠内源酶与体壁胶原纤维CCF悬浊液或PSC溶液相互作用时,内源酶能够有效降低体壁CCF的流变特性,同时可明显降解体壁PSC。研究结果显示,刺参肠中含有能够降解体壁胶原蛋白的内源酶,并在刺参自溶中可能发挥重要作用。

不同字母之间标记的数据具有显著差异(P<0.05)
图6 刺参肠内源酶酶解体壁PSC过程中TCA可溶性寡肽相对质量的变化
Fig.6 Change of TCA-soluble oligopeptide content during degradation of PSC of body wall by endogenous enzyme from gut inStichopusjaponicus
[1] 朱蓓薇.海珍品加工理论与技术的研究[M].北京:科学出版社,2010.
[2] ZHU B W, ZHENG J, ZHANG Z S, et al. Autophagy plays a potential role in the process of sea cucumber body wall “melting” induced by UV irradiation[J]. Wuhan University Journal of Natural Sciences, 2008, 13(2): 232-238.
[3] 郑杰.海参自溶过程中生化变化及抗氧化活性寡肽的研究[D].镇江:江苏大学,2012.
[4] 肖枫,曾名勇,董士远,等.海参胶原蛋白的研究进展[J].水产科学,2005,24(6):39-41.
[5] 肖和兰,孙素琴,周群,等.温度对胶原蛋白结构影响的二维红外相关光谱的研究[J].分子物理学报,2003,20(2):211-218.
[6] TROTTER J A, THURMOND F A, KOOB T J. Molecular structure and functional morphology of echinoderm collagen fibrils[J]. Cell and Tissue Research, 1994, 275(3): 451-458.
[7] GAO F, YANG H S, XU Q, et al. Effect of water temperature on digestive enzyme activity and gut mass in sea cucumberApostichopusjaponicus, with special reference to aestivation[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(4): 714-722.
[8] SUN L M, ZHU B W, WU H T, et al. Purification and characterization of cathepsin B from the gut of the sea cucumber (Stichopusjaponicus)[J]. Food Science and Biotechnology, 2011, 20(4): 919-925.
[9] FU X Y, XUE C H, MIAO B C, et al. Study of a highly alkaline protease extracted from digestive tract of sea cucumber (Stichopusjaponicus)[J]. Food Research International, 2005, 38(4): 323-329.
[10] McGETTIGAN S, CANNING M, O’CUINN G, et al. Peptide hydrolases in holothurian intestinal mucosa[J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1981, 69(4): 169-170.
[11] WU H T, LI D M, ZHU B W, et al. Proteolysis of noncollagenous proteins in sea cucumber,Stichopusjaponicus, body wall: characterisation and the effects of cysteine protease inhibitors[J]. Food Chemistry, 2013, 141(2): 1287-1294.
[12] 商文慧.海参自溶过程中蛋白质变化的研究[D].大连:大连工业大学,2014.
[13] 杨洋.内源酶对刺参体壁自溶过程中蛋白质降解作用研究[D].大连:大连工业大学,2015.
[14] ZHU B W, DONG X P, ZHOU D Y, et al. Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumberStichopusjaponicus[J]. Food Hydrocolloids, 2012, 28(1): 182-188.
[15] 李毅,张萌,陈庭家,等.虾夷扇贝生殖腺酶解液的凝胶特性[J].中国食品学报,2015,15(4):22-29.
[16] ZHENG J, WU H T, ZHU B W, et al. Identification of antioxidative oligopeptides derived from autolysis hydrolysates of sea cucumber (Stichopusjaponicus) guts[J]. European Food Research and Technology, 2012, 234(5): 895-904.
[17] 侯虎,孙江,毛家楠,等.刺参胶原纤维形态及胶原蛋白理化性质研究[J].现代食品科技,2013(7):1491-1495.
EffectofendogenousenzymefromgutonbodywallcollagendegradationinStichopusjaponicus
QIShen1,WUHaitao1,2,WANGChengcheng1,TANGYue1,2,SUNNa1,2,YUCuiping1,2
( 1.School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;2.National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian 116034, China )
TS254.2
A
1674-1404(2017)05-0313-05
2016-03-18.
国家自然科学基金项目(31370037);辽宁省科学技术计划项目(2015103020).
齐 申(1992-),女,硕士研究生;通信作者:吴海涛(1980-),女,副教授.
齐申,吴海涛,王成成,唐越,孙娜,于翠平.刺参肠内源酶对体壁胶原蛋白的降解作用[J].大连工业大学学报,2017,36(5):313-317.
QI Shen, WU Haitao, WANG Chengcheng, TANG Yue, SUN Na, YU Cuiping. Effect of endogenous enzyme from gut on collagen degradation from body wall inStichopusjaponicus[J]. Journal of Dalian Polytechnic University, 2017, 36(5): 313-317.

