干旱胁迫对燕麦叶片气孔和叶肉细胞超微结构的影响
张志芬,刘景辉,付晓峰,赵宝平,李立军,刘俊青,杨海顺
(1.内蒙古农业大学农学院,内蒙古呼和浩特 010018; 2.内蒙古自治区农牧业科学院特色作物所,内蒙古呼和浩特 010031)
干旱胁迫对燕麦叶片气孔和叶肉细胞超微结构的影响
张志芬1,刘景辉1,付晓峰2,赵宝平1,李立军1,刘俊青2,杨海顺2
(1.内蒙古农业大学农学院,内蒙古呼和浩特 010018; 2.内蒙古自治区农牧业科学院特色作物所,内蒙古呼和浩特 010031)
为了解干旱后燕麦解剖结构的变化,以燕麦品种白燕2号为材料,通过盆栽控水试验,设置正常供水、轻度干旱和重度干旱三个不同水分处理(土壤含水量分别为田间持水量的75%、60%和45%),研究了干旱胁迫对燕麦叶片渗透调节物质含量、气孔和叶肉细胞超微结构的影响。结果表明,正常水分条件(对照)下,燕麦叶片脯氨酸和可溶性糖含量较低,表皮细胞皱褶,气孔关闭或微张,叶肉细胞内细胞器形状规则,结构清晰。与对照相比,轻度干旱胁迫下,燕麦叶片脯氨酸和可溶性糖含量增加,叶片表皮细胞饱满,气孔开启度较大,叶绿体形状变圆,近球状,线粒体外被膜膨胀,但结构未见明显损伤;重度干旱胁迫下,叶片脯氨酸和可溶性糖含量极显著增加,表皮细胞干瘪,气孔保卫细胞膨胀,气孔关闭,气孔器下陷。重度干旱胁迫下,燕麦叶绿体和线粒体受到的损伤较大,叶绿体内基粒、基质类囊体降解,出现较大的空腔;线粒体外被膜断裂,内含物流失;细胞核染色质凝聚,叶绿体之间出现嵌合现象。因此,干旱胁迫能诱导燕麦叶片渗透调节物质的积累和细胞超微结构的改变,渗透调节物质增幅和细胞超微结构的破坏程度随着土壤有效水分含量的降低而上升,但在细胞超微结构上也出现抗性反应,表明燕麦具有较强的抗旱性。
燕麦;干旱胁迫;叶片;气孔;超微结构
Abstract:The variety of oat Baiyan 2 were used to investigate the effect of soil drought stress on the contents of osmotic regulators, the stomata and ultrastructure of mesophyll cell under pot culture condition.Soil water content is 75%, 60% and 45% of the water holding capacity in the field under normal water,light drought stress and severe drought stress,respectively.The result showed under normal water condition, the contents of proline and soluble sugar were low, the epidermal cells were wrinkled, and the stomata were closed or slightly opened. The shape of organelles in mesophyll cells was regular and the structure was clear. Under light drought stress, the content of proline and soluble sugar in oat leaves increased, the epidermal cells were full, the stomatal opening was larger, the chloroplast and mitochondria changed slightly, but the structure did not show obvious damage. Compared with the control, under the severe drought stress, the content of proline and soluble sugar in leaves increased significantly, and the epidermal cells were shrunk; The stomatal guard cells expanded, the stomata was closed, the stomatal apparatus was sagged;Under the condition of severe drought stress, the chloroplast and mitochondria in the mesophyll cells caused great damage,granum lamellae and stroma lamellaein the chloroplast were degraded, and the larger cavity appeared inside;Membrane of mitochondrial broken, inclusions loss; in addition, nuclear chromatin condensed, and there was chimerism between chloroplasts. It can be seen that drought stress induced the accumulation of osmotic regulators and structural change. The growth rate of osmotic regulators increases rapidly with the decrease of soil water content,and the degree of structural damage increases,the oat also showed strong drought resistance in structure.
Keywords:Oat;Drought Stress;Leaf;Stomata;Ultrastructures
燕麦(AvenasativaL.)是禾本科燕麦属草本植物,抗逆性强,广泛种植于贫瘠、干旱、冷凉等地区,是粮饲兼用型作物[1]。燕麦根系发达,吸水能力较强,且根冠比较大,调节水分能力较强,成为治理土地荒漠化的先锋作物[2]。干旱胁迫是限制干旱半干旱地区植物生长发育的关键因素[3-5]。关于干旱对燕麦渗透调节物质的影响,报道较多的是可溶性糖和脯氨酸变化,其含量随着干旱胁迫程度的增加而显著升高[6-10]。研究表明,植物叶片的组织结构对环境变化的反应比较敏感[11],干旱胁迫不仅会降低作物的光合作用,改变酶活性、叶片表皮气孔[12]以及叶绿体、线粒体等[13-15]结构。叶绿体和线粒体是植物光合、呼吸作用和能量转化的重要细胞器[16],随着环境条件变化,其形态结构也会发生相应改变[17-18],因而可在一定程度上表征植物对逆境条件的耐受性[11-13]。干旱胁迫下水稻叶片的气孔密度明显增大,气孔的长、宽减小,且随着干旱胁迫强度的增大,气孔开度变小,趋于关闭状态[12]。干旱胁迫后,小麦叶绿体片层结构变混乱[19],线粒体部分外膜断裂,嵴结构模糊不清[20];大麦叶片细胞核中染色质的凝聚程度高,叶绿体变形,外被膜出现较大程度的波浪状和膨胀,同时基粒出现弯曲、膨胀、排列混乱的现象;线粒体外形及膜受到破坏,内部嵴部分消失等[21]。由此可见,叶绿体和线粒体对逆境胁迫比较敏感,因此,研究逆境胁迫下作物显微结构和生理功能变化,观察干旱胁迫后叶绿体和线粒体结构的变化规律是了解植物抗旱生理机制的重要手段[22]。但目前关于逆境胁迫后燕麦叶绿体和线粒体超微结构的变化鲜见报道。本研究采用盆栽试验模拟干旱胁迫条件,在扫描电镜和透射电镜下观察了不同干旱胁迫程度下燕麦叶片气孔和叶肉细胞超微结构的变化,以期进一步丰富燕麦适应干旱逆境的生理机制理论。
1 材料与方法
1.1 试验材料
试验于2016年5-10月在内蒙古农牧业科学院温室内进行。供试燕麦品种为白燕2号。所用盆的直径为16 cm,高15 cm,装有2.2 kg来自田间的土壤。土壤田间持水量、永久萎蔫点及土壤质量含水量按Ryan等[23]的方法分析测定。设置正常供水(对照)、轻度干旱胁迫和重度干旱胁迫3个处理,土壤含水量分别为田间持水量的75%、60%和45%,每个处理3次重复,每次重复种植7盆,每盆20株。每天下午5点利用称重法进行称重补水,以保持各处理土壤含水量稳定。燕麦于5月5日播种,5月12日出苗,6月6日拔节期取样。
1.2 取样与测定方法
1.2.1 脯氨酸和可溶性糖含量测定
采集新鲜燕麦幼苗,立即液氮速冻并保存。测定时,先放入液氮预冷,再研磨至粉末,用冷冻干燥机将新鲜燕麦幼苗粉末冷冻干燥,4 ℃保存。脯氨酸含量采用茚三酮比色法测定[24],可溶性糖含量采用蒽酮比色法测定[ 24]。
1.2.2 叶片表皮结构观测
上午10:30取材料顶部第2叶,用磷酸缓冲液冲洗,取叶片的中间部位,剪为1 cm长,用2.5%戊二醛固定,置于4 ℃冰箱中过夜,取出样品,用磷酸缓冲液漂洗,然后取1 mm×1 mm叶片,1%的锇酸固定2 h,经乙醇系列梯度脱水,临界点干燥,粘台喷金后在JSM-5310LV扫描电镜下观察和拍照。
1.2.3 叶肉细胞超微结构观测
取样方法同1.2.2,样品脱水后,转入Epon812环氧树脂内浸透包埋。用LeicaEMUC6型超薄切片机切片,在JEM-100KXⅡ透射电镜下观察、拍照。
1.3 数据处理与分析
数据利用Excel 2007软件处理, 利用SAS软件进行显著性分析。
2 结果与分析
2.1 干旱胁迫对燕麦叶片脯氨酸和可溶性糖含量的影响
随着土壤水分含量的降低,燕麦叶片脯氨酸和可溶性糖含量均呈上升趋势(图1)。与对照相比,轻度干旱胁迫下脯氨酸和可溶性糖含量分别提高21.4%和10.2%,但脯氨酸含量变化不显著;重度干旱胁迫下脯氨酸和可溶性糖含量均显著提高,增幅分别为4.23倍和53.2%。
2.2 干旱胁迫对燕麦叶片表皮结构的影响
燕麦叶片上、下表皮细胞形状规则,由长型细胞和短型细胞组成,表皮细胞均顺着叶长轴成行排列(图2A)。气孔器长条形,气孔关闭或者微张,由2个哑铃形保卫细胞和2个肾形副卫细胞组成(图2B)。正常水分条件下,表皮凸凹不平,形成脊和沟,表皮毛分布在脊上,形成皮毛带,气孔分布在脊的两侧,形成气孔带(图2C),叶片表皮细胞皱褶,下表皮较上表皮更明显(图2A),下表皮脊较突出(图2D);表皮毛主要分布在下表皮(图2C)。下表皮气孔下陷,副卫细胞空瘪(图2D),上表皮气孔副卫细胞较饱满。
轻度干旱胁迫下,燕麦叶片表皮细胞饱满,上表皮有较少的皱褶,表皮相对平滑,表皮毛较少,气孔较平整(图3C、D),气孔副卫细胞饱满,保卫细胞空瘪,气孔开口孔径增大(图3E、F),大部分气孔微张(图3A、B);下表皮气孔器表面分泌物较多(图3D)。
重度干旱胁迫下,燕麦叶片表皮细胞干瘪,表皮毛较少,叶表皮平滑(图4A、B),气孔器副卫细胞和周围细胞均塌陷,保卫细胞膨胀,气孔关闭,气孔器下陷(图4C、D)。
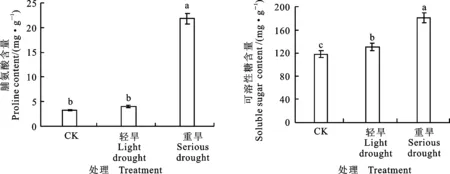
图柱上不同字母表示处理间差异显著(P<0.05)。
Different letters on the columns indicate significant difference among the treatment at 0.05 level.
图1不同处理下燕麦叶片脯氨酸和可溶性糖含量
Fig.1Prolineandthesolublesugarcontentofoatleafunderdifferenttreatments
2.3 干旱胁迫对燕麦叶片超微结构的影响
正常水分条件下,燕麦叶肉细胞有明显的细胞核及叶绿体、线粒体等细胞器,各细胞的形状规则(图2E),细胞核外被膜结构清晰,内部染色质均匀分布(图2F)。叶绿体较大,数目多,面向细胞壁一侧外被膜平直,另一侧向细胞中央突出;叶绿体外被膜及基粒和基质类囊体膜结构清晰,基粒排列整齐,其类囊体片层排列紧密(图2G),内具少量淀粉粒和随机分布的嗜锇颗粒(图2E、H)。线粒体外被膜完整,内部嵴分布均匀,结构清晰(图2E)。
轻度干旱胁迫下,燕麦叶肉细胞仍然有明显的细胞核及叶绿体、线粒体等细胞器,被膜清晰且基本完整。但与对照相比,叶绿体变圆,近球状,淀粉粒较大(图3G、H),基质类囊体较少,基粒类囊体皱缩(图3I);线粒体膨胀,外被膜完整,内部嵴仍较清晰(图3J)。
重度干旱胁迫下,燕麦叶肉细胞内出现双层膜的较大空泡状结构(图4I),部分细胞器边缘化(图4E),叶绿体紧贴细胞壁(图4F),部分叶绿体形状变为近球状,或外被膜部分向外突出形成波浪状,或2个叶绿体之间出现嵌合现象(图4H),但外被膜仍然较为完整;叶绿体内部嗜锇颗粒较多(图4G),基粒和基质类囊体膜断裂,出现了较大的空腔。线粒体外被膜断裂现象明显,内含物流失,内部出现空腔。细胞核核膜出现膨胀甚至断裂现象,核内染色质分布不均匀,出现轻微凝聚现象(图4J)。
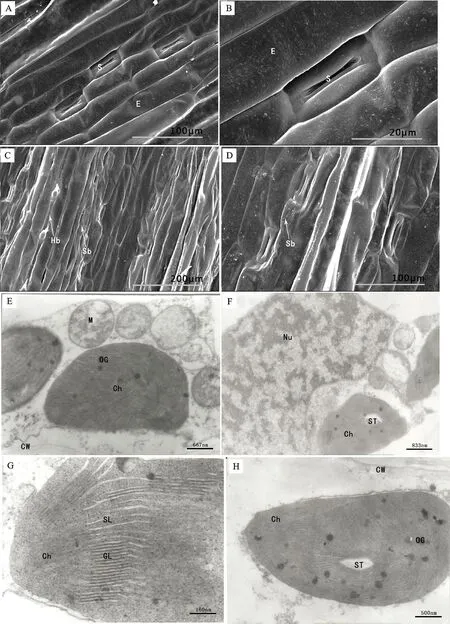
A~D:扫描电镜照片;E~H:透射电镜照片;A&B:上表皮;C&D:下表皮;E:细胞器;F:核染色质;G&H:叶绿体;E:表皮细胞;S:气孔;Hb:表皮毛带;Sb:气孔带;M:线粒体;Ch:叶绿体;GL:基粒片层;SL:基质片层;Nu:核染色质;ST:淀粉粒;OG:嗜锇颗粒;CW:细胞壁。下同。
A-D:Scanning electron micrographs; E-H:Transmission electron micrographs; A&B:Upper epidermis; C&D:Lower epidermis; E:Organelles; F:Nuclear chromatin;G&H:Chloroplasts; E:Epidermal cell; S:Stomatal;Hb:Hair band; M:Mitochondria; Ch:Chloroplast; GL:Granum lamellae; SL:Stroma lamellae; Nu:Nuclear chromatin; ST:Starch granules; OG:Osmiophilic globlue. The same blow.
图2正常水分条件下燕麦叶片表皮细胞、气孔结构和细胞的超微结构
Fig.2Epidermalcell,stomatalstructureandultrastructureofmesenchymalcellsofoatleafundernormalwatercondition
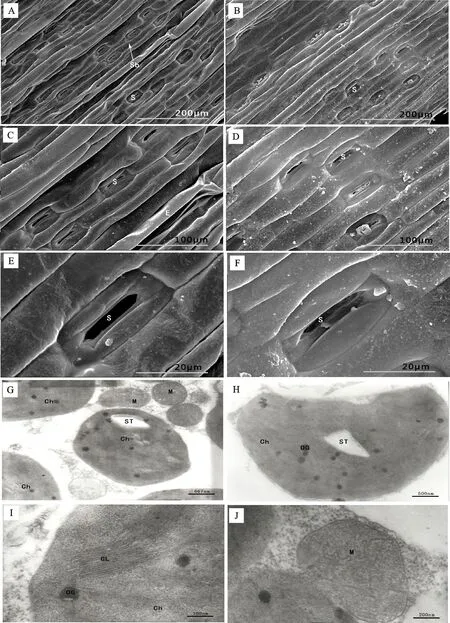
A~F:扫描电镜照片;G~J:透射电镜照片;A、C和E:上表皮;B、D和F:下表皮;G、H和I:叶绿体;J:线粒体。
A-F:Scanning electron micrographs; G-J:Transmission electron micrographs:A,C and E:Upper epidermis; B,D,F:Lower epidermis; G,H and I:Chloroplast; J:Mitochondria.
图3轻旱条件下燕麦叶片表皮细胞、气孔结构和叶肉细胞的超微结构
Fig.3Epidermalcell,stomatalstructureandultrastructureofmesenchymalcellsofoatleafunderlightdroughtcodition
3 讨 论
随着干旱胁迫程度的加大,植物的脯氨酸含量会显著增加[7,9]。糖既是植物光合作用产物,也是呼吸作用底物,为植物生长发育提供碳架和能量,增强植物抗逆性[25];可溶性糖含量增加可使原生质粘稠度增大,弹性增强,细胞液浓度增大,进而提高了作物对水分的吸收能力及保水能力[26]。本研究也表明,干旱胁迫后燕麦叶片的脯氨酸含量增加,其中重度干旱胁迫的影响明显;可溶性糖含量也表现出类似的趋势。这说明干旱胁迫促进了这两种物质在叶片中的累积,有助于增强植株的渗透调节能力,减轻干旱对组织的伤害。

A~D:扫描电镜照片;E~J:透射电镜照片;A&C:上表皮;B&D:下表皮;E:细胞器;F、G和H:叶绿体;I:线粒体; J:核染色质。
A-D:Scanning electron micrographs; E-J:Transmission electron micrographs; A&C:Upper epidermis;B&D:Lower epidermis; E:Organelles;F,G and H:Chloroplasts; I:Mitochondria;J:Nuclear chromatin.
图4重度干旱条件下燕麦叶片表皮细胞、气孔结构和叶肉细胞的超微结构
Fig.4Epidermalcell,stomatalstructureandultrastructureofmesenchymalcellsofoatleafunderseriousdroughtcondition
气孔关闭是植物对干旱胁迫最普遍反应[27],气孔开启度对土壤含水量变化的敏感程度大于气孔密度,但就上、下表皮而言,下表皮的敏感度大于上表皮[28]。本研究中,干旱胁迫对燕麦叶片气孔开启度的影响较大,与对照相比,轻度胁迫下气孔开启度增大,重度胁迫下气孔开启度减小,甚至彻底关闭,说明轻度干旱胁迫下并未引起气孔限制,反而增加叶片表皮细胞的饱满度,可见燕麦具有较强的抗旱性。林叶春等[29]研究也发现,裸燕麦孕穗期土壤含水率由高降低至中等并未诱发明显的气孔限制。此外,燕麦叶片表皮的气孔器下陷,气孔常常处于关闭状态或开得很小,具有表皮毛,是典型耐旱作物结构特征[30];重度干旱胁迫下保卫细胞和副卫细胞缩水,气孔面积减小,气孔关闭,气孔器下陷,是燕麦在进化过程中形成的一种自我保护机制,适度降低土壤含水量未显著降低叶片光合能力,有利于提高叶片水分利用效率[29],从而提高燕麦的抗旱能力。
在干旱胁迫下,植物叶片叶肉细胞的超微结构会发生明显的变化,其中叶绿体和线粒体是对胁迫比较敏感且所担负功能较为重要的2个细胞器[13-15];干旱胁迫造成叶绿体的基粒弯曲、膨胀及排列混乱,使线粒体膨胀、变圆,外被膜不完整,内部嵴消失等现象[19,23,31-32]。本研究结果显示,随着土壤含水量的降低,燕麦叶绿体首先出现形状改变,然后逐渐内部结构降解,出现较大的空隙;线粒体首先出现膨胀,然后内部结构降解,最终外被膜断裂,内含物外流;重度干旱胁迫下出现细胞器周缘化。王复标等[33]研究表明,水稻叶绿体沿细胞壁排列的周缘化及形态结构的球状化是其类囊体片层膜结构退化与降解过程启动的“前奏”,对叶片的光合作用也有一定程度的影响。轻度干旱胁迫下,线粒体的形状和内部结构与对照相比变化较小。由此说明,叶绿体对干旱胁迫更为敏感,这与白志英等[19]对小麦叶片超微结构的研究结果一致。另外,在本试验中发现叶绿体之间出现嵌合现象,这有助于叶片加强细胞结构的支持力[21],显示燕麦具有较强抗旱性。
干旱胁迫下,作物通过增加渗透调节物质含量来抵御损伤,其中脯氨酸和可溶性糖是重要的调节物质[15],其含量增加有助于提高细胞的亲水性,减缓膜脂蛋白的解体。本研究中,轻度干旱胁迫下由于渗透物质的增加,细胞的保水能力增强,叶片表皮细胞更加饱满,气孔开启度增加,叶肉细胞膜结构并未受到损伤;重度干旱胁迫后虽然脯氨酸和可溶性糖含量显著高于正常水分和轻度干旱胁迫,但对燕麦叶肉细胞叶绿体和线粒体的伤害程度超过了燕麦的自我调控能力,叶绿体和线粒体膜解体。
[1]REN C Z,MA B L,BURROWS V,etal.Evolutions of early mature naked oat varieties as a summer-seeded crop in dryland northern climate regions [J].FiledCropResearch,2007,103:249.
[2] 任长忠,胡跃高.中国燕麦学[M].北京:中国农业出版社,2013:43.
REN C Z,HU Y G.Chinese Oat [M].Beijing:China Agriculture Press,2013:43.
[3]BIEHLER K,FOCK H.Evidence for the contribution of the Mehler-peroxidase reaction in dissipating excess elections in drought stressed wheat [J].PlantPhysiology,1996,112:271.
[4]BOSABALIDIS A M,KOFIDIS G.Comparative effects of drought stress on leaf anatomy of two olive cultivars [J].PlantScience,2002,163:377.
[5]KLICH M G.Leaf variations inElaeagnusangustifoliarelated to environmental heterogeneity [J].EnvironmentandExperimentalBotany,2000,44:182.
[6] 任 鹏,赵宝平,刘瑞芳,等.水分胁迫对燕麦穗颖渗透调节和抗氧化能力的影响[J].西北植物学报,2014,34(10):2051.
REN P,ZHAO B P,LIU R F,etal.Effect of stress on osmotic adjustment and antioxidation ability in glume of oat [J].ActaBotanicaBoreali-OccidentaliaSinica,2014,34(10):2051.
[7] 张 娜,赵宝平,任 鹏,等.水分胁迫对不同抗旱性燕麦品种根部生理特性的影响[J].中国农学通报,2012,28(21):65.
ZHANG N,ZHAO B P,REN P,etal.Effect of water stress on physiological characteristics in root of different oat cultivars [J].ChineseAgriculturalScienceBulletin,2012,28(21):65.
[8] 张 娜,赵宝平,郭若龙,等.水分胁迫对不同抗旱性燕麦品种生理特性的影响[J].麦类作物学报,2012,32(1):150.
ZHANG N,ZHAO B P,GUO R L,etal.Effect of water stress on physiological characteristics of different oat cultivar [J].JournalofTriticeaeCrops,2012,32(1):150.
[9] 刘景辉,赵海超,任永峰,等.土壤水分胁迫对燕麦叶片渗透调节物质含量的影响[J].西北植物学报,2009,29(7):1433.
LIU J H,ZHAO H C,REN Y F,etal.Change of osmotica in oat leaf under soil moisture stress [J].ActaBotanicaBoreali-OccidentaliaSinica,2009,29(7):1433.
[10] 刘建新,王金成,王瑞娟,等.旱盐交叉胁迫对燕麦幼苗生长和渗透调节物质的影响[J].水土保持学报,2012,26(03):244.
LIU X J,WANG J C,WANG R J,etal.Interactive effect of drought and salinity stresses on growth and osmotic of naked oat seedlings [J].JournalofSoilandWaterConservation,2012,26(3):244.
[11] 李芳兰,包维楷.植物叶片形态解剖结构对环境变化的响应与适应[J].植物学通报,2005,22(增刊):119.
LI F L,BAO W K.Responses of the morphological and anatomical structure of the plant leaf to environmental change [J].ChineseBulletinofBotany,2005,22(S):119.
[12] 孟 雷,李磊鑫,陈温福,等.水分胁迫对水稻叶片气孔密度、大小及净光合速率的影响[J].沈阳农业大学学报,1990,30(5):480.
MENG L,LI L X,CHEN W F,etal.Effect of water stress on stomatal density,length,width and net photosynthetic rate in rice leave [J].JournalofShenyangAgriculturalUniversity,1990,30(5):480.
[13] 吴建慧,郭 瑶,崔艳桃.水分胁迫对绢毛委陵菜叶绿体超微结构及光合生理因子的影响[J].草业科学,2012,29(3):435.
WU J H,GUO Y,CUI Y T.Effects of water stress on ultrastructure and photosynthetic physiological factor ofPotentiallasericea[J].PrataculturalScience,2012,29(3):434.
[14] 郁 慧,刘中亮,胡宏亮,等.干旱胁迫对5种植物叶绿体和线粒体超微结构的影响[J].植物研究通报,2011,31(2):153.
YU H,LIU Z L,HU H L,etal.Effect of drought stress on the ultramicrostructures of chloroplasts and mitochondria of five plants [J].BulletinofBotanicalResearch,2011,31(2):153.
[15] 周宇飞,王德权,陆樟镳,等.干旱胁迫对持绿性高粱叶片渗透调节及叶绿体超微结构的影响[J].应用生态学报,2013,24(9):2548.
ZHOU Y F,WANG D Q,LU Z B,etal.Impact of drought stress on leaf osmotic adjustment and chloroplast ultrastructure of staygreen sorghum [J].ChineseJournalofAppliedEcology,2013,24(9):2548.
[16] 万里强,石永红,向 林.高温干旱胁迫下三个多年生黑麦草品种叶绿体和线粒体超微结构的变化[J].草业学报,2008,18(1):25.
WNG L Q,SHI Y H,XIANG L.Alterations in leaf cellular ultra-structure of three varieties ofLoliumperennesubjected to high temperature and soil drought stress [J].ActaPrataculturaeSinica,2008,18(1):25.
[17] 翟中和,王喜忠,丁明孝.细胞生物学[M].北京:高等教育出版社,2000:207.
ZHAI Z H,WANG X Z,DING M X.Cell Biology [M].Beijing:Higher Education Press,2000:207.
[18] 郑敏娜,李向林,万里强,等.水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J].草地学报,2009,17(5):644.
ZHANG M L,LI X L,WAN LQ,etal.Effect of water stress on ultrastructures of chloroplast and mitochondria and photosynthesis in six gramineous grass species [J].ActaAgrestiaSinica,2009,17(5):644.
[19] 白志英,李存东,屈 平.干旱胁迫对小麦中国春Synthetic 6X代换系叶片超微结构的影响[J].电子显微学报,2009,28(1):71.
BAI Z Y,LI C D,QU P.Effect of drought stress on ultrastructure of flag leaves in wheat chromosome substitution lines [J].JournalofChineseElectronMicroscopySociety,2009,28(1):71.
[20]VASSILEVA V,SIMOVA-STOILOVA L,DEMIREVSKA K,etal.Variety-specific response of wheat(TriticumaestivumL.) leaf mitochondria to drought stress [J].JournalofPlantResearch,2009,122:448.
[21] 陈健辉,李荣华,郭培国,等.干旱胁迫对不同耐旱性大麦品种叶片超微结构的影响[J].植物学报,2011,46(1):32.
CHEN J H,LI R H,GUO P G,etal.Impact of drought stress on the ultrastructure of leaf cells in three barley genotypes differing in level of drought tolerance [J].ChineseBulletinofBotany,2011,46(1):32.
[22] 闻志彬,莱孜提·库里库,张明理.干旱胁迫对3种不同光合类型荒漠植物叶绿体和线粒体超微结构的影响[J].西北植物学报,2016,36(6):1156.
WEN Z B,LAZITI K,ZHANG M L.Effect of soil drought stress on the ultramicstructural of chloroplasts and mitochondria in there desert plants with different photosynthetic types [J].ActaBotanicaBoreali-OccidentaliaSinica,2016,36(6):1156.
[23]RYAN J,ESTEFAN G,RASHID A.Soil and Plant Analysis Laboratory Manual [M].Aleppo:Jointly published by the International Center for Agricultural Research in the Dry Areas(ICARDA) and the National Agricultural Research Center(NARC),2001:25-36.
[24] 邹 琦.植物生理试验指导[M].北京:中国农业出版社,2000:51- 54.
ZOU Q.Guidance of Plant Physiological Experiment [M].Beijing:China Agriculture Press,2000:51-54.
[25] 孙永梅,刘丽杰,冯明芳,等.植物在低温胁迫下的糖代谢研究进展[J].东北农业大学学报,2015,46(7):95.
SUN YM,LIU L J,FENG M F,etal.Research progress of sugar metabolism of plants under cold stress [J].JournalofNortheastAgriculturalUniversity,2015,46(7):95.
[26] 李广敏,关军锋.作物抗旱生理与节水技术研究[ M].北京:气象出版社,2001:6.
LI G M,GUANJ F.Study on Crop Drought Resistance and Water Saving Technology [M].Beijing:Meteorological Press,2001:6.
[27] 简令成,王 红.逆境植物细胞生物学[M].北京:科学出版社,2009:115.
JIAN L C,WANG H.Adversity Plant Cell Biology [M].Beijing:Science Press,2009:115.
[28] 郭建平,高素华.土壤水分对冬小麦影响机制研究[J].气象学报,2003,61(4):502.
GUO J P,GAO S H.Mechanism study on impact of soil water on winter wheat [J].ActaMeteorologicaSinica,2003,61(4):502.
[29] 林叶春,钱 欣,曾昭海,等.负水头供水裸燕麦需水特性及其对不同土壤湿度的生理响应[J].农业工程学报,2012,28(16):97.
LIN Y C,QIAN X,ZENG Z H,etal.Water consumption property of naked oat irrigated by negative pressure water supplying equipment and its physiological responses to soil humidity [J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2012,28(16):97.
[30]CECCARELLI S.Specific adaptation and breeding for marginal conditions [J].Euphytica,1994,77:205.
[31]RISTIC Z,CASS D D.Chloroplast structure after water shortage and high temperature in two lines ofZeamaysL.that differ in drought resistance [J].BotanicalGazette,1991,152:186.
[32] 韩善华.油菜叶绿体在干旱处理过程中的超微结构变化[J].作物学报,1991,17(4):312.
HAN S H.Ultrastructural change of rape chloroplasts during drought treatments [J].ActaAgronomicaSinica,1991,17(4):312.
[33] 王复标,黄福灯,程方民,等.水稻生育后期叶片早衰突变体的光合特性与叶绿体超微结构观察[J].作物学报,2012,38(5):878.
WANG F B,HUANG F D,CHANG F M,etal.Photosynthesis and chloroplast ultra-structure characteristics of flag leaves for a premature senescence rice mutant [J].ActaAgronomicaSinica,2012,38(5):878.
EffectofDroughtStressonStomataandUltrastructureofMesophyllCellsofOatLeaf
ZHANGZhifen1,LIUJinghui1,FUXiaofeng2,ZHAOBaoping1,LILijun1,LIUJunqing2,YANGHaishun2
(1.Inner Mongolia Agricultural University,Hohhot,Inner Mongolia 010018,China; 2.Inner Mongolia Academy of Agriculture and Animal Husbandry,Hohhot,Inner Mongolia 010031,China)
时间:2017-09-13
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170913.1139.024.html
S512.6;S311
A
1009-1041(2017)09-1216-08
2017-05-05
2017-05-31
国家燕麦荞麦产业技术体系项目(CARS-08-B-5);国家自然科学基金项目(31560373);内蒙古自然科学基金项目(2015MS0353)
E-mail:zzf2663@126.com
刘景辉(E-mail:cauljh@163.com)

