2-(2-羟苯基)-1H-苯并咪唑系列化合物的合成及光谱性质研究
郑巧巧,吴林钢,吴佩玲,沈静静,吴雅姿,陈定奔
2-(2-羟苯基)-1H-苯并咪唑系列化合物的合成及光谱性质研究
郑巧巧,吴林钢,吴佩玲,沈静静,吴雅姿,陈定奔
(台州学院医药 化工学院, 浙江 台州 318000)
以2-硝基苯胺或取代2-硝基苯胺为初始原料,利用保险粉直接还原缩合“一锅法”合成目标产物2-(2-羟苯基)-1H-苯并咪唑系列化合物。测试了该类化合物荧光性质及紫外光谱性质,发现了化合物具有较强荧光性质,研究了其荧光、紫外光谱的变化规律,探讨了各取代基对化合物荧光及紫外性质的影响。
2-(2-羟苯基)-苯并咪唑;合成;荧光光谱;紫外光谱
2-(2-羟苯基)-苯并咪唑及其衍生物是一类重要的荧光化合物,被广泛用于医药、工业等行业[1]。此类化合物通过激发态分子内质子转移(ESIPT)而具有强烈的发射斯托克斯位移特征的荧光性能,备受人们关注。在新型荧光探针、高能量的辐射探测器、塑料闪烁体和聚合物紫外线稳定剂方面具有广泛的应用前景,在生物学储存器电路的开发和应用具有重要意义。
通常情况下,一般利用邻苯二胺与有机羧酸或其衍生物的环化、脱水反应合成该类化合物[2,3],也有文献报道用PPA作缩合剂,微波辐照下合成了这类化合物[4-6]。本文以2-硝基苯胺或取代2-硝基苯胺为初始原料,利用保险粉直接还原缩合“一锅法”合成目标产物2-(2-羟苯基)-1H-苯并咪唑系列化合物,研究其紫外和荧光光谱,探讨各取代基对其光谱性质的影响。
1 实验部分
1.1 主要仪器与试剂
Nicolet 5700型智能傅立叶红外光谱仪(美国);Varian mercury Vx-200核磁共振波谱仪(美国),UV-2401PC型紫外分光光度计(日本岛津);Cary Eclipse 荧光分光光度计(美国瓦里安);WRS-1B数字熔点仪(温度计未经校正,申光)。
2-硝基苯胺(化学纯,国药试剂集团,下同。);5-氯-2-硝基-苯胺;5-甲基-2-硝基-苯胺;5-氟水杨醛;5-氯水杨醛;5-溴水杨醛;3,5-二氯水杨醛;3,5-二溴水杨醛;无水乙醇;保险粉;氢氧化钠。
1.2 2-(2-羟苯基)-1H-苯并咪唑化合物的合成
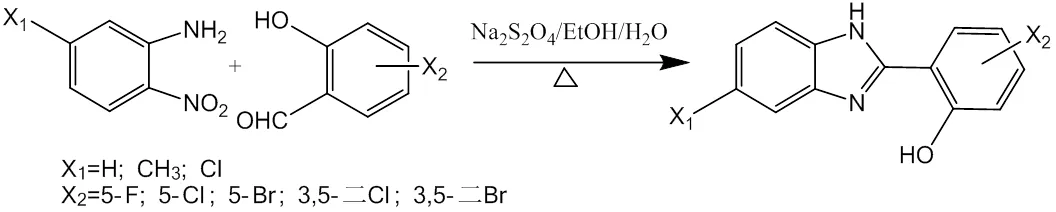
称取2-硝基苯胺或取代2-硝基苯胺(10.0 mmol),取代水杨醛(10.0 mmol)加入到三口烧瓶中,加入乙醇(40 mL),搅拌,再加入保险粉5.22 g(30.0 mmol)及水30 mL,在80 ℃下水浴加热反应6 h,停止反应冷却至室温,滴加NaOH至pH = 8,抽滤,并将滤饼转入到小烧杯中,加入少量乙醇重结晶纯化,干燥,称量。产率:70.2 %~87.3 %。
(1)2-(5-氟-2-羟苯基)-1H-苯并咪唑(1a):黄绿色固体粉末,产率70.2%。m.p. 240.3~240.8 ℃ (文献值[7]:240~242 ℃)。1HNMR (DMSO-d6),δ:6.98~7.21(m,2H),7.24(dd,J1= 3.4 Hz,J2=6.1 Hz,2H),7.62(dd,J1= 3.4 Hz,J2=5.8 Hz,2H),7.84 (dd,J1= 3.1 Hz,J2=9.8 Hz,1H),13.03 (S,2H)。IR(KBr) 3 377.1,2 360.7,2 343.4,1 492.8,1 452.3,1 394.4,1 251.7,1 197.7,1 168.8,819.7,736.8 cm-1。
(2) 2-(5-氯-2-羟苯基)-1H-苯并咪唑(2a):淡黄色固体粉末,产率81.8%。m.p.>300 ℃。1HNMR(DMSO-d6),δ:7.05(d,J=8.9 Hz,1H),7.28(dd,J1= 3.1 Hz,J2=5.8 Hz,2H),7.38(dd,J1= 2.4 Hz,J2=8.6 Hz,1H),7.68(S,2H),8.16(d,J=2.4 Hz,1H),13.25(S,2H)。IR(KBr)3 567.1,1 486.1,1 395.4,1 379.0,1 282.6,1 256.5,812.9,722.3 cm-1。
(3) 2-(5-溴-2-羟苯基)-1H-苯并咪唑(3a):淡黄色晶体,产率79.6%。m.p.299~300 ℃。1HNMR(DMSO-d6),δ:6.96(d,J=8.6 Hz,1H),7.25(t,2H),7.45(dd,J1= 2.5 Hz,J2=8.9 Hz,1H),7.57(t,2H),8.25(d,J=2.4 Hz,1H),13.23(S,2H)。IR(KBr) 3 301.9,2 500.5,1 487.0,1 450.4,1 394.4,1 372.3,1 281.6,1 255.6,1 235.3,1 226.6,811.0,800.4,732.9,699.1,623.9 cm-1。
(4) 2-(3,5-二氯-2-羟苯基)-1H-苯并咪唑(4a):淡黄色晶体,产率75.3%。m.p.>300 ℃。1HNMR(DMSO-d6),δ:7.27(dd,J1= 3.1 Hz,J2=6.1 Hz,2H),7.62(m,3H),8.10(t,1H),13.90(S,2H)。IR(KBr) 3 367.5,1 627.8,1 490.9,1 460.0,1 380.9,1 278.7,1 263.3,1 245.9,1 190.0,850.5,840.9,761.8,734.8,702.0 cm-1。
(5) 2-(3,5-二溴-2-羟苯基)-1H-苯并咪唑(5a):黄绿色晶体,产率84.7%。m.p.249.7~252.3 ℃。1HNMR(DMSO-d6),δ:7.27(m,2H),7.63(dd,J1= 3.4 Hz,J2=6.1 Hz,2H),7.84(d,J=2.1 Hz,1H),8.26(d,J=2.4 Hz,1H),13.95(S,3H)。 IR(KBr) 3 396.4,3 066.6,2 530.4,1 448.4,1 369.4,1 257.5,848.6,750.3,740.6,686.6,551.6cm-1。
(6) 2-(5-氟-2-羟苯基)-6-甲基-1H-苯并咪唑(1b):得乳黄色粉末,产率82.6%。m.p287.9~288.4 ℃。1HNMR(DMSO-d6),δ:2.46(S,3H),7.00~7.28(m,3H),7.46(S,1H),7.54(d,J=8.2 Hz,1H),7.86(dd,J1= 3.1 Hz,J2=9.8 Hz,1H),13.05(S,2H)。13CNMR(DMSO-d6)δ:39.70,40.12,40.54,40.96,41.38,120.82,127.39,127.87,130.40,130.73,132.60,132.98,137.07,153.95,172.77。13CNMR(DMSO-d6)δ:21.76,120.82 ,127.39,127.87,130.40,130.73,132.60,132.98,137.07,153.95,172.77。IR(KBr) 3 375.2,2 362.6,1 529.4,1 490.9,1 458.1,1 394.4,1 263.3,1 249.8,1 197.7,1 172.6,812.0,796.5 cm-1。
(7) 2-(5-氯-2-羟苯基)-6-甲基-1H-苯并咪唑(2b):土黄色粉末,产率81.2%。m.p.297.2~299 ℃。1HNMR(DMSO-d6),δ:2.45(S,3H),7.04(dd,J1=8.9 Hz,J2=13.4 Hz,2H),7.37(dd, J1=2.8 Hz,J2=11.6 Hz,1H),7.46(S,1H),7.54(d,J=7.9 Hz,1H),8.13(d,J=2.8 Hz,1H),13.23(S,2H)。13CNMR(DMSO-d6)δ:19.25,21.95,114.68,115.52,119.64,123.38,125.33,126.11,131.73,133.37,136.01,137.19,150.58,157.33。IR(KBr) 3 269.1,1 485.1,1 375.2,1 272.9,1 249.8,798.5 cm-1。
(8) 2-(5-溴-2-羟苯基)-6-甲基-1H-苯并咪唑(3b):淡棕色粉末,产率82.5%。m.p.280.4~282.5 ℃。1HNMR(DMSO-d6),δ:2.45(S,3H),6.98(S,1H),7.10(d,J=8.2 Hz,1H),7.47(dd,J1=2.4 Hz,J2=8.9 Hz,3H),8.26(d,J=2.4 Hz,1H),13.19(d,J=22.9 Hz,2H)。13CNMR(DMSO-d6)δ:21.96,110.78,112.06,115.38,118.33,120.09,125.26,128.90,133.45,134.47,150.61,157.76。IR(KBr) 3 288.4,2 574.8,2 360.7,2 343.4,1 585.4,1 481.2,1 373.2,1309.6,1 259.4,1 278.7,1 228.6,813.9,798.5,617.2 cm-1。
(9) 2-(3,5-二氯-2-羟苯基)-6-甲基-1H-苯并咪唑(4b):土黄色针状晶体,产率78.5%。m.p.271.1~273 ℃。1HNMR(DMSO-d6),δ:2.46(S,3H),7.13(d,J=8.6 Hz,1H),7.47(S,1H),7.55(d,J=7.9 Hz,1H),7.64(d,J=2.4 Hz,1H),8.11(d,J=2.4 Hz,1H),13.90(S,2H);13CNMR(DMSO-d6)δ:21.94,115.31,122.72,123.12,124.79,125.70,131.12,133.81,150.16,153.71。IR(KBr) 3 689.6,3 676.1,3 649.1,3 375.2,2 360.7,1 458.1,1 379.0,1 365.5,1 307.6,1 257.5,1 184.2,1 134.1,852.5,796.5,754.1,704.0,597.9,572.8 cm-1。
(10) 2-(3,5-二溴-2-羟苯基)-6-甲基-1H-苯并咪唑(5b):棕色针状晶体,产率84.2%。m.p.262.5~263 ℃。1HNMR(DMSO-d6),δ:2.40(S,3H),7.11(S,1H),7.41(S,1H),7.49(d,J=8.6 Hz,1H),7.80(d,J=2.1 Hz,1H),8.21(d,J=2.1 Hz,1H),13.92(S,3H)。IR(KBr) 3 390.6,1 448.4,1 363.6,1 307.6,1 257.5,1 176.5,842.8,794.6,596.0,553.5,501.5 cm-1。
(11) 2-(5-氟-2-羟苯基)-6-氯-1H-苯并咪唑(1c):淡黄色晶体,产率80%。m.p.>300 ℃。1HNMR(DMSO-d6),δ:7.03(dd,J1=4.6 Hz,J2=8.9 Hz,1H),7.22~7.31(m,2H),7.68(d,2H),7.88(dd,J1=3.1 Hz,J2=9.5 Hz,1H),12.52(S,1H),13.30(S,1H);13CNMR(DMSO-d6)δ:112.77,113.27,113.57,113.74,119.12,119.28,119.74,123.90,127.93,152.34,153.44,154.76,158.10。IR(KBr) 3 369.4,3 074.3,1 431.1,1 411.8,1 261.4,1 195.8,1 166.9,1 120.6,813.9,796.5 cm-1。
(12) 2-(5-氯-2-羟苯基)-6-氯-1H-苯并咪唑(2c):黄色粉末,产率78.9%。m.p.>300 ℃。1HNMR(DMSO-d6),δ:7.06(d,J=8.9 Hz,1H),7.28-7.46(m,2H),7.67(t,2H),8.16(d,J=2.8 Hz,1H),13.16(S,2H);13CNMR(DMSO-d6)δ:114.74,116.20,118.32,119.76,122.43,123.58,123.95,126.65,127.99,128.28,132.19,152.08,157.18。IR(KBr) 3 340.5,1 631.7,1 581.5,1 487.0,1 379.0,1 288.4,1 253.6,813.9,547.7 cm-1。
(13) 2-(5-溴-2-羟苯基)-6-氯-1H-苯并咪唑(3c):淡黄色粉末,产率74.2%。m.p.298.4~300 ℃。1HNMR(DMSO-d6),δ:7.01(d,J=8.6 Hz,1H),7.28(dd,J1=1.8 Hz,J2=8.6 Hz,1H),7.51(dd,J1=2.4 Hz,J2=8.9 Hz,1H),7.67(t,2H),8.28(d,J=2.8 Hz,1H),13.16(S,2H);110.99,115.34,120.19,123.97,128.05,129.53,135.00,151.99,157.59,204.89,210.45,224.26,247.76。IR(KBr) 3 689.6,3 649.1,3 340.5,1 577.7,1 490.9,1 481.2,1 384.8,1 373.2,1 286.4,1 278.7,1 253.6,1 139.9,1 058.8,837.0,812.0,632.6,542.0 cm-1。
(14) 2-(3,5-二氯-2-羟苯基)-6-氯-1H-苯并咪唑(4c):淡黄色晶体,产率73.4%。m.p.>300 ℃。1HNMR(DMSO-d6),δ:7.67(d,J=2.5 Hz,4H),8.11(d,J=2.5 Hz,1H),13.80(S,2H)。IR(KBr) 3 369.4,3 081.1,1 452.3,1 433.0,1 365.5,1 302.8,1 253.6,1 182.3,1 059.8,935.4,861.2,854.4,838.0,763.8,704.0,595.0,576.7 cm-1。
(15) 2-(3,5-二溴-2-羟苯基)-6-氯-1H-苯并咪唑(5c):橘红色粉末,产率87.3%,m.p.199~201.1 ℃。1HNMR(DMSO-d6),δ:7.56(S,1H),7.68(S,1H),7.92(m,2H),8.97(d,J=5.5 Hz,1H),13.64(S,1H),13.84(S,1H);13CNMR(DMSO-d6)δ:110.22,113.98,120.91,121.52,128.35,128.65,129.93,131.07,133.31,134.03,135.28。IR(KBr) 3 435.0,1 610.5,1 485.1,1 438.8,1 352.0,1 294.1,1 203.5,1 164.9,1 120.6,864.1,808.1,688.5 cm-1。
2 结构及荧光、紫外光谱分析
2.1 结构分析
从IR数据猜测,波数1 585.4~1 452.3 cm-1为苯环伸缩振动吸收峰;1 058.8~1 226.6 cm-1为C-N伸缩振动吸收峰;1 627.8~1 631.7 cm-1为C=N伸缩振动吸收峰;3 396.4~3 435.0 cm-1为N-H伸缩振动吸收峰;3 435.0~3 689.6 cm-1为O-H伸缩振动吸收峰;1 120.6~1 263.3 cm-1为C-F伸缩振动吸收峰;702.0~850.5 cm-1为C-Cl伸缩振动吸收峰;501.5~686.6 cm-1为 C-Br伸缩振动吸收峰;754.1~1197.7 cm-1为 C-C伸缩振动吸收峰。
从1HNMR谱图(主要数据见表1)可知:具有3,5-二Cl;3,5-二Br取代基的化合物,其化学位移值相其它化合物大,分析原因可能为3,5-二Cl或3,5-二Br取代基,其电负性较强,吸电子诱导效应大,使得靠近它们的质子周围电子云密度减小,质子所受到的抗磁性屏蔽减小,所以共振发生在较低场,化学位移值就大。并且,电负性基团越多,吸电子诱导效应的影响越大。
从13CNMR数据看出,为20附近应对应与苯环相连的甲基;=110~140范围处对应没有和氧或其他供电子基团相连芳环上的碳原子;为140以上处对应是和氧或其他供电子基团相连芳环上的其他碳原子。

表1 化合物的1HNMR数据
2.2 荧光光谱分析
将化合物a、b、c配制成1×10-5mol·L-1的乙醇溶液,测得它们的最大激发波长max1、最大发射波长max2及最大荧光强度(见表2)。
观察苯并咪唑类化合物的荧光谱图(图1)可得:具甲基取代基的同类化合物,其荧光强度最大,但其最大发射波长相对较小,而具氯取代基的同类化合物,其荧光强度最弱,但其最大发射波长最长,分析其原因为:
(1) 取代基的影响:在化合物b中,邻对位取代基CH3为推电子取代基,P→π共轭引起分子刚性芳环的电子云密度升高,产生的荧光的几率增大,导致荧光的波长和强度增大。
(2) 重原子效应:在化合物c的苯并咪唑环上引入相对较重的Cl原子,使得荧光分子中自旋轨道偶合作用增强,造成分子激发态的单重态和三重态电子在能量上更加接近(即两者之间的能量差减小),导致产生荧光的几率下降而出现荧光减弱,并且这种内部重原子效应是按照F、Cl、Br的次序依次递减。其中,化合物1b在波长400 nm处出现双重峰,主要原因是二位苯上羟基所带的电子与苯并咪唑-NH所带的质子发生转换,形成异构体。化合物5c的最大发射光谱峰发生蓝移,荧光强度明显减小。

表2 化合物的荧光光谱数据
以a类化合物的荧光发射光谱为例:

图1 a类化合物的荧光发射光谱
2.3 紫外光谱分析
将化合物a、b、c配制成1×10-3mol·L-1的乙醇溶液,在200~400 nm的紫外区内,测定其紫外吸收光谱(以a类化合物的紫外可见光谱图2为例,数据见表3)。
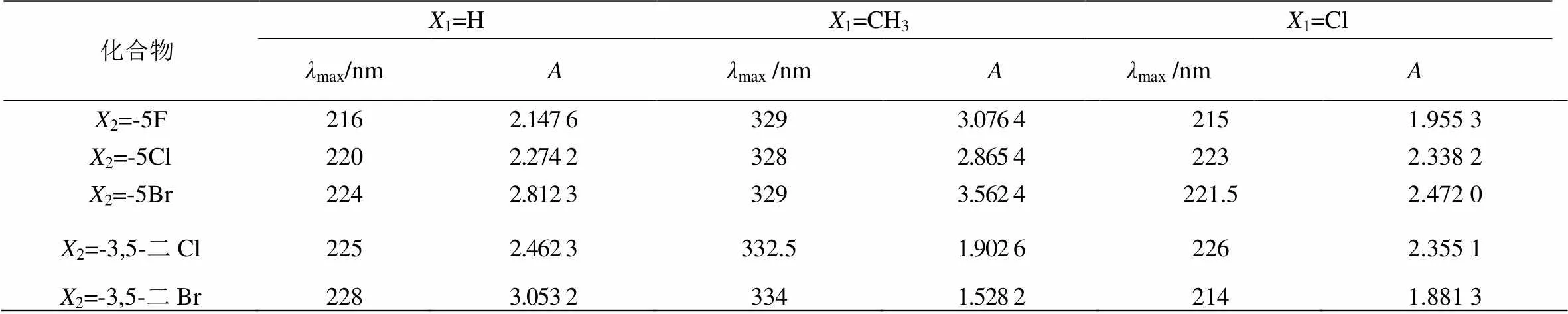
表3 化合物的紫外可见光谱数据
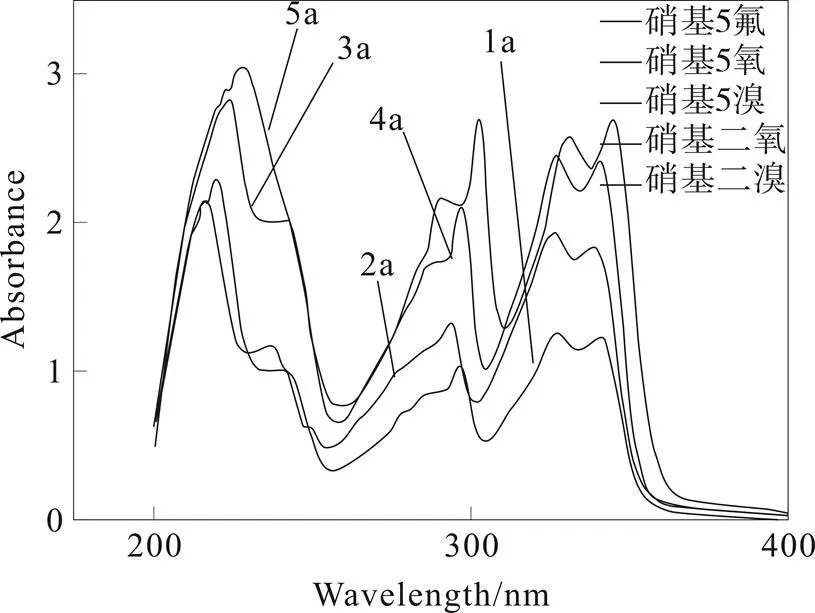
图2 a类化合物的紫外可见光谱图
3 结论
观察荧光谱图可知,具甲基取代基的同类化合物,其荧光强度最大,但其最大发射波长相对较小,而具氯取代基的同类化合物,其荧光强度最弱,但其最大发射波长最长。
观察紫外光谱图 (b类及c类化合物紫外可见光谱图略)可知,紫外光吸收强度大小为:b>a>c,分析其原因主要为:b系列化合物的苯环上引入了CH3取代基,为推电子基, p→π共轭引起分子刚性芳环的电子云密度升高,使得紫外光吸收强度增加,b系列化合物的最大吸收波长发生红移,与b系列化合物相比,c系列化合物的苯环上引入了Cl取代基,为吸电子基,使得c系列化合物发生蓝移,强度也减小。a系列化合物的紫外光吸收强度大小为:5a>3a>4a>2a>1a,分析其原因主要为:a系列化合物的苯环上分别引入了F、Cl、Br,这些卤族元素均为吸电子基,且吸电子强度为:F>Cl>Br,因此造成a系列化合物发生蓝移,且蓝移大小为:1a>2a>3a>4a>5a,由于吸电子取代基的引入,使得分子芳环的电子密度下降,且1a<2a<3a,4a<5a。
[1] 于瑞林, 欧阳杰, 王苹,等. 三价锰存在下2-(1H-苯并咪唑-2-基)-苯酚及其衍生物的合成与其光谱特性[J]. 天津理工大学学报, 2005, 21(6):44-47.
[2]徐云根, 罗穗, 华维一. 2-(取代苯氨基)苯并咪唑合成方法的改进[J]. 化学通报, 2004, 11:4-6.
[3]ChinPao Chen,Yi-Jing Chen.Liquid-Phase Synthesis of–2-Substituted benzimidazoles, benzoxazoles and benzothia-zoles[J].Tetrahedron Letters, 2004, 45:113-115.
[4]张水花, 陆伟东. 微波促进双苯并咪唑基化合物的合成[J]. 红河学院学报, 2006, 4(5):13-13.
[5]吕维忠. 微波辐射下2-氨基苯并咪唑的合成与表征[J]. 化学试剂, 2006,12:32-33.
[6]潘文龙. 微波辐射下2-苯并咪唑基烯烃的一步法合成[J]. 中山大学学报(自然科学版), 2006,06:21-24.
[7]于文涛, 陈国松, 张红漫, 等. 以Na2S2O4为还原剂光度法测定废水中硝基苯[J]. 分析实验室, 2002, 21(4):88-89.
[8]Chih-Ming Yeh and Chung-Ming Sun . Liquid-phase synthesis of 2-(alkylthio) benzimidazoles[J].Tetrahedron Letters,1999,40:7247-7250.
Study on Synthesis and Spectral Properties of 2-(2-Hydroxy phenyl)-1H-benzimidazoles
,,,,,
(College of Pharmaceutical and Chemical Engineering, Taizhou University, Zhejiang Taizhou 318000,China)
Fifteen 2-(2-hydroxy phenyl)-1H-benzimidazoles were synthesized by “one-pot”direct reduction condensation from 2-nitroaniline and substituted salicylaldehyde using insurance powder. Their fluorescent and UV spectra were characterized, and their strong fluorescent properties were found. The effect of substituents of the compounds on the fluorescence and UV properties was discussed.
2-(2-hydroxy phenyl)-1H-benzimidazole; Synthesis; UV; Fluorescent
TQ 252
A
1671-0460(2017)06-1051-04
国家自然科学基金资助项目( 21302135)。
2016-12-06
郑巧巧(1995-),女,浙江衢州人,研究方向:有机化学合成。E-mail:1018458508@qq.com。
陈定奔,E-mail:cdb23@163.com。

