MPTP致空间学习记忆障碍小鼠脑内NSF表达变化*
徐 红, 余伟志, 薛 莹, 邢 悦, 肖昭扬, 孙艺平, 张万琴, 赵 杰, 唐一源, 殷盛明△
(1. 大连医科大学基础医学院, 辽宁 大连 116044; 2. 大连医科大学13-15级研究生, 辽宁 大连 116044;3. 大连医科大学附属第二临床学院, 辽宁 大连 116023; 4. 美国德州理工大学脑成像研究院, 德克萨斯州 79409)
MPTP致空间学习记忆障碍小鼠脑内NSF表达变化*
徐 红1, 余伟志2, 薛 莹2, 邢 悦2, 肖昭扬3, 孙艺平1, 张万琴1, 赵 杰1, 唐一源4, 殷盛明1△
(1. 大连医科大学基础医学院, 辽宁 大连 116044; 2. 大连医科大学13-15级研究生, 辽宁 大连 116044;3. 大连医科大学附属第二临床学院, 辽宁 大连 116023; 4. 美国德州理工大学脑成像研究院, 德克萨斯州 79409)
目的观察1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)致空间学习记忆障碍小鼠脑内N-乙基马来酰亚胺敏感融合蛋白(NSF)表达变化。方法C57BL/6J小鼠随机分为2组(n=24),包括对照组和MPTP处理组,雌雄各半。MPTP处理组给予C57BL/6J小鼠MPTP (20 mg/0.2 ml/(kg·d), s.c.) 连续8 d,每天一次,对照组给予等量的生理盐水用同样方法处理。第9天起采用水迷宫实验,连续4 d检测C57BL/6J小鼠空间学习记忆的改变,水迷宫实验测试结束后,采用免疫组化和Western blot方法检测小鼠脑内NSF表达改变。结果每组选取小鼠24只进行水迷宫测试,与对照组相比,MPTP处理组小鼠出现空间学习记忆障碍;每组选取小鼠5只进行免疫组化检测,同时每组选取5只小鼠进行Western blot检测,海马CA1区NSF免疫反应活性明显减弱(P<0.01),前额叶皮层NSF的免疫反应活性(P<0.01)和蛋白表达(P<0.05)都明显增高。结论MPTP致空间学习记忆障碍小鼠脑内NSF表达出现异常,可能参与MPTP致空间学习记忆障碍的发病机制。
1-甲基-4-苯基-1,2,3,6-四氢吡啶;空间学习记忆;N-乙基马来酰亚胺敏感融合蛋白
MPTP; spatial Learning memory; NSF
帕金森病(Parkinson's disease,PD)是常见的中老年神经变型性疾病,认知障碍是常见的非运动症状[1],包括空间学习记忆障碍,影响PD患者的生活质量,但是其相关机制尚不清楚。
已有研究提示PD患者表现出工作记忆障碍,与其皮层相关神经元通路的受损有关[2,3]。1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)作为神经毒物可作用于多巴胺能神经元,进而引起其变性,已经广泛用来制备PD模型。MPTP可引起人和猴的认知功能障碍[4],认知功能障碍发生在运动症状之前[5]。我们前期研究已经发现MPTP可引起小鼠空间学习记忆障碍[5,6]。但是MPTP致空间学习记忆障碍小鼠脑内N-乙基马来酰亚胺敏感融合蛋白(N-ethylmaleimide-sensitive fusion protein, NSF)表达是否有异常改变尚不清楚。
NSF是在1998年Block等首次纯化得到。NSF已知在多种囊泡转运过程中发挥重要作用[7]。NSF与学习记忆关系密切,NSF调节神经递质释放和参与调解神经突触可塑性,通过突触前和突触后机制在学习记忆中起着重要的作用[8]。越来越多的研究提示NSF不仅参与调控生理条件下的学习记忆功能而且与病理状态下引起的学习记忆障碍密切相关。已有报道NSF在不同的学习记忆障碍动物模型的海马有异常表达[9]。Morris 水迷宫用于检测实验动物的空间学习记忆能力。Morris水迷宫可检测海马、纹状体、基底前脑和大脑皮层损伤的动物的空间学习记忆障碍[10]。本研究通过Morris 水迷宫筛选出MPTP引起的空间学习记忆障碍小鼠,进一步观察并分析小鼠海马和皮层区域NSF表达改变及其表达分布的变化特点,为进一步揭示PD患者伴有认知功能障碍的机制提供依据。
1 材料与方法
1.1 实验材料
MPTP购于美国Sigma公司,NSF抗体购于美国Santa Cruz Biotechnology公司,β-actin 抗体购于美国Sigma公司。实验所用C57BL/6J小鼠,体重为18~22 g,雌雄各半,由大连医科大学实验动物中心提供。水迷宫实验装置为DMS-2型水迷宫自动记录仪,是由中国医学科学院药物研究所研制。水迷宫主要由直径为120 cm和高50 cm的圆形水池构成,圆形水池平均分为4个象限。在其中一个象限低于水面0.5 cm处放置直径为12 cm和高为24 cm的透明有机玻璃站台。
1.2 MPTP模型制备与分组
48只6~7周龄的C57BL/6J小鼠随机分为对照组和MPTP处理组,每组24只。MPTP处理组小鼠给予颈部皮下注射MPTP(20 mg/0.2 ml/(kg·d)),每天一次,连续注射8日,对照组同样处理方法给予相同剂量的生理盐水。第9天进行水迷宫实验,每组选取小鼠24只进行水迷宫测试,检测C57BL/6J小鼠空间学习记忆的改变,水迷宫实验连续测试4 d,结束后每组选取小鼠5只进行免疫组化检测小鼠脑内NSF免疫反应活性改变,同时每组选取小鼠5只进行Western blot检测小鼠脑内NSF蛋白表达改变。
1.3 Morris水迷宫测试
具体实验方法参见已发表论文[5]。在测试中,实验装置周围的参照物不变,实验水域中加入脱脂奶粉便于识别实验小鼠。将小鼠放在实验平台上停留20 s,分别在每个象限,将实验小鼠面向水池壁的中点处放入水中,60 s内如果小鼠找到平台,就让其停留20 s,如果小鼠没找到平台,就将其放在平台上停留20 s,连续训练3 d。第4天将小鼠随机从任意象限中点面壁入水,训练其寻找平台。记录4 d的寻找隐匿平台潜伏期,评估其空间学习能力,第5天移除平台,在第1象限放入小鼠,记录小鼠在60 s内在目标象限和对侧象限里的游泳时间占总游泳时间的百分比,用以评估小鼠空间记忆能力。
1.4 免疫组织化学实验
采用4%水合氯醛 (400 mg/kg,i.p.) 将实验小鼠麻醉。分别用1%和4%的多聚甲醛进行灌流,将脑组织取出于4%的多聚甲醛中加以固定,蔗糖梯度脱水后,冰冻切取冠状脑片,厚度为50 μm,10 min×2的PBS漂洗,采用1%BSA进行30 min孵育;加入NSF抗体(1∶500)和β-actin 抗体(1∶500)后在 4℃条件下进行孵育过夜,10 min×2的PBS漂洗;分别与相应的生物素化二抗 (1∶400) 在室温下,进行1 h的振荡孵育,10 min×2的PBS漂洗;加入卵白素化生物素复合物A∶B∶PBS (1∶1∶400) 在室温下,振荡孵育2 h,采用二氨基联苯胺(3,3’-diaminobenzidine,DAB)进行显色。空白对照脑片的第一抗体用PBS加以代替。采用HPIAS系列彩色病理图文分析系统进行定量计数NSF免疫反应阳性表达信号数量。各组选取5只小鼠、测量面积为3120.4 μm2(43.1 μm×72.4 μm),计算选取的4个部位的计数平均值。根据Paxinos& Franklin (1997)小鼠脑图谱选取脑区,如图所示(图3A),所选方框脑区放大后为下列图。标尺为50 μm。前额叶皮层处的脑切片从Bregma 1.18 mm 开始连续切4片,海马从Bregma 2.18 mm开始连续切4片。每组选5个样本,统计分析前额叶皮层锥体细胞层和海马CA1区锥体细胞层的NSF免疫反应阳性表达信号数量。
1.5 Western blot检测小鼠脑内NSF蛋白表达含量的变化
根据图谱定位,选取小鼠额叶皮层脑区,每50~100 mg的小鼠脑组织加入1 ml Trizol进行匀浆,加入0.2 ml的氯仿进行摇匀,12 000 g×离心15 min;在有机相(大约0.8 ml)中加入1.5 ml异丙醇,在室温下静置10 min,在4℃条件下,12 000 g×离心10 min,弃上清后, 95%乙醇进行洗涤沉淀20 min×3,每次在洗涤后,在4℃条件下,7 500 g×离心5 min。真空条件下,干燥10 min,用1%SDS进行溶解沉淀(50℃,3 h),在4℃条件下,进行10 000 g×离心10 min,将上清移置新管,于-80℃条件下进行保存。采用分光光度计于595 nm下,进行蛋白含量的测定,SDS-PAGE,之后转膜、染色和脱色,采用凝胶分析系统(上海天能公司生产)进行定量分析,统计学处理NSF表达产物与内参的比值。
1.6 统计学处理
2 结果
2.1 水迷宫实验
MPTP处理8 d后,进行4 d的Morris水迷宫测试,测定其第1~4天寻找隐匿平台潜伏期。与对照组相比,MPTP组小鼠寻找隐匿平台潜伏期较对照组明显延长(P<0.01)。MPTP小鼠空间学习能力明显下降(图1)。
与对照组相比,MPTP组小鼠在第5天,于目标象限游泳的时间占总时间的百分比明显降低,在对侧象限游泳的时间占总时间百分比明显增高(P<0.01, 图2)。MPTP小鼠的空间记忆能力明显下降。
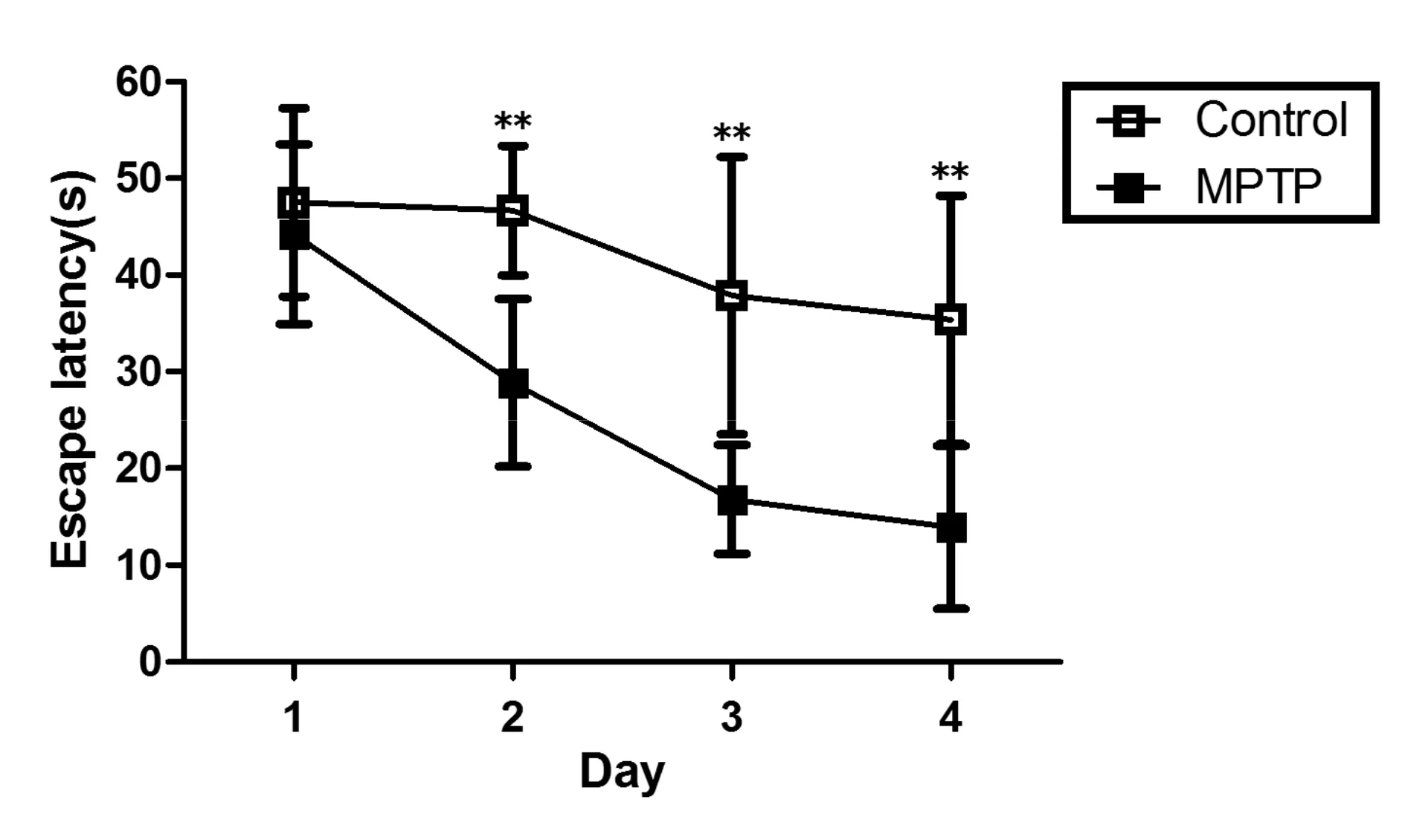
Fig.1The escape latency of C57BL/6 mice in the spatial learning MPTP: 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine**P<0.01vscontrol(n=24)

Fig.2Measurement of spatial learning and memory ability in C57BL/6J mice(n=24)**P<0.01vscontrol
2.2 免疫组织化学结果
与对照组相比,MPTP组小鼠海马CA1区NSF免疫反应阳性信号表达明显减弱(图3A,1,2),单位面积免疫反应阳性信号表达数量明显降低(P<0.01,图3B);在前额叶皮层(prefrontal cortex,PFc)的NSF免疫反应阳性信号表达明显增强(图3A,4),单位面积免疫反应阳性信号表达数量明显增多(P<0.01,图3B)。
2.3 Western blot结果
与对照组相比,MPTP组C57BL/6J小鼠在前额叶皮层(PFc)的NSF蛋白表达明显增多(P<0.01, 图4)。
3 讨论
认知功能障碍是帕金森病患者的非运动症状,随着其发生率的增高,对PD伴有的学习记忆障碍的相关研究逐步深入。Leplow B等发现PD早期的患者已经出现降低的学习记忆[11]。我们前期研究已经表明连续8 d给予MPTP(20 mg/0.2 ml/(kg·d))可引起C57BL/6J小鼠出现空间学习记忆障碍[5,6]。与我们的研究报道相似的还有李学坤等曾报道给予2次MPTP (4.0 mg/kg,s.c.),可引起 C57BL/6J小鼠出现空间学习记忆障碍[12]。MPTP作为神经毒物,可选择性引起多巴胺能神经元的变性,用于制备PD模型。我们前期研究已发现早期PD鼠脑内出现小胶质细胞激活[13],凋亡因子的表达增加[14],脑源性神经生长因子降低[15]和强啡肽表达出现异常[16]。但是MPTP致空间学习记忆障碍小鼠脑内NSF表达是否有异常改变尚不清楚。

Fig.3The results of NSF immnunoreactivity-positive signals in hippocampal CA1 and prefrontal cortex (scale bar=50 μm) A: 1 and 3 represented the control mice, 2 and 4 represented MPTP treated mice; B: The statistical results of NSF immnunoreactivity-positive signals in hippocampal CA1 and prefrontal cortex(n=5); MPTP: 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine; PFC: Prefrontal cortex; CA1: Hippocampus area**P<0.01vscontrol
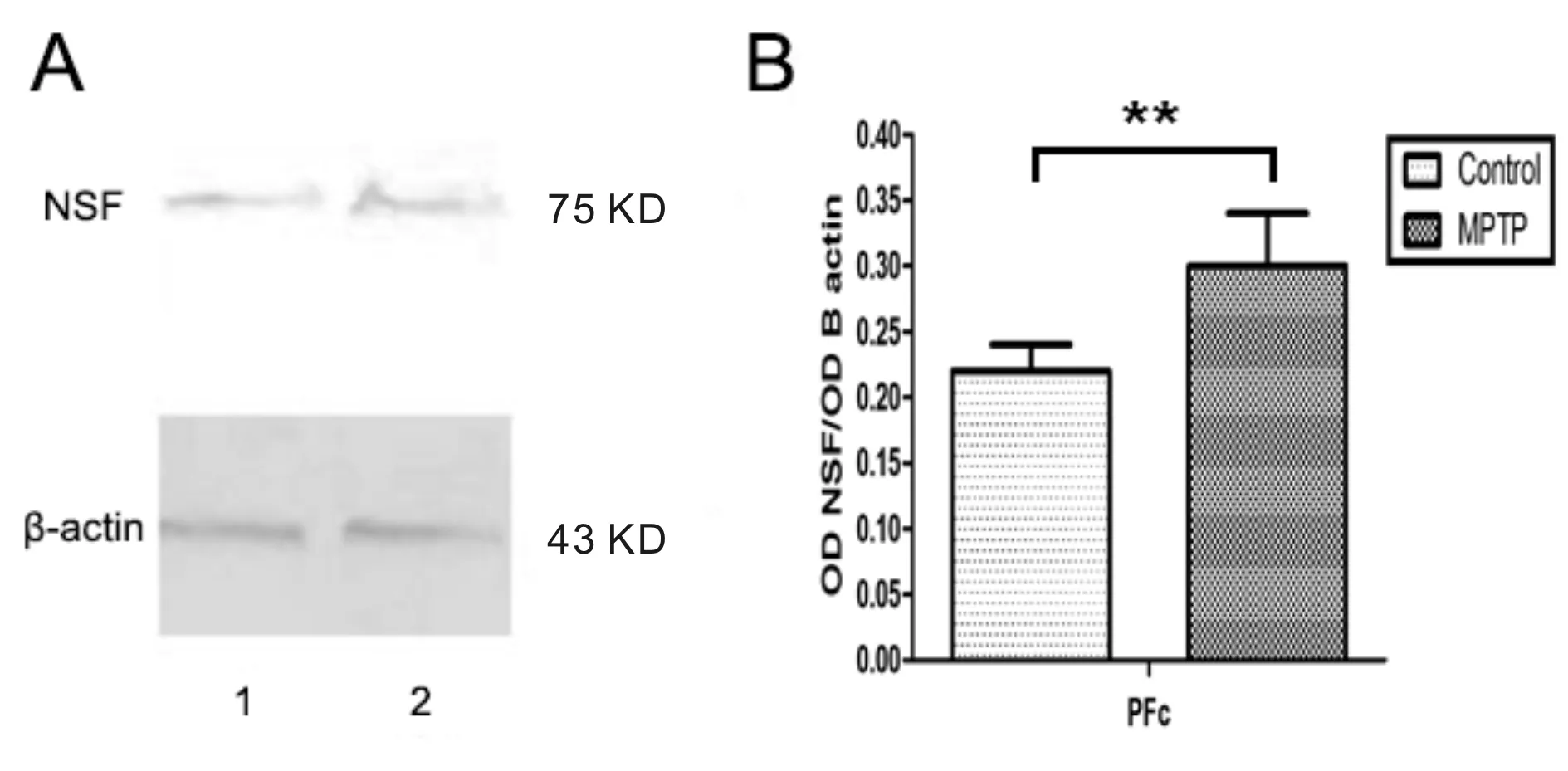
Fig.4The changes of NSF protein expression in prefrontal cortex A: 1 represented the control mice, 2 represented MPTP treated mice; B: The statistical results of NSF protein expression in prefrontal cortex(n=5); NSF: N-ethylmaleimide-sensitive fusion protein**P<0.01vscontrol
NSF是在神经递质释放过程中,参与突触囊泡和突触前膜融合过程的一种ATP酶,可调节不同类型细胞分泌过程及囊泡转运,并参与神经递质释放过程中突触囊泡和突触前膜的融合[17]。采用NSF抑制剂N-ethylmaleimide(NEM)处理神经元后,能够阻断诱导与学习记忆密切相关的长时程增强(long-term potentiation, LTP)[18]。在海马切片水平的研究表明,NEM能够明显增强CA1区的锥体神经元的抑制性突触电流的频率[19]。这些研究均提示NSF参与维持正常学习记忆的功能。但是MPTP引起的空间学习记忆障碍小鼠脑内NSF表达改变及其表达分布的变化特点尚不清楚。
我们的研究发现MPTP小鼠出现空间学习记忆障碍,在海马CA1区的NSF免疫反应阳性表达信号的免疫反应活性减弱,CA1区是海马三级突触的主要组成部分。CA1区锥体细胞通过Schaffer 侧支通路产生的LTP参与学习记忆,而且在CA1区的神经递质也参与学习记忆的调控机制。海马CA1区参与海马依赖的空间学习过程。我们发现MPTP致学习记忆障碍小鼠海马CA1处NSF表达减少很可能是引起学习记忆障碍的原因之一。有趣的是,我们还发现MPTP致学习记忆障碍小鼠前额叶皮层的NSF免疫反应活性和NSF蛋白表达明显增强。PD患者的额叶功能损害最为常见[20],已有研究证实PD伴有的认知功能障碍与皮质-皮质下多巴胺环路的破坏有关[21]。MPTP致学习记忆障碍小鼠前额叶皮层的NSF表达的增加有可能是MPTP造成损伤后的代偿机制。我们研究提示CA1区和前额叶皮层的NSF异常表达可能与PD小鼠空间学习记忆障碍的发病机制有关。进一步论证仍需采用以NSF基因为靶点的转基因小鼠进行深入研究。
[1] Xu J, Zhang J, Wang J,etal. Abnormal fronto-striatal functional connectivity in Parkinson's disease[J].NeurosciLett, 2016, 613(7): 66-71.
[2] Lewis SJ, Slabosz A, Robbins TW,etal. Dopaminergic basis for deficits in working memory but not attentional set-shifting in Parkinson's disease[J].Neuropsychologia, 2005, 43(6): 823-832.
[3] Cao CY, Zeng K, Li DY,etal. Modulations on cortical oscillations by subthalamic deep brain stimulation in patients with Parkinson disease: A MEG study[J].NeurosciLett, 2017, 636: 95-100.
[4] Schneider JS, Roeltgen DP. Delayed matching-to-sample, object retrieval, and discrimination reverasl deficits in chronic low dose MPTP treated monkeys[J].BrainRes, 1993, 615(2): 351-354.
[5] 殷盛明, 于德钦, 王世伟, 等. MPTP对小鼠空间学习和记忆能力的影响[J]. 中国行为医学与脑科学杂志, 2005, 14(1): 18-20.
[6] 殷盛明, 肖昭扬, 高 溪, 等. MPTP对小鼠空间学习记忆和脑内强啡肽免疫反应的影响[J]. 神经解剖学杂志, 2005, 21(2): 159-164.
[7] Ryu JK, Jahn R, Yoon TY. Review: Progresses in understanding N-ethylmaleimide sensitive factor (NSF) mediated disassembly of SNARE complexes[J].Biopolymers, 2016, 105(8): 518-531.
[8] Lin RC, Scheller RH. Mechanisms of synaptic vesicle exocytosis[J].AnnuRevCellDevBiol, 2000, 16: 19-49.
[9] Kirchner L, Weitzdoerfer R, Hoeger H,etal. Impaired cognitive performance in neuronal nitric oxide synthase knockout mice is associated with hippocampal protein derangements.NitricOxide, 2004, 11(4): 316-330.
[10]Dhooge R, De Deyn PP. Applications of the morris water maze in the study of learning and memory[J].BrainResBrainResRev, 2001, 36(1): 60-90.
[11]Leplow B, Holl D, Zeng L,etal. Spatial behaviour is driven by proximal cues even in mildly impaired Parkinson's disease[J].Neuropsychologia, 2002, 40(8): 1443-1455.
[12]李学坤, 张 卿, 郭安臣, 等. 移植的神经干细胞在帕金森病模型小鼠脑内的存活与分化[J]. 中国康复理论与实践, 2003, 9(7): 387-389.
[13]徐 红, 董方圆, 殷盛明, 等. 早期帕金森病大鼠胶质细胞免疫反应活性的改变及其意义[J]. 中国应用生理学杂志, 2012, 28(1): 71-73.
[14]徐 红, 安 冬, 殷盛明, 等. 蝎源活性肽对帕金森病大鼠凋亡因子改变的影响[J]. 中国应用生理学杂志, 2015, 31(3): 225-229.
[15]于德钦, 陈 薇, 殷盛明, 等. 蝎源活性肽对早期帕金森病大鼠脑源性营养因子及神经肽Y的影响[J]. 中国应用生理学杂志, 2017, 31(1): 30-32.
[16]王冬梅, 赵 丹, 殷盛明, 等. 蝎源活性肽对早期帕金森病大鼠强啡肽改变的保护作用[J]. 中国应用生理学杂志, 2015, 33(2): 120-122.
[17]Teng FY, Wang Y, Tang BL. The syntaxins[J].GenomeBiol, 2001, 2(11): 3012.1-3012.7.
[18]Morishita W, Kirov SA, Pitler TA,etal. N-ethylmaleimide blocks depolarization-induced suppression of inhibition and enhances GABA release in the rat hippocampal sliceinvitro[J].JNeurosci, 1997, 17(3): 941-950.
[19]Yao Y, Kelly MT, Sajikumar S,etal. PKM zeta maintains late long-term potentiation by N-ethylmaleimide-sensitive factor/GluR2-dependent trafficking of postsynaptic AMPA receptors[J].JNeurosci, 2008, 28(31): 7820-7827.
[20]Mohr E, Mendis T, Grimes JD. Late cognitive changes in Parkinson′s disease with an emphasis on dementia[J].AdvNeurol, 1995, 65: 113-197.
[21]Owen AM, James M, Leigh PN,etal. Frontostriatal cognitive deficits at different stages of Parkinson’s disease[J].Brain, 1992, 115(pt6): 1727-1751.
R282.74
A
1000-6834(2017)04-356-04
国家自然科学基金(31201724, 501680);大学生科研创新活动基金资助课题(201310161008)
2016-12-23
2017-05-15
△
Tel: 13889662795; E-mail: dlshengming@163.com
10.12047/j.cjap.5545.2017.086

