右美托咪啶对肺缺血/再灌注诱发小鼠肾脏超微结构改变的影响*
项冰倩, 高 慧, 罗梓垠, 方周溪, 王万铁△
(1. 温州医科大学基础医学院缺血/再灌注损伤研究所, 2. 温州医科大学电镜室, 浙江 温州 325035)
右美托咪啶对肺缺血/再灌注诱发小鼠肾脏超微结构改变的影响*
项冰倩1, 高 慧1, 罗梓垠1, 方周溪2△, 王万铁1△
(1. 温州医科大学基础医学院缺血/再灌注损伤研究所, 2. 温州医科大学电镜室, 浙江 温州 325035)
目的评价右美托咪啶对小鼠肺缺血/再灌注诱发肾脏损伤的影响。方法雄性健康SPF级C57BL/6J小鼠50只,体重20 g~24 g,8~10周龄,采用随机数字表法,将其分为5组(n=10):假手术组(sham组)、肺缺血/再灌注损伤组( I/R组)、肺缺血/再灌注+生理盐水组(NS组)、右美托咪啶组(Dex组)、右美托咪啶+阿替美唑(Atip)(DA组)。采用小鼠在体左侧肺门夹闭30 min再灌注180 min方法制备肺缺血/再灌注损伤(I/R)模型。Dex组在肺门阻断前30 min腹腔注射右美托咪啶20 μg/kg,NS组为用同Dex组等体积的生理盐水替代Dex,DA组腹腔注射右美托咪啶(20 μg/kg )+阿替美唑(250 μg/kg),其余处理同I/R组。再灌注结束后静脉取血ELISA法检测血浆中IL-1β和TNF-α浓度; 取双肾组织,透射电镜下观察肾组织病理学结果。结果与对照组相比,其余组血浆IL-1β和TNF-α浓度明显升高,肾组织病理学损伤明显加重;与I/R、NS、DA组相比,Dex组IL-1β和TNF-α浓度明显下降,差异有统计学意义(P<0.05),且肾组织超微结构损伤有所减轻。结论右美托咪啶预先给药可减轻小鼠肺缺血/再灌注诱发肾脏损伤,其机制可能与抑制炎性反应有关。
右美托咪啶;缺血/再灌注损伤;肾;IL-1β; TNF-α
肺缺血/再灌注损伤(ischemia reperfusion injury,IRI)是围手术期常见并发症之一,是临床常见的病理过程,多见于肺溶栓治疗、肺移植、肺动脉袖状切除、心肺联合移植等手术治疗。肺缺血/再灌注损伤常引发急性肺损伤,同时也伴随远隔器官的功能障碍和病理性损伤,如心脏、肝脏及肾脏等。肾脏毛细血管丰富,对肺I/R反应中的促炎因子较为敏感,使之容易发生急性肾损伤(acute kidney injury, AKI), 当肺I/R合并肾脏损伤时,可明显增加死亡率。而目前为止,尚无一种有效的药物或治疗措施可以防治肺缺血/再灌注引起的肾损伤。因此,寻找有效的方法来防治肺I/R及肺I/R引起的肾损伤迫在眉睫。
右美托咪啶是高选择性α2肾上腺素能受体激动药,我们前期的研究结果表明,肺脏缺血前给予右美托咪啶可降低促炎介质和炎性因子,从而减轻肺缺血/再灌注损伤,具有肺脏保护作用,而其对肺I/R诱发的肾损伤是否也具有同样的保护作用?目前国内外尚未见有关报道,还有待我们进一步探讨。本研究拟观察右美托咪啶预处理对肺I/R诱发的肾损伤的影响及可能机制,为临床提供参考依据,也为进一步探讨缺血/再灌注引发的远隔器官损伤提供科学依据。
1 材料与方法
1.1 实验动物
雄性健康SPF级C57BL/6J小鼠50只,体重20 g~24 g,8~10周龄,由温州医科大学实验动物中心提供【SYXK(浙)2012-075】。采用随机数字表法,将其分为5组(n=10):对照组(sham组)、缺血/再灌注损伤组( I/R组)、缺血/再灌注+生理盐水组(NS组)、右美托咪啶组(Dex组)、右美托咪啶+阿替美唑组(DA组)。
1.2 小鼠肺缺血/再灌注模型制备
采用C57BL/6J小鼠在体左侧肺门夹闭30 min再灌注180 min方法制备肺缺血/再灌注损伤(I/R)模型。100 mg/kg氯胺酮(福建古田药业有限公司,中国)+10 mg/kg塞拉嗪(吉林长春华牧有限公司,中国)联合腹腔注射进行麻醉。消毒胸颈部皮肤后切开并分离皮下组织和肌肉,暴露气管行T型切口切开,置人22号动脉穿刺针针芯外套管气管插管,接小动物呼吸机行机械通气,调节呼吸机参数为:呼吸频率RR=120 counts/min,吸呼比为2∶3,氧浓度100%,潮气量0.6~0.8 ml/min。于小鼠左胸部2、3肋间心脏搏动最明显处开胸,暴露并游离左侧肺门,用无损伤动脉夹阻断左肺门缺血缺氧30 min,期间用盐水纱布覆盖左胸切口,30 min后松开动脉夹再灌注180 min。术中检测体温,维持体温36.5~37.5℃,按需追加麻醉药物。灌注结束后静脉取血,处死小鼠留取肾脏组织 。sham组仅行开胸处理,不夹闭肺门,机械通气210 min; I/R组:开胸后行左侧肺门阻断30 min,再灌注180 min;NS组、Dex组、DA组分别在肺门阻断前30 min腹腔注射同Dex组等体积的生理盐水、右美托咪啶(20 μg/kg,江苏恒瑞制药有限公司,中国)和右美托咪啶(20 μg/kg)+阿替美唑(250 μg/kg),其余处理同I/R组。
1.3 ELISA法检测血浆中IL-1β和TNF-α浓度
各组小鼠分别于再灌注结束时取血3 ml,离心机3 000 r/min (4℃),15 min,取上清液-70℃保存。BCA试剂盒对各组血浆进行蛋白定量,按白介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)ELISA试剂盒操作说明书分别进行IL-1β、TNF-α浓度的检测。
1.4 电镜下肾脏组织超微结构的观察
各组于再灌注结束后迅速取出肾脏组织,放置于蜡板上,滴上2.5%戊二醛固定液,用双刀切割法切取肾脏皮质部分约1 mm3大小若干块,然后再浸入装有2.5%戊二醛固定液的标本瓶内,并放置于4℃冰箱内固定2 h以上,依次经1%锇酸后固定,1%醋酸铀块染,丙酮梯度脱水,Epon812环氧树脂包埋剂包埋聚合,半薄切片光镜定位于肾小球并超薄切片,经醋酸铀-柠檬酸铅双重染色,H-7500透射电镜下观察并拍照。
1.5 统计学处理
2 结果
2.1 各组小鼠血浆中IL-1β和TNF-α浓度的变化
与sham组相比,其余组血浆中IL-1β和TNF-α浓度明显上升(P<0.01)。与I/R、NS组相比,Dex组IL-1β、TNF-α浓度明显降低(P<0.01)。与Dex组相比,DA组血浆中IL-1β、TNF-α浓度上升明显,差异有统计学意义(P<0.05)。I/R、NS和DA组间两两比较,差异均无统计学意义(P>0.05,表1)。


GroupIL⁃1β(pg/ml)TNF⁃α(pg/ml)Sham3.94±3.1021.25±5.40I/R15.59±1.75∗∗63.25±6.13∗∗NS18.26±6.84∗∗##61.50±4.04∗∗##Dex7.28±3.06∗∗ΔΔ34.25±5.85∗∗ΔΔDA18.85±3.52∗∗##66.75±11.87∗∗#
IL-1β: Interleukin-1β; TNF-α: Tumor necrosis factor-α; Sham: Sham group; I/R: Lung ischemia/reperfusion group; NS: Normal saline group; Dex: Dexmedetomidine group; DA: Dexmedetomidine and atipamezole group
**P<0.01vssham group;#P<0.05,##P<0.01vsDex group;ΔΔP<0.01vsI/R group
2.2各组小鼠透射电镜下肾组织超微结构变化情况
2.2.1 Sham组肾脏无明显损伤,肾组织超微结构无明显改变 电镜下可见肾小球结构正常,毛细血管腔充盈完好,内皮细胞结构基本正常,吞饮小泡较丰富,内皮窗孔清晰。基底膜厚薄均匀,足突排列整齐、裂孔清晰,足细胞结构基本正常。系膜区及系膜细胞结构基本正常。近曲小管基膜完整,细胞间连接紧密。上皮细胞核膜清晰,线粒体呈长杆状,数目丰富,嵴清晰,高尔基体、核糖体较丰富;微绒毛丰富,排列整齐。远曲小管上皮细胞结构基本正常,线粒体较丰富,微绒毛较多(图1-1A-1D)。
2.2.2 I/R组肾脏有较明显的损伤,肾组织超微结构可见损伤性变化 电镜下可见肾小球结构局部损伤,可见部分毛细血管腔有狭窄和淤血现象,有的可见中性粒细胞附壁现象,部分内皮细胞出现肿胀现象,个别细胞空泡化较明显,有的出现与基底膜局部分离现象,吞饮小泡比假手术组略微增多,内皮窗孔增大。基底膜略有改变,局部出现隆凸、疏松和厚薄不均现象;足细胞结构尚正常,仅见局部足突肿胀,或存在轻微融合现象,排列较不规则,裂孔尚清晰。系膜区及系膜细胞未见明显改变。近曲小管基膜基本完整,部分上皮细胞肿胀较明显,部分核膜模糊,线粒体散在分布,部分出现肿胀现象,部分基质浓聚,嵴断裂;高尔基体、核糖体略微减少;微绒毛排列紊乱、稀疏,部分腔内可见板层样小体沉积;细胞间连接较为疏松。远曲小管上皮细胞基膜基本完整,个别细胞出现水肿或线粒体肿胀等现象。肾间质可见炎细胞局部浸润(图1-2A-2D)。
2.2.3 NS组肾脏亦有损伤,肾组织超微结构与肺I/R组相近 电镜下肾脏超微结构的改变与肺缺血/再灌注组相近,可见肾小球局部损伤,部分毛细血管腔狭窄闭塞,部分内皮细胞肿胀、空泡化,胞浆疏松水肿,吞饮小泡较假手术组略微增多,内皮窗孔增大。基底膜局部隆凸、松解;局部足突肿胀、融合,排列紊乱。系膜区及系膜细胞未见明显改变。近曲小管基膜基本完整,部分上皮细胞肿胀明显,线粒体肿胀、空泡化,高尔基体、核糖体略微减少;微绒毛形态不规则,排列紊乱,部分小管腔内有蛋白和红细胞渗出。细胞间连接较疏松。远曲小管上皮细胞基膜基本正常,部分细胞出现线粒体肿胀,内质网扩张等现象。肾间质炎细胞局部浸润(图1-3A-3D)。
2.2.4 Dex组肾损伤减轻,肾组织超微结构可见轻微的损伤性变化 与肺缺血/再灌注组和生理盐水组相比,右美托咪啶组肾组织损害减轻较明显,电镜下表现为:肾小球结构基本正常,局部有轻微的损伤,毛细血管腔充盈完好,个别内皮细胞出现肿胀、空泡等现象,吞饮小泡数目较多,内皮窗孔基本清晰。基底膜大体上呈连续完整厚薄一致的形态,部分模糊、融合;足细胞结构尚正常,足突基本完整,排列整齐,无明显肿胀。系膜区及系膜细胞未见明显改变。近曲小管基膜基本完整,上皮细胞损伤、坏死、刷状缘的脱落减少;线粒体数目较多,个别线粒体膜稍模糊,略微肿胀变形;微绒毛数目略微减少,排列稍紊乱,少部分出现肿胀、空泡变性;细胞间连接较为紧密;远曲小管上皮细胞基膜基本完整,细胞水肿或线粒体肿胀等现象明显减轻,肾间质未见明显改变,有少量炎细胞浸润(图1-4A-4D)。
2.2.5 DA组肾损伤较明显,电镜下可见损伤性变化 电镜下可观察到,肾小球结构局部损伤明显,部分毛细血管腔有轻微狭窄,部分内皮细胞出现水肿、空泡和溶解,且有与基底膜局部分离现象,内皮窗孔略微增大。基底膜出现局部隆凸、疏松分层和厚薄不均的现象;局部足突肿胀、空泡变性,排列不规则,足细胞核轻微固缩;系膜区及系膜细胞结构未见明显改变。近曲小管基膜大致完整,部分上皮细胞水肿,空泡变性以及坏死脱落,线粒体肿胀疏松,内质网扩张;微绒毛排列紊乱、稀疏,数目较右美托咪啶组减少;细胞间连接较为疏松。远曲小管上皮细胞基膜基本完整,部分细胞水肿、线粒体肿胀。肾间质有局灶性炎性细胞浸润(图1-5A-5D)。
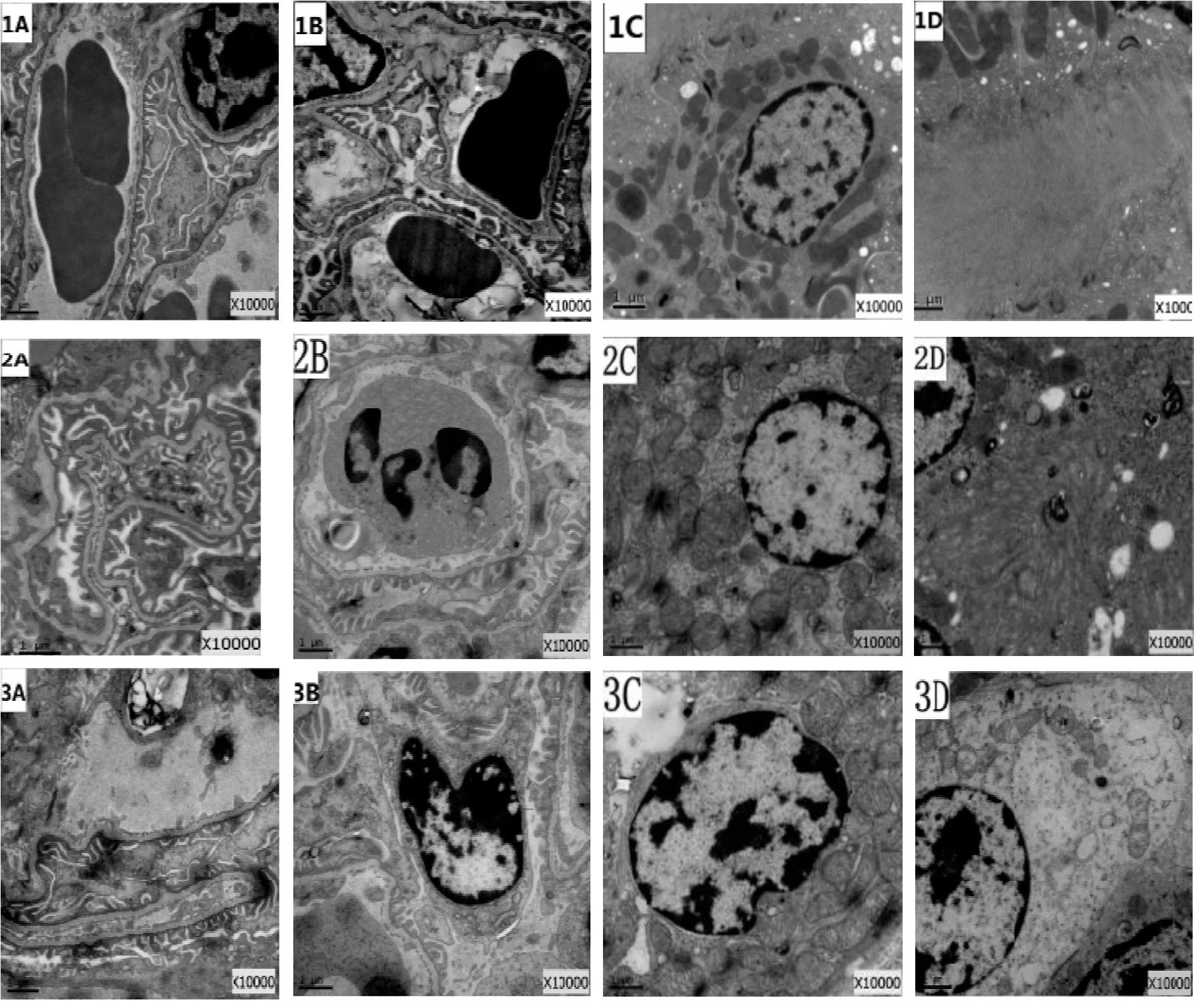
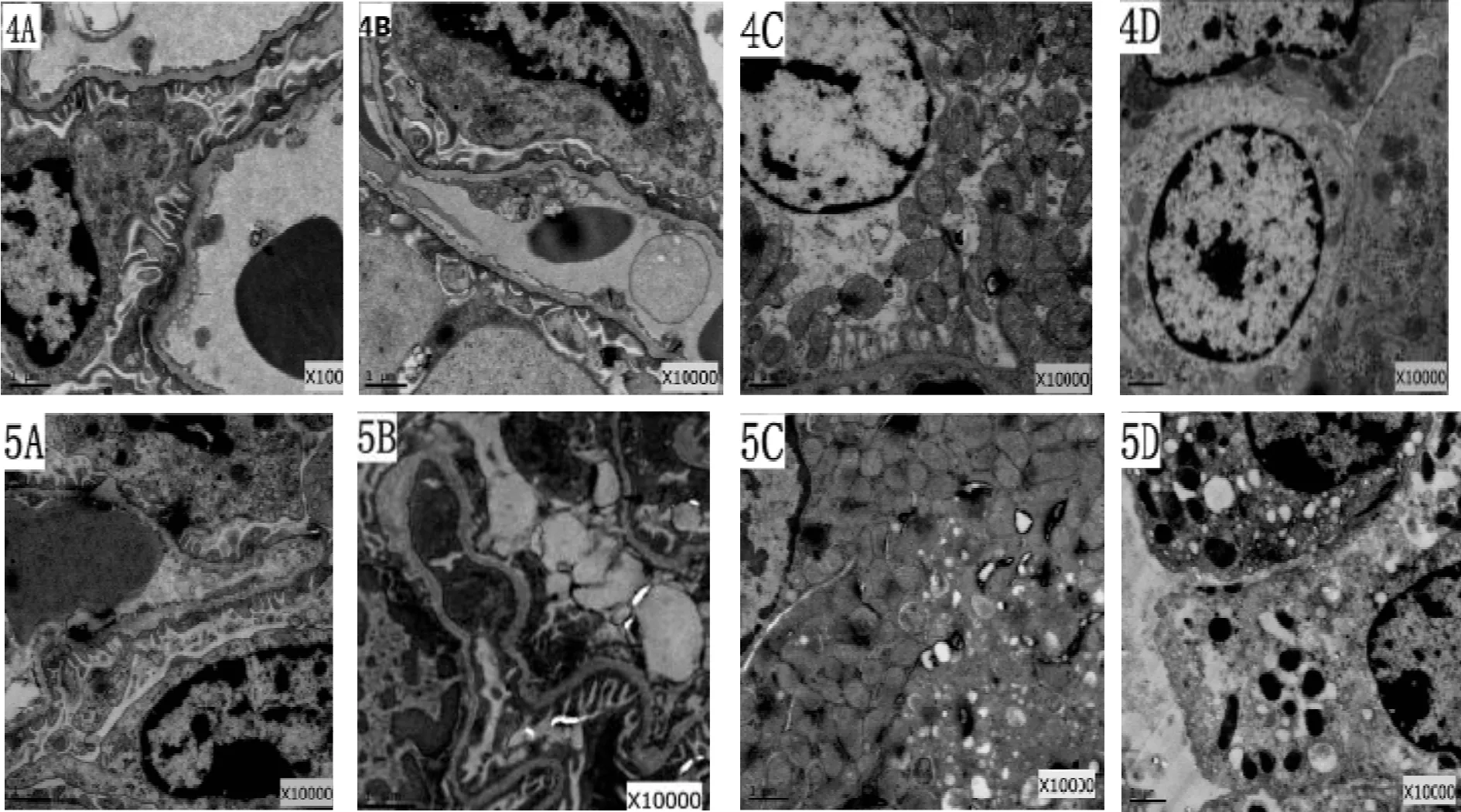
Fig.1The changes of kidney tissue ultrastructure in each group (×10000) 1: Sham group; 2: Lung ischemia/reperfusion group; 3: Normal saline group; 4: Dexmedetomidine group; 5: Dexmedetomidine and atipamezole group; A, B: Glomerulus; C, D: Kidney tubule
3 讨论
右美托咪啶为高选择性α2肾上腺素能受体激动药,具有剂量依赖性的镇静、镇痛、抗焦虑作用,同时降低交感神经张力,间接提高迷走神经张力,激活胆碱能抗炎通路,具有抗炎、器官保护作用[1-2]。实验研究结果表明,右美托咪啶有很好的围术期器官保护作用,能够有效改善术中缺血对器官的损伤,对缺血/再灌注损伤器官有很好的保护作用[3-5]。
本实验显示,与假手术组相比,肺I/R组血浆中IL-1β和TNF-α浓度明显升高,透射电镜下肾组织明显损伤,肾小球足突与基底膜局部肿胀、隆凸;肾小管上皮细胞和线粒体肿胀,微绒毛大部分消失,说明肺缺血/再灌注的确引发了远隔器官肾脏的损伤。NS组和DA组的血浆IL-1β和TNF-α浓度升高亦较显著,肾组织电镜下超微结构的变化与肺I/R组相近。与肺I/R组相比,Dex组的血浆IL-1β和TNF-α浓度明显下降,且肾组织损害亦明显减轻,电镜下可观察到肾小球足突与基底膜基本完整,肾小管微绒毛部分轻微肿胀、空泡变性。说明右美托咪啶预处理能够抑制炎症反应,降低促炎介质IL-1β、TNF-α水平,减轻肺I/R诱发的肾损伤,对肾脏有一定的保护作用。而这一保护作用能被选择性α2-肾上腺素受体阻滞剂阿替美唑所阻断,提示右美托咪啶保护肺缺血/再灌注诱发的肾损伤可能与激动α2-肾上腺素能受体有关。与此同时,Chen等[6]研究发现,肺缺血/再灌注不仅可导致自身受损,还可损害肺外远端多种器官如心、脑、肾、肝脏和胃肠道等。肺缺血/再灌注诱发肾脏损伤的机制可能与炎性反应增强有关。炎症反应是缺血/再灌注损伤最主要特征之一, 在肺缺血/再灌注损伤发生发展过程中发挥着关键的作用,急性肾损伤的发生可能与多种炎症因子激活密切相关。肺缺血/再灌注后,会产生大量促炎细胞因子和趋化因子,促炎因子有助于激活炎症因子的大量释放,包括TNF-α、IL-1和IL-6等,TNF-α可诱发其他炎性因子如IL-8的释放。IL-6可诱发中性粒细胞释放大量弹性蛋白酶损伤肾组织。细胞因子释放入血后可加剧应激反应,干扰免疫系统功能,从而导致远隔器官肾脏受损[7],引发如急性肾损伤为特征的多器官功能衰竭,是最终导致全身炎症反应综合征(SIRS)的重要因素之一。并且研究发现[8-13],通过激动α2-肾上腺素能受体,抑制TLR4/NF-κB通路的活化能够减轻炎症反应,对组织损伤有一定积极的保护作用。简言之,在肺缺血/再灌注诱发的肾损伤中,肾组织发生的失控性炎症反应、大量致炎因子和活性氧物质的产生以及多形核中性粒细胞(PMN)在肾脏大量聚集是其发生的中心环节[14]。中性粒细胞激活、氧自由基释放及炎性细胞因子释放等机制是肺缺血/再灌注累及远隔重要脏器损伤的主要病理生理机制[15-18]。
综上所述,肺缺血/再灌注前给予右美托咪啶可减轻肺缺血/再灌注诱发的肾脏损伤,其机制可能与激动α2-肾上腺素能受体,抑制炎症反应,降低促炎因子IL-1β和TNF-α,减轻全身炎症反应对肾组织的损伤有关。
[1] 罗梓垠, 郭长满, 项冰倩, 等. 右美托咪定对肺缺血/再灌注损伤小鼠内质网应激相关分子Caspase-12表达的影响[J].中国应用生理学杂志, 2016, 32(2): 164-168.
[2] Mantz J, Josserand J, Hamada S. Dexmedetomidine:new insights[J].EurJAnaesthesiol, 2011, 28(1): 3-6.
[3] 何金波, 宋 冬, 罗梓垠, 等. 右美托咪定对大鼠I/R损伤肺组织TLR4表达及保护作用的影响[J]. 中国应用生理学杂志, 2016, 32(4): 356-360.
[4] Luan HF, Zhao ZB, Feng JY.etal. Prevention of etomidate-induced myoclonus during anesthetic induction by pretreatment with dexmedetomidine[J].BrazJMedBiolRes, 2015, 48(2): 186-190.
[5] Gertler R, Brown HC, Mitchell DH,etal. Dexmedetomidine:a novel sedative- analgesic agent[J].ProcBaylUnivMedCent, 2001, 14(1): 13-21.
[6] Park SW, Chen SW, Kim M,etal. Cytokines induce small intestine and liver injury after renal ischemia or nephrectomy[J].LabInvest, 2011, 91(1): 63-84.
[7] Riker RR, Shehabi Y, Bokesch PM,etal. Dexmedetomidine vs midazolam for sedation of critically ill patients: a randomized trial[J].JAMA, 2009, 301(5): 489-498.
[8] Mancek-Keber M, Jerala R. Postulates for validating TLR4 agonists[J].EurJImmunol, 2015, 45(2): 356-370.
[9] 黄翠源, 潘灵辉, 林 飞, 等. 肺泡巨噬细胞TLR4/MyD88信号通路参与并介导了机械通气所致的肺损伤[J]. 细胞分子免疫学杂志, 2015, 31(2): 182-185.
[10]刘亚坤, 何金波, 陈海娥, 等. 血必净注射液对缺氧/复氧大鼠心肌TLR4-NF-κB-TNF-α通路的影响[J]. 中国中西医结合杂志, 2014, 34(12): 1463-1468.
[11]Xing B, Chen H, Wang L,etal. Ozone oxidative preconditioning protects the rat kidney from reperfusion injury via modulation of the TLR4-NF-κB pathway[J].ActaCirBras, 2015, 30(1): 60-66.
[12]何金波, 包财盈, 叶玉柱, 等. 缺氧/复氧大鼠心肌中IL-1β浓度的动态变化及意义[J]. 中国应用生理学杂志,2015, 31(1): 27-30.
[13]Hua F, Tang H, Wang J,etal. TAK-242, an antagonist for Toll-like receptor 4, protects against acute cerebral ischemia/reperfusion injury in mice[J].JCerebBloodFlowMetab, 2015, 35(4): 536-542.
[14]Carden DL, Granger DN. Pathophysiology of ischaemia-reperfusion injury[J].JPathol, 2000, 190(3): 255-266.
[15]Estebe JP, Davies JM, Richebe P. The pneumatic tourniquet: mechanical,ischaemia-reperfusion and systemic effects[J].EurJAnaesthesiol, 2011, 28(6): 404-411.
[16]陈 月, 张加强, 孟凡民. 右美托咪定对肢体缺血/再灌注诱发肺损伤的影响[J]. 中国医院药学杂志, 2015, 35(12): 1113-1115.
[17]Matthay MA, Folkesson HG, Clerici C. Lung epithelial fluid transport and the resolution of pulmonary edema[J].PhysiolRev, 2002, 82(3): 569-600.
[18]张莉莉, 毛仲霞, 赵 敏, 等. 右美托嘧啶复合芬太尼对心脏手术麻醉诱导期间血流动力学的影响[J]. 中国医药指南, 2012, 10(13): 132-133.
Effectofdexmedetomidineonrenalinjuryinducedbylungischemia/reperfusioninmice
XIANG Bing-qian1, GAO Hui1, LUO Zi-yin1, FANG Zhou-xi2△, WANG Wan-tie1
(1. Ischemia/Reperfusion Injury Research Institute, Wenzhou Medical University; 2. Department of Electron Microscopy, Wenzhou Medical University, Wenzhou 325035, China)
Objective: To evaluate the effect of dexmedetomidine(Dex) on renal injury induced by lung ischemia/reperfusion(I/R) in mice.MethodsFifty healthy SPF male C57BL/6J mice, weighing 20 g~24 g,aged 8~10 weeks,were randomly divided into five groups(n=10 each):sham operation group(sham group),lung ischemia/reperfusion group(I/R group), lung ischemia/reperfusion and normal saline group (NS group), dexmedetomidine group(Dex group) , dexmedetomidine and atipamezole group (DA group). Lung ischemia / reperfusion model was established by occlusion of the left pulmonary artery for 30 min followed by 180 min reperfusion in mice. In Dex and DA groups, dexmedetomidine 20 μg/kg and dexmedetomidine 20 μg/kg plus atipamezole 250 μg/kg were injected intraperitoneally respectively at 30 min before establishment of the model, isopyknic normal saline instead of Dex were injected intraperitoneally in NS group. After the experiment the mice were killed and plasma IL-1 beta and tumor necrosis factor α(TNF-α) concentration were detected by ELISA; the renal tissues were harvested to observe ultra structure under electron microscope.ResultsCompared with sham group, the concentrations of IL-1β and TNF-α in other groups were increased significantly and the structure damages of renal tissues observed under electron microscope in other groups were more serious than those of sham group. Compared with I/R group, NS groups and DA group, the concentrations of IL-1β and TNF-α in Dex group were significantly lower(P<0.05)and the structure damages of renal tissues observed under electron microscope in Dex group were slighter.ConclusionDexmedetomidine pretreatment can attenuate renal injury induced by lung ischemia/reperfusion and the mechanism may be related to inhibition of inflammatory responses.
dexmedetomidine; ischemia/reperfusion injury; renal; IL-1β; TNF-α
R363
A
1000-6834(2017)04-380-05
浙江省公益技术应用研究项目(2013C33168);浙江省新苗人才计划项目(2014R413043);温州市公益性科技计划项目(Y20140652)
2016-10-08
2017-05-08
△
Tel: 0577-86689817, 0577-86689818; E-mail: wwt@wmu.edu.cn, E-mail: fzx@wmu.edu.cn
10.12047/j.cjap.5500.2017.092

