姬松茸子实体多糖高速剪切提取及其抗氧化活性
刘晓庆 秦春青 孙培龙 张安强
姬松茸子实体多糖高速剪切提取及其抗氧化活性
刘晓庆 秦春青 孙培龙 张安强*
(浙江工业大学食品科学技术系,浙江杭州 310014)
姬松茸多糖具有显著的抗肿瘤、抗疲劳、抗突变、抗氧化等功能。为提高姬松茸多糖得率、缩短提取时间,而采用高速剪切提取技术从姬松茸子实体中提取多糖。在单因素试验的基础上,根据中心组合试验设计原理,采用3因素3水平的响应面分析法优化提取工艺。最终确定最佳提取条件为液料比27 mL/g,转速22 000 r/min,剪切时间6.60 min,此时多糖实际得率为(12.33±0.020)%,与预测值12.48%相近。并通过乙醇梯度沉淀获得ABM40、ABM60、ABM80 3个姬松茸多糖组分,进而对其进行体外抗氧化活性测定。结果表明,3个多糖组分均表现出良好的ABTS自由基和DPPH自由基的清除能力,且具有一定的还原力。
姬松茸;多糖;高速剪切提取;抗氧化
姬松茸(Murill,ABM)又名巴西蘑菇,原产于巴西,是一种药食兼用的珍稀食用菌,在巴西和日本常用来治疗癌症、心脏病、肥胖症等疾病[1,2]。大量研究表明:姬松茸多糖具有显著的抗肿瘤[3]、抗疲劳[4]、抗突变[5]、抗氧化[6]等功能。因此,提高和简化姬松茸多糖的提取工艺对有效利用姬松茸资源至关重要。目前,提取姬松茸多糖的常用方法有热水浸提、复合酶提取、微波或超声波辅助提取等[7~9],热水浸提法虽操作简单但耗时过长;复合酶提取虽条件温和、杂质易除,但酶易失活且成本较高;微波或超声波辅助提取缩短了提取时间,然而仍需数小时。高速剪切技术作为近年来发展起来的一种均质化技术,已广泛用于天然产物提取、分离和改性方面[10]。它主要通过负压、剪切、高速碰撞等各种外力作用使原料中的有效成分迅速扩散到溶剂中,在短时间内达到溶解平衡[11]。李丽等利用高速剪切技术破碎油菜蜂花粉细胞壁,使花粉破壁率达到99%以上,并提高了其黄酮提取率[12, 13]。魏鉴腾等采用高速剪切技术辅助提取浒苔多糖,剪切时间80 s,剪切3次便可使多糖得率达到17.19%[10],大大缩短了提取时间。而高速剪切技术应用于姬松茸子实体多糖提取仍未见报道。
本文在单因素试验的基础上,根据中心组合试验设计原理,利用响应面分析法优化提取工艺,最终确定最佳提取工艺;并通过乙醇梯度沉淀获得ABM40、ABM60、ABM80三个姬松茸多糖组分,进而对其体外抗氧化活性进行了测定。
1 实验材料与试剂、仪器
1.1 实验材料与试剂
姬松茸子实体由杭州百山祖生物科技有限公司提供,浙江省农业科学院蔡为明研究员鉴定;葡萄糖标准品、ABTS、DPPH,为美国Sigma公司产品;苯酚、浓硫酸、过硫酸钾、硫酸亚铁、铁氰化钾、三氯乙酸、氯化铁、3,5-二硝基水杨酸等其他化学试剂,为国产分析纯。
1.2 实验仪器
AL-104电子天平(METTLER TOLEDO有限公司),FA25型高剪切分散乳化机(上海弗鲁克流体机械制造公司),V-1800PC型可见分光光度计(上海美谱达仪器公司),CR21GII型高速冷冻离心机(日本Hitachi(日立)公司),RE-2000A旋转蒸发仪(上海亚荣生化仪器厂)。
2 实验方法
2.1 姬松茸子实体多糖提取
姬松茸子实体经95%乙醇脱脂干燥后,粉粹,并以水为溶剂,在一定液料比和转速下高速剪切提取。提取液以10 000 r/min速率离心10 min,弃去沉淀收集上清液。上清液旋转蒸发浓缩至体积为原体积的1/10后即得粗多糖浓缩液。浓缩液经Sevag法除去蛋白(重复6次)后向其加入95%乙醇使乙醇浓度分别达到40%、60%、80%,各组分离心所得沉淀命名为ABM40、ABM60、ABM80;加水复溶,挥干残留的乙醇后冷冻干燥可得3个组分的多糖粗提物。
2.2 姬松茸子实体多糖高速剪切提取条件优化
(1)单因素试验。对液料比(10、15、20、25、30 mL/g)、转速(13 000、16 000、19 000、22 000、25 000 r/min)、剪切时间(1、2、4、6、8 min)进行单因素试验,分别考察这3个因素对姬松茸子实体多糖得率的影响并初步确定各因素的取值范围。
(2)响应面实验。在单因素试验基础上,用Box-Benhnken中心组合实验设计原理,进行3因素3水平的实验设计,获取最优提取工艺条件。
(3)姬松茸子实体多糖含量的测定。用苯酚硫酸法[14]和DNS法[15]分别测定姬松茸子实体粗多糖的总糖含量和还原糖含量,按式(1)计算即得姬松茸子实体的多糖含量。
多糖含量 = 总糖含量-还原糖含量(1)
(4)姬松茸子实体多糖得率的计算:
得率(%)=(2)
2.3 姬松茸子实体粗多糖(ABM40、ABM60、ABM80)的体外抗氧化活性实验
(1)ABTS 自由基清除能力[16]。取8 mL 7 mmol/L ABTS与141 μL 140 mmol/L的过硫酸钾溶液混合,在4 ℃下避光反应12~16 h,用pH=7.4的磷酸缓冲液将ABTS自由基溶液稀释至OD=0.7±0.02备用。
各取1 mL不同浓度的粗多糖溶液于试管中,各加入3 mL ABTS自由基溶液,在30 ℃下,避光反应5 min,于734 nm处测定吸光值。以蒸馏水为参比溶液,Vc作为阳性对照组。
ABTS自由基清除率(%)=

式(3)中:A0为空白对照组的吸光值;Ai为样品测定管的吸光值;Aj为样品本底管的吸光值。
(2)DPPH自由基清除能力[17]。各取3 mL不同浓度的粗多糖溶液于试管中,加入1 mL 0.1 mmol/L DPPH-甲醇溶液,密封混匀,在25 ℃条件下恒温避光反应1 h,并在517 nm处测定吸光值。以甲醇溶液为参比溶液,Vc作为阳性对照组。
DPPH羟基自由基清除率(%)=

式(4)中:A0为空白对照组的吸光值;Ai为样品测定管的吸光值;Aj为样品本底管的吸光值。
(3)还原力的测定[18]。各取2.5 mL不同浓度的粗多糖溶液于试管中,加入2.5 mL磷酸缓冲液(pH=6.6,0.2 mol/L)和2.5 mL 1 %的铁氰化钾溶液,振荡均匀, 50 ℃反应20 min,迅速冷却后加入2.5 mL 10%三氯乙酸溶液终止反应。室温离心(8 000 r/min,10 min)后,取上清液2 mL于试管中,加入2 mL 蒸馏水和0.4 mL 0.1%氯化铁溶液,摇匀后反应10 min 在700 nm处测定吸光值。以蒸馏水为参比溶液,Vc作为阳性对照组。
还原力=Ai-A0(5)
式(5)中:A0为空白对照组的吸光值;Ai为样品测定管的吸光值。
3 结果与分析
3.1 单因素试验结果
(1)不同液料比的多糖得率。取10 g 姬松茸子实体粉末,按不同液料比(10、15、20、25、30 mL/g)加入蒸馏水,在25 000 r/min的转速下室温剪切提取6 min,提取液经离心(10 000 r/min,10 min)后取上清液测其多糖含量。由图1可知,多糖的得率随液料比的增大而大幅度提高,但当液料比大于25 mL/g时,得率趋于稳定。因此,选用液料比20、25、30 mL/g为响应面实验中料液比的因素水平。
(3)不同剪切时间的多糖得率。取10 g 姬松茸子实体粉末,按液料比为20 mL/g加入蒸馏水,在25 000 r/min转速下,以不同的剪切时间(1、2、4、6、8 min)进行提取,提取液经离心(10 000 r/min,10 min)后取上清液测其多糖含量。由图3可知,当剪切时间小于4 min时,得率随剪切时间的增加而增加,大于6 min 后其得率基本不变,说明继续延长剪切时间对提高多糖得率无明显作用。因此选用剪切时间4、6、8 min 进一步进行响应面实验。
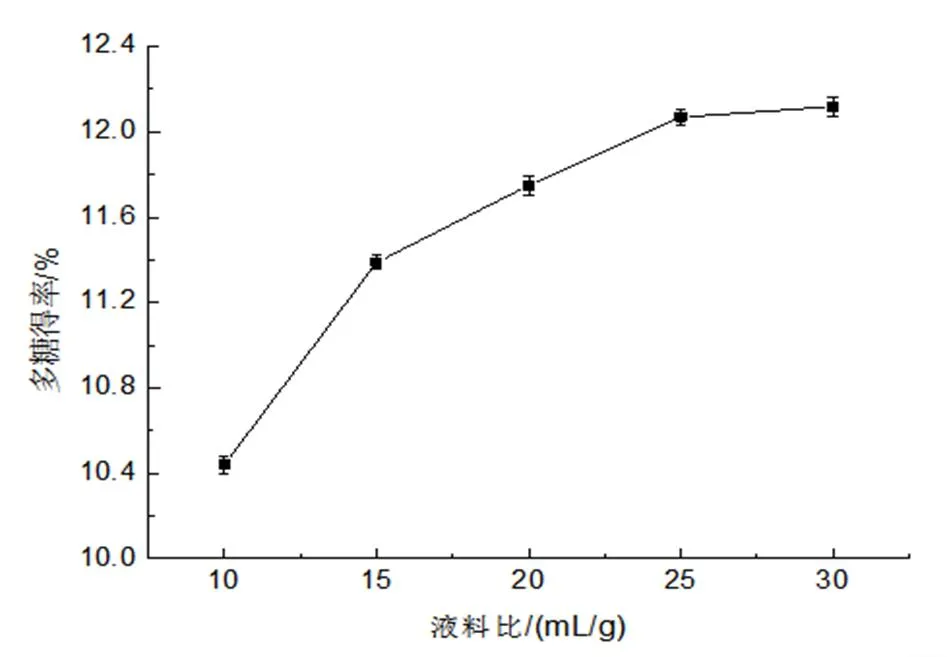
图1 不同料液比对多糖得率的影响
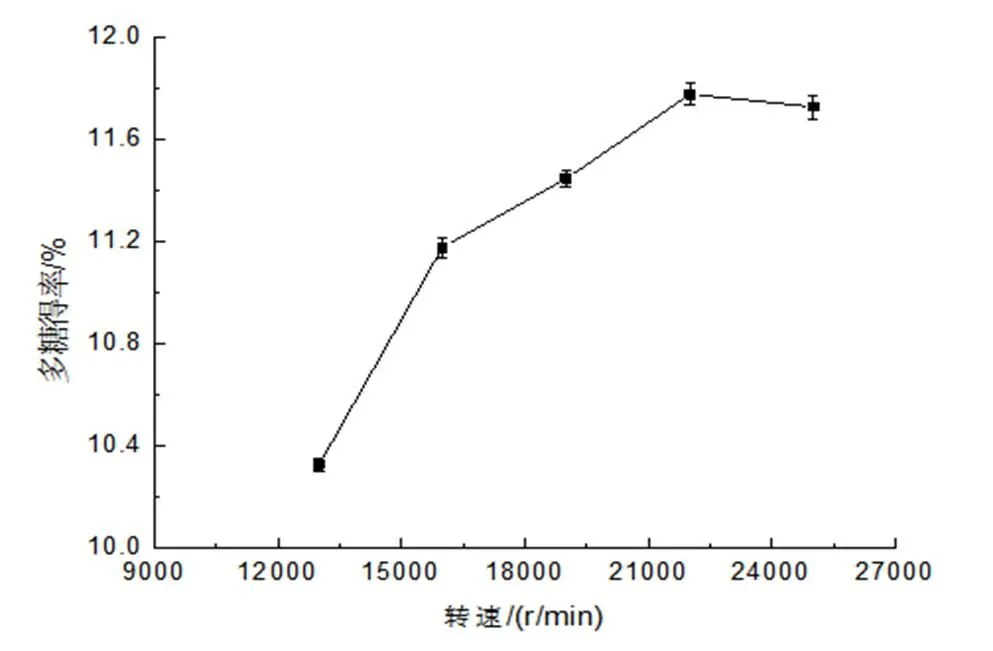
图2 转速对多糖得率的影响
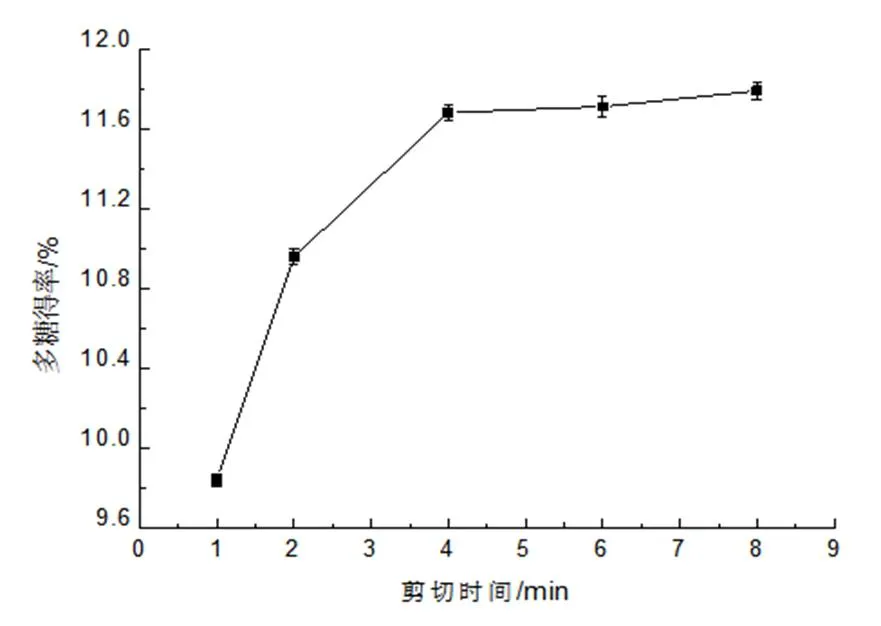
图3 剪切时间对多糖得率的影响
3.2 响应面分析实验结果与分析
(1)分析因素的选取及分析方案。根据单因素实验结果,运用Box-Benhnken中心组合实验设计原理,采用表1所示的因素水平进行响应面实验设计。以A、B、C为自变量,姬松茸多糖的得率为响应值Y,实验方案和结果如表2所示;一共17组实验,其中10 ~ 14 为中心试验,其他为析因试验。
(2)回归方程的建立及显著性检验。对实验结果进行多元回归拟合后得到一个二次多项回归方程:
Y=12.38+0.14A+0.29B+0.13C+0.080AB+0.098AC-0.025BC-0.23A2-0.49B2-0.27C2
回归方程的方差分析见表3。方差分析可用来评估预测模型的准确性,各项系数的显著性可由F值和P值检验,P值越小越显著[19]。回归模型的F=89.54(P <0.0001),说明模型极显著;失拟项F=0.68(P=0.6082>0.05)以及R2=0.9914,R2adj=0.9803,更进一步说明此数学模型可以用来预测高速剪切提取姬松茸多糖的实验结果及最优提取条件。
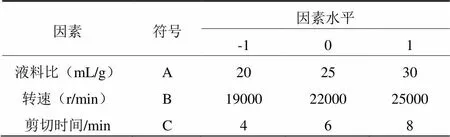
表1 响应面分析实验因素水平

表2 响应面设计方案及实验结果
由表3可知,液料比、转速、剪切时间的一次项均达到极显著水平(P<0.001)。此外液料比和转速,液料比和剪切时间的交互作用也达到显著水平(P<0.05)。由F值可得出,各因素对姬松茸多糖的得率影响次序为转速>液料比>剪切时间。
(3)响应面分析。图4~6为各交互因素的等高线图和响应面图,反映了各因素的交互作用
与类似,当和分别等于零时,式(12)中的P、Lv和Mv分别为0,可得其交点轴线T-Map的3维空间域边界方程分别为:
对响应值的影响。等高线图的形状可用来判断因素间交互作用是否显著,椭圆形表示因素间交互作用显著,而圆形则反之[20]。从图4a、图5a可以看出AB、AC因素间交互作用显著,而图6a中的BC因素间交互作用不显著。
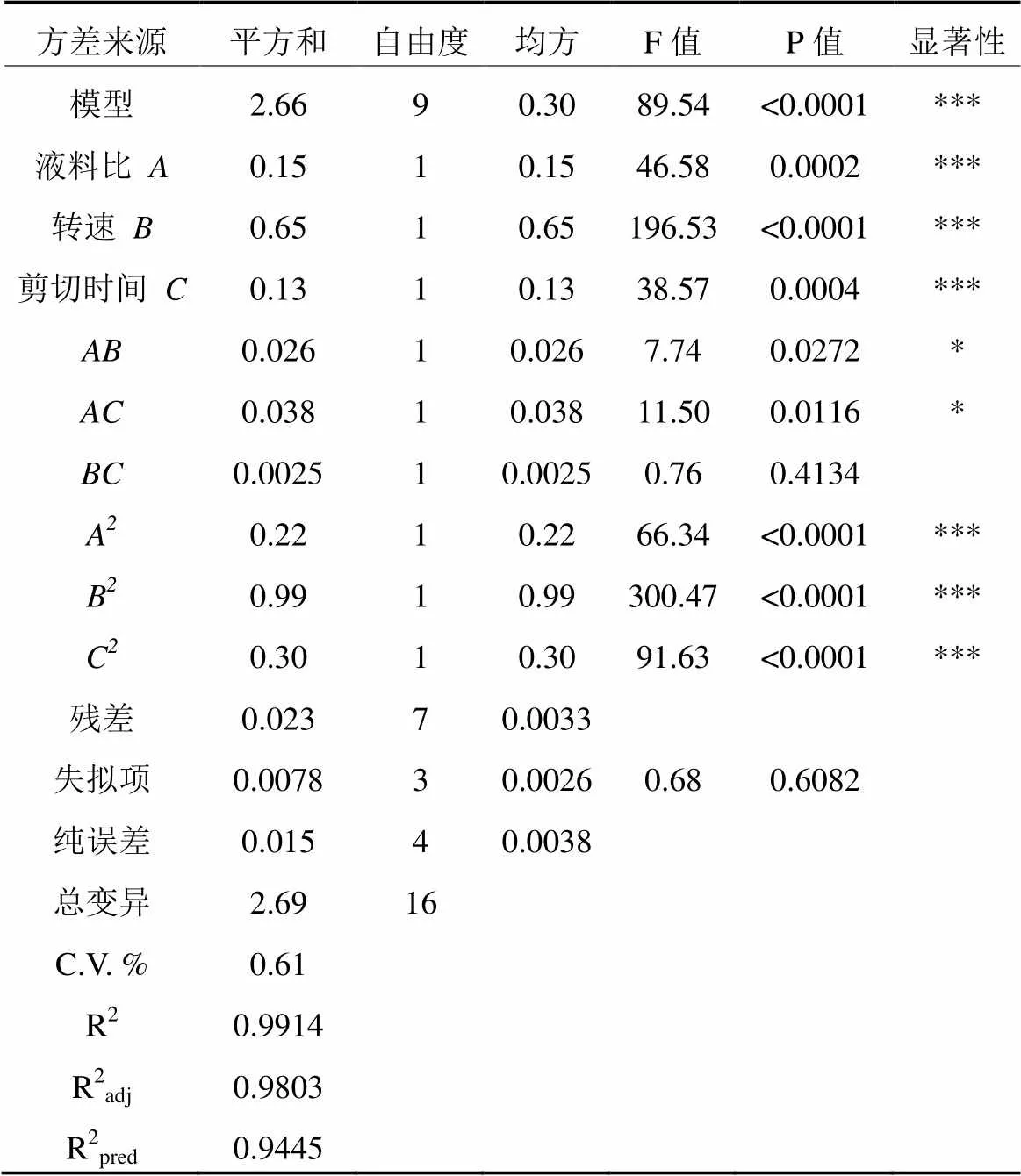
表3 回归方程各项方差分析
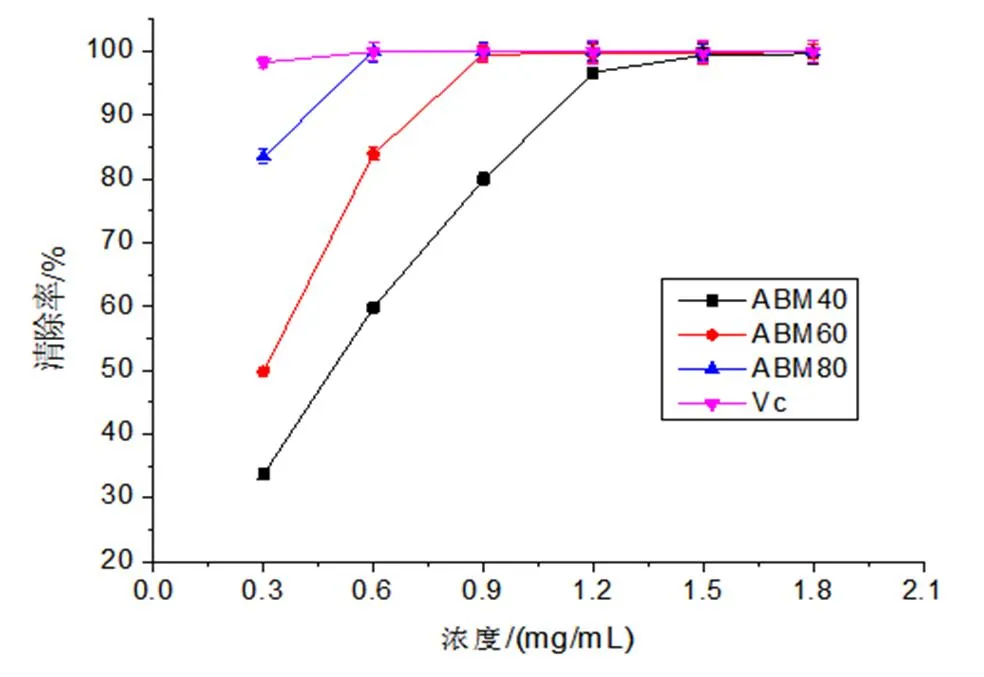
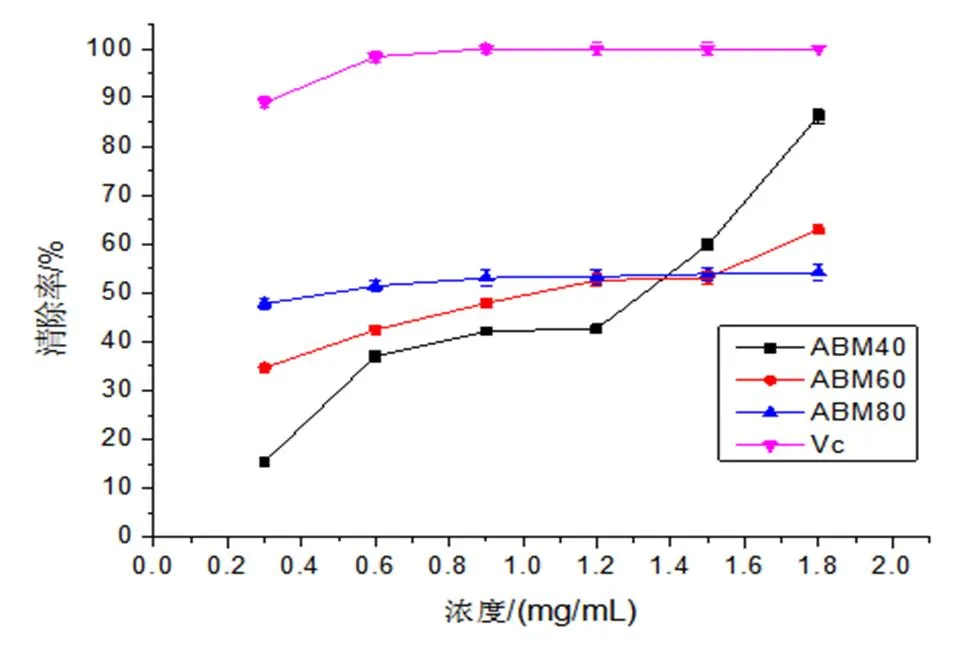
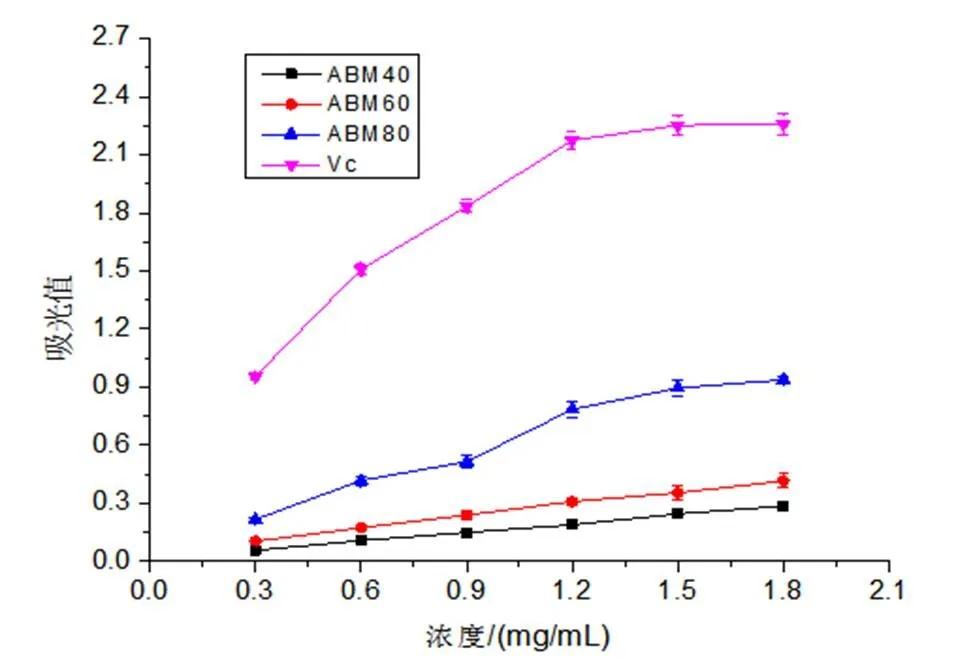
注: ***表示p<0.001水平显著,**表示0.001 (4)最佳工艺条件的确定。由Design Expert 8.0 软件可得提取姬松茸多糖的最佳工艺条件为液料比27.12 mL/g,转速22 959.37 r/min,剪切时间6.59 min,此时多糖得率为12.48%。考虑实际情况及操作的可行性,确定最佳提取条件为液料比27 mL/g、转速22 000 r/min、剪切时间6.60 min。在此条件下,重复3次验证实验,得实际多糖得率为(12.33±0.020)%,与预测值12.48%相近。说明该模型可靠,可预测实际的实验结果。 3.3 体外抗氧化活性实验结果与分析 (1)ABTS 自由基清除能力。ABTS自由基清除法目前已被广泛应用于生物样品的总抗氧化能力的测定。ABTS经氧化可生成相对稳定的蓝绿色ABTS自由基水溶液,若与抗氧化剂反应可使其溶液褪色,溶液颜色褪色越明显,说明该物质的抗氧化能力越强[21]。姬松茸子实体粗多糖ABM40、ABM60、ABM80 的ABTS 自由基清除能力如图7所示:在一定浓度范围内,ABM40、ABM60、ABM80的ABTS 自由基清除能力均与其浓度呈正相关关系;ABTS 自由基清除能力由大到小的顺序为Vc>ABM80>ABM60>ABM40;当浓度大于1.5 mg/mL时,3个组分的ABTS 自由基清除率接近100%,说明姬松茸子实体粗多糖具有较好的ABTS 自由基清除能力。 (2)DPPH自由基清除能力。DPPH自由基是一个以氮为中心的脂溶性自由基,在电子供体即抗氧化剂的存在下,稳定的DPPH自由基由紫色转化为黄色[22,23]。由图8可知,当样品浓度小于1.2 mg/mL时,DPPH自由基清除能力大小顺序为Vc>ABM80>ABM60>ABM40;而当浓度大于1.5 mg/mL,DPPH自由基清除能力大小顺序改变为Vc>ABM40>ABM60>ABM80,并且ABM40组分在浓度为1.8 mg/mL时,其对DPPH自由基清除率达到86.24 %。 (3)还原力的测定。抗氧化剂能够通过自身的还原作用给出电子使自由基变成稳定的分子,从而失去活性;还原力越大,抗氧化能力就越强,因此可根据Fe3+还原为Fe2+的多少来间接评价样品的抗氧化能力[24]。图9显示3个组分的还原力均具有浓度依赖性,其随样品浓度的增加而增强,ABM80组分的还原力最强,ABM60,ABM40为最弱。 图7 ABTS 自由基清除能力 图8 DPPH自由基清除能力 图9 还原力 本研究将高速剪切技术首次应用于姬松茸子实体多糖的提取,在单因素试验的基础上,采用响应面分析法优化提取工艺,最终确定最佳提取条件为液料比27 mL/g、转速22 000 r/min、剪切时间6.60 min。在此条件下,多糖实际得率为(12.33±0.020)%,与预测值12.48 %相近。此方法与传统提取方法——热水浸提相比,不仅提高了多糖的得率,大大缩短了提取时间,而且还可在常温水环境中提取,减少能耗。通过乙醇梯度沉淀获得ABM40、ABM60、ABM80 3个姬松茸多糖组分,体外抗氧化活性实验结果表明:3个多糖组分均表现出良好的ABTS自由基、DPPH自由基清除能力,且具有一定的还原力。本研究以期为将姬松茸多糖工业化生产应用于保健食品提供一定的理论基础。 [1] 沈爱英, 孙震, 刘平, 等. 姬松茸多糖的分离纯化及其对白血病细胞的抑制作用[J]. 食品与生物技术学报, 2001, 20(4): 380-383. [2] Wu S H, Li F, Jia S Y, et al. Drying effects on the antioxidant properties of polysaccharides obtained from[J]. Carbohydrate Polymers, 2014, 103(1): 414-417. [3] 葛红霞. 姬松茸及其多糖的研究进展[J]. 2012(5): 77-78. [4] 刘新海, 冯培勇, 史亚丽, 等. 姬松茸菌丝体多糖的分离纯化及抗疲劳研究[J]. 西南农业大学学报(自然科学版), 2006, 28(2): 190-194. [5] 席孝贤, 侯新江, 贺新怀, 等. 姬松茸菌孢多糖抗突变作用的实验研究[J]. 四川中医, 2005, 23(8): 27-28. [6] 王伟娟, 冯翠萍, 常明昌, 等.姬松茸多糖对铅中毒雄性大鼠的抗氧化作用[J]. 中国食品学报, 2013, 13(6): 15-19. [7] 沈爱英, 谷文英. 姬松茸子实体水溶性多糖提取工艺的研究[J]. 中国食用菌, 2002, 21(1): 15-17. [8] 孙培龙, 杨开, 赵培城, 等. 姬松茸子实体多糖提取方法的研究[J]. 食品科学, 2003, 24(6): 71-76. [9] 沈爱英, 谷文英. 复合酶法提取姬松茸子实体多糖的研究[J]. 食用菌, 2001, 23(3): 7-9. [10] 魏鉴腾, 裴栋, 刘永峰, 等. 高速剪切辅助提取浒苔多糖的工艺研究[J]. 食品工业科技, 2014, 35(19): 267-269. [11] 刘延泽. 植物组织破碎提取法及闪式提取器的创制与实践[J]. 中国天然药物, 2007, 5(6): 401-407. [12] 李丽, 刘晔玮, 赵剑喜, 等. 高速剪切技术破碎油菜蜂花粉细胞壁工艺[J]. 食品科学, 2012, 33(12): 97-101. [13] 李丽, 卜令娜, 刘晔玮, 等. 高速剪切技术提取油菜蜂花粉总黄酮工艺[J]. 食品工业科技, 2012, 33(13): 285-287. [14] Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances, Anal. Chem. 1956 28: 350–356. [15] Breuil C, Saddler J N, Comparison of the 3,5-dinitrosalicylic acid and Nelson-Somogyi methods of assaying for reducing sugars and determining cellulase activity, Enzyme. Microb. Technol. 1985, 7: 327-332. [16] Re R, Pellegrini N, Proteggente A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay [J]. Free Radical Biological and Medicine, 1999, 26(9-10): 1231-1237. [17] Blois M S. Antioxidant determination by the use of a stable free radical [J]. Nature, 1958, 181: 1199-1200. [18] Yildirim A, Mavi A, Kara A A. Determination of antioxidant and antimicrobial activities of Rumes crispus L. Extracts [J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 4083-4089. [19] Zhu C P, Zhai X C, Li LQ, et al. Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel, Food chem. 2015, 177: 139-146. [20] 王允祥, 吕凤霞, 陆兆新. 杯伞发酵培养基的响应曲面法优化研究[J]. 南京农业大学学报, 2004, 27(3): 89~94. [21] 郑善元, 陈填烽, 郑文杰, 等. 单丛茶水提物清除和自由基的光谱学研究[J]. 光谱学与光谱分析, 2010, 30(9): 2417-2423. [22] Siriwardhana S S K W, Shahidi F. Antiradical activity of extracts of almond and its by-products[J]. Journal of the American Oil Chemists’ Society. 2002, 79(9): 903-908. [23] Shima da K, Fujikawa K, Yahara K, et al. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion. Journal of Agricultural and Food Chemistry. 1992, 40: 945-948. [24] 张春梅, 宋海, 魏生龙. 荷叶离褶伞菌丝体多糖的提取及还原力的研究[J]. 中国食用菌, 2012, 31(6): 44-48. Optimization of polysaccharides extraction fromMurill by high-speed shear technique and their antioxidant activities Liu Xiaoqing Qin Chunqing Sun Peilong Zhang Anqiang* ( Department of Food Science and Technology, Zhejiang University of Technology, Hangzhou 310014, China ) Polysaccharides fromMurill have remarkable functions, such as antitumor, antifatigue, antimutagen, antioxidant and so on. In order to improve the extraction yield and shorten the extraction time, HSDE (High-Speed Shear Dispersing Emulsifier) is used to extract polysaccharides fromMurill. The extraction parameters were optimized by using a three-variable-three-level Box-Behnken design and a response surface methodology (RSM) based on the single-factor experiments. The optimum conditions were predicted as follows: ratio of water to raw material 27 mL/g; rotate speed 22000 r/min; extraction time 6.60 min, and the highest extraction yield reached 12.33±0.020% under these conditions, which was in good agreement with the predicted value 12.48 %. In addition, three fractions (ABM40, ABM 60 and ABM80) were obtained by the ethanol precipitation method and showed appreciable antioxidant potential on ABTS radical scavenging activity, DPPH radical scavenging capacity and a certain reducing power. Murill; polysaccharides; high-speed shearing; antioxidant S646 A 2095-0934(2017)02-113-07 国家自然基金项目“姬松茸α-葡聚糖缀合物高持水性特征内在分子机制研究”(31671813) 刘晓庆(1992-),女,研究生 张安强,男,副教授。E-mail:zhanganqiang@zjut.edu.cn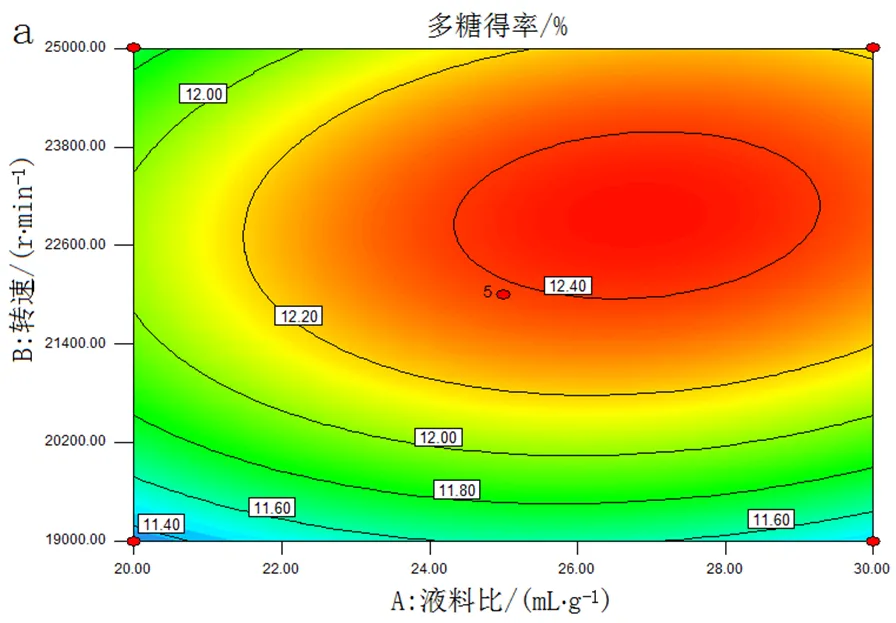


4 结 论

