甜杏仁分离蛋白的组成及部分理化特性
张清安,张馨允,冯郁蔺,史芳芳
甜杏仁分离蛋白的组成及部分理化特性
张清安,张馨允,冯郁蔺,史芳芳
(陕西师范大学食品工程与营养科学学院,西安 710119)
【目的】明确甜杏仁分离蛋白的相关理化性质,研究蛋白质性质变化与产品加工特性间的关系,开发高质量的甜杏仁产品。【方法】通过碱溶酸沉法制得甜杏仁粗蛋白,经Osborne分级法制备分离蛋白—清蛋白、球蛋白、醇溶蛋白和谷蛋白,利用全自动氨基酸分析仪、环境电子扫描显微镜(ESEM)、圆二色光谱(CD)、差示扫描量热法(DSC)、热重法(TGA)及流变仪等,研究甜杏仁分离蛋白的氨基酸组成、表面形态特征、二级结构、热性质及流变性,并拟合出温度与分离蛋白黏度间的线性方程,计算其活化能a及频率因子0。【结果】甜杏仁4种分离蛋白的氨基酸组成丰富,含有17种人体所需的氨基酸,包括8种必需氨基酸(含组氨酸),谷氨酸含量最多;清蛋白、球蛋白及醇溶蛋白表观结构较为紧密,呈聚集态,而谷蛋白则表现为松散、多孔的片状;分离蛋白二级结构分子构象中,α-螺旋及无规则卷曲占主要部分。由DSC结果可知清蛋白、球蛋白、醇溶蛋白和谷蛋白的热变性温度分别为62.84、72.98、78.33和45.70℃,热稳定性关系为:醇溶蛋白>球蛋白>清蛋白>谷蛋白,结合DSC与ESEM可知聚集程度为:清蛋白>醇溶蛋白>球蛋白>谷蛋白。4种甜杏仁分离蛋白的溶液均属于非牛顿流体,其黏度与温度符合阿累尼乌斯(Arrhenius)指数方程,能够很好地对实际情况进行拟合,可运用于指导实际生产。【结论】甜杏仁分离蛋白可作为一种优质植物蛋白来源,本研究结果对甜杏仁蛋白质产品的开发具有参考意义,有利于在产品开发及生产加工过程中对含蛋白产品的功能及品质进行控制,提高其附加值进而促进甜杏仁产业发展。
甜杏仁;分离蛋白;氨基酸;热性质;流变性
0 引言
【研究意义】杏仁()是蔷薇科李属植物—杏的种子[1],在中国西北、华北、东北一带均有大面积种植,栽培历史悠久。杏仁是一种具有高营养价值的特色作物,作为一种健康食品,已被证实能够有效预防心血管疾病、促进人体新陈代谢[2]。杏仁中油脂含量约为50.0%[3],富含油酸、亚油酸等不饱和脂肪酸[4],蛋白质含量为22.4%—29.3%[5],杏仁中约15%的能量来源于高质量的蛋白质[6],可作为日常饮食中蛋白质的良好来源[7]。根据杏仁中苦杏仁苷的含量,可将其分为苦杏仁和甜杏仁两种;苦杏仁多用于提取香味物质、制备蛋白饮料和止咳口服液;而甜杏仁由于苦杏仁苷含量较低,因此一直被当做原料或辅料用于食品中,是很多传统饮食的营养来源[1]。根据王淑英等[8]的研究,甜杏仁中的蛋白质含量(30.1%)高于瓜籽仁(19.1%)、松仁(12.6%)、核桃仁(22.0%)及花生仁(27.1%)中的蛋白质含量,且氨基酸种类齐全,其中8种必需氨基酸(不包括色氨酸)占总氨基酸的32.0%—34.0%[9],接近FAO/WHO在1973年修正的标准模式谱。另外,甜杏仁中微量元素硒的含量也较为丰富,高达27.6 μg/100 g,具有护肝、提高机体免疫力等作用[8]。甜杏仁已成为中国出口创汇率较高的土特产品之一[10],中国“三北”地区所种植的‘龙王帽’‘白玉扁’‘一窝蜂’等品种均属于甜杏仁,也称大扁杏,产量不断增加,但在深加工方面鲜有报道。在食品开发及加工过程中,蛋白质的功能特性会对产品最终品质产生较大影响[11],因此,有必要对甜杏仁分离蛋白理化特性——尤其是二级结构、热性质及流变性等作深入研究,从而科学地了解其加工特性,合理优化加工工艺参数、减少营养品质损失以及提升其附加值。同时,也为拓宽甜杏仁深加工产业、开发蛋白质资源等方面提供技术支撑和参考。【前人研究进展】甜杏仁蛋白质由清蛋白、球蛋白、醇溶蛋白和谷蛋白组成,其中以清蛋白为主,含量高达45.76%,球蛋白约占40.32%,其余为谷蛋白与醇溶蛋白[12-13]。目前,对分离蛋白的研究集中于大豆分离蛋白,主要是对其结构与功能性质[14]及改性生物膜[15]等方面的研究,张逸婧等[16]还研究了CMC-Na对大豆分离蛋白的零切黏度、圆二色性及表面疏水性的影响,而对杏仁分离蛋白的报道很少,且主要集中于对其提取工艺的优化[17]及其功能性质的研究[11-18]。与大豆分离蛋白相比,甜杏仁分离蛋白不仅吸油性、吸水性优于大豆分离蛋白,且因其表面疏水性指数(S0=164.86)高于大豆分离蛋白(S0=5.57),从而使其具有良好的乳化性,且在高浓度下仍能保持较低的黏度[15],比较有利于高蛋白制品的稳定性。【本研究切入点】甜杏仁分离蛋白具有与大豆分离蛋白同等重要的开发及应用前景,但目前对甜杏仁分离蛋白理化特性,特别是其二级结构组成、热性质及流变性等与加工密切相关的特性,未见研究报道,极大制约了甜杏仁产品的开发及其生产加工过程中品质的有效控制。【拟解决的关键问题】以甜杏仁为研究对象,采用现代食品分析技术,全面、系统地对4种甜杏仁分离蛋白的理化特性进行研究与分析,加深对甜杏仁产品的组分、内部结构及分子形态的认识,为产品在加工及储藏过程中的品质变化与控制提供相关数据。
1 材料与方法
试验于2015年7月至2016年5月在陕西师范大学食品工程与营养科学学院进行。
1.1 材料
1.1.1 主要的试剂与仪器 氢氧化钠(天津市化学试剂六厂)、无水乙醇(天津市北联精细化学品开发有限公司)、石油醚(天津市河东区红岩试剂厂)、盐酸(西安化学试剂厂)、三羟甲基氨基甲烷(上海山浦化工有限公司)、氯化钠(天津市博迪化工有限公司)均为分析纯。
JA2003N型电子天平,上海精密科学仪器有限公司;FZ102微型植物粉粹机,北京科伟永兴仪器有限公司;SHB-Ⅲ型循环水式多用真空泵,巩义市予华仪器有限责任公司;KQ2200DA型数控超声波清洗器,昆山市超声仪器有限公司;3k30超高速低温离心机,美国Sigma公司;DL-4C低速大容量离心机,上海安亭科学仪器厂;LGJ-18C冷冻干燥机,北京四环科学仪器厂;L-8900全自动氨基酸分析仪,日本HITACHI公司;Quanta 200环境电子扫描显微镜,Philips-FEI Company,Amsterdam,Netherlands;Chirascan圆二色光谱仪,英国应用光物理公司;Q1000DSC+LNCS+ FACS Q600SDT热分析系统,美国TA公司;AR-G2型流变仪,美国TA公司。
1.1.2 样品 甜杏仁分离蛋白制备见图1。
甜杏仁购自陕西省榆林市榆阳区,杏仁品种为‘龙王帽’。将杏仁洗净去杂质,料液比1﹕4(g∙mL-1)于100℃水中放置4 min去皮,用清水冲洗干净后[19],于40℃烘箱烘干,粉碎至60目;石油醚脱脂,脱出有机溶剂后取脱脂粉末,甜杏仁粗蛋白的提取参考Zheng等[20]的方法并略作改动,样品于4℃保存备用。利用Osborne分级法[13]制备甜杏仁分离蛋白,具体如图1所示。将上清液I、II、III和IV分别用去离子水在4℃透析72 h(透析袋相对分子质量截留量:8 000—14 000),再分别于4℃、8 000 r/min离心,收集沉淀,冷冻干燥,依次制得甜杏仁的清蛋白、球蛋白、醇溶蛋白和谷蛋白,采用半微量凯式定氮法[13]测定出4种分离蛋白的含量:清蛋白55.0%、球蛋白37.4%、醇溶蛋白1.6%和谷蛋白6.0%。
1.2 方法
1.2.1 氨基酸组成测定 参照GB/T 5009.124—2003,分别对4种样品进行处理,用全自动氨基酸分析仪对样品液进行测定。
1.2.2 表面形态特征观测 取样品适量,平铺较薄一层于已贴好静电纸的座台上,以保证视野清晰,在电压20 kV、15 Pa低真空模式下,用环境电子扫描显微镜(ESEM)观察分离蛋白在500倍、1 000倍及2 500倍下的表面形态特征。
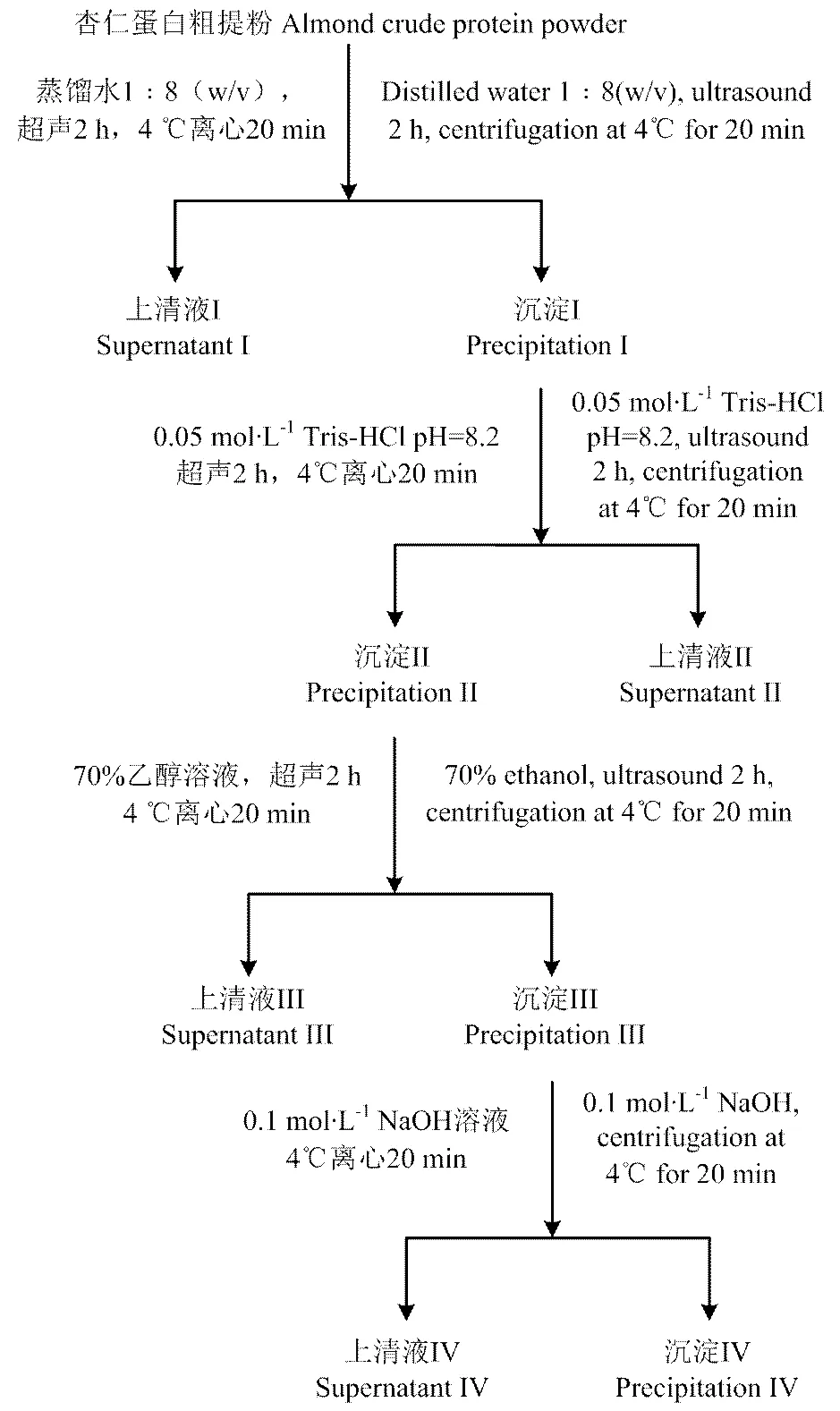
图1 Osborne分级法制备甜杏仁分离蛋白
1.2.3 分子构象的圆二色光谱(CD)测定 分别配制0.08 mol∙L-1的样品溶液,用光径为0.1 cm的比色皿,在远紫外区190—260 nm范围内测定分离蛋白的圆二色性,研究其二级结构。
1.2.4 热性质研究 用差示扫描量热仪(DSC)研究分离蛋白的热性质,使样品在20℃时保持1 min,在20—140℃扫描样品,升温速率10℃∙min-1,氮气流速20 mL∙min-1,测定分离蛋白的热变性温度。热重法(TGA):将冷冻干燥的样品从0℃加热至700℃,升温速率10℃∙min-1,氮气流速20 mL∙min-1,研究分离蛋白的质量与温度间的关系。
1.2.5 流变特性研究 配制0.5 mg∙mL-1的样品溶液,采用AR-G2流变仪的同心圆筒装置进行流变特性测定,分别在10、20、30、40、50、60℃下测定剪切速度对分离蛋白剪切应力的影响;再于20℃下测定蛋白质在剪切速率为0.1—1 000 s-1范围内的黏度;研究温度与黏度的关系。
2 结果
2.1 氨基酸组成
由表1可知,4种分离蛋白的氨基酸含量丰富,种类齐全,均含有17种人体所需氨基酸,其中包括8种人体必需氨基酸(含组氨酸)。所含的氨基酸中谷氨酸的含量最高,其次为天冬氨酸和精氨酸,尤其在球蛋白中这3种氨基酸的含量均高于其余3种分离蛋白中所含有的量。其中,谷氨酸与天冬氨酸为鲜味氨基酸[21],且谷氨酸的鲜味很强,这也是甜杏仁口感及风味良好、深受消费者青睐的原因之一;而蛋氨酸在4种分离蛋白中的含量均为最低,需要指出的是,虽然甜杏仁分离蛋白中蛋氨酸的含量较低,但可由蛋氨酸转变而成的半胱氨酸的含量相对较高,因此,可在一定程度上节省蛋氨酸在转化过程中的消耗,更多地供人体吸收利用。
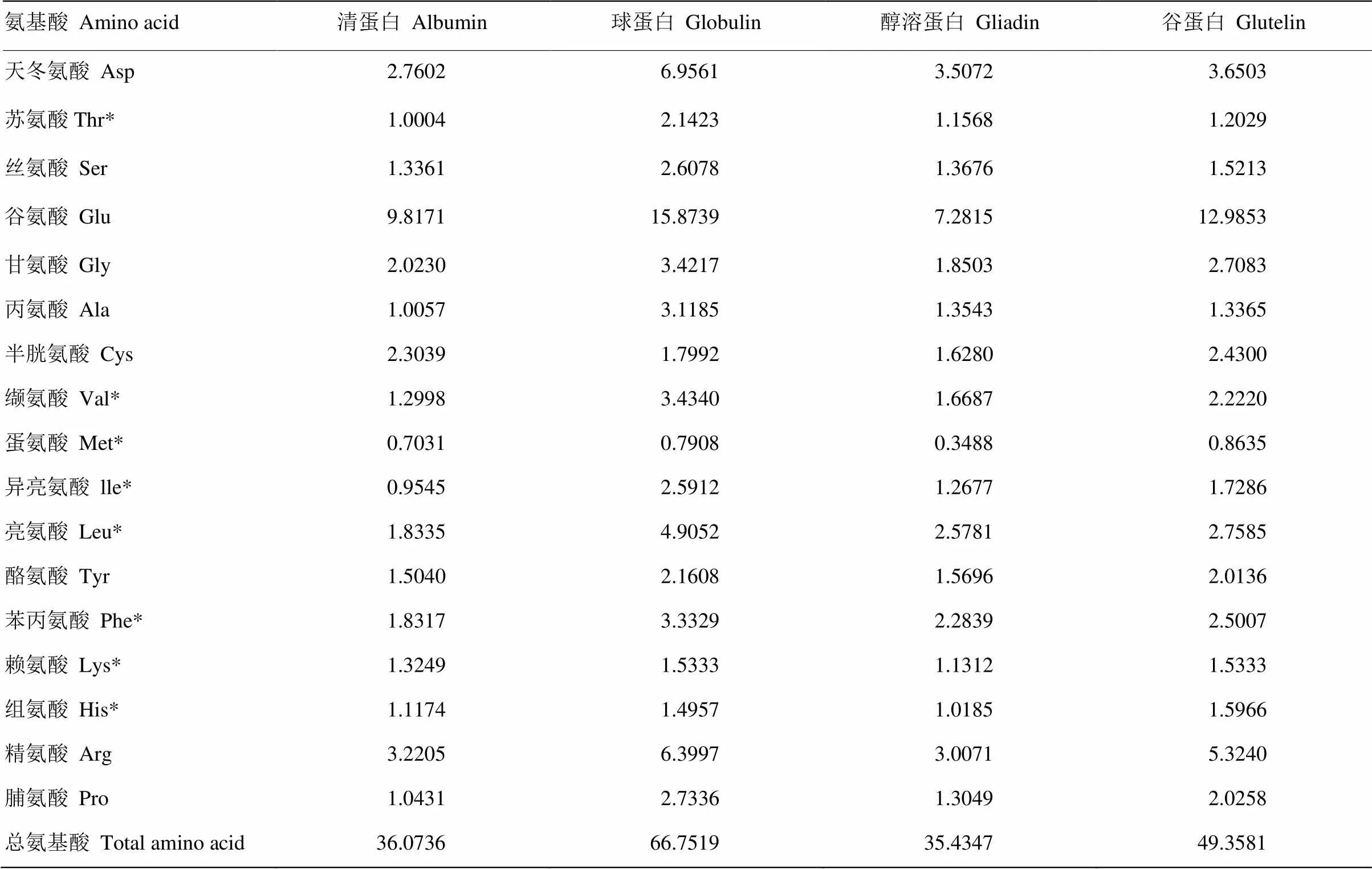
表1 蛋白质氨基酸组成
*表示必需氨基酸 * Essential amino acids
2.2 表面形态特征
鉴于蛋白质分子的性质会受其聚集状态的影响,因此对甜杏仁4种分离蛋白的表观形态进行环境电镜扫描,分别在500、1 000及2 500三种不同的倍数下进行,结果如图2所示。由图2可看出不同分离蛋白的聚集形态存在较大差异,由500倍下的扫描图不易判断出各分离蛋白的聚集形态;通过1 000倍下的扫描图可知,清蛋白、球蛋白及醇溶蛋白显示为较紧密的结构,而谷蛋白的结构较为松散;再由2 500倍扫描图可清晰地看出,清蛋白与球蛋白的表观形态特征比较相似,均表现为结构较为紧密,类似球状聚集态,但大小不够均一,构象也无规则,醇溶蛋白表现为结构致密的纤维状结构,而谷蛋白则表现为多孔的片状结构。
2.3 圆二色谱
甜杏仁4种分离蛋白的圆二色谱图如图3所示,利用CD Pro软件对图谱进行计算,得出分离蛋白二级结构中的α-螺旋、β-折叠、β-转角及无规则卷曲结构的含量(表2)。虽然4种分离蛋白的分子构象存在一定的差异,但可看出α-螺旋与无规则卷曲是甜杏仁分离蛋白二级结构中的主要构成部分,4种分离蛋白中有序结构(α-螺旋、β-折叠和β-转角)所占的比例分别为:清蛋白67.80%,球蛋白66.80%,醇溶蛋白69.00%,谷蛋白67.50%。可知,分离蛋白二级结构的有序性为:醇溶蛋白>清蛋白>谷蛋白>球蛋白。
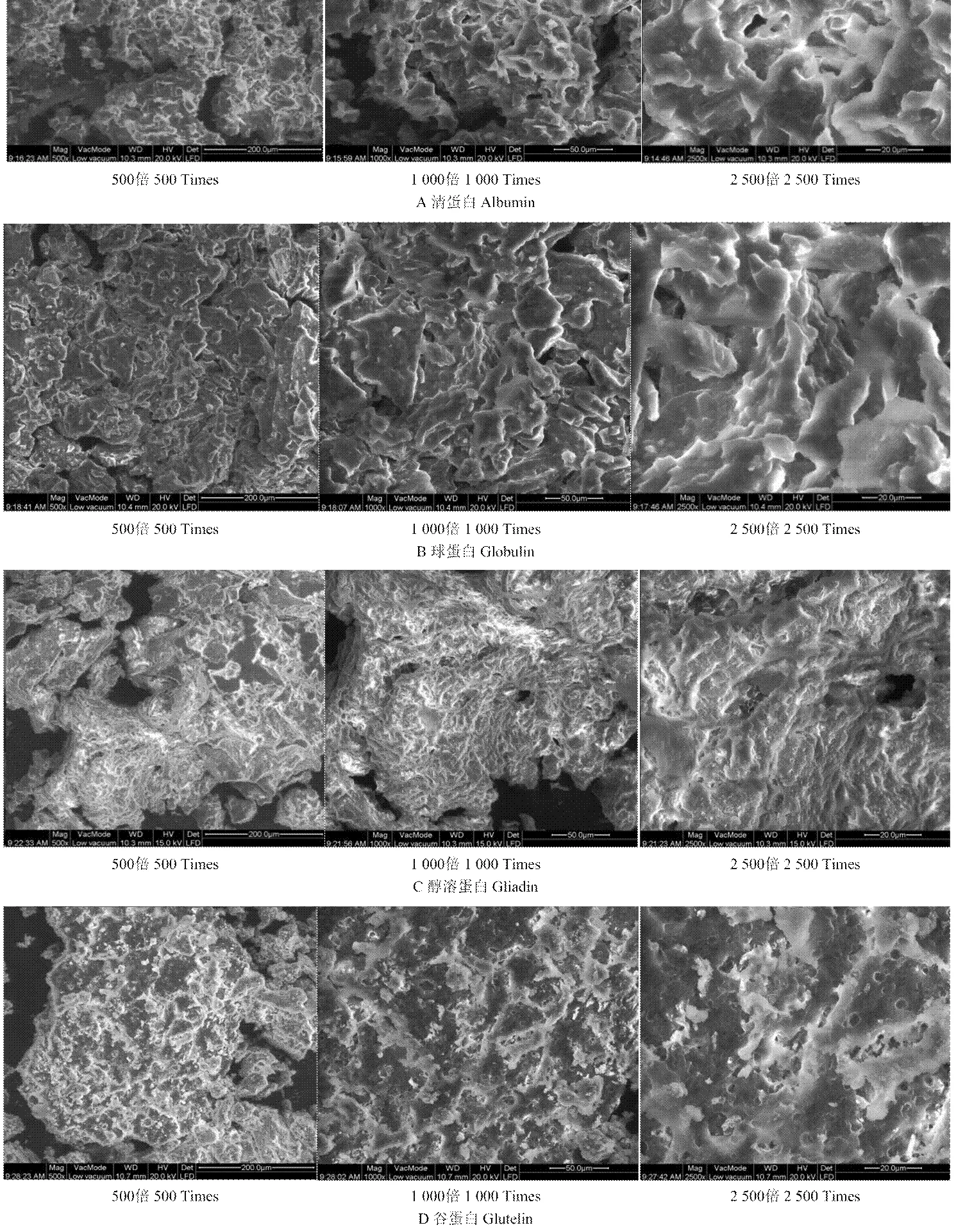
图2 甜杏仁分离蛋白的环境扫描电镜图
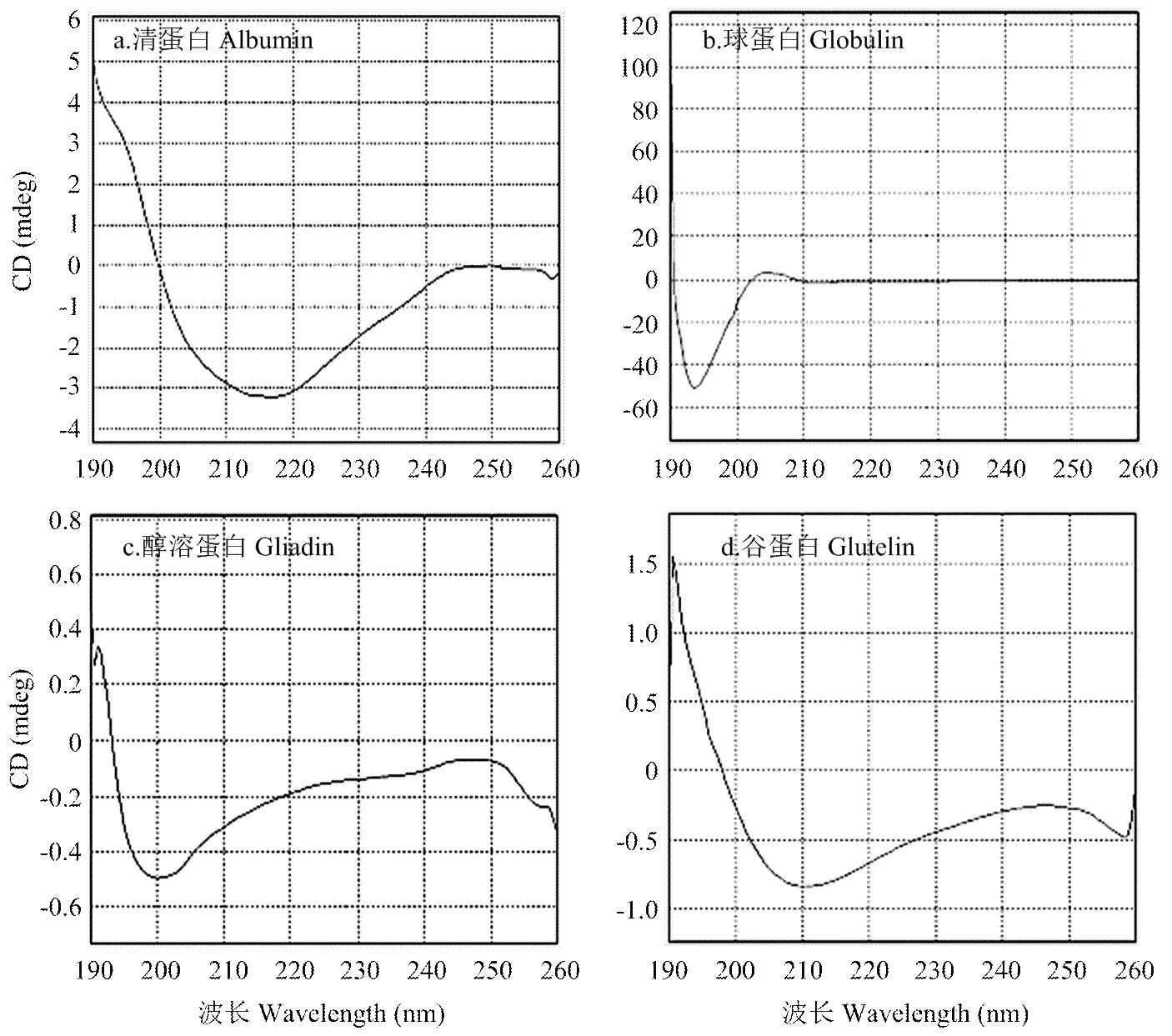
图3 4种分离蛋白的圆二色图谱
2.4 分离蛋白热性质分析
2.4.1 差示扫描量热曲线(DSC) 蛋白质从天然状态到变性状态往往伴随着焓变,DSC通过测量蛋白质在变性过程中能量的变化来评价蛋白质的热力学性质。由图4中4种DSC曲线最大峰值所对应的温度及峰面积可知,清蛋白、球蛋白、醇溶蛋白和谷蛋白的热变性温度(Td)分别为62.84℃、72.98℃、78.33℃和45.70℃,焓变值(ΔH)分别为122.3、80.54、124.1和35.31 J∙g-1。根据TANG等[22]的研究,Td能够反映出分离蛋白的热稳定性,ΔH则表示蛋白质变性所需的热量,能够反映出样品中变性蛋白的比例,ΔH越大,有序结构的含量越多,变性程度越小,分离蛋白的聚集程度就越高。因此,4种分离蛋白的热稳定性为:醇溶蛋白>球蛋白>清蛋白>谷蛋白;聚集程度:清蛋白>醇溶蛋白>球蛋白>谷蛋白。
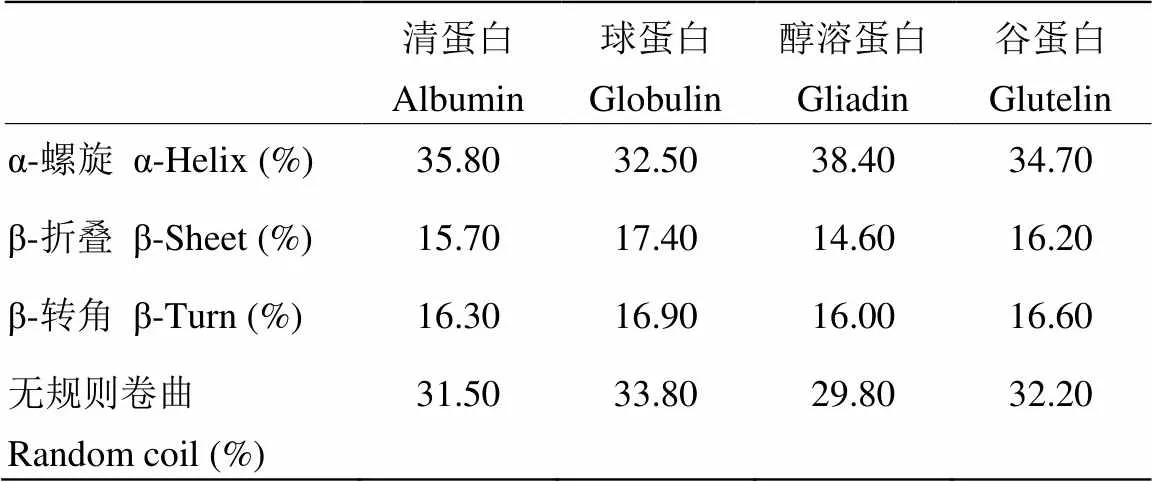
表2 甜杏仁分离蛋白的分子构象
2.4.2 热重分析法(TGA) TGA是在程序升温的条件下,测量物质的质量随温度变化的一种热分析方法,提供了待测样品的水分含量、水化程度、分解温度及样品的热信息及组成[23]。由图5可知,清蛋白、球蛋白、醇溶蛋白与谷蛋白的TGA曲线均可分为3个主要的阶段,第一和第三阶段的质量损失较小,第二阶段分离蛋白的失重明显,尤其是清蛋白,其在该阶段的重量损失最大,热解最为充分。一般来说,第一阶段主要是少量自由水蒸发及蛋白质高级结构被破坏,构象发生变化;第二阶段是热分解阶段,蛋白质晶体中的水也开始损失,且羟基基团被破坏,是样品质量损失最多的一个阶段;第三阶段是一些其他杂质发生降解[24]。除了醇溶蛋白热分解的过程还可细化为两个小的阶段外,其作3种分离蛋白质的TGA曲线趋势大致相同,由于各分离蛋白的组成不同,导致其热损失的速率也不同,一般来说,蛋白质质量的变化还与蛋白质的含水量、分子间的相互作用力以及聚集态有很大关系[25]。
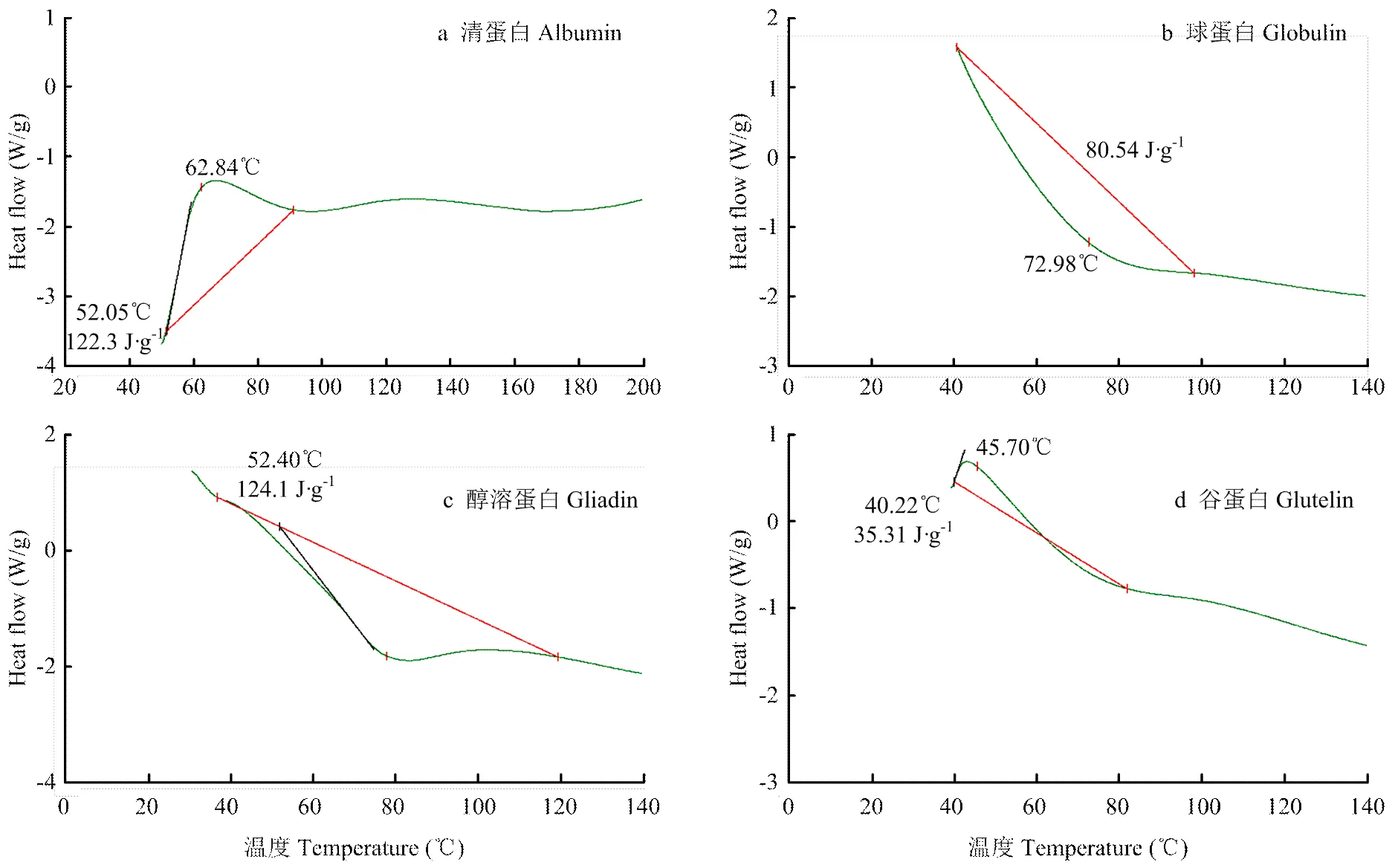
图4 分离蛋白的DSC曲线
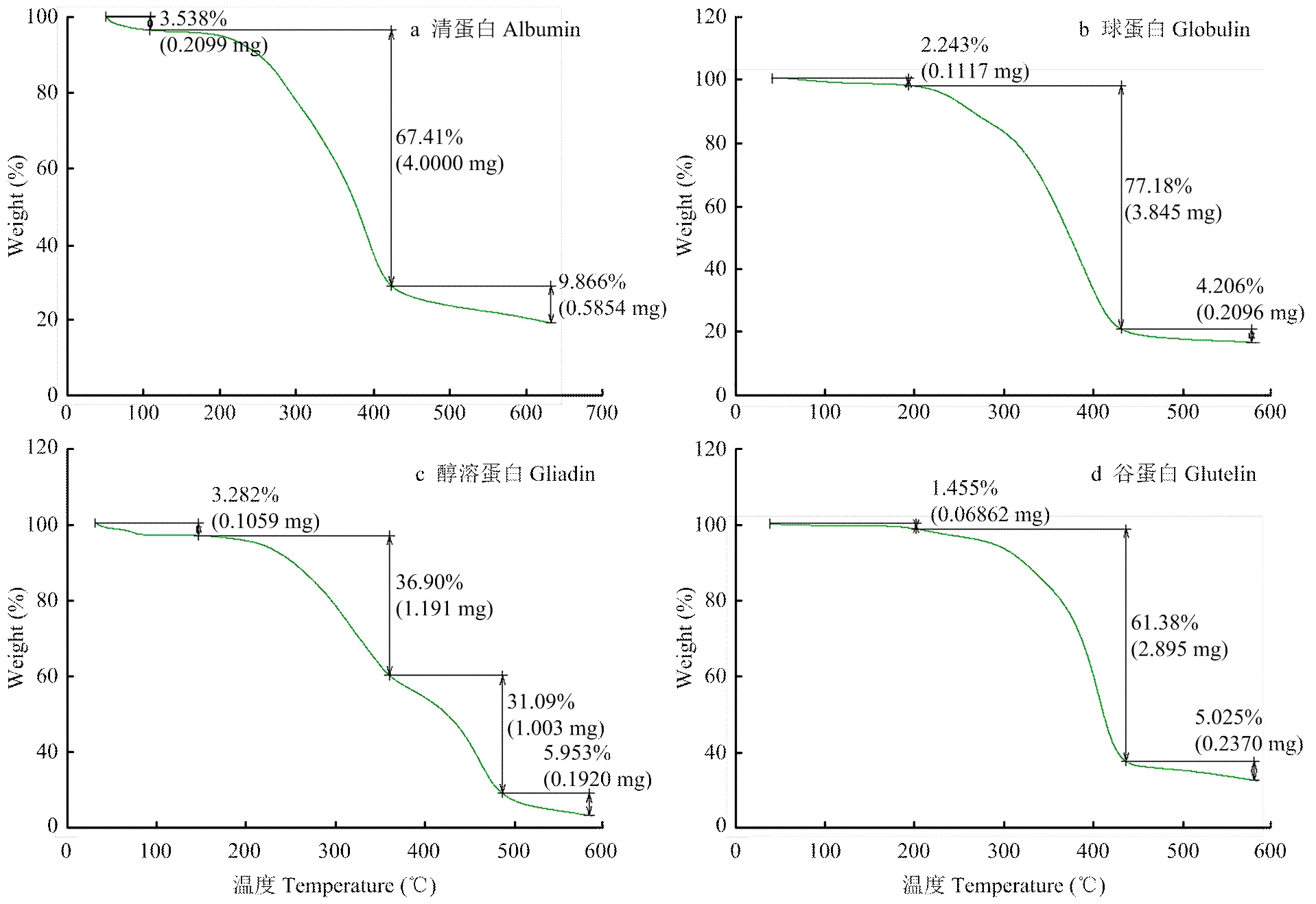
图5 分离蛋白的TGA曲线
2.5 流变性
2.5.1 剪切速率对剪切应力的影响 图6所示为10、20、30、40、50和60℃下分离蛋白剪切应力与剪切速率间的关系。对比4种分离蛋白的流变特性可知,在相同的温度及剪切速率下,醇溶蛋白的剪切应力明显大于其他3种分离蛋白的,且在10℃和20℃的温度条件下,醇溶蛋白的剪切应力随剪切速率的变化表现出更加迅速的增长趋势。总体上看,当温度相同时,4种分离蛋白的剪切应力均随着剪切速率的增加而增大;而随着温度的上升,相同剪切速率下分离蛋白的剪切应力逐渐减小。另外,剪切速率与剪切应力呈非线性关系,据此可判定甜杏仁分离蛋白溶液为非牛顿流体[26],且在试验温度范围内(10—60℃),分离蛋白的流体类型没有发生改变。
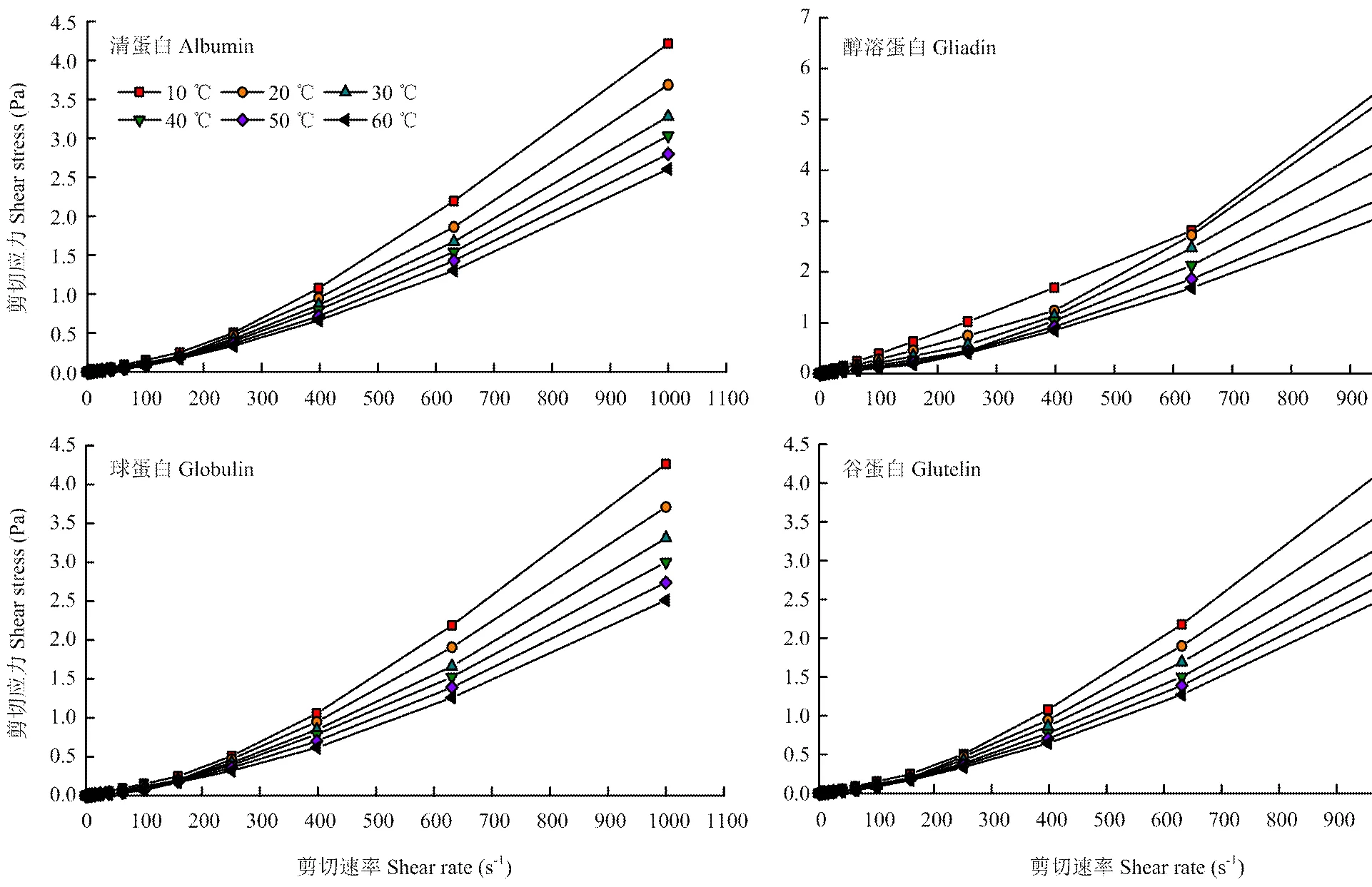
图6 不同温度下分离蛋白的流变特性
2.5.2 剪切速率对分离蛋白黏度的影响 由图7可知,当剪切速率在0.1—1 s-1范围内变化时,随剪切速率的增加,4种分离蛋白的黏度均呈先升高后缓慢降低的变化趋势,因为在剪切速率较小时,分离蛋白的剪切应力也较小,溶液中分离蛋白与水分子间的相互作用以及蛋白质间的相互作用使得黏度较大,之后随着剪切速率变大,剪切应力也逐渐增大,剪切应力破坏了分子间的作用力,从而使黏度降低[27]。当剪切速率在0.1—10 s-1范围内变化时,分离蛋白的黏度在经过初始阶段的波折变化后越来越趋于平稳,不再随着剪切速率的变化而发生大的改变,且在相同的剪切速率下,醇溶蛋白的黏度很明显地高于其他3种分离蛋白的黏度,可能与醇溶蛋白的致密结构有一定的关系。当剪切速率大于10 s-1后,4种分离蛋白的黏度均不再有大的波动变化,说明分离蛋白的溶液正逐渐趋于一个均匀、稳定的体系。
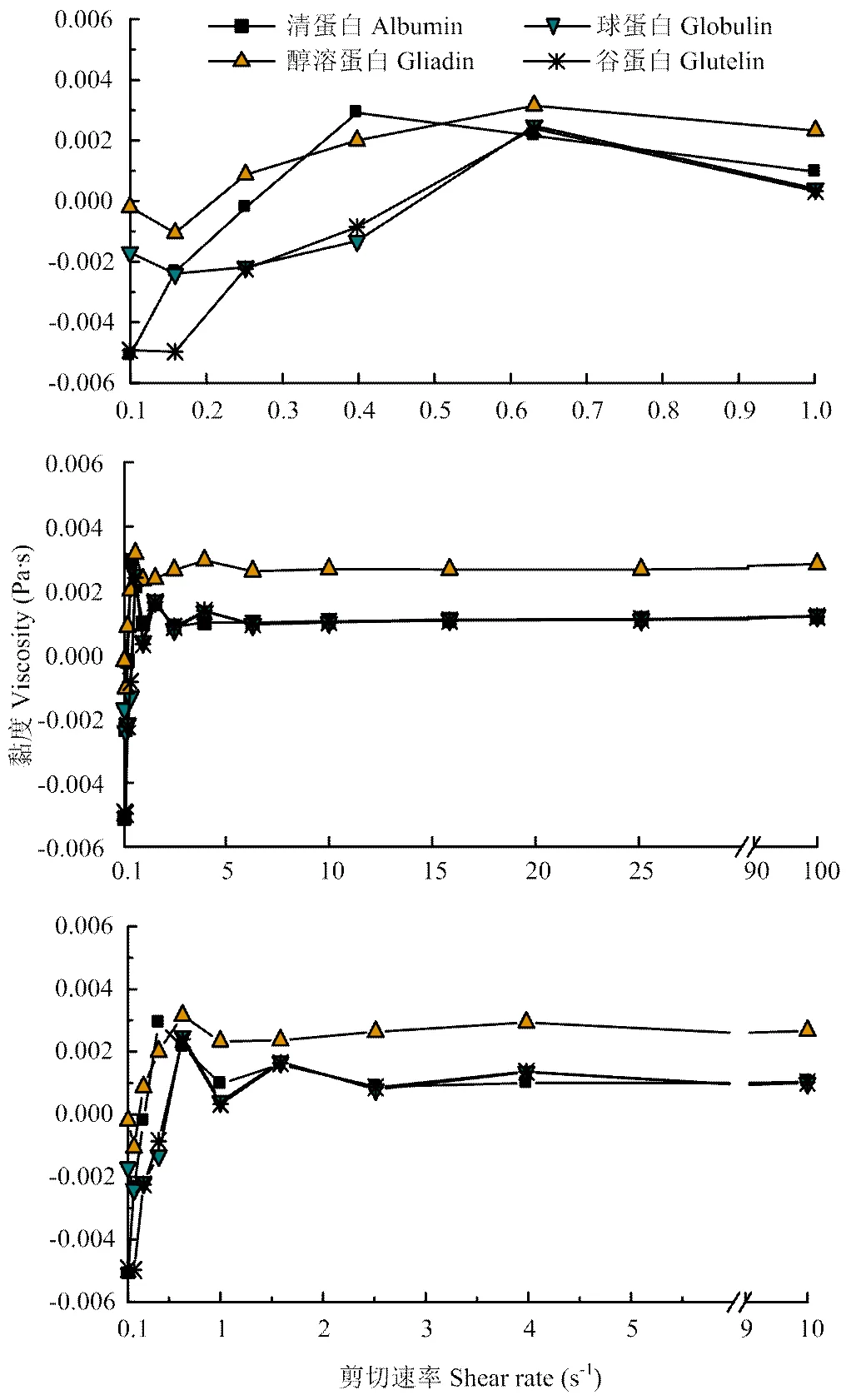
图7 甜杏仁分离蛋白的黏度与剪切速率关系
2.5.3 温度对分离蛋白黏度的影响 图8以温度的倒数1/T作为横坐标,以黏度的对数ln(η)作为纵坐标,研究温度与分离蛋白黏度间的关系,由图8可知,4种分离蛋白的黏度均随着温度的升高而降低,因为温度的升高加速了分子间的热运动,同时,溶液的体积膨胀,蛋白质分子的平均动能增大,从而使分离蛋白溶液的黏度降低。在相同温度条件下,醇溶蛋白的黏度始终大于其余3种分离蛋白溶液的黏度,但其黏度随温度变化的规律与其他3种分离蛋白的一致。图8中1/T与ln(η)呈线性关系,可分别得出4种分离蛋白黏度与温度间的线性方程,列于表3,可知各方程的相关系数2均在0.99左右,表明本研究的实测值与理论值有较好的一致性。可知甜杏仁分离蛋白黏度随温度的变化符合阿累尼乌斯(Arrhenius)指数方程[28]:
式中,—黏度(Pa∙s),—流动活化能(kJ∙mol-1),—气体常数(8.315 J∙K-1∙mol-1),—温度值(K),0—频率因子。
根据表3中线性方程的斜率及截距,通过线性拟合Arrhenius方程的斜率(-a/)及截距(ln0),即可计算出分离蛋白的活化能a及频率因子0,结果如表4所示,可看出4种分离蛋白的活化能均处于较低水平,且与频率因子相互补偿。其中醇溶蛋白的活化能最大,为15.46 kJ∙mol-1,表明醇溶蛋白的黏度对温度变化的敏感程度高于清蛋白、球蛋白和谷蛋白对温度的敏感程度[29],但从总体上来看,甜杏仁分离蛋白的黏度对温度的变化较不敏感,即在温度发生变化时,甜杏仁蛋白质的黏度不会发生剧烈变化。
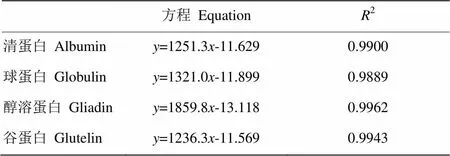
表3 温度与黏度的线性方程
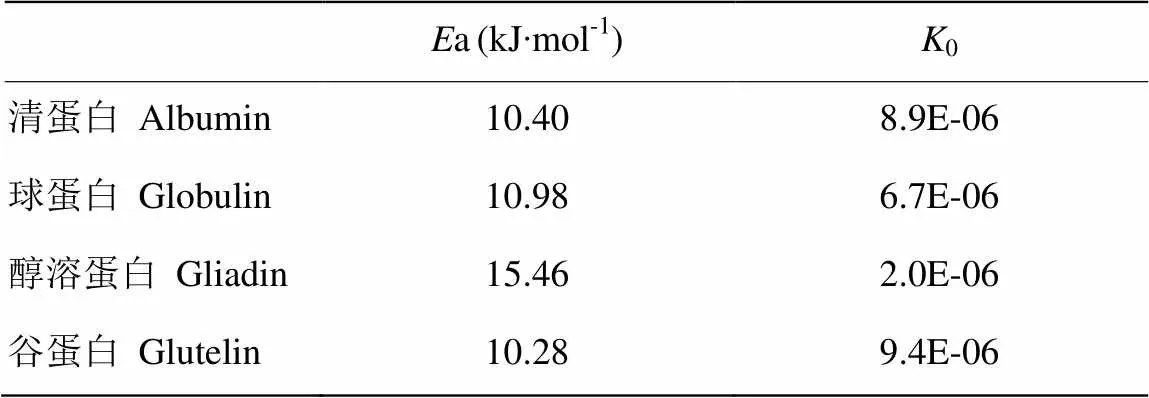
表4 分离蛋白的活化能和频率因子
3 讨论
甜杏仁清蛋白、球蛋白、醇溶蛋白和谷蛋白经Osborne分级法制备而得,4种分离蛋白相对比例分别为:55.0%、37.4%、1.6%和6.0%,与El-Aal等[12]和李新华等[13]的研究结果基本一致,虽然受到杏仁品种间差异的影响,使得每种分离蛋白所占的相对比例在数值上不能达到完全一致,但结果均显示为清蛋白所占的相对比例最大,其次是球蛋白和谷蛋白,而醇溶蛋白所占的相对比例最小。
本研究所得甜杏仁分离蛋白氨基酸的组成结果稍微低于Femenia等[9]的研究结果,因为不同文献中所用杏仁的品种不同,导致所得结果具有一定的差异;但甜杏仁中谷氨酸的含量最丰富而蛋氨酸含量最低的结果与Femenia等[9]、李翠芹等[30]的研究相一致。同时,需要强调的是,本文是采用全自动氨基酸分析仪对氨基酸进行的测定,故表1中未列出各分离蛋白中色氨酸的含量,但Adu等[31]的研究显示,印度杏仁中色氨酸的含量为0.16 g/100g。根据本文对甜杏仁氨基酸的研究,不能判断出色氨酸在4种分离蛋白中的具体含量。但不可否认的是,甜杏仁分离蛋白中的氨基酸含量丰富,清蛋白、球蛋白、醇溶蛋白和谷蛋白中8种必需氨基酸(包括组氨酸)依次占总氨基酸的27.90%、30.30%、32.32%和29.19%,与Femenia等[9]的研究结果比较接近。在制备ESEM样品的过程中,涉及了超声波、脱水干燥以及酸碱处理等步骤,这些处理方式可能会在一定程度上对分离蛋白形态及构象造成影响,且在不同倍数下进行ESEM扫描时,随机选取的扫描部位也会影响蛋白质的表面形态特征,因此很难通过ESEM图像准确地判断出各分离蛋白的聚集程度。ESEM图像显示甜杏仁清蛋白、球蛋白及醇溶蛋白的聚集程度较高,而谷蛋白呈现为多孔的松散状。因此,通过ESEM图像仅能确定谷蛋白的聚集程度最低,而不能判断出清蛋白、球蛋白及醇溶蛋白的聚集程度,通过DSC对分离蛋白热性质进行的研究,可根据焓变值(ΔH)明确地判断出分离蛋白的聚集程度。4种甜杏仁分离蛋白圆二色图谱的变化规律基本一致,在190 nm附近的正峰表示β-折叠结构,205—220 nm的负槽是α-螺旋结构的典型表征,220 nm后出现的微弱正峰表示无规则卷曲结构,符合蛋白质的圆二色性[32-33]。王辰等[34]对大豆分离蛋白的研究表明,蛋白质的表面疏水性与其二级结构分子构象中α-螺旋结构所占的比例呈负相关,与β-折叠及无规则卷曲结构所占的比例呈正相关,而表面疏水性与蛋白质的功能性质如黏度、凝胶性等均有很大关联[35-36],通过本文对甜杏仁分离蛋白二级结构的研究,有助于对其相关性质的进一步认识。
通过对圆二色性的研究可知,4种分离蛋白二级结构的有序程度为:醇溶蛋白>清蛋白>谷蛋白>球蛋白,可见该结果与DSC得出的分离蛋白热稳定性的结果并未达到完全一致。蛋白质的热稳定性是其各结合力发生综合效应的一个体现,除了受α-螺旋结构的影响,还与蛋白质的氢键、盐键、共价键的稳定以及疏水作用等有很大的关联性[37]。因此,圆二色性作为二级结构的表观,其结果与热稳定性结果未能达到完全一致属于正常现象,且从大体上看,除球蛋白的排序存在差异外,其余3种分离蛋白的热稳定性排序均与二级结构的有序性一致。由DSC结果还可看出,分离蛋白的聚集程度与其二级结构的有序性也不一致。虽然二级结构的有序性在一定程度上决定蛋白质的聚集程度,但分离蛋白的聚集程度还受其三级结构与四级结构的影响,尤其是二硫键,它对杏仁分离蛋白热聚集的影响大于氢键和离子键[38]。DSC结果还表明了谷蛋白的变性温度最低,为45.70℃,即对甜杏仁蛋白质进行热处理的过程中,只要温度达到45.70℃,则谷蛋白开始变性,而当加工温度大于78.33℃时,4种分离蛋白均发生变性。因此,在生产加工的过程中应有效控制加工温度,以达到产品品质所需的要求。根据TGA结果可知,分离蛋白在热分解阶段的失重最为明显,因为该阶段主要是分离蛋白晶体中的水开始损失,且羟基基团也被破坏,而醇溶蛋白热解的第二阶段还可细化为两个小的阶段,可能是因其具有较为紧密的聚集状态。当剪切速率在10—100 s-1范围内时,分离蛋白的黏度均呈现出较平稳的变化趋势,因此,在与甜杏仁蛋白相关的流体产品的加工过程中,可将剪切速率控制在10—100 s-1范围内,使蛋白质的整体黏度处于较低且较平稳的水平,进而增加体系的流动性和稳定性。通过对甜杏仁分离蛋白流变性的研究可发现,无论是不同温度下剪切速率对分离蛋白剪切应力的影响、相同温度下剪切应力对分离蛋白黏度的影响,还是温度对分离蛋白黏度的影响,结果均显示为清蛋白、球蛋白和谷蛋白的流变性具有高度的相似性,而醇溶蛋白总是显现出较特殊的流变特性,如在相同温度及剪切速率下具有高的剪切应力和黏度,这些现象均已通过分离蛋白a值的结果得到合理的解释,因为在甜杏仁的分离蛋白中,醇溶蛋白的活化能最高,因而导致其黏度对温度的敏感程度最大,在相同的温度和剪切速率下拥有较高的黏度。
4 结论
甜杏仁分离蛋白的氨基酸种类丰富,鲜味氨基酸所占比重大;清蛋白与球蛋白作为甜杏仁蛋白质的主要成分,显示为紧密的聚集态;在分离蛋白的二级结构中,球蛋白的无序结构(无规则卷曲)所占的比例最大,为33.80%;谷蛋白的热变性温度最低,为45.70℃;甜杏仁分离蛋白的剪切应力随剪切速率的增加而增加,当剪切速率在10—100 s-1范围内时,黏度几乎不发生变化;4种分离蛋白的a值较低,与其变性温度较低的现象相呼应。综上所述,甜杏仁分离蛋白可作为一种优质的蛋白质来源,只要对其加工、贮藏及运输等过程中的条件进行优化控制,则可减少资源的浪费,促进甜杏仁产业良性发展。
References
[1] Yada S, Lapsley K, Huang G. A review of composition studies of cultivated almonds: Macronutrients and micronutrients., 2011, 24(4): 469-480.
[2] Richardson D P, Astrup A, Cocaul A, Ellis P. The nutritional and health benefits of almonds: A healthy food choice., 2009, 6(6): 41-50.
[3] Zhang Q A, Zhang Z Q, Yue X F, Fan X H, Tao L, Chen S F. Response surface optimization of ultrasound-assisted oil extraction from autoclaved almond powder., 2009, 116(2): 513-518.
[4] TURAN S, TOPCU A, KARABULUT I, VURAL H, HAYALOGLU A A. Fatty acid, triacylglycerol, phytosterol, and tocopherol Variations in kernel oil offrom Turkey., 2008, 55(26): 10787-10794.
[5] JIA X Y, ZHANG Q A, ZHANG Z Q, YAN W, YUAN J F, WANG H Y. Hepatoprotective effects of almond oil against carbon tetrachloride induced liver injury in rats., 2011, 125(2): 673-678.
[6] Ahrens S, Venkatachalam M, Mistry A M, Lapsley K, Sathe S K. Almond (L.) protein quality., 2005, 60(3): 123-128.
[7] KING J C, BLUMBERG J, INGWERSEN L, JENAB M, TUCKER K L. Tree nuts and peanuts as components of a healthy diet., 1978, 138(9): 1736S-1740S.
[8] 王淑英, 温哲屹, 李慧颖. 我国甜杏仁营养成分含量分析. 北京农业, 2008(9): 13-16.
Wang S Y, Wen Z Y, Li H Y. Analysis of the nutritional components and contents of sweet apricot kernel., 2008(9): 13-16. (in Chinese)
[9] FEMENIA A, ROSSELLO C, MULET A, CANELLAS J. Chemical composition of bitter and sweet apricot kernels., 1995, 43(2): 356-361.
[10] 杜琨, 牟朝丽. 杏仁的营养价值与开发利用. 食品研究与开发, 2005, 26(5): 151-154.
DU K, MOU Z L. The nutrition and exploitation of almond., 2005, 26(5): 151-154. (in Chinese)
[11] SZETAO K W C, SATHE S K. Functional properties and in vitro digestibility of almond (L.) protein isolate., 2000, 69(2): 153-160.
[12] EL-AAL M H A, HAMZA M A, RAHMA E H. In vitro, digestibility, physico-chemical and functional properties of apricot kernel proteins., 1986, 19(3): 197-211.
[13] 李新华, 闫荣. 辽西大扁杏杏仁蛋白的组成及碱法提取工艺的研究. 食品科技, 2009(5): 132-135.
LI X H, YAN R. Study on composition and extraction of almond protein.2009(5): 132-135. (in Chinese)
[14] NICOLASA D, PATRICIAA M, LAWRENCEA J. Characterization of fractionated soy proteins produced by a new simplified procedure.’, 2007, 84(2): 137-149.
[15] GONZALEZ A, ALVAREZ IGARZABAL C I. Soy protein-Poly (lactic acid) bilayer films as biodegradable material for active food packaging., 2013, 33(33): 289-296.
[16] 张逸婧, 陈海娟, 吕奕, 刘永祥, 汤晓智, 沈新春. 羧甲基纤维素钠对大豆分离蛋白骨粘合性能的影响. 中国农业科学, 2016, 49(8): 1550-1558.
ZHANG Y J, CHEN H J, LÜ Y, LIU Y X, TANG X Z, SHEN X C. Effects of sodium carboxymethyl cellulose on adhesion properties of soybean protein isolate onto porcine bones., 2016, 49(8): 1550-1558. (in Chinese)
[17] 盛小娜. 水酶法提取甜杏仁油及水解蛋白的研究[D]. 江苏: 江南大学, 2008.
SHENG X N. Aqueous enzymatic extraction of sugary almond oil and protein hydrolysate[D]. Jiangsu: Jiangnan University, 2008. (in Chinese)
[18] 刘贺, 李清华, 刘剑侠, 朱丹实, 慧丽娟, 王勃, 何余堂, 马涛. 扁杏仁分离蛋白与水解蛋白功能性质的比较研究. 食品工业科技, 2014, 35(4): 92-95.
LIU H, LI Q H, LIU J X, ZHU D S, HUI L J, WANG B, HE Y T, MA T. Study on comparison of properties of sweet almond protein isolated and protein hydrolysate.2014, 35(4): 92-95. (in Chinese)
[19] 申辉. 苦杏仁去皮过程中品质变化及其原因探究[D]. 陕西: 陕西师范大学, 2015.
SHEN H. Quality changes of bitter apricot seed in peeling process and its cause exploration [D]. Shaanxi:2015. (in Chinese)
[20] ZHENG Y, LI Y, ZHANG Y, ZHANG R, ZHANG Y, ZHAO S. Effects of limited enzymatic hydrolysis, pH, ionic strength and temperature on physicochemical and functional properties of palm (Jacq.) kernel expeller protein., 2015, 52(11): 1-13.
[21] Ninomiya K. Science of umami taste: Adaptation to gastronomic culture., 2015, 4(1): 13.
[22] Tang C H, Wang X Y. Physicochemical and structural characterisation of globulin and albumin from common buckwheat (Moench) seeds., 2010, 121(1): 119-126.
[23] Chen T, Oakley D M. Thermal analysis of proteins of pharmaceutical interest., 1995, 248(1): 229-244.
[24] Das S N, Routray M, Nayak P L. Spectral, thermal, and mechanical properties of furfural and formaldehyde cross-linked soy protein concentrate: A comparative study., 2008, 47(6): 576-582.
[25] Fuente J L D L, Ruiz-Bermejo M, Menor-Salván C, Osuna-Esteban S. Thermal characterization of HCN polymers by TG-MS, TG, DTA and DSC methods., 2011, 96(5): 943-948.
[26] Alfredo V O, David B A, Luis C G. Physicochemical and functional properties of a protein-rich fraction produced by dry fractionation of chia seeds (L.)., 2013, 11(1): 75-80.
[27] Fennema O R. 食品化学. 北京: 中国轻工业出版社, 2003: 322-328.
Fennema O R.Beijing: China Light Industry Press. 2003: 322-328. (in Chinese)
[28] Monkos K. Viscosity analysis of the temperature dependence of the solution conformation of ovalbumin., 2000, 85(1): 7.
[29] 靳福泉. 阿累尼乌斯方程探讨. 大学化学, 2007, 22(5): 45-47.
Jin F Q. The investigate of Arrhenius exponential equation.2007, 22(5): 45-47. (in Chinese)
[30] 李翠芹, 陈桐, 章平, 陈梦瑜. 甜杏仁中微量元素及氨基酸成分的分析. 贵州工业大学学报, 2006, 35(2): 92-94.
Li C Q, Chen T, Zhang P, Chen M Y. Analysis of trace elements and amino acids in sugary almond., 2006, 35(2): 92-94. (in Chinese)
[31] Adu O B, Ogundeko T O, Ogunrinola O O, Elemo B O. The effect of thermal processing on protein quality and free amino acid profile of(Indian Almond) seed., 2015, 52(7): 4637-4641.
[32] 王镜岩, 朱圣庚, 徐长法. 生物化学. 北京: 高等教育出版社, 2002.
Wang J Y, Zhu S G, Xu C F.. Beijing: Higher Education Press, 2002. (in Chinese)
[33] Jing X, Yang C, Zhang L. Characterization and analysis of protein structures in oat bran., 2016, 81(10): C2337-C2343.
[34] 王辰, 江连洲. 使用圆二色性光谱分析二级结构对大豆分离蛋白表面疏水性的影响. 食品工业科技, 2016(14): 134-137.
Wang C, Jiang L Z. Effect of secondary structure determined by CD spectra on surface hydrophobicity of soybean protein isolate., 2016(14): 134-137. (in Chinese)
[35] Kinsella J E, Damodaran S, German B. V-physicochemical and functional properties of oilseed proteins with emphasis on soy proteins., 1985, 79(79): 107-179.
[36] Keeratiurai M, Corredig M. Effect of dynamic high pressure homogenization on the aggregation state of soy protein., 2009, 57(9): 3556-3562.
[37] Warren G L, Petsko G A. Composition analysis of α-helices in thermophilic organisms., 1995, 8(9): 905-913.
[38] Sathe S K, Kwc S. Thermal aggregation of almond protein isolate., 1997, 59(1): 95-99.
(责任编辑 赵伶俐)
Compositions and Physicochemical Properties of Sweet Almond Isolate Proteins
ZHANG QingAn, ZHANG XinYun, FENG YuLin, SHI FangFang
(School of Food Engineering and Nutrition Sciences, Shaanxi Normal University, Xi'an 710119)
【Objective】The aim of this study is to investigate the physical and chemical properties of sweet almond albumin, globulin, gliadin and glutelin. The relationship between the change of protein’s properties and product processing features was also studied to promote the development of high-quality sweet almond products. 【Method】Alkali-solution and Acid-isolation was employed upon the skimmed sweet almond to extract crude protein, and, subsequently, Osborne classification method was adopted to extract the albumin, globulin, gliadin and glutelin. The amino acid composition was determined by Automatic Amino Acid Analyzer. ESEM was used to observe the morphological characteristics of above mentioned proteins; CD spectra scanning was utilized to measure its secondary structure; thermal properties were determined by using DSC and TGA; Rheometer was applied to determine the influence of shear rate, moreover, the linear equation between temperature and viscosity of proteins was determined, and, therefore, the value ofa and0could be calculated.【Result】Various amino acids were detected in isolated proteins derived from sweet almond, containing 17 kinds of amino acids which the human need. It should be noticed that eight kinds of essential amino acids (including histidine) are completely embraced, among which the content of glutamic acid is the highest. Albumin, globulin and gliadin show a state of close aggregation structure, while glutelin shows a state of loose and porous plate. As for the constitution of the secondary structure, alpha helix and random curl are dominant in the isolated proteins compared with other forms of secondary structures. The denaturation temperatures for albumin, globulin, gliadin and glutelin are 62.84, 72.98, 78.33 and 45.70℃, respectively. Therefore, the thermal stability should coincide with the following order: gliadin > globulin > albumin > glutelin. Combined DSC with ESEM, the aggregation degree should conform to the following order: albumin > gliadin >globulin > glutelin protein. The aqueous solution of the four kinds of isolated proteins derived from sweet almond are non-newtonian fluid and, furthermore, the relationship between temperature and viscosity is conform to the Arrhenius index equation, and the linear equation matches the parameters in processing well.【Conclusion】Sweet almond isolated protein can be regarded as a high-quality source for plant protein. Results of this study will make greater contributions to the development of sweet almond protein products. Besides, this study definitely do contribution to the function and property control of the protein products derived from sweet almond both in development and processing of the products, which could enhance the additional value and promote the development of sweet almond industry.
sweet almond; isolate protein; amino acid; thermal properties; rheological properties
2016-12-05;接受日期:2017-04-28
国家自然科学基金青年基金(31101324)、陕西省自然科学基金项目(2015JM3097)、西安市科技局技术转移促进工程项目(CXY1434(5))、中央高校基本科研业务费专项(GK201602005)
张清安,E-mail:qinganzhang@snnu.edu.cn

