绿盲蝽AlEcR-A的单克隆抗体制备及在外源20E诱导下的应答
谭永安,肖留斌,郝德君,赵静,孙洋,柏立新
绿盲蝽AlEcR-A的单克隆抗体制备及在外源20E诱导下的应答
谭永安1,肖留斌1,郝德君2,赵静1,孙洋1,柏立新1
(1江苏省农业科学院植物保护研究所,南京 210014;2南京林业大学林学院,南京210037)
【目的】获得绿盲蝽()蜕皮激素受体()原核表达的重组蛋白,制备单克隆抗体,分析绿盲蝽在外源蜕皮激素(20E)诱导下mRNA及蛋白表达量的变化趋势,为进一步研究的功能奠定前期基础,同时也为构建20E信号传导的网络图谱提供理论依据。【方法】在前期获得绿盲蝽的基础上,将含有其基因的T载体经I和I双酶切,构建AlEcR-A原核表达载体(pCzn1-AlEcR-A),将该表达载体经IPTG诱导表达和蛋白Ni-IDA亲和纯化,以获得基因功能区的纯化蛋白。进一步用其进行免疫反应,取小鼠的脾细胞与SP2/0细胞进行细胞融合,采用间接ELISA及Western blot筛选验证是否为目的抗体,通过抗体纯化,Western blot检测该抗体能否特异性结合AlEcR-A重组蛋白及绿盲蝽总蛋白,从而制备得到AlEcR-A蛋白单克隆抗体。最后利用RT-PCR及Western blot方法,进行20E微注射绿盲蝽2龄若虫,分析8 d内的mRNA及蛋白含量的变化,明晰20E诱导下的应答反应。【结果】 经I和I双酶切后原核表达载体pCzn1-AlEcR-A在大肠杆菌Arctic express中能高效表达一个约为55 kD的蛋白,且该重组蛋白经IPTG诱导后主要以包涵体的形式存在;经Ni-IDA亲和层析后,pCzn1-AlEcR-A重组蛋白的包涵体纯度仅在55 kD附近有一条明显的特异性条带,说明靶蛋白已得到纯化。进一步通过小鼠免疫、细胞融合及腹水制备,获得了1株能稳定分泌抗AlEcR-A蛋白单克隆抗体的细胞株,命名为8H7;Western blot分析表明,该细胞株不仅能与绿盲蝽总蛋白结合,还可特异性与AlEcR-A重组蛋白反应,且条带大小一致,说明制备的AlEcR-A单克隆抗体准确、有效;RT-PCR及Western blot结果表明,与注射蒸馏水相比,20E微注射处理后的绿盲蝽mRNA表达量及蛋白表达量均显著升高,且随着处理时间的延长,其增值幅度也逐渐增高。【结论】获得了一株高特异性的能稳定分泌AlEcR-A单克隆抗体的细胞株,20E有诱导mRNA及蛋白表达的作用。
绿盲蝽;蜕皮激素受体;20-羟基蜕皮酮;单克隆抗体;表达量
0 引言
【研究意义】自20世纪90年代转Bt基因棉花在中国大面积商业种植以来,其靶标鳞翅目害虫如棉铃虫()等得到有效控制,棉田化学农药的施用频率及使用量大幅度降低,从而使得棉田害虫的生态位发生了一系列的演替变化,绿盲蝽()已上升成为长江及黄河流域棉区上的主要致灾性害虫[1-3]。目前,防治绿盲蝽主要以化学农药为主,但也随之带来了诸多问题,如抗药性的产生导致防治效果下降、污染环境及食品安全等[4]。因此绿盲蝽的防控减灾亟需开拓基于新靶标的有效技术。与化学农药相比,昆虫生长调节剂类杀虫剂具有高毒力且与环境友好的优点[5],其作用机理多为干扰昆虫蜕皮激素或保幼激素,导致昆虫不能蜕皮而死亡[6]。【前人研究进展】类固醇激素 20-羟基蜕皮酮(20-hydroxyecdysone,20E)是昆虫蜕皮激素的主要活性形式,在昆虫的变态发育过程中起着重要的调控作用[7]。已有研究表明,昆虫蜕皮激素受体(ecdysone receptors,)为20E的作用靶标受体,在蜕皮激素信号传导中扮演着关键角色[8]。昆虫隶属于核受体(nuclear receptor,NR)基因家族,该家族通常具有5个模块结构域:A/B域(反式调控域)、C域(DNA结合域,DNA binding domain,DBD)、D域、E域(配体结合域,ligand binding domain,LBD)和F域[9],其中C域及E域相对保守,且C域含有2个锌指结构[10]。迄今,已经明确了20E与其受体在调控昆虫蜕皮时的分子机制,EcR首先与20E结合形成一个配体-受体复合物,再与(超气门蛋白,另一个20E核受体)结合形成 20E-EcR-USP异源二聚体来行使生理功能[11]。此异源二聚体可对昆虫血淋巴中的蜕壳启动激素(ecdysis-triggering hormone,ETH)进行双重调控,当昆虫血淋巴中20E滴度下降后,羽化激素(eclosion hormone,EH)可促进ETH的分泌,最终使得ETH启动昆虫的蜕皮过程[12]。20E-EcR-USP绑定形成的配体-受体复合物引发20E初级应答基因的表达,由20E初级反应基因诱导表达的20E次级应答基因级联放大20E信号[13],从而在基因组途径上调控昆虫蜕皮、变态及生殖等重要生理过程。【本研究切入点】昆虫自身在外源20E诱导下的应答反应如何,目前还不清晰。【拟解决的关键问题】在笔者实验室前期克隆获得的绿盲蝽蜕皮激素受体基础上,分析其在外源20E诱导后的mRNA表达量的变化趋势,及利用原核细胞表达系统,进行重组表达获得纯化蛋白,通过小鼠免疫、细胞融合获得特异性的AlEcR-A单克隆抗体,进一步分析外源20E诱导后AlEcR-A蛋白表达的差异。为在蛋白水平上进一步研究的功能打下基础,同时也可为丰富20E信号传导的网络图谱提供依据。
1 材料与方法
试验于2015年4月至2016年5月在江苏省农业科学院植物保护研究所完成。
1.1 供试昆虫
初始绿盲蝽虫源采自江苏大丰及东台早春蚕豆()田,于室内用四季豆()豆荚继代饲养,饲养条件为温度(25±1)℃,相对湿度70%±5%,光周期12L﹕12D,成虫期补充10%蜂蜜水。
1.2 主要试剂与仪器
20E为Sigma公司产品,SYBR Premix Ex Taq Kit为TaKaRa产品,iCycler iQ为Bio-Rad产品,原核表达载体pCzn1、大肠杆菌Arctic express菌株、SP2/0细胞株及含有的T载体均为笔者实验室前期保存,6—8周龄雌性BALB/c小鼠购于扬州大学兽医学院,限制性内切酶I和I,dNTPs,IPTG,Acr、Bis、Tris、ExTaq酶,质粒提取试剂盒及PEG为Sigma产品。Pfu DNA聚合酶为Zoonbio公司产品,卡那霉素、咪唑、尿素为上海生工工程生物公司产品,DNA胶纯化试剂盒、质粒小提试剂盒为AnyGen公司产品,TEMED为Bio-Rad公司产品,Tyrptone、Yeast Extract为Oxoid公司产品,Ni2+IDA亲和层析胶为Novagen公司产品,组织蛋白提取试剂盒为南京钟鼎公司产品。其余所需各种试剂、药品均为国产分析纯。
1.3在大肠杆菌Arctic Express中的表达及纯化
1.3.1 重组蛋白AlEcR-A的诱导表达I和I双酶切含有的T载体及pCzn1载体,DNA Fragment Purification Kit回收,T4DNA连接酶大片段连接。将上述阳性重组质粒转入大肠杆菌Arctic Express克隆菌株中,挑取阳性克隆子后,将1 μl质粒加入100 μl感受态细胞,冰孵20 min,42℃热激90 s后迅速置冰中5 min;最后加入600 μl LB培养液,37℃ 220 r/min振摇1 h后离心,涂布于含50 μg·ml-1Amp的LB平板后培养过夜。
挑取单个菌落接种于含50 μg·ml-1Amp的3 ml LB培养基中,37℃ 220 r/min培养过夜,次日按1﹕100的比例接种于LB培养基中,37℃ 220 r/min振摇至菌体OD600值为0.6—0.8时,取1 ml培养物,10 000 ×室温离心2 min,弃上清,用100 μl 1×上样缓冲液重悬菌体沉淀,向剩余的培养物中加入IPTG至终浓度为0.5 mmol·L-1,37℃ 220 r/min振摇4 h,以诱导AlEcR-A-His融合蛋白表达,取1 ml培养物,12 000 ×室温离心2 min,弃上清,用100 μl 1×上样缓冲液重悬菌体沉淀,收集菌液,取适量菌液进行SDS-PAGE分析。对照为不加IPTG。
1.3.2 重组蛋白AlEcR-A的亲和纯化 于0℃,6 000×离心上述菌液10 min后置于lysis buffer中进行沉淀重悬与超声破碎;将超声破碎的细胞裂解液于4℃,10 000×离心20 min后收集沉淀;用洗涤液(20 mmol·L-1Tris,1 mmol·L-1EDTA,2 mol·L-1尿素,1 mol·L-1NaCl,1% Triton X-100,pH 8.0)洗涤包涵体3次;用溶解缓冲液(20 mmol·L-1Tris,5 mmol·L-1DTT,8 mol·L-1尿素,pH 8.0),按比例溶解包涵体,将上述溶液滴加20 mmol·L-1Tris-HCL及5 mmol·L-1EDTA Buffer(pH 7.8)缓冲液中,逐步成倍梯度稀释缓慢搅拌,将蛋白溶液装入透析袋于PBS(pH 7.4)溶液中透析过夜。
将上述包涵体溶液上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose CL-6B亲和层析柱上,用Ni-IDA Binding-Buffer进行冲洗,再用Ni-IDA Washing-Buffer(20 mmol·L-1Tris-HCl,20 mmol·L-1咪唑,0.15 mol·L-1NaCl,pH 8.0)进行冲洗,最后用Ni-IDA Elution-Buffer(20 mmol·L-1Tris-HCl,250 mmol·L-1咪唑,0.15 mol·L-1NaCl,pH 8.0)洗脱目的蛋白,收集流出液,将上述收集的蛋白溶液用PBS缓冲液(pH 7.4)进行透析过夜。取适量透析液进行SDS-PAGE分析。
1.4 单克隆抗体的制备
1.4.1 免疫 选取5只6—8周龄雌性BALB/c小鼠,于其腹部和背部皮下多点注射上述纯化后的AlEcR-A重组蛋白,注射量为50—100 μg/只。具体方法:用等体积弗氏完全佐剂乳化AlEcR-A重组蛋白,每隔14 d用弗氏不完全佐剂乳化的蛋白免疫2次,2周后加强免疫1次(剂量加倍),四免后采血ELLSA确定血清抗体效价,并利用Western blot检测重组蛋白是否阳性,以进行下一步的细胞融合。
1.4.2 建立杂交瘤细胞株 采用聚乙二醇(PEG)介导的融合方法将小鼠脾细胞与骨髓瘤细胞SP2/0进行融合[14]。融合后4 d查看杂交瘤细胞株的克隆率,将ELLSA法检测为阳性的杂交瘤细胞株进行亚克隆,有限稀释法克隆3次,待阳性杂交瘤细胞稳定分泌抗体后扩增培养定株。
1.4.3 制备腹水 将0.2 mL弗氏不完全佐剂注射至小鼠腹腔,于7 d后再注入适量的上述阳性杂交瘤细胞后收集腹水。
1.5 单克隆抗体的鉴定
1.5.1 抗体的纯化 将腹水与PBS按1﹕1混匀后缓慢上样置层析柱(蛋白A琼脂糖介质填装),待抗体结合后用甘氨酸洗脱缓冲液洗脱,立即在PBS中进行4℃透析过夜,隔日进行纯度、浓度和效价检测。
1.5.2 Western blot检测单克隆抗体的特异性 Western blot测定方法按照Song等[15]的方法进行并稍作修改。将原核表达的AlEcR-A重组蛋白及新鲜孵化的绿盲蝽3龄若虫进行SDS-PAGE分析。转印PVDF膜后封闭,一抗为上述制备的蛋白抗体,二抗为辣根过氧化物酶标记的羊抗鼠HRP。
1.6 20E微注射处理
蒸馏水溶解20E,配置成1.0 mg·ml-1母液后置于-20℃储存待用。于新鲜孵化的2龄若虫第一腹足注射20E,浓度为4 μg/头。每处理60头绿盲蝽若虫,3次重复,以注射蒸馏水为对照(Control组),注射后每隔1 d取样,共取8次,用于后续的mRNA及蛋白表达量分析。
1.7 Western blot分析AlEcR-A蛋白表达差异
将上述20E处理后的不同日龄绿盲蝽用组织蛋白提取试剂盒提取总蛋白,并用二奎琳甲酸法测定其浓度。Western blot测定方法同1.5。
1.8 荧光定量PCR
TRIzol法提取各处理的绿盲蝽RNA样本,MMLV Reverse Transcriptase合成cDNA模板后进行RNase处理,-20℃保存待用。根据本实验前期克隆得到的(KM401656)设计RT-PCR引物,具体为ALEcR-A-F:GGGCAGACGATGACTGGATG,ALEcR-A-R:GTAGCTGTTGCTGGACATAGTTG;并设定(JN616391)为内参基因:具体为AL--actin-F:ACCTGTACGCCAACACCGT,AL-- actin-R:TGGAGAGAGAGGCGAGGAT。RT-PCR试验步骤按照SYBR Premix Ex Taq Kit说明书上进行。扩增程序:原始预变性95℃ 3 min;95℃ 5 s;60℃ 10 s;循环40次。每个样品设置3个独立的生物学重复,每个生物学重复设置5个技术重复,计算方法为2-ΔΔCt法[16]。
1.9 数据分析
不同处理的绿盲蝽相对表达量变化以2-ΔΔCt计算。差异显著性采用统计软件SAS 8.0中的Duncan’s新复极差法进行分析。
2 结果
2.1 原核表达载体pCzn1-AlEcR-A的构建及重组AlEcR-A蛋白的表达
测序结果表明,T4DNA连接酶可将经双酶切后的表达载体pCzn1及含有序列的T载体大面积连接,表明重组质粒已经亚克隆到pCzn1载体上,将其命名为pCzn1-AlEcR-A(图1)。随后将其转化至大肠杆菌Arctic Express表达菌株中,对在37℃培养下的pCzn1-AlEcR-A重组载体的蛋白表达情况进行了分析。SDS-PAGE电泳显示,经0.5 mmol·L-1IPTG诱导的pCzn1-AlEcR-A重组质粒可特异性表达一个约55 kD的蛋白,与理论大小相符,说明已在大肠杆菌Arctic Express细胞中成功表达,而不经IPTG诱导的pCzn1-AlEcR-A重组质粒无此条带的蛋白表达。此外,此诱导表达的重组AlEcR-A蛋白主要分布在沉淀体中,上清液中几乎没有表达,说明AlEcR-A重组蛋白主要以包涵体的形式存在(图2)。
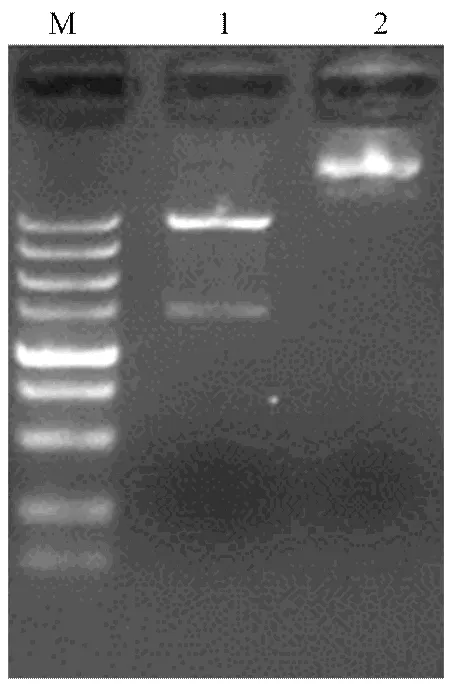
M:DL10000;1:酶切前质粒Plasmid before enzyme digestion;2:酶切后质粒Plasmid after enzyme digestion

M:蛋白分子量标准物Protein molecular weight marker;1:对照(无IPTG诱导、沉淀)un-induced (without IPTG induction, precipitate);2:37℃过夜培养(总蛋白1) Overnight culture of 37℃ (total protein 1);3:37℃过夜培养(总蛋白2)Overnight culture of 37℃(total protein 2);4:37℃过夜培养(沉淀)Overnight culture of 37℃(precipitate);5:37℃过夜培养(上清液)Overnight culture of 37℃(supernatant)
2.2 重组蛋白的Ni柱亲和纯化
利用SDS-PAGE电泳分析了经Ni柱亲和纯化后pCzn1-AlEcR-A基因重组蛋白的纯化情况。经缓冲液洗脱、透析后,上述含有pCzn1-AlEcR-A基因重组蛋白的包涵体纯度有较大程度的改善,仅在55 kD附近有一条明显的特异性条带,并未见其他条带,说明已得到纯化的AlEcR-A重组蛋白(图3)。
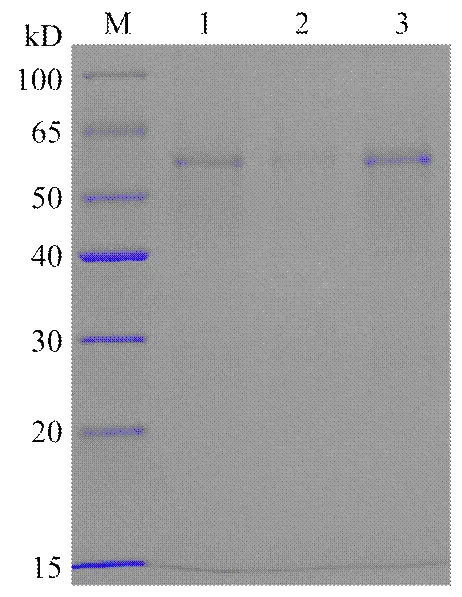
M:蛋白分子量标准物Protein molecular weight marker;1:未纯化的包涵体un-purified inclusion body;2:未与Ni柱结合的杂蛋白Miscellaneous protein un-combined with Ni;3:与Ni柱结合的目的蛋白Protein combined with Ni
2.3 抗AlEcR-A蛋白单克隆抗体杂交瘤细胞株的建立
用上述制备的重组蛋白pCzn1-AlEcR-A免疫小鼠,细胞融合4 d后发现,包被抗原的细胞株阳性克隆率均达到了100%,且不同时期收集的杂交瘤细胞上清的OD450 nm值几乎没有变化。将得到的能稳定分泌抗AlEcR-A蛋白的单克隆抗体杂交瘤细胞株,命名为8H7,进而扩增培养定株,以进行下一步的抗体特异性鉴定。
2.4 AlEcR-A蛋白单克隆抗体的特异性鉴定
ELISA检测效价结果显示,细胞株8H7的腹水效价达到了5.12×105。Western blot分析表明,所制备的单克隆抗体不仅能与绿盲蝽总蛋白结合,还可特异性与AlEcR-A重组蛋白反应(图4),且条带大小一致,说明制备的AlEcR-A单克隆抗体准确、有效,可以用于后续的Western blot检测。
2.5 外源20E对绿盲蝽mRNA含量的影响
RT-PCR结果表明,与注射蒸馏水相比,外源20E处理的绿盲蝽相对表达量均显著或极显著升高(<0.05或0.01)。在处理的8 d内,外源20E处理的相对表达量分别为1.15、1.25、1.32、1.35、1.43、1.63、1.66和1.61,说明随着处理时间的延长,相对表达量的增值幅度也逐渐增高,且在20E处理后的第7天达到峰值(图5),20E有诱导绿盲蝽mRNA表达的作用。

M:蛋白分子量标准物Protein molecular weight marker;1:3龄绿盲蝽若虫3rd instar nymph;2:重组蛋白pCzn1-AlEcR-A Recombinant protein pCzn1-AlEcR-A
2.6 外源20E对绿盲蝽AlEcR-A蛋白含量的影响
Western blot结果表明,随着20E处理时间的延长,绿盲蝽AlEcR-A蛋白表达量呈现出逐渐上升的趋势。此外,与蒸馏水处理组(CK)相比,20E处理的绿盲蝽AlEcR-A蛋白表达量均有一定富集效果,且注射蒸馏水处理组(CK)的AlEcR-A蛋白表达量的变化趋势与其mRNA相对表达量趋势较为一致(图6),20E有诱导绿盲蝽AlEcR-A蛋白表达的作用。

数据为平均值±标准误;柱上标注的不同字母表示同一天AlEcR-A相对表达量差异显著或极显著 The histogram bars represented mean±SE of at least three replicates. Different letters above each bar indicated statistical difference based on Duncan’s Multiple Comparison test
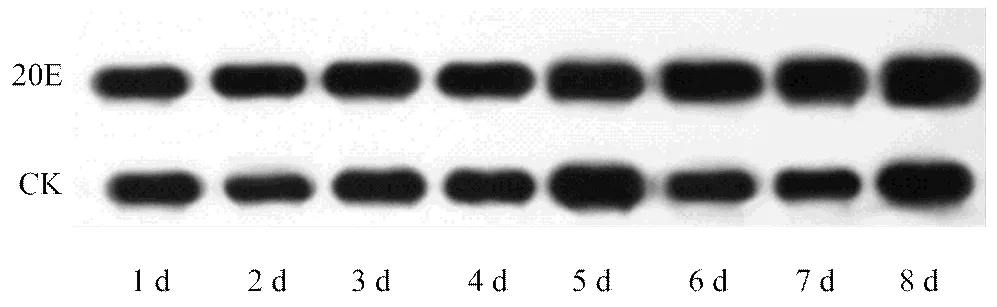
图6 不同处理对AlEcR-A蛋白表达量的影响
3 讨论
可溶性蛋白质的异源表达已经有较多的表达系统可用,目前很多可溶性蛋白以融合蛋白的形式得到成功表达[17-19]。本研究在前期保存在含有完整T载体的基础上,通过原核表达载体构建、IPTG诱导表达、Ni亲和纯化、小鼠免疫、细胞融合及腹水制备等技术手段,成功制备了绿盲蝽AlEcR-A的单克隆抗体,发现IPTG能够很好地诱导重组pCzn1- AlEcR-A质粒的表达,但主要以包涵体的形式存在。SDS-PAGE结果表明,经Ni柱的包涵体进行亲和纯化后,重组pCzn1-AlEcR-A质粒纯度可明显提高(图3),且无需经过尿素的变性和复性,避免了蛋白在此过程中活性的降解和产量的降低。单克隆抗体的成功制备需要良好的免疫原和稳定的筛选方法,在AlEcR-A单克隆抗体筛选过程中,以重组质粒pCzn1-AlEcR-A作为初始免疫制得的AlEcR-A蛋白单克隆抗体的细胞株,ELISA检测显示,该细胞株的腹水效价较高,Western blot分析结果也表明该单克隆抗体可同时与绿盲蝽总蛋白及AlEcR-A重组蛋白特异性结合(图4),可用于检测绿盲蝽体内AlEcR-A蛋白的丰度变化。
由于A/B域的碱基差异,昆虫EcR基因分为A、B1和B2这3个亚型蛋白,目前仅黑腹果蝇()中发现同时存在3个亚型蛋白[20],而在其他昆虫中仅存在A型或B型。本试验的昆虫绿盲蝽中也存在A和B两种亚型蛋白[21-22]。近年来,针对昆虫蜕皮激素与EcR之间的互作机制越来越受到研究者的重视,尤其在它们的转录调控下游靶基因的机制获得了许多重要突破。研究表明,EcR-USP异源二聚体在分子伴侣蛋白复合物Hsp90和Hsc70的协助下才能获得DNA结合活性[23]。此外,20E需要通过解除共阻遏因子和募集共激活因子来激活EcR-USP异源二聚体并启动下游基因的转录[24]。研究还表明,蛋白激酶C(protein kinase)是一种昆虫蜕皮激素的细胞膜受体,在传递20E信号中的功能也可发挥重要作用[25]。此外,20E还能激活一种非基因组途径——钙离子/钙调蛋白来调控下游基因的表达[26]。上述的研究均侧重于20E传导过程中各种受体对其下游基因的影响,或者是进行了20E信号网络中各种影响因子的功能鉴定,而在这过程中,这些受体自身在20E诱导下的表达模式如何,如受体的mRNA及蛋白的表达目前还未见报道。前人研究结果表明,昆虫EcR的表达丰度与体内20E滴度息息相关,家蚕()丝腺中的EcR只有在20E滴度超过5 ng·ml-1时才启动转录[27]。在本研究中,对照处理组绿盲蝽的mRNA及蛋白表达量表现为波浪线的变化趋势,由于本试验绿盲蝽为2龄初孵若虫,其平均若虫龄期为1.6、2.2、1.8和3.2 d(2—5龄若虫)[28],其表达量上升的时间正是绿盲蝽蜕皮的节点,一般来说,昆虫蜕皮时其体内的蜕皮激素含量较高。因此,绿盲蝽mRNA及蛋白表达量有明显的龄期表达特性,即在其蜕皮时,表达量显著上升。此外,本研究还发现,绿盲蝽的mRNA表达量及蛋白表达量均可受到外源20E的诱导,呈现出表达量显著上升的趋势,再次证实了EcR是昆虫蜕皮激素的作用靶标,下一步的研究应着重进行20E的细胞膜受体的鉴定及其在20E信号传导中的功能分析。
4 结论
获得了AlEcR-A原核表达的纯化蛋白,制备了高特异性的AlEcR-A单克隆抗体,进一步明确了外源20E有诱导mRNA及蛋白表达的作用。
References
[1] Lu Y H, Wu K M, Jiang Y Y, Xia B, Li P, Feng H Q, Wyckhuys K A G, Guo Y Y. Mirid bug outbreaks in multiple crops correlated with wide-scale adoption of Bt cotton in China., 2010, 328(5982): 1151-1154.
[2] Lu Y H, Wu K M, Wyckhuys K A G, Guo Y Y. Overwintering hosts of(Hemiptera: Miridae)in northern China., 2010, 29(9): 1026-1033.
[3] Wu K M, Li W, Feng H Q, Guo Y Y. Seasonal abundance of the mirids,andspp. (Hemiptera: Miridae) on Bt cotton in northern China., 2002, 21(10): 997-1002.
[4] Lu Y H, Wu K M, Jiang Y Y, Guo Y Y, Desneux N. Widespread adoption of Bt cotton and insecticide decrease promotes biocontrol services., 2012, 487(7407): 362-365.
[5] Nedjoua Z, Noureddine S. Environmental risks of two chitin synthesis inhibitors on Gambsia affinis: chronic effects on growth and recovery of biological responses., 2011, 59: 106-113.
该工厂于3月份投产,目前生产板材厚度为2~35 mm。其日产量为650 m3,由此Action Tesa公司成为印度最大的MDF生产商,年产能 51.1 万 m3。
[6] Li Y Q, Qin Y G, Yang N, Sun Y F, Yang X L, Sun R F, Wang Q M, Ling Y. Studies on insecticidal activities and action mechanism of novel benzoylphenylurea candidate NK-17., 2013, 8(6): e66251.
[7] Levine R B, Fahrback S E, Weeks J C. Steroid hormones and the reorganization of the nervous system during metamorphosis., 1991, 3(6): 437-447.
[8] Billas I M L, Browning C, Lawrence M C, Graham L D, Moras D, Hill R. The structure and function of ecdysone receptor//Smagghe G.. Springer, Berlin, 2009: 335-360.
[9] Riddiford L M, Cherbas P, Truman J W. Ecdysone receptors and their biological actions., 2000, 60: 1-73.
[10] Reinking J, Lam M M S, Pardee K, Sampson H M, Liu S, Yang P, Williams S, White W, Lajoie G, Edwards A, Krause H M. Thenuclear receptor E75 contains heme and is gas responsive., 2005, 122(2): 195-207.
[11] Riddiford L M, Hiruma K, Zhou X F, Nelson C A. Insights into the molecular basis of the hormonal control of molting and metamorphosis fromand., 2003, 33(12): 1327-1338.
[12] 郭恩恩, 李胜, 曹阳. 昆虫蜕皮的激素网络调控. 蚕业科学, 2008, 34(2): 370-374.
[13] Spindler K D, Hönl C, Tremmel C, Braun S, Ruff H, Spindler-Barth M. Ecdysteroid hormone action., 2009, 66(24): 3837-3850.
[14] 武强. 双水相萃取分离免疫球蛋白和单克隆抗体研究[D]. 杭州: 浙江大学, 2014.
WU Q. Separation of immunoglobulin and monoclonal antibody by aqueous two-phase extraction[D]. Hangzhou: Zhejiang University, 2014. (in Chinese)
[15] Song N N, Ding W H, Chu S Y, Zhao J, Dong X, Di B B, Tang C S. Urotensin II stimulates vascular endothelial growth actor secretion from adventitial fibroblasts in synergy with angiotensin II.2012, 76(5): 1267-1273.
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod., 2001, 25(4): 402-408.
[17] Schluepmann H, Pellny T, van Dijken A, Semmkens S, Paul M. Trehalose 6-phosphate is indispensable for carbohydrate utilization and growth in., 2003, 100 (11): 6849-6854.
[18] 谭永安, 肖留斌, 孙洋, 柏立新. 绿盲蝽水溶性海藻糖酶ALTre-1基因原核表达、纯化与酶学特性. 中国农业科学, 2013, 46(17): 3587-3593.
Tan Y A, Xiao L B, Sun Y, Bai L X. Prokaryotic expression, purification and functional activity assayof soluble trehalse from, 2013, 46(17): 3587-3593. (in Chinese)
[19] 谭永安, 肖留斌, 柏立新, 孙洋. 绿盲蝽膜结合型海藻糖酶ALTre-2基因表达、纯化及酶学特性. 棉花学报, 2013, 25(5): 396-402.
Tan Y A, Xiao L B, Bai L X, Sun Y. Expression, purification and enzymatic activity of a membrane-bound trehalase gene from., 2013, 25(5): 396-402. (in Chinese)
[20] Hoskins R A, Carlson J W, Kennedy C, Acevedo D, Evans-Holm M, Frise E, Wan K H, Park S, Mendez-Lago M, Rossi F, Villasante A, Dimitri P, Karpen G H, Celniker S E.Sequence finishing and mapping ofheterochromatin., 2007, 316(5831): 1625-1628.
[21] Tan Y A, Xiao L B, Zhao J, Sun Y, Bai L X. Molecular and functional characterization of the ecdysone receptor isoform-A from the cotton mirid bug,(Meyer-Dür)., 2015, 574(1): 88-94.
[22] Tan Y A, Xiao L B, Zhao J, Xiao Y F, Sun Y, Bai L X. Ecdysone receptor isoform-B mediate soluble trehalase expression to regulate growth and development in the mirid bug,(Meyer-Dür)., 2015, 24(6): 611-623.
[23] Arbeitman M N, Hogness D S. Molecular chaperones activate theecdysone receptor, an RXR heterodimer., 2000, 101(1): 67-77.
[24] Kimura S, Sawatsubashi S, Ito S, Kouzmenko A, Suzuki E, Zhao Y, Yamagata K, Tanabe M, Ueda T, Fujiyama S, Murata T, Matsukawa H, Takeyama K, Yaegashi N, Kato S.arginine methyltransferase 1 (DART1) is an ecdysone receptor co-repressor., 2008, 371(4): 889-893.
[25] Sun Y N, An S H, Henrich V C, Sun X P, Song Q S. Proteomic identification of PKC-mediated expression of 20E-induced protein in., 2007, 6(11): 4478-4488.
[26] Jing Y P, Liu W, Wang J X, Zhao X F. The steroid hormone 20-hydroxyecdysone via non-genomic pathway activates Ca2+/calmodulin- dependent protein Ⅱ to regulate gene expression., 2015, 290(13): 8469-8481.
[27] Manabu K, Shuichiro T, Makoto K, Haruhiko F. Tissue-specific and stage-specific expression of two silkworm ecdysone receptor isoforms ecdysteroid-dependent transcription in cultured anterior silk glands., 1997, 248(3): 786-793.
[28] Lu Y H, Wu K M, Wyckhuys K A G, Guo Y Y. Temperature- dependent life history of the green plant bug,(Meyer-Dür) (Hemiptera: Miridae)., 2010, 45(3): 387-393.
(责任编辑 岳梅)
preparation of monoclonal antibody against AlEcR-A protein and its response induced by exogenous 20-hydroxyecdysone in
Tan Yongan1, Xiao LiuBin1, Hao Dejun2, Zhao Jing1, Sun Yang1, Bai Lixin1
(1Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014;2College of Forestry, Nanjing Forestry University, Nanjing 210037)
【Objective】The objectives of this study are to prepare the monoclonal antibody against ecdysone receptors protein and clarity the response ofunder exogenous ecdysterone hormone (20E) in.【Method】The vector containingwas double enzyme restricted byIandI, then the cDNA identified by sequencing was constructed to pCzn1 vector and transformed into Arctic express of. The target recombinant protein has over expressed and has been purified by using Ni-NTA agarose. BALB/c mice were immunized with the purified recombinant fusion protein. The spleen cells of mouse were fused with SP2/0 cells. Thespecificity of hybridoma cell line was characterized by ELISA and Western blot analysis. Finally, the mRNA relative expression and protein content of AlEcR-A treated with exogenous 20E by RT-PCR and Western blot were analyzed, respectively.【Result】The recombinant plasmid pCzn1-AlEcR-A was high-efficient expression in Arctic expresswhen induced by 37℃ and 5.0 mmol·L-1IPTG. The 55 kD target protein from the strain containing AlEcR-A was obtained by the Ni-NTA agarose. One hybridoma cell line, named 8H7, was obtained and characterized by ELISA and Western blot analysis, which could specifically combine with the total protein ofand recombinant protein of AlEcR-A. By using RT-PCR and Western blot analysis, both the mRNA relative expression and protein content ofwere remarkably increased after treating with 20E which compared with control.【Conclusion】the high specificity monoclonal antibody of AlEcR-A protein was obtained, and 20E could induce the mRNA and protein expressions of AlEcR-A.
; ecdysone receptor; 20E; monoclonal antibodies; expression level
2016-09-18;接受日期:2016-10-20
国家科技支撑计划(2012BAD19B05)、国家自然科学基金(31301668)、国家现代农业产业技术体系建设专项资金(CARS-18-16)、转基因棉花环境安全性评价技术(2016ZX08011)、江苏省农业科学院院基金(611613)、江苏省农业科技自主创新资金(CX(14)5026)
谭永安,E-mail:kellytan001@163.com。通信作者柏立新,E-mail:jaasblx@jaas.ac.cn

