橡胶树白粉病菌OhPbs2的克隆及功能分析
冯霞,林春花,康迅,金洋,刘晓,何其光,刘文波,缪卫国,郑服丛
橡胶树白粉病菌的克隆及功能分析
冯霞,林春花,康迅,金洋,刘晓,何其光,刘文波,缪卫国,郑服丛
(海南大学环境与植物保护学院,海口570228)
【目的】Pbs2是MAPK信号途径HOG-MAPK通路的重要成员之一,在植物病原菌渗透压调节方面发挥着重要作用。橡胶树白粉病菌()是专性寄生菌,论文借助橡胶树炭疽病菌(),研究橡胶树白粉病菌的功能。【方法】采用同源克隆方法,分别以橡胶树白粉病菌基因组DNA和cDNA为模板,PCR扩增;利用生物信息学分析该基因的结构域,对该基因和其他真菌的7个同源蛋白序列进行系统进化分析,并利用MEGA6中最大简约法构建系统进化树来进一步分析鉴定该基因;利用同源重组和原生质体转化技术,将转化到缺失的橡胶树炭疽菌突变体中;在PDA+1.5 mol·L-1山梨醇的平板上筛选转化子,同时提取转化子的基因组作为模板,用橡胶树白粉病菌OhPbs2的引物对进行PCR鉴定,选择正确的转化子进行后续表型测定;在不同培养条件下,比较、和野生型菌株生长状态,并在橡胶树叶片接菌检测3个菌株致病力。【结果】基因序列全长1 927 bp,cDNA序列全长1 860 bp,含有一个内含子,编码一个619个氨基酸的蛋白;生物信息学分析表明该蛋白具有与CgPbs2相同的S_TKc功能域,构建系统进化树发现橡胶树白粉病菌Pbs2蛋白与烟曲霉()Pbs2蛋白亲缘关系最近,相似度为55%,与橡胶树炭疽病菌的相似度为49%,与粗糙脉孢菌()、稻瘟菌()、酿酒酵母()、禾谷镰孢()的Pbs2蛋白具有较近的亲缘关系, 相似度分别为54%、53%、53%、50%;菌株能在PDA+1.5 mol·L-1山梨醇培养基上长出白色菌落,菌株不能生长,并且测序结果显示已成功转入;在MM培养基上菌落呈白色,气生菌丝较短,不同于wild type菌株。在含有不同浓度NaCl、山梨醇、SDS、H2O2及咯菌腈的MM培养基上,、和wild type菌株随着浓度增加,菌落生长速度逐渐降低,不仅能恢复橡胶树炭疽菌菌株耐渗透压尤其耐受山梨醇的能力以及对咯菌腈的敏感性,甚至具有增强的能力,互补改变了橡胶树炭疽病菌颜色,抑制了气生菌丝生长;可能参与了橡胶树炭疽病菌致病性,但互补没有恢复其致病性。【结论】可能参与调控病菌的营养生长、氧化应激反应、渗透压响应及细胞壁形成等,并能增强橡胶树炭疽病菌相应功能,但与调控病菌致病力的机制可能存在不同。
橡胶树白粉病菌;;基因克隆;渗透压;致病性
0 引言
【研究意义】由白粉病菌()引起的橡胶树白粉病危害严重,是中国早春防治“两病一虫”的重点[1]。目前,橡胶树白粉病的研究多集中于化学防治[2],对该病的发病规律及病菌致病机理缺乏深入研究。研究橡胶树白粉病菌致病相关基因功能有助于了解其致病机理并为该病的防治提供理论依据。【前人研究进展】MAPK是一类生物进化上较为保守的蛋白激酶,它普遍存在于真核生物中,主要参与胞外信号传导,调节细胞的多种生物学过程[3-4]。根据其蛋白的功能,MAPK信号途径分为Fus3、Kss1、Slt2、Hog1和Smk1等信号途径[5-9]。Hog1级联系统是经典的MAPK级联途径,该途径首先在酿酒酵母()中发现[10],参与诱导胁迫反应基因的表达,信息素反应途径的阻遏,细胞形态恢复及致病性等[11],调控这一信号转导过程的途径就是Hog1类蛋白(Ste11→Pbs2→Hog1)[12],Pbs2是Hog1类蛋白中的重要成员[13]。已报道的Pbs2作用机理为该途径受到外界高渗条件的诱导,通过激活甘油合成相关酶基因的表达,使胞内积累高浓度甘油,从而维持细胞较高的膨压[14-16]。有研究发现Pbs2与杀真菌剂的敏感性和真菌细胞壁代谢相关[4,17-18],或者在感受外界冷热等压力变化中起重要作用[19-20]。【本研究切入点】是一种专性寄生菌,有关的MAPK信号途径及相关基因功能研究未见报道。笔者课题组前期研究发现橡胶树白粉病菌基因组中含有25个MAPK信号途径相关基因,并运用蛋白质结构域及聚类分析,构建橡胶树白粉病菌中的MAPK级联途径简图,共发现了2个MAPK基因、2个MAPKK基因和5个MAPKKK基因[21]。【拟解决的关键问题】从橡胶树白粉病菌菌株HO-73中克隆并鉴定MAPK信号途径中的重要基因的同源基因(),利用原生质体转化的方法将该基因转化到橡胶树炭疽菌()的对应敲除突变体中,通过表型分析推测的生物学功能。
1 材料与方法
试验于2015年9月至2016年4月在海南大学热带分子植物病理学实验室完成。
1.1 材料
1.1.1 供试菌株 橡胶树白粉病菌HO-73、橡胶树炭疽病菌野生型菌株wild type(Cg-1)及其基因突变体(该突变体由作者之一林春花构建,未发表)等,保存于海南大学环境与植物保护学院热带分子植物病理学实验室。
1.1.2 培养基及试剂 PDA+1.5 mol·L-1山梨醇:马铃薯200 g,葡萄糖20 g,山梨醇 182.17 g,琼脂粉13 g加蒸馏水定容至1 L;PDB+1.5 mol·L-1山梨醇:马铃薯200 g,葡萄糖20 g,山梨醇 182.17 g加蒸馏水定容至1 L;MM培养基:K2HPO47 g,KH2PO43 g,(NH4)SO41 g,MgSO40.1 g,柠檬酸钠0.5 g,葡萄糖5 g,琼脂粉18 g加蒸馏水定容至1 L。
NaCl、30% H2O2为分析纯试剂(广州化学试剂);山梨醇、十二烷基硫酸钠SDS(Solarbio公司);咯菌腈(Fluka公司)。
1.2基因克隆及生物信息学分析
基因组DNA的提取参照OMEGA Fungal DNA Kit说明书。总RNA提取参照RNA prep Pure多糖多酚植物总RNA提取试剂盒说明书,利用试剂盒Revert Aid First Strand cDNA Synthesis Kit合成cDNA。采用本地BLAST和同源克隆的方法,参照GenBank报道的真菌Pbs2序列,设计一对引物1,OhPbs2-F-1:5′-AAAGACCTAACTCAATGCCCTA-3′,OhPbs2-R-1:5′-AAGAATGGTTTTTACCTAATGG-3′,分别以橡胶树白粉病菌基因组DNA和cDNA为模板,PCR扩增的DNA和cDNA序列。同时设计一对引物2,OhPbs2-F-2:5′-GAAGAGGGTGTCAAGGATCCAAC G-3′,OhPbs2-R-2:5′-CCTCATCCCATAGATAGGAA TATG-3′,以橡胶树白粉病菌基因组DNA为模板,PCR扩增包括以及起始密码子前1 300 bp左右和终止密码子后300 bp左右共3 526 bp用于后续转化。PCR产物经切胶回收、连接、转化、鉴定后送上海生工测序公司测序。利用在线分析工具预测蛋白功能域(http://smart.embl-heidelberg.de/),利用MEGA6 中最大简约法(Maximum Parsimony Methods)进行氨基酸序列比对并构建系统进化树。
1.3 原生质体转化及阳性克隆的筛选
参照林春花等[22]的方法制备的原生质体,在每份200 μL原生质体(1×107个原生质体/mL)中加入10 μg用于回补的切胶回收片段进行转化。由于在Hog1通路中处于关键位置,没有该基因的菌株在高渗透压力的培养基上无法生长,反之则可以正常生长,故在PDA+1.5 mol·L-1山梨醇的平板上筛选阳性转化子,参照1.2的方法提取转化子的基因组作为模板,用橡胶树白粉病菌的引物对OhPbs2-F/R-2进行PCR鉴定,选择正确的转化子进行后续表型测定。
1.4 橡胶白粉病菌转化子的功能测定
将、和wild type 3个菌株分别接种于PDA培养基上,25℃恒温静置培养8 d后在菌落外缘相同的位置用直径为9 mm的打孔器打菌饼用于测定。
1.4.1 菌落形态的观察及生长速率的测定 将3个菌株菌饼分别接种在PDA和MM培养基平板上,25℃恒温培养。从第1天起用十字交叉法逐日测量菌落直径,绘制菌落生长曲线,同时观察菌落形态及颜色变化并拍照。
1.4.2在病菌耐受渗透压力中的调节作用 将3个菌株菌饼分别接种于含有NaCl(浓度为0.3、0.5、0.7、1.0 mol·L-1)、山梨醇(浓度为1.0、1.5、2.0 mol·L-1)的MM培养基上,25℃培养7 d后观察并测量菌落直径,计算抑制率。菌株抑制率=(对照组菌落直径-试验组菌落直径)/对照组菌落直径×100%。
1.4.3在病菌细胞壁发育中的作用 参照1.4.2的方法在含有SDS(浓度为25、50、100 μg·mL-1)的MM培养基上培养3个菌株,计算菌株抑制率。
1.4.4在氧化压力调节中的作用 参照1.4.2的方法在含有H2O2(浓度为1、3、5和10 mmol·L-1)的MM培养基上培养3个菌株,计算菌株抑制率。
1.4.5在病菌对咯菌腈敏感性中作用 参照1.4.2的方法在含有咯菌腈(浓度为10、30、40 μg·mL-1)的MM培养基上培养3个菌株,计算菌株抑制率。
1.4.6对病菌致病力的影响 采用离体健康的幼嫩叶片进行接种。在35 mm×45 mm的白色磁盘中铺两层吸水纸,用水浸透后保湿,将橡胶树嫩绿初期叶片放在吸水纸上,喷洒水雾于叶片上,叶柄用湿润的棉花保湿,用灭过菌的接种针刺伤半边叶片,将3个菌株的菌饼在叶表面伤口处接种,保鲜膜包住白磁盘,在潮湿环境下水雾依然存在,以刺伤接种同样大小的无菌PDA培养基小块为空白对照,置于25℃培养7 d后观察接种处叶片发病情况,参照崔华威等[23]的方法测量橡胶树叶片相对病斑面积。
1.5 数据分析
采用Excel和SPSS进行数据分析,1.4.1—1.4.5的所有试验至少重复3次,1.4.6的试验至少重复50次。
2 结果
2.1基因克隆及生物学信息学分析
用引物对OhPbs2-F/R-1经PCR扩增获得的DNA和cDNA序列。基因全长1 927 bp(GenBank登录号:KX675257),cDNA全长1 860 bp(图1-A左),含有一个内含子,编码一个619个氨基酸的蛋白,且该蛋白结构域分析发现含有一个S_TKc功能域(图1-C)。用引物对OhPbs2-F/R-2经PCR扩增获得包括以及起始密码子前 1 300 bp左右和终止密码子后300 bp左右共3 526 bp(图1-A右)。利用MEGA6构建系统进化树(图1-B)。通过构建系统进化树发现橡胶树白粉病菌的Pbs2蛋白与烟曲霉(,Af293 XP_752961.1)Pbs2蛋白亲缘关系最近,相似度为55%,与橡胶树炭疽病菌(Cg-1 KT387309)的相似度为49%,与粗糙脉孢菌(,XP_965727)、稻瘟菌(,70-15 EAQ71627.1)、酿酒酵母(YJM789 EDN63254.1)、禾谷镰孢(,PH-1 ESU14622.1)的Pbs2蛋白具有较近的亲缘关系,相似度分别为54%、53%、53%、50%。
2.2的互补及鉴定
经过原生质体转化获得阳性转化子,能在筛选培养基(含有1.5 mol·L-1山梨醇的PDA)平板上长出菌落,并产生白色菌丝,而对照在该平板上不能够生长(图2-A)。以该阳性转化子的基因组为模板,用引物对OhPbs2-F/R-2进行PCR扩增。琼脂糖凝胶电泳后发现在3 000—5 000 bp处有单一条带,而无条带出现(图2-B)。胶回收测序与序列比对验证后,说明被成功转化到橡胶树炭疽菌的突变体中,获得了互补转化子。
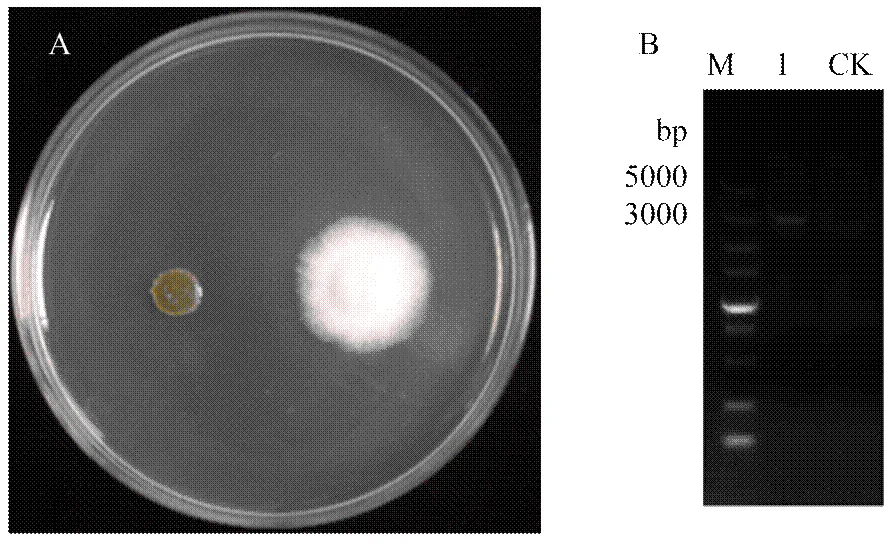
A:培养基筛选,左侧为ΔCgPbs2菌株,右侧为ΔCgPbs2+OhPbs2菌株Medium filter, the left side was ΔCgPbs2 strain, the right side was ΔCgPbs2+ OhPbs2 strain;B:M:DNA标准(5000)DNA Marker (5000);1:ΔCgPbs2+OhPbs2菌株DNA中OhPbs2的PCR扩增OhPbs2 amplification from the ΔCgPbs2+OhPbs2 DNA by PCR;CK:ΔCgPbs2菌株 DNA中OhPbs2的PCR扩增OhPbs2 amplification from the ΔCgPbs2 DNA by PCR
2.3 表型分析
2.3.1 菌落形态的观察及生长速率的测定 将、和wild type分别接种于PDA和MM培养基上(图3-A)。在PDA培养基上,6 d之前,生长速度更接近,但培养6 d后,与wild type生长速率一致(图3-B),尽管如此,3个菌株菌落生长速率没有显著差异,同时在菌落颜色上也没有显著差异。在MM培养基上,菌落生长速度虽快于wild type,但与wild type无显著性差异(图3-C)。在菌落颜色上,wild type呈灰白色,与趋于一致,而菌落颜色趋近白色,且气生菌丝稀疏,不同于和wild type。
2.3.2在调节病菌渗透压力中的作用 在不同浓度NaCl或山梨醇存在的条件下培养7 d,生长最快,wild type次之,而生长最慢;生长速度表现为随着NaCl或山梨醇浓度增加,菌落的生长速度逐渐降低。至山梨醇浓度为1.5、2.5 mol·L-1时,的菌丝不生长,与wild type仍可生长,并且两者达显著差异,而在NaCl存在条件下,两者无显著差异(图4-A、4-B)。
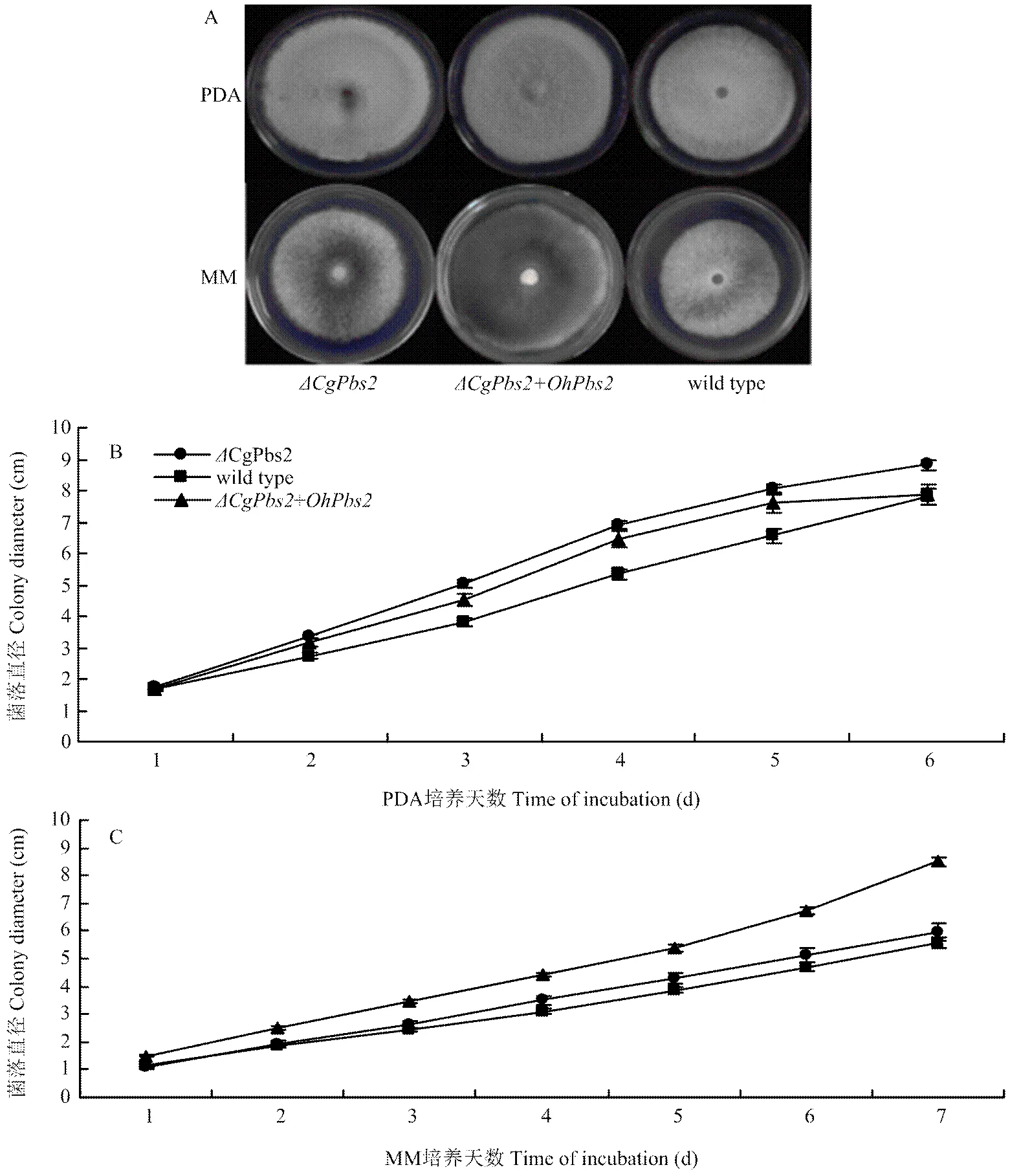
A:将ΔCgPbs2、ΔCgPbs2+OhPbs2和wild type分别接种于PDA培养基上6 d后和MM培养基上7 d后的菌落大小和形态Colony size and morphology of ΔCgPbs2, ΔCgPbs2+OhPbs2 and wild type after inoculated 6 days in PDA medium and 7 days in MM medium;B:PDA培养基上菌落直径生长速度colony diameter growth rate in PDA medium;C:MM培养基上菌落直径生长速度colony diameter growth rate in MM medium
2.3.3在病菌细胞壁发育中的作用 在不同浓度SDS存在的条件下,生长最快,wild type次之,而生长最慢;随着SDS浓度的增加,3个菌株生长速度逐渐减缓,但与wild type没有显著差异,两个菌株与有显著差异(图4-C)。
2.3.4在氧化压力调节中的作用 在不同浓度H2O2存在的条件下,生长最快,wild type次之,而生长最慢;生长量表现为随H2O2浓度增加,3个菌株菌落的生长速度逐渐降低。至H2O2浓度为10 mmol·L-1时,仍可生长,但和wild type均不能生长(图4-D)。
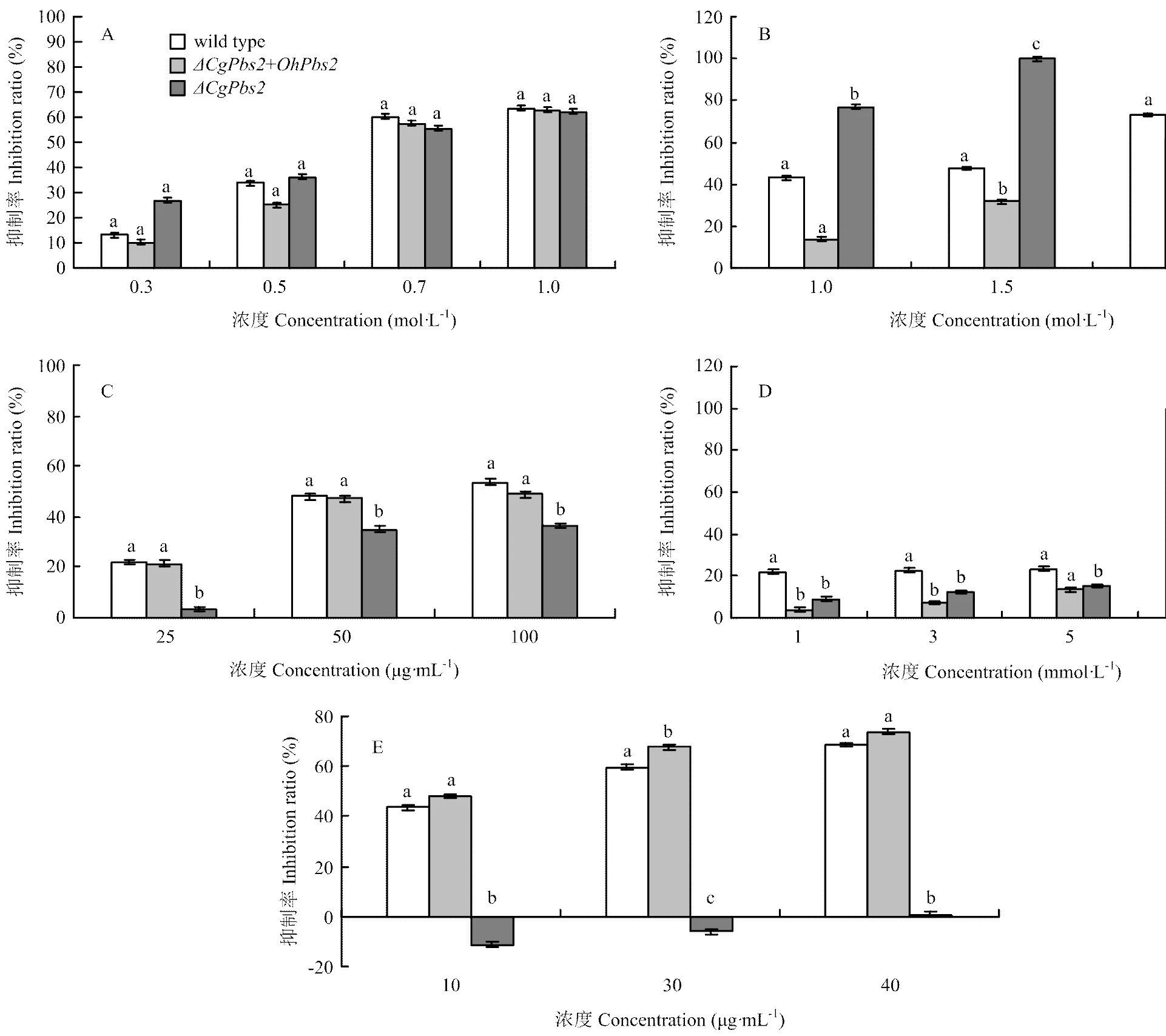
A:NaCl;B:山梨醇Sorbitol;C:SDS;D:H2O2;E:咯菌腈fludioxonil
2.3.5对病菌抗杀菌剂咯菌腈的影响 在不同浓度咯菌腈存在的条件下,生长最快,次之,而wild type生长最慢;生长量表现为随着咯菌腈浓度增加,3个菌株菌落的生长速度逐渐降低,与和wild type差异显著,但和wild type差异不显著(图4-E)。
2.3.6 致病力测定 在叶片上接种菌饼3 d后便表现出了明显的橡胶树炭疽病斑,随着培养时间的延续病斑直径不断扩展,7 d后调查结果显示,wild type病斑面积最大,病斑面积占整个叶片面积21%,和次之病斑面积分别占整个叶片面积16%和14%,和二者无显著差异,但与wild type差异显著(图5)。

图5 致病力测定
3 讨论
橡胶树白粉病菌是一类专性活体寄生真菌[24],在橡胶树白粉病菌中目前不能做敲除和互补等实验操作,而专性活体寄生真菌的等基因功能研究尚未见报道,所以本试验借用研究较为深入的真菌来验证橡胶树白粉病菌中重要基因的功能。利用原生质体转化的方法将转化到橡胶树炭疽菌的对应敲除突变体中,笔者发现橡胶树炭疽病菌的敲除并不影响橡胶树炭疽病菌菌落的生长及颜色,橡胶树白粉病菌的互补使与wild type菌落颜色、生长速率及气生菌丝有差异,说明橡胶树白粉病菌的互补影响了橡胶树炭疽病菌菌落的颜色和气生菌丝生长,有研究表明芸薹生链格孢不影响菌落颜色和菌株菌落生长速率[25],玉米大斑病菌可造成菌落颜色变淡,气生菌丝变短(稀疏)或者不明显[26]。但以往报道互补后菌株的生长速率均慢于野生型菌株,而的生长速率高于wild type,并有显著差异,这与以往报道不同,说明参与调控并能增强橡胶树炭疽病菌的营养生长。
是调控渗透压和氧化压力的重要基因,有研究表明烟曲霉不仅参与渗透压的传导,还参与氧化压力的传导,但只参与传导特定的氧化压力[27];玉米大斑病菌参与调控该菌的高渗胁迫反应和氧胁迫反应并具有正调控作用[26];在芸薹生链格孢的渗透压调节中也起到了一定的作用[25]。本研究也表明的互补可以恢复橡胶树炭疽病菌耐渗透压和耐氧化压力的能力,但是的互补可在一定程度上增强橡胶树炭疽病菌耐渗透压和氧化压力的能力,尤其显著增强病菌对山梨醇的耐受能力,这与以往报道不同,有研究报道额外拷贝烟曲霉的和能增强菌株对高渗透压和氧化压力的抵抗能力[28],这两者的机制是否相同有待验证。
咯菌腈是一种苯基吡咯类杀菌剂,由于它比天然产物硝吡咯菌素抗光解,能专一性地抑制霉菌而广泛地应用于防治农业生产中的真菌性病害[29-30]。有研究发现玉米大斑病菌的沉默使转化子对杀菌剂的抗性明显增强,表明该基因表达的蛋白很可能就是该杀菌剂的作用位点[26],芸薹生链格孢也参与了调控对杀菌剂的抗性[25]。本研究结果也验证了的缺失使菌株对咯菌腈的抗性增强。目前未见报道互补是否可恢复病原菌抗性,本研究中,互补恢复了橡胶树炭疽病菌对咯菌腈的敏感性,但并没有增强其对咯菌腈敏感性趋势,这可能也与OhPbs2蛋白的结构及其来源不同有关。
玉米大斑病菌参与调控病菌细胞壁的发育,并且随着表达量的降低,突变体菌落生长速率依次降低,说明的沉默对细胞壁的发育起正调控的作用[26]。本研究表明的互补不仅可以恢复橡胶树炭疽病菌耐SDS的能力,而且可增强病菌耐SDS能力,该结果未见报道。芸薹生链格孢参与调控该病原菌致病力强弱,互补的互补子致病力大致恢复到野生型[25]。本研究中的缺失导致橡胶树炭疽病菌的致病力下降,但的互补并没有恢复橡胶树炭疽病菌的致病力,而与的致病力一致。从上述结果发现,参与橡胶树炭疽病菌渗透压、氧化压力等方面的调控,但对橡胶树炭疽病菌致病力的影响可能与不同。
在植物病原真菌中,同源基因的功能是比较复杂的,在不同的病菌中该类基因的功能均有所不同,但是目前比较一致的看法是该类基因参与调控病菌的各种胁迫反应和应激反应,这在本研究中也得到了证实。试验中发现在MM培养基中加入NaCl、山梨醇、H2O2、SDS、咯菌腈等时,与野生型相比,菌落较大,但的致病力比野生型弱,对于其中的原因还有待进一步研究。
本研究从橡胶树白粉病菌中鉴定了MAPK信号通路中Hog1类蛋白家族中的重要成员Pbs2的编码基因,其同源基因在真菌中广泛存在且相对保守。OhPbs2与烟曲霉Pbs2蛋白亲缘关系最近,相似度为55%,这可能与烟曲霉和橡胶树白粉病菌都为半知菌类有关,OhPbs2与粗糙脉孢菌、稻瘟菌、酿酒酵母、禾谷镰孢中的Pbs2蛋白具有较近的亲缘关系,但同为橡胶树重要致病菌,OhPbs2与橡胶树炭疽菌的Pbs2相似度仅为49%,这预示OhPbs2与CgPbs2在病菌生长发育及其致病性等方面可能存在较大不同。
4 结论
橡胶树白粉病菌参与调控橡胶树炭疽菌的营养生长、氧化应激反应、渗透压响应及细胞壁发育等,并且可能具有增强病菌相应功能的能力,尤其在调控病菌颜色、耐受山梨醇、SDS等的能力方面与以往报道不同,同时与调控病菌致病力的机制可能存在不同。
References
[1] 万三连, 梁鹏, 刘文波, 张宇, 缪卫国, 郑服丛. 橡胶树与白粉病菌亲和互作组织细胞学研究. 植物保护, 2014, 40(3): 26-36.
Wan S L, Liang P, LIU W B, Zhang Y, Miao W G, Zheng F C. Cytological analysis of compatible interactions between rubber tree and., 2014, 40(3): 26-36. (in Chinese)
[2] Li X, Bi Z H, Di R, Liang P, He Q G, Liu W B, Miao W G, Zheng F C. Identification of powdery mildew responsive genes inthrough mRNA differential display., 2016, 17(2): 181.
[3] Schaeffer H J, Weber M J. Mitogen-activated protein kinases: specific messages from ubiquitous messengers., 1999, 19(4): 2435-2444.
[4] Xu J R. MAP kinases in fungal pathogens., 2000, 31(3): 137-152.
[5] 巩校东, 张晓玉, 田兰, 王星懿, 李坡, 张盼, 王玥, 范永山, 韩建民, 谷守芹, 董金皋. 玉米大斑病菌MAPK超家族的全基因组鉴定及途径模型建立. 中国农业科学, 2014, 47(9): 1715-1724.
Gong X D, Zhang X Y, Tian L, Wang X Y, Li P, Zhang P, Wang Y, Fan Y S, Han J M, Gu S J, Dong J G. Genome-wide identification MAPK superfamily and establishment of the model of MAPK cascade pathway in., 2014, 47(9): 1715-1724. (in Chinese)
[6] Herskowitz I. MAP kinase pathways in yeast: For mating and more., 1995, 80(2): 187-197.
[7] Nakagami H, Pitzschke A, Hirt H. Emerging MAP kinase pathways in plant stress signalling., 2005, 10(7): 339-346.
[8] Hamel L P, Nicole M C, Duplessis S, Ellis B E. Mitogen-activated protein kinase signaling in plant-interacting fungi: Distinct messages from conserved messengers., 2012, 24(4): 1327-1351.
[9] Gustin M C, Albertyn J, Alexander M, Davenport K. MAP kinase pathways in the yeast., 1998, 62(4): 1264-1300.
[10] 张鑫, 曹志艳, 刘士伟, 郭丽媛, 董金皋. 玉米大斑病菌聚酮体合成酶基因功能分析. 中国农业科学, 2011, 44(8): 1603-1609.
Zhang X, Cao Z Y, Liu S W, Guo L Y, Dong J G. Functional analysis of polyketide synthase genein., 2011, 44(8): 1603-1609. (in Chinese)
[11] 冯飞. 极细链格孢菌、基因克隆及功能初步分析[D]. 北京: 中国农业科学院, 2007.
Feng F. Cloning and functional characterization ofandgenes of the fungus[D]. Beijing: Chinese Academy of Agricultural Sciences, 2007. (in Chinese)
[12] Chen R E, Thorner J. Function and regulation in MAPK signaling pathways: Lessons learned from the yeast.,2007, 1773: 1311-1340.
[13] Zarrinpar A, Bhattacharyya R P, Nittler M P, Lim W A. Sho1 and Pbs2 act as coscaffolds linking components in the yeast high osmolarity MAP kinase pathway., 2004, 14(6): 825-832.
[14] Brewster J L, de Valoir T, Dwyer N D, Winter E, Gustin M C. An osmosensing signal transduction pathway in yeast., 1993, 259: 1760-1763.
[15] Hohmann S, Krantz M, Nordlander B. Yeast osmoregulation., 2007, 428: 29-45.
[16] Adler L, Blomberg A, Nilsson A. Glycerol metabolism and osmoregulation in the salt-tolerant yeast., 1985, 162(1): 300-306.
[17] Kojima K, Takano Y, Yoshimi A, Tanaka C, Kikuchi T, Okuno T. Fungicide activity through activation of a fungal signalling pathway., 2004, 53(6): 1785-1796.
[18] Alonso-Monge R, Carvaihlo S, Nombela C, Rial E, Pla J. The Hog1 MAP kinase controls respiratory metabolism in the fungal pathogen., 2009, 155(2): 413-423.
[19] Hohmann S. Osmotic stress signaling and osmoadaptation in yeasts., 2002, 66(2): 300-372.
[20] Posas F, Wurgler-MuqDhy S M, Maeda T, Witten E A, Thai T C, Saito H. Yeast HOG l MAP kinase cascade is regulated by a multistep phosphorelay mechanism in the SLNl-YPDI-SSKl “two-component” osmoeensor., 1996, 86(6): 865-875.
[21] 孙雅琦, 梁鹏, 刘文波, 缪卫国, 郑服丛. 橡胶树白粉菌MAPK级联信号途径全基因组鉴定及途径模型建立. 江苏农业科学, 2015, 43(12): 41-45.
Sun Y Q, Liang P, Liu W B, Miao W G, Zheng F C. Genome-wide identification and pathway model establishment of MAPK cascade signal pathway in rubber tree., 2015, 43(12): 41-45. (in Chinese)
[22] 林春花, 郑服丛. 稻瘟菌基因敲除突变株的构建及其表型分析. 微生物学报, 2008, 48(9): 1160-1167.
Lin C H, Zheng F C. Characterization of oxysterol binding protein homologthe rice blast fungus., 2008, 48(9): 1160-1167. (in Chinese)
[23] 崔华威, 杨艳丽, 黎敬涛, 罗文富, 苗爱敏, 胡振兴, 韩小女. 一种基于photoshop的叶片相对病斑面积快速测定方法. 安徽农业科学, 2009, 37(22): 10760-10762, 10805.
Cui H W, Yang Y L, Li J T, Luo W F, Miao A M, Hu Z X, Han X N. A faster method for measuring relative lesion area on leaves based on software photoshop., 2009, 37(22): 10760-10762, 10805. (in Chinese)
[24] 万三连, 梁鹏, 宋风雅, 张宇, 刘文波, 缪卫国, 郑服丛. 橡胶树白粉病菌分生孢子在不同介质的萌发过程及其内容物的变化. 植物病理学报, 2014, 44(6): 595-602.
Wan S L, Liang P, Song F Y, Zhang Y, Liu W B, Miao W G, Zheng F C. Germination morphology of conidia ofin different media and its content changes., 2014, 44(6): 595-602. (in Chinese)
[25] 祝春晓. 芸薹生链格孢基因功能及下游MAPK锚定作用位点的研究[D]. 泰安: 山东农业大学, 2015.
Zhu C X. Studies on the function ofgene ofand downstream MAPK anchorsite[D]. Taian: Shandong Agricultural University, 2015.(in Chinese)
[26] 田兰. 玉米大斑病菌HOG-MAPK级联途径中基因的结构分析及功能研究[D].保定: 河北农业大学, 2014.
Tian L. Structural and functional analysis ofgene in encoding a MAPK kinase HOG-MAPK cascade pathway of[D]. Baoding: Agricultural University of Hebei, 2014. (in Chinese)
[27] 马彦, 乔建军, 刘伟, 李若瑜. 烟曲霉基因功能初步探讨. 中华微生物学和免疫学杂志, 2008, 28(12): 1126-1130.
Ma Y, Qiao J J, Liu W, Li R Y. Cloning and functional analysis ofgene in., 2008, 28(12): 1126-1130. (in Chinese)
[28] 马冬梅, 季雅娟, 阳芳, 刘伟, 万喆, 李若瑜. 烟曲霉、基因额外拷贝对几种应激能力的影响. 中国真菌学杂志, 2012, 7(4): 193-198.
Ma D M, Ji Y J, Yang F, Liu W, Wan J, Li R Y. The effect of extra copies oforgene on the adaptive ability ofto several stresses., 2012, 7(4): 193-198. (in Chinese)
[29] 闫潇敏, 宁斌科, 王列平, 张媛媛. 新型杀菌剂氟咯菌腈及其研究开发进展. 世界农药, 2010, 32(3): 36-46.
Yan X M, Ning B K, Wang L P, Zhang Y Y. Advances in the research and development of a new fungicide fludioxonil., 2010, 32(3): 36-46. (in Chinese)
[30] Wu D X, Zhang R S, Han X, Wang J X, Zhou M G, Chen C J. Resistance risk assessment for fludioxonil in., 2015, 167(2): 277-284.
(责任编辑 岳梅)
Gene cloning and functional analysis of
FENG Xia, LIN ChunHua, KANG Xun, JIN Yang, LIU Xiao, HE QiGuang, LIU WenBo, MIAO WeiGuo, ZHENG FuCong
(College of Environment and Plant Protection, Hainan University, Haikou 570228)
【Objective】Pbs2 is one of the important members of HOG-MAPK pathway in MAPK signaling pathway, and plays an important role in osmotic regulation of plant pathogens.is an obligate parasite. In this paper, the function and effect ofofwere studied by using【Method】The homologous cloning method was used to amplify theby using the genomic DNA and cDNA as template. The domain of this gene was analyzed by bioinformatics. Phylogenetic analysis of seven homologous protein sequences of other fungi and OhPbs2 was conducted, and the phylogenetic tree was constructed by the maximum parsimony method in MEGA6 to further analyze and identify this gene. Using homologous recombination and protoplast transformation,was transformed into theof. The transformant was screened on PDA+1.5 mol·L-1sorbitol. At the same time, the genome of the transformant was extracted as a template and identified with the primer pairs of OhPbs2, and the correct transformantwas selected for subsequent phenotypic determination. The growth state of,and wild type strains was compared under different culture conditions. And the pathogenicity of the three strains was detected by inoculating the leaves of the rubber tree.【Result】The full-length of theis 1 927 bp, cDNA of theis 1 860 bp, and contains an intron that encodes a 619 amino acids protein. Bioinformatics analysis showed that the protein had the same S_TKc domain as CgPbs2. The phylogenetic tree showed that the Pbs2 protein was closely related toPbs2 protein, and the similarity was 55%. And the similarity towas 49%, also it was close to Pbs2 protein of,,and, the similarities were 54%, 53%, 53% and 50%, respectively.strain could grow white colonies on PDA+1.5 mol·L-1sorbitol medium, butstrain could not grow. The sequencing results showed that thehad been successfully transferred into the. The color of,and wild type strains decreased gradually with increasing concentration in MM medium containing different concentrations of NaCl, sorbitol, SDS, H2O2and fludioxonil.not only restored the ability of the wild type strain to tolerate osmolality, especially to sorbitol, but also to the susceptibility to fludioxonil, and even to enhance potency.Butcomplementary changed the color ofand inhibited the growth of aerial hyphae.might be involved in the pathogenicity of, howeverdid not restore its pathogenicity, but weakened its pathogenic ability to a certain extent.【Conclusion】may be involved in the regulation of the vegetative growth, oxidative stress, osmotic pressure and cell wall formation of the pathogen, and enhance the corresponding function of the.may be involved in the pathogenicity of the pathogen, but pathogenicity may be different from.
;; gene cloning; osmotic pressure; pathogenicity
2016-10-08;接受日期:2016-11-10
国家自然科学基金(31660033)、重点发展(“973”)(2011CB111612)、国家农业产业技术体系建设(CARS-34-GW8)、海南自然科学基金创新研究团队项目(2016CXTD002)
冯霞,E-mail:952372934@qq.com。通信作者缪卫国,E-mail:weiguomiao1105@126.com。通信作者郑服丛,E-mail:zhengfucong@126.com

